细胞冻存液及其制备方法与应用与流程
本发明涉及细胞治疗和医药领域,具体地说,涉及一种细胞冻存液及其制备方法与应用。
背景技术:
细胞治疗是指将正常或生物工程改造过的人体细胞移植或输入患者体内,新输入的细胞可以替代受损细胞或者具有更强的免疫杀伤功能,从而达到治疗疾病的目的。细胞治疗在治疗癌症、血液病、心血管病、糖尿病、老年痴呆症等方面显示出越来越高的应用价值。一般来讲,细胞治疗包括免疫细胞治疗和干细胞治疗两大类。常见的免疫细胞治疗种类包括nk细胞、cik细胞、dc-cik细胞、til细胞、lak细胞、car-t细胞等。常见的干细胞治疗种类包括胚胎干细胞、ips细胞、脂肪间充质干细胞、骨髓间充质干细胞、脐带间充质干细胞、脐血间充质干细胞、乳牙间充质干细胞、羊膜间充质干细胞、胎盘间充质干细胞等。
在细胞治疗临床中,常需要将细胞液氮冷冻保存,一段时间后再用于继续培养或临床直接回输。目前,实验室常用的细胞冻存液或商用的细胞冻存液往往添加异种血清或异种蛋白,在细胞治疗时存在引入污染或过敏原的风险。此外,目前这些细胞冻存液还存在细胞复苏后活性差等缺点。总之,目前临床上对高效、安全细胞冻存液存在实际需求。
技术实现要素:
本发明的目的是提供一种可有效提高细胞冻存效率并提高细胞复苏成活率,可安全用于临床的细胞冻存液及其制备方法与应用。
为了实现本发明目的,本发明的细胞冻存液,由含有人血清白蛋白、二甲基亚砜和高分子材料的细胞培养基组成;所述培养基中人血清白蛋白的体积百分数为1-5%(优选4%),二甲基亚砜的体积百分数为5-15%(优选10%),高分子材料的质量百分数为0.1-10%(优选5%)。优选地,所述培养基中人血清白蛋白的体积百分数为4%,二甲基亚砜的体积百分数为10%,高分子材料的质量百分数为5%。
本发明中,所述高分子材料是主链为碳氢链,侧基为羧基和疏水基团的高分子共聚物。所述高分子材料中羧基的质量百分数为0.01%-40%。所述高分子材料的数均分子量为3,000-100,000。所述疏水基团选自烷基、苯基、酯基等中的至少一种。
优选地,所述高分子材料选自甲基丙烯酸-甲基丙烯酸酯共聚物、苯乙烯-甲基丙烯酸共聚物、丙烯酸-丙烯酸酯共聚物、聚乳酸-羟基乙酸共聚物、马来酸烷基酯-马来酸共聚物、苯乙烯-甲基丙烯酸酯-丙烯酸三嵌段共聚物等中的至少一种。
更优选地,所述高分子材料选自甲基丙烯酸-甲基丙烯酸酯共聚物、聚乳酸-羟基乙酸共聚物和苯乙烯-甲基丙烯酸嵌段共聚物等中的至少一种。
本发明的细胞冻存液可按如下方法制备得到:
(1)将所述高分子材料溶于二甲基亚砜中,得到溶液i;
(2)向溶液i中加入人血清白蛋白,将所得混合物加入到细胞培养基中,得到细胞冻存液。
本发明还提供所述细胞冻存液在细胞冻存及复苏中的应用。
所述细胞包括但不限于nk细胞、cik细胞、dc-cik细胞、til细胞、lak细胞、cart细胞、哺乳动物胚胎干细胞、ips细胞、脂肪间充质干细胞、骨髓间充质干细胞、脐带间充质干细胞、脐血间充质干细胞、乳牙间充质干细胞、羊膜间充质干细胞或胎盘间充质干细胞。
前述的应用,冷冻保存细胞的具体方法为:向细胞中加入所述细胞冻存液,获得细胞悬浮液(浓度1×105~1×106个/ml);然后将细胞悬浮液程序降温至-80℃,转入液氮保存。
优选地,所述程序降温是指以5℃/小时的降温速度,由室温降至-80℃。
本发明进一步提供含有所述的细胞冻存液的试剂盒。
所述细胞冻存液在制备免疫细胞、干细胞等细胞用于临床疾病治疗、生物美容中的应用,也属于本发明的保护范围。
与现有技术相比,本发明具有以下优点:
(一)生物安全性高。本发明的细胞冻存液由人血清白蛋白、二甲基亚砜、高分子材料和培养基构成,细胞冻存液中不含异种蛋白或血清,大大提高了临床细胞治疗的安全性。
(二)大大提高细胞冻存效率和细胞复苏成活率。与传统细胞冻存液相比,本发明的细胞冻存液可大幅提高细胞,尤其是干细胞、免疫细胞的细胞复苏成活率,最大提升幅度可达67%。
(三)利用本发明的细胞冻存液制备的免疫细胞、干细胞等在疾病治疗、生物美容等方面具有广阔的应用前景。
附图说明
图1为本发明实施例1中细胞冻存液对细胞成活率影响对比。
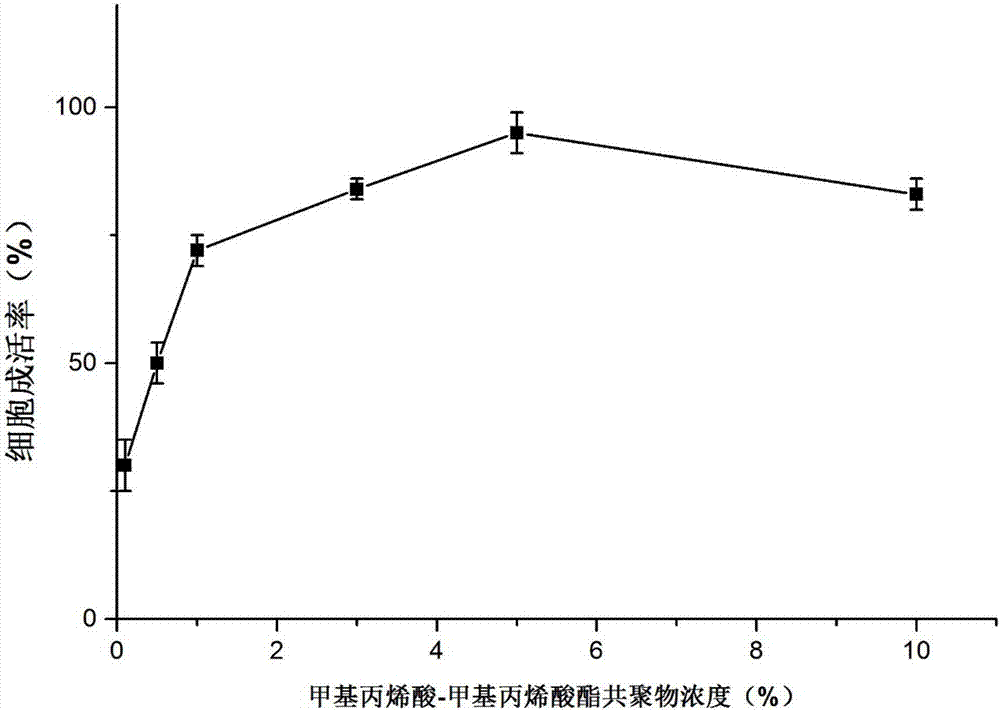
图2为本发明实施例2中高分子浓度对细胞成活率影响。
图3为本发明实施例3中不同人血清白蛋白浓度对细胞成活率影响。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段,所用原料均为市售商品。
本发明中涉及到的百分号“%”,若未特别说明,是指质量百分比;但溶液的百分比,除另有规定外,是指100ml溶液中含有溶质的克数。
以下实施例中细胞冻存液的制备方法如下:
(1)将所述高分子材料溶于二甲基亚砜中,得到溶液i;
(2)向溶液i中加入人血清白蛋白,将所得混合物加入到细胞培养基中,得到细胞冻存液。
实施例1两种不同细胞冻存液比较
细胞:人脐带间充质干细胞。
冻存方法:向细胞中加入所述细胞冻存液,获得细胞悬浮液(浓度1×105~1×106个/ml);然后将细胞悬浮液以5℃/小时降温速度程序降温至-80℃,转入液氮保存。
细胞复苏方法:采用常规方法复苏细胞。
细胞冻存液a:10%胎牛血清+10%二甲基亚砜+培养基;
细胞冻存液b:0.1%人血清白蛋白+10%二甲基亚砜+1%甲基丙烯酸-甲基丙烯酸酯共聚物(mw约34,000,cas:25086-15-1)+培养基。
细胞冻存复苏后细胞成活率对比如图1所示。从图1可以看出,采用细胞冻存液a冻存细胞,复苏后细胞成活率82%;采用细胞冻存液b冻存细胞,复苏后细胞成活率93%。
实施例2高分子浓度对细胞成活率影响
细胞:人脐带间充质干细胞。
细胞冻存液:5%人血清白蛋白+10%二甲基亚砜+0.1-10%甲基丙烯酸-甲基丙烯酸酯共聚物(mw约34,000,cas:25086-15-1)+培养基。其中,甲基丙烯酸-甲基丙烯酸酯共聚物的浓度分别为0.2%、0.8%、1.0%、1.5%、5.0%和10.0%。
细胞冻存复苏后细胞成活率见图2,从图2可以看出甲基丙烯酸-甲基丙烯酸酯共聚物的浓度分别为0.2%、0.8%、1.0%、1.5%、5.0%和10.0%时,对应的复苏后细胞成活率分别为40%、50%、75%、80%、95%和81%。
实施例3不同人血清白蛋白浓度对细胞成活率影响
细胞:人脐带间充质干细胞。
细胞冻存液:1-5%人血清白蛋白+10%二甲基亚砜+3%甲基丙烯酸-甲基丙烯酸酯共聚物(mw约34,000,cas:25086-15-1)+培养基。其中,人血清白蛋白的浓度分别为1%、2%、3%、4%和5%。
细胞冻存复苏后细胞成活率见图3,从图3可以看出人血清白蛋白的浓度分别为1%、2%、3%、4%和5%时,对应的复苏后细胞成活率分别为85%、90%、92%、95%和94%。
实施例43%聚乳酸-羟基乙酸共聚物的冻存效果
细胞:人脐带间充质干细胞。
细胞冻存液:5%人血清白蛋白+10%二甲基亚砜+3%聚乳酸-羟基乙酸共聚物+培养基。
细胞冻存复苏后细胞成活率为94±3%。
实施例51%聚乳酸-羟基乙酸共聚物的冻存效果
细胞:人脐带间充质干细胞。
细胞冻存液:5%人血清白蛋白+10%二甲基亚砜+1%聚乳酸-羟基乙酸共聚物+培养基。
细胞冻存复苏后细胞成活率为91±3%。
实施例6hela细胞及l929细胞的冻存效果
细胞:hela和l929。
细胞冻存液:5%人血清白蛋白+10%二甲基亚砜+5%甲基丙烯酸-甲基丙烯酸酯共聚物(mw约34,000,cas:25086-15-1)+dmem培养基。
将hela细胞和l929细胞用冻存液冻存一周。然后细胞复苏,台盼蓝计数计算细胞成活率。hela细胞和l929细胞复苏成活率分别为97±3%、96±4%。
实施例7dc-cik细胞的冻存效果
细胞:dc-cik细胞。
细胞冻存液:5%人血清白蛋白+10%二甲基亚砜+3%甲基丙烯酸-甲基丙烯酸酯共聚物(mw约34,000,cas:25086-15-1)+dmem培养基。
外周血单个核细胞的制备方法如下:按照常规的聚蔗糖-泛影葡胺分层液密度梯度离心法分离患者的外周血单个核细胞,以75%酒精擦拭血袋后放入生物安全柜中;以碘酒及75%酒精消毒血袋注射管口2遍,用50ml注射器将血抽出,转入50ml离心管,每管20ml左右;血液抽净后,将20mlrpmi1640加入到血袋中,上下倒转血袋2-3次,清洗血袋,将清洗液转入到50ml离心管;每管外周血补加20mlrpmi1640至约40ml,用10ml移液管将外周血混匀;以转速320g离心8min;轻轻将上清吸出约17ml,弃掉,重新将沉淀打散;计数细胞,将细胞浓度调至1.5×109-2×109/22ml;取12.5mlficoll至一新的50ml离心管中,将22ml外周血细胞悬液沿管壁缓慢加至分离液之上,并注意保持两者界面清晰;以转速450g在室温下离心25分钟,管内可清晰的分为四层;用移液管小心的吸取乳白色的单个核细胞层,并转入到新的50ml离心管中,用大于或等于单个核细胞层体积的pbs清洗移液管;转入到离心管中,以转速450g室温离心10分钟,去除混杂的血小板。
淋巴细胞的制备方法如下:通过外周血单个核细胞中的淋巴细胞和单核细胞贴壁性能不同将其分开,淋巴细胞在培养液中是悬浮生长,单核细胞会吸附到培养器皿的底部。将单个核细胞沉淀以aim-v(无血清培养基)重悬,以7×107/6ml/盘的密度接种于10cm培养皿;在37℃5%co2浓度的培养箱中培养2小时;将上层悬浮细胞用移液管转移至50ml离心管中,用3mlrpmi1640洗培养皿两次,将悬浮的淋巴细胞尽量都收起来,转入50ml离心管中;以转速320g室温离心7分钟,转移上清,用aim-v培养基重悬,移液管来回吹打几次,将细胞悬液混匀,用以上方法细胞计数,计算细胞存活率;同样以7×107/6ml/盘的密度再一次接种于10cm培养皿,尽量将淋巴细胞中的单核细胞剔除。
抗原提呈细胞-树突状细胞的制备方法如下:将第一次收集淋巴细胞之后的10cm培养皿(贴附有单核细胞),每盘加入aim-v培养液3ml清洗一次,尽量去除淋巴细胞核和残留的rpmi1640培养液,之后每个培养皿加入3mlaim-v培养液,加入树突状细胞诱导因子gm-csf(50ng/ml)和il-4(25ng/ml),在37℃5%co2培养箱中培养18-48小时;用10ml移液管将单核细胞培养皿中的悬浮细胞,转移至50ml离心管中,并用3mlpbs清洗培养皿;加入3ml5mmedta/pbs,在培养箱中抚育5-10min;将培养皿从培养箱中将培养皿转入到生物安全柜中,用原有的3mledta/pbs将贴壁的树突细胞冲下,转入50ml离心管中;以转速320g室温离心7min;去上清,用细胞冻存液悬浮,以1×108/2ml的浓度转入冻存管,拧好盖,装入程序降温仪,于-80℃冰箱放置4小时以上,转移到液氮中将dc-cik细胞冻存一周。然后细胞复苏,台盼蓝计数计算细胞成活率。dc-cik细胞复苏成活率分别为95±3%。
实施例8dc-cik细胞的冻存效果
细胞:dc-cik细胞。
细胞冻存液:5%人血清白蛋白+10%二甲基亚砜+5%甲基丙烯酸-甲基丙烯酸酯共聚物(mw约34,000,cas:25086-15-1)+dmem培养基。
外周血单个核细胞的制备方法如下:按照常规的聚蔗糖-泛影葡胺分层液密度梯度离心法分离患者的外周血单个核细胞,以75%酒精擦拭血袋后放入生物安全柜中;以碘酒及75%酒精消毒血袋注射管口2遍,用50ml注射器将血抽出,转入50ml离心管,每管20ml左右;血液抽净后,将20mlrpmi1640加入到血袋中,上下倒转血袋2-3次,清洗血袋,将清洗液转入到50ml离心管;每管外周血补加20mlrpmi1640至大约40ml,用10ml移液管将外周血混匀;以转速320g离心8min;轻轻将上清吸出17ml左右,弃掉,重新将沉淀打散;数细胞,将细胞浓度调整为1.5×109-2×109/22ml;取12.5mlficoll至一新的50ml离心管中,将22ml外周血细胞悬液沿管壁缓慢加至分离液之上,并注意保持两者界面清晰;以转速450g室温离心25分钟,管内可清晰的分为四层;用移液管小心的吸取乳白色的单个核细胞层,并转入到新的50ml离心管中,用多于或等于单个核细胞层体积的pbs清洗移液管;转入到离心管中,以转速450g室温离心10分钟,去除混杂的血小板。
淋巴细胞的制备方法如下:通过外周血单个核细胞中得淋巴细胞和单核细胞贴壁性能不同将其分开,淋巴细胞在培养液中是悬浮生长,单核细胞会吸附到培养器皿的底部。将单个核细胞沉淀以aim-v(无血清培养基)重悬,以7×107/6ml/盘的密度接种于10cm培养皿;在37℃5%co2浓度的培养箱中培养2小时;将上层的悬浮细胞用移液管转移至50ml离心管中,用3mlrpmi1640洗培养皿两次,将悬浮的淋巴细胞尽量都收起来,转入50ml离心管中;以转速320g室温离心7分钟,转移上清,用aim-v培养基重悬,移液管来回吹打几次,将细胞悬液混匀,用以上方法细胞计数,计算细胞存活率;同样以7×107/6ml/盘的密度再一次接种于10cm培养皿,尽量将淋巴细胞中的单核细胞剔除。
抗原提呈细胞-树突状细胞的制备方法如下:将第一次收集淋巴细胞之后的10cm培养皿(贴附有单核细胞),每盘加入aim-v培养液3ml清洗一次,尽量去除淋巴细胞核和残留rpmi1640培养液,之后每个培养皿加入3mlaim-v培养液,加入树突状细胞诱导因子gm-csf(50ng/ml)和il-4(25ng/ml),在37℃5%co2浓度的培养箱中培养18-48小时;用10ml移液管将单核细胞培养皿中的悬浮细胞,转移至50ml离心管中,并用3mlpbs清洗培养皿;加入3ml5mmedta/pbs,在培养箱中抚育5-10min;将培养皿从培养箱中将培养皿转入到生物安全柜中,用原有的3mledta/pbs将贴壁的树突细胞冲下,转入50ml离心管中;以转速320g室温离心7min;去上清,用细胞冻存液悬浮,以1×108/2ml的浓度转入冻存管,拧好盖,装入程序降温仪,放在-80℃冰箱,放置4小时以上,转移到液氮中将dc-cik细胞冻存一周。然后细胞复苏,台盼蓝计数计算细胞成活率。
用rpmi1640重悬细胞,台盼蓝染色,进行细胞计数和计算存活率。dc-cik细胞复苏成活率分别为92±3%。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之做一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!