生成医学结果图像的制作方法
生成医学结果图像
1.将三维(3d,体积)图像数据集进行组合是已知的,每个数据集是使用3d/3d配准技术在独立的医学成像模态下获取的。例如,计算机断层扫描(ct)3d图像或磁共振断层扫描(mrt)3d图像可以与血管造影术/血管造影3d图像融合、或者叠加在血管造影术/血管造影3d图像上。进一步已知的是,将期望的体积数据集叠加到二维(2d)荧光透视术/荧光透视图像上,以通过显示该叠加来提供直观的手术内指导(intra
‑
procedural guidance)。可以随着血管造影系统(例如,用于获取荧光透视图像的c形臂血管造影x射线系统)的几何改变来动态地更新叠加体积。因此,可以惯常地和/或在介入过程之前很久被获取的诊断医学成像数据集因此可以用于提供附加的解剖信息。使用3d ct血管造影术(cta)或mrt血管造影术(mra),可以在导管插入术、支架置入术或盘绕术(coiling)过程之类的介入过程期间提供详细的血管信息。因此,可以减少重复性的手术内2d/3d血管造影术获取,从而有利地减少了针对患者的总x射线剂量和/或对比剂(contrast agent)负担。用于这些过程的示例例如被描述在zhang、qiang等人的“cbct
‑
based 3d mra and angiographic image fusion and mra image navigation for neuro interventions”(in:medicine;vol. 95,no. 32;第1
‑
7页;doi 10.1097/md.0000000000004358;2016年)或zhang、qiang等人的“three
‑
dimensional image fusion of cta and angiography for real
‑
time guidance during neuro interventional procedures”(in:neuroimaging;第1
‑
7页;2016年)中。
2.关于包括涉及脑部、髓质、头部和/或颈部的血管失调(vascular disorder)的血管内治疗以及其他外周血管畸形的血管内治疗的神经介入,提供对整个感兴趣区域的血管系统的概览是特别有利的。可以通过产生cta或mra 3d路径图(roadmap)并且将其与3d血管造影术(例如,西门子dynact大体积或dynact 360技术,其使得能够使用覆盖了从主动脉弓到颅端的视场(fov)的30*40cm2检测器来对患者进行纵向平行扫描(portrait scan))进行配准来提供该概览。然而,患者位置在cta/mra与血管造影术获取之间通常是不同的,这主要是由于颈椎扭曲。这妨碍了基于3d/3d骨结构的全局配准,并且通常会在3d血管路径图绘制期间引入不准确性。
3.为了针对这些路径图不准确性进行校正,已知的是,使用附加的、优选地是手术内数字减影血管造影术(dsa)来调整cta/mra与实时血管位置之间的任何偏差。这涉及相当多的对比剂施用,这是由于在理想情况下要针对不同的解剖区域来重复dsa。
4.替代地,已知的是,获取胸
‑
颈和颅部区域的个体3d血管造影术图像,从而确保针对当前感兴趣区域的最佳配准准确度,同时保持了对从主动脉弓到颅内血管的整个主动脉上循环的概览。当然,针对每次3d血管造影术获取,需要单独地执行3d/3d配准(参见zhang、qiang等人的“three
‑
dimensional image fusion of cta and angiography for real
‑
time guidance during neuro interventional procedures”;in:neuroimaging;第1
‑
7页;2016年)。
5.这两种方法都涉及针对患者的附加对比剂和/或x射线剂量负担。
6.因此,本发明的目的是提供一种替代的手段和/或方法,其允许手术内医学图像叠加,同时保持患者x射线剂量和对比剂施用尽可能低。
7.该目的通过根据独立权利要求的用于使用当前图像、目标图像和参考图像来生成医学结果图像的方法、对应的计算单元、医学成像设备、计算机程序产品、以及计算机可读存储介质来解决。替代和/或优选实施例是从属权利要求的目的。
8.在下文中,关于所要求保护的设备以及关于所要求保护的方法来描述根据本发明的技术解决方案。本文中描述的特征、优点或替代实施例同样可以被指派给其他要求保护的目的,并且反之亦然。换句话说,论述本发明方法的权利要求可以由关于设备而描述或要求保护的特征来改进。在这种情况下,例如,该方法的功能性特征由设备的目标单元来体现。
9.本发明的第一方面涉及一种用于使用当前图像、目标图像和参考图像来生成医学结果图像的方法。所涉及的所有图像至少部分地描绘了患者的相同身体区域。当前图像、参考图像和目标图像全部是使用医学成像设备获取的医学图像,该医学成像设备如计算机断层扫描系统、磁共振断层扫描系统、c形臂x射线系统等。患者的所描绘的身体区域对应于身体部位、身体(子)区域,如腹部、胸部、颈部、头部等。参考图像、目标图像和当前图像至少部分地描绘了相同身体区域,即它们全部包括或示出了至少一个共同的解剖结构、器官、组织等。参考图像、目标图像和当前图像中的每一个可以包括在其他图像之一中不存在的附加或额外的解剖结构。换句话说,当前图像、目标图像和参考图像可以覆盖不同或相同的视场。优选地,参考图像和目标图像覆盖比当前图像更大的视场。虽然目标图像优选地是三维图像、最优选地是血管造影术图像,但是当前图像优选地是二维图像、最优选地是荧光透视术图像。当前图像优选地描绘了其中发生医学、即外科手术介入的场景和/或身体部位。优选地,使用相同的医学成像设备来获取目标图像和当前图像。优选地,使用c形臂x射线设备来获取它们。优选地,在对患者的医学或外科手术介入过程(例如,导管插入术、支架置入术或盘绕术过程)中获取目标图像和当前图像。进一步优选地,在与所成像的身体区域的初始图像相对应的医学介入开始时获取目标图像。优选地,在医学介入期间的任意稍后时间点处获取当前图像。优选地,参考图像是手术前三维图像,例如磁共振血管造影术图像或计算机断层扫描血管造影术图像。最优选地,参考图像描绘了图像患者的血管系统的概览。换句话说,参考图像不是在相同的医学过程中获取的,而是优选地在介入之前获取的。进一步优选地,参考图像是作为诊断图像来获取的,作为患者的医学检查路径和/或疗法路径的一部分,并且存在于电子患者健康记录文件中,并且被存储在数据库中,例如存储在医学企业或医院的本地pacs(图片存档和通信系统)中、或者存储在云数据存储装置中。
10.在本发明方法中涉及的所有图像可以优选地是根据dicom标准等的数字图像文件。这些图像可以全部由根据本发明的计算单元来加载和处理,该计算单元将在下面进一步描述。根据本发明的图像处理、图像操纵和/或图像分析发生在图像空间中。
11.该方法包括众多步骤。
12.第一步骤涉及在目标图像内定义至少一个图像片段。本发明方法标识至少一个、优选地多于一个图像片段。换句话说,目标图像被细分成片段。片段在大小方面可能小于目标图像,或者可能与目标图像大小相同。优选地,相对于目标图像中所描绘的患者解剖结构来选择、定向和/或对准片段位置和/或大小。
13.根据本发明的优选实施例,通过设置基于所描绘的身体区域中的解剖结构而定向的至少一个分割平面来定义该至少一个图像片段。最优选地,分割平面被设置为垂直于患
者的纵向身体轴。通过定义多于一个分割平面,可以定义对应于横向定向的图像片段的若干个图像片段。
14.根据本发明的另一个优选实施例,分割平面由用户手动设置。
15.因此,通过在视觉上分析目标图像和所显示的解剖结构,用户可以单独地定位至少一个分割平面,该分割平面然后用作图像片段边界。分割平面可以与至少一个解剖结构对准,该解剖结构例如目标图像中存在的骨结构和/或器官和/或特定界标。替代地,可以由本发明的计算单元基于目标图像分割结果和/或界标和/或结构和/或纹理检测结果来自动设置该至少一个分割平面。此外,可以通过自动建议分割平面来半自动地设置分割平面,其中该建议可以被用户接受和/或校正。
16.第二步骤涉及通过针对目标图像内的每个图像片段建立配准矩阵来将参考图像与目标图像配准,其中配准矩阵特定于相应的图像片段。图像配准一般描述了两个图像的对准,其中图像中的差异可能是例如由于视角的差异、使用不同的医学成像设备、患者移动、随时间的解剖结构改变等引起的。换句话说,将参考图像和目标图像两者彼此对准,以便补偿所论述的差异。配准矩阵对应于数学和/或几何和/或特殊变换的总和,这些变换的总和在被应用于例如参考图像空间时最优地将参考图像的解剖结构与目标图像的对应结构对准。同样地,可以将目标图像对准到参考图像。然而,由于目标图像以及还有当前图像通常表示患者的最新解剖状态或状况,因此优选地将参考图像对准到目标图像。优选地,在对参考图像和目标图像进行配准之前,使用在医学图像处理领域中本身众所周知的分割技术来分割这两个图像中的解剖结构/对象/器官/组织/结构。此外,将参考图像预配准到用于获取目标图像的医学成像设备的坐标系对于配准而言可能是必要的。
17.根据本发明的优选实施例,使用基于强度的刚性变换技术来执行参考图像和目标图像的配准。刚性配准通常限于线性变换,如旋转、平移、缩放等。线性变换的特征在于:它们仅能够被全局地应用于图像,这意味着仅能够部分地计及参考图像与目标图像之间的局部偏差差异。换句话说,刚性配准矩阵应被理解为变换的折衷或权衡,其总体上导致了解剖结构的对准,然而其小于100%对准。基于强度的配准通常将在参考图像和目标图像中标识的强度模式进行比较以便彼此相对应,并且尝试找到引起参考图像和目标图像的解剖结构的对准的变换。如果认为必要,则根据本发明自动建立的配准矩阵可以由用户手动校正和/或适配。
18.根据本发明的概念,在该步骤中不仅建立一个配准矩阵,而且还建立至少两个配准矩阵。配准矩阵特定于目标图像的对应图像片段。换句话说,配准矩阵是身体区域特定的。
19.根据本发明的另一个优选实施例,仅基于位于相应图像片段中的解剖特征来建立图像片段特定的配准矩阵。换句话说,配准过程仅考虑位于相应图像片段内的解剖特征和/或结构,例如器官、组织、病变等。因此,与考虑整个目标图像而建立的配准矩阵相比,图像片段特定的配准矩阵对于位于该片段内的解剖结构(优选地,骨结构)是更精确的。因此,构造仅计及相应图像片段中的解剖结构的至少两个配准矩阵。对于建立相应图像片段的配准矩阵而言,不考虑该相应图像片段外部的解剖结构。因此,不同图像片段的至少两个配准矩阵可以彼此不同。因此,每个配准矩阵仅表示适配于相应片段内的患者解剖结构的变换操作。
20.第三步骤涉及检测外科手术器械在当前图像中的位置,该位置对应于目标图像的图像片段。在这里,可以应用在医学图像处理领域中本身众所周知的对象检测过程。外科手术器械可以是例如导管、支架等,或者仅仅是器械的特定部分。
21.根据本发明的优选实施例,使用二维实时器械跟踪技术来执行该步骤。例如,在lessard、s等人的“automatic detection of selective arterial devices for advanced visualization during abdominal aortic aneurysm endovascular repair”(in:med eng phys.,2015年,vol. 37(10),第979
‑
986页)中描述了对象检测过程。替代地,用户可以通过经由用户接口提供手动输入来提供关于外科手术器械在当前图像中位于何处的信息。
22.该步骤基于如下创造性见解:即,在目标图像中标识的至少一个图像片段以及该片段内的解剖结构也存在于当前图像中。换句话说,通过验证检测到的位置属于目标图像的哪个图像片段,将检测到的外科手术器械的当前位置指派给一个图像片段。因此,检测到的位置对应于目标图像中定义的一个图像片段。换句话说,首先需要例如通过使用用于配准目标图像和当前图像的配准技术将目标图像边界传递到当前图像。例如,为了简化该方法步骤,可以将目标图像和当前图像配准到共同的坐标系,优选地是c形臂x射线设备的坐标系。
23.本发明方法的第四步骤涉及通过使用被指派给根据外科手术器械在当前图像内的位置的图像片段的配准矩阵来融合当前图像和参考图像,从而生成医学结果图像。为了融合当前图像和参考图像,与当前外科手术器械位置所属于的图像片段相对应的配准矩阵首先被应用于参考图像,以将解剖结构对准到目标图像,并且由此也对准到当前图像。然后,合并/融合/叠加参考图像和当前图像。
24.根据另一个优选实施例,将图像片段特定的配准矩阵全局地应用于参考图像。尽管在片段特定的配准矩阵中定义的变换基于相应图像片段内的解剖结构,但是将该配准矩阵应用于完整参考图像,而不仅仅是与目标图像中的图像片段相对应的参考图像扇区。因此,在结果图像中提供了针对(包括器械位置的)该图像片段的最高配准准确度,从而接受针对结果图像的其余图像部分的较小叠加准确度。结果图像对应于包括关于外科手术器械的最新位置的信息的图像叠加、以及血管系统的优选全局概览,并且用于用户的手术内指导。
25.本发明方法通过确定当前器械位置并且应用对于与检测到的器械位置相对应的图像片段最精确的配准矩阵,来提供针对外科手术图像指导的介入内或手术内高配准准确度。
26.根据本发明的优选实施例,在用于在目标图像内定义至少一个图像片段、以及通过针对目标图像内的每个图像片段建立配准矩阵来将参考图像与目标图像配准的方法步骤中,将当前图像用作目标图像,其中配准矩阵特定于相应的图像片段。根据该实施例,本发明有利地仅需要两个图像来生成结果图像。
27.根据本发明的另一个优选实施例,在外科手术介入的过程中重复地更新当前图像,并且同样使用更新的当前图像来重复用于检测器械位置和生成结果图像的步骤。换句话说,可以在医学介入或外科手术的过程中重复地应用本发明方法,以重复地提供用于介入指导的更新的结果图像。在每次迭代中或针对每个当前图像,检查当前器械位置位于哪
个图像片段中。如果器械位置在两个连续当前图像的获取之间从一个图像片段移动到另一个图像片段,则相应地更新配准矩阵,以用于针对两个连续当前图像中的第二个生成结果图像。针对所有进一步的迭代,只要器械尖端停留在相应图像片段内,就使用更新的配准矩阵。在该实施例中,结果图像对应于包括关于介入期间的外科手术器械的最新位置的信息的图像叠加、以及血管系统的优选全局概览,其中根据外科手术器械位置来选择被应用于参考图像的配准矩阵。
28.根据本发明的另一个优选实施例,在用于在目标图像内定义至少一个图像片段、以及通过针对目标图像内的每个图像片段建立配准矩阵来将参考图像与目标图像配准的步骤中,将在外科手术介入期间首先获取的当前图像用作目标图像。换句话说,目标图像对应于在外科手术介入期间获取的众多当前图像中的第一个。通过这种方式,有利地简化了使用目标图像定义的至少一个图像片段到众多当前图像的应用或传递,这是由于当前图像是利用相同的医学成像设备来获取的,并且因此从开始就被配准到相同的坐标系。
29.根据本发明的另一个优选实施例,在外科手术介入的过程中,用于在目标图像内定义至少一个图像片段、以及通过针对目标图像内的每个图像片段建立配准矩阵来将参考图像与目标图像配准的步骤被重复,其中将更新的当前图像用作目标图像。因此,建立至少一个更新的配准矩阵,其中在用于生成医学结果图像的步骤中应用该至少一个更新的配准矩阵。本发明的该实施例有利地计及了目标图像与当前图像之间的严重改变,该严重改变可能在外科手术介入期间发生,并且禁止了针对当前图像继续使用原始目标图像和对应配准矩阵。
30.此外,根据本发明的该实施例,将图像片段特定的配准矩阵全局地应用于参考图像以便生成结果图像。换句话说,对应于片段特定配准的几何变换不仅逐片段地应用于参考图像,而且还应用于完整参考图像。该方法确认了如下事实:即,外科手术器械当前所位于的图像片段外部的结果图像中的解剖结构的叠加的不准确性和/或偏差不会严重地影响介入指导的质量,只要该图像片段内的配准质量最高(at maximum)即可,以便在外科手术器械当前所位于的地方提供最优指导。
31.根据本发明的另一个优选实施例,用于检测器械位置和生成结果图像的步骤是实时或接近实时地执行的。该实施例有利地允许为用户瞬时显示结果图像和/或更新的结果图像的连续序列。
32.本发明的另一个方面涉及一种用于使用当前图像、目标图像和参考图像来生成医学结果图像的计算单元。计算单元包括定义单元,定义单元被适配成在目标图像内定义至少一个图像片段。计算单元包括配准单元,配准单元被适配成通过针对每个图像片段建立至少一个配准矩阵来将参考图像与目标图像配准。计算单元包括检测单元,检测单元被适配成检测外科手术器械在当前图像中的位置,该位置对应于目标图像的一个图像片段,并且计算单元包括生成单元,生成单元被适配成:通过使用被指派给根据外科手术器械的位置的图像片段的配准矩阵来融合当前图像和参考图像,从而生成医学结果图像。计算单元可以可选地包括获取单元,获取单元被适配成例如从医学成像设备、pacs、云存储装置等获取和/或接收和/或加载当前图像、目标图像和参考图像。
33.根据本发明的计算单元被适配成实现本发明方法。计算单元可以被配置成特别地执行如下步骤:通过使用被指派给根据外科手术器械的位置的图像片段的配准矩阵来融合
当前图像和参考图像,从而生成医学结果图像。计算单元可以同样地被布置成针对医院、医学场所等中的个体医学成像设备和/或若干个医学成像设备来执行本发明方法的所有步骤。
34.计算单元可以实现为数据处理系统或数据处理系统的一部分。这种数据处理系统可以例如包括云计算系统、计算机网络、计算机、平板计算机、智能电话等。计算单元可以包括硬件和/或软件。例如,硬件可以是处理器系统、存储器系统以及其组合。硬件可以由软件来配置和/或由软件来操作。一般而言,所有单元、子单元或模块可以至少暂时地彼此进行数据交换,例如经由网络连接或相应的接口。
35.本发明的另一个方面涉及一种用于使用当前图像、目标图像和参考图像来生成医学结果图像的医学成像设备。医学成像设备包括本发明的计算单元。优选地,计算单元在物理上被集成到医学成像设备中。替代地,计算单元可以在物理上与医学成像设备分开地定位。医学成像设备是用于医学目的的成像设备。特别地,医学成像设备可以涉及使用光学电磁辐射和/或x射线辐射的成像。特别地,医学成像设备可以是磁共振成像设备、计算机断层扫描成像设备、x射线成像设备、正电子发射断层扫描(pet)成像设备和/或超声成像设备。最优选地,医学成像设备是通常用于获取血管造影术和/或荧光透视术图像的c形臂x射线设备。
36.本发明的另一个方面涉及一种包括程序元件的计算机程序产品,当该程序元件被加载到计算单元的存储器中时,该程序元件促使计算单元执行本发明方法的步骤。
37.本发明的另一个方面涉及一种计算机可读介质,其上存储有由计算单元可读取和/或可执行的程序元件,以便当该程序元件被计算单元执行时实行技术操作,例如包括本发明方法的步骤。
38.通过计算机程序产品和/或计算机可读介质对本发明的实现具有如下优点:即,已经存在的提供系统可以容易地被软件更新所采用,以便如本发明所提出的那样工作。
39.例如,计算机程序产品可以是计算机程序,或者包括计算机程序本身旁边的另一个元件。该另一个元件可以是硬件,例如其上存储有计算机程序的存储器设备、用于使用计算机程序的硬件密钥等,和/或可以是软件,例如用于使用计算机程序的文档或软件密钥。计算机程序产品可以进一步包括开发材料、运行时系统和/或数据库或程序库(library)。计算机程序产品可以分布在若干个计算机实例当中。
40.根据将关于附图详细描述的以下描述和实施例,上面描述的发明的特性、特征和优点以及实现它们的方式变得更清楚且更容易理解。该以下描述并不将本发明限于所包含的实施例。在不同的附图中,相同的组件或部分可以用相同的参考符号来标记。一般而言,附图不是按比例绘制的。在下文中:图1 示出了根据本发明实施例的本发明方法的示意性流程图,图2 示出了根据本发明的另一个实施例的本发明方法的示意性流程图,图3 描绘了根据本发明实施例的包括计算单元的采用c形臂x射线成像设备形式的医学成像设备的示意图,图4 示出了根据本发明实施例的包括分割平面的参考图像,以及图5 示出了根据本发明的另一个实施例的包括分割平面的目标图像。
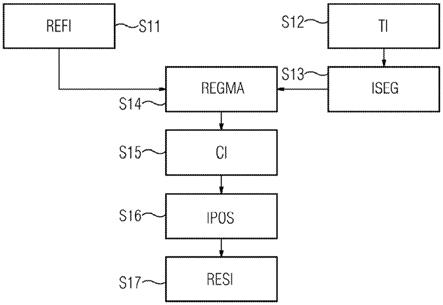
41.图1示出了根据本发明实施例的本发明方法的示意性流程图。在第一步骤s11中,
获取参考图像refi。该步骤包括:或者使用医学成像设备进行图像获取,和/或将对应的参考图像数据集从本地或中央存储单元(如pacs或云存储装置)加载到计算单元7中以用于进一步处理。参考图像refi优选地是三维mra或cta,其示出了至少覆盖待成像患者的身体区域的血管系统的概览。优选地,使用对比剂来获取三维参考图像,这是因为那些图像最适合于对血管系统进行成像。参考图像refi还描绘了患者的骨结构。在第二步骤s12中,获取目标图像ti。这优选地包括使用医学成像设备进行图像获取,但是也可以包括将对应的目标图像数据集从本地或中央存储单元(如pacs或云存储装置)加载到计算单元7中以用于进一步处理。目标图像ti优选地是三维血管造影术图像,该三维血管造影术图像是在外科手术介入开始时应用对比剂的情况下使用c形臂x射线成像设备1来获取的。因此,目标图像ti也描绘了患者的血管系统。目标图像ti优选地具有与参考图像refi相同或相似的视场,然而也可以具有更小的视场。目标图像ti也描绘了骨结构。虽然目标图像ti对应于介入内图像数据集,但是参考图像refi而是对应于外科手术介入之前或之前很久被获取的图像。因此,目标图像ti表示所成像的身体区域中的患者解剖结构的当前或最新状态。在第三步骤s13中,在目标图像ti中定义至少一个图像片段iseg。替代地,可以在参考图像refi中定义图像片段iseg。图像片段iseg被对准到解剖结构(例如,骨和/或骨界标)和/或根据该解剖结构而定向。例如通过设置至少一个分割平面sp来定义图像片段iseg,该分割平面sp被对准到所描绘的身体区域中的解剖结构、和/或根据该解剖结构而定向。优选地,目标图像ti经由输出单元48被呈现给用户,并且由考虑所描绘的患者解剖结构的用户经由输入单元50手动地输入分割平面sp。例如,用户可以使用激活的鼠标光标在期望的位置处画线。为了进一步的用户支持,目标图像ti以及参考图像refi两者都可以被呈现给用户。基于这两个图像中的患者解剖结构之间的局部偏差,用户可以单独地决定适合于该患者的图像片段iseg的数量和位置。例如,可以定义三个图像片段iseg。替代地,至少一个分割平面sp可以由计算单元7来自动设置,并且经由输入/输出单元48/50被呈现给用户以用于确认或校正。此外,可以在没有用户输入的情况下完全自动地执行步骤s13。在这里,首先可能需要对目标图像ti和/或参考图像refi进行分割以标识解剖结构。基于所分割和分析的解剖结构(如骨、器官、组织等),可以自动设置分割平面sp。在第四步骤s14中,将目标图像ti和参考图像refi彼此配准。该步骤s14包括:针对每个图像片段iseg建立配准矩阵regma。每个图像片段iseg的配准矩阵regma特定于图像片段iseg,这是由于它仅计及图像片段iseg内的解剖特征。配准矩阵对应于数学变换的总和,这些数学变换在被应用于参考图像refi的每个图像元素时,使相应图像片段iseg内的解剖结构与目标图像ti中的对应解剖结构一致。配准优选地是基于强度的刚性配准。在进一步的步骤s15中,获取当前图像ci。当前图像ci对应于在目标图像ti在其中被获取的相同外科手术介入过程中所获取的二维荧光透视术图像。当前图像ci通常描绘了比目标图像ti更小的视场。换句话说,当前图像ci的视场被准直到所成像的身体区域内的更小的感兴趣区域,例如发生外科手术介入的地方。当前图像ci通常是在不涉及对比剂的情况下获取的。为了进一步减少针对患者的对比剂负担,当前图像ci可以在步骤s12、s13和s14中用作目标图像ti。最优选地,在外科手术介入过程中获取众多当前图像ci,每个当前图像ci描绘了外科手术过程和/或解剖结构的最新状态。详细地,当前图像ci描绘了医学器械(的一部分)的位置ipos,优选地是导管尖端在所描绘的血管系统中的位置。在另一个步骤s16中,使用众所周知的器械跟踪技术来检测当前器械位置ipos。优选地,使用
二维实时器械跟踪技术来跟踪器械。由于目标图像ti和当前图像ci是使用相同的c形臂x射线成像设备1来获取的,因此器械位置ipos可以容易地被传递到目标图像ti,并且被指派给至少一个图像片段iseg中的一个,其中每个图像片段还被指派有特定的配准矩阵regma(参见上文)。在最后的步骤s17中,使用被指派给该器械在当前图像ci中所位于的图像片段iseg的配准矩阵regma以通过如下方式来生成结果图像resi:首先将所提及的配准矩阵regma应用于参考图像refi,并且然后融合当前图像ci和参考图像refi。需要提及的是,可以特别地建立配准矩阵regma,即专门地用于相应图像片段iseg内的患者解剖结构。然而,在步骤s17中,配准矩阵regma是被全局地应用的,即应用于参考图像refi的所有图像元素(即,体素)。因此,当前图像ci和经变换的参考图像refi的重叠或叠加(即,结果图像resi)在外科手术器械所位于的所描绘的图像区域中为用户提供了最优介入指导。这是由于如下事实:即,在包括器械位置ipos的图像片段iseg中,对参考图像refi的配准是利用特别适配于该图像片段iseg中的患者解剖结构的相应配准矩阵regma来进行的,其中配准矩阵regma可能仅次优地适合于周围身体区域。可以将结果图像resi立即呈现给用户。不仅可以实时或接近实时地执行步骤s16,而且还可以实时或接近实时地执行步骤s17。
42.图2示出了根据本发明的另一个实施例的本发明方法的示意性流程图。基本上,步骤s21、s22、s23、s24、s25、s26和s27分别对应于步骤s11、s12、s13、s14、s15、s16和s17,并且可以用与已经关于图1描述的方式相同的方式来执行。然而,图2进一步包括迭代循环i1,该迭代循环i1基于外科手术介入期间的当前图像ci的更新。如已经关于图1所指示的,在外科手术介入期间可以获取若干个当前图像ci。步骤s25(获取当前图像ci)、步骤s26(检测外科手术器械的当前位置ipos)、以及步骤s27(使用该器械当前所位于的图像片段iseg的配准矩阵regma来生成结果图像resi)被不断地重复,从而提供更新的结果图像resi,每个结果图像描绘了外科手术器械在全局解剖概览(尤其是由参考图像refi提供的血管系统概览)的情境下的最新位置ipos。根据图1中的步骤s15,可以将在迭代循环i1中首先获取的当前图像ci用作目标图像ti。此外,图2还包括迭代循环i2,根据该迭代循环i2,在当前图像ci或目标图像ti与参考图像refi之间的解剖偏差高于针对有用图像配准的最大可接受的预定义阈值的情况下,可以同样在外科手术介入过程中更新目标图像ti,以针对每个图像片段iseg根据步骤s24来提供至少一个更新的配准矩阵regma。在这里,可以使用在外科手术介入过程中获取的当前图像ci来更新目标图像ti。
43.在下文中,本发明再次被概述从而描述神经介入过程的用例。然而,要注意的是,本发明不限于这种特殊用例,而是可以应用于其他外科手术介入过程、以及不同的身体区域(例如,腹部或腿部)。
44.本发明可以例如有利地应用于外科手术介入,如头部、颈部或脊髓中的神经介入。在这里,三维诊断cta/mra参考图像数据集refi可能无法用于在外科手术介入期间提供足够的指导。这可能主要是由于颈椎扭曲,即局部解剖偏差,使用全局配准技术可能难以计及该局部解剖偏差。为了克服该障碍,本发明将全局配准问题分解成多个局部配准,诸如例如胸部区域(胸部图像片段)配准、颈区域(颈部图像片段)配准和颅部区域(头部图像片段)配准,这取决于外科手术器械(即导管)的当前位置ipos。换句话说,本发明使用目标图像ti和参考图像refi在基于强度的刚性变换的基础上执行自动且区域特定的3d/3d配准,并且将其与2d实时导管跟踪方法相组合。作为结果,针对c形臂x射线成像设备的当前c形臂位置、
以及当前感兴趣区域(即,外科手术器械当前所位于的图像片段iseg),实时实现了更高的配准准确度,而无需附加的对比剂注射和/或血管造影术获取。
45.首先,优选地,获取覆盖了相似区域的两个3d体积数据集(例如,描绘血管树的介入前cta=参考图像refi,并且同一患者的介入内低剂量3d非对比(non
‑
contrasted)血管造影术=目标图像ti)。接下来,在目标图像ti中定义分割平面sp,以基于两个3d图像中描绘的共同骨结构来分割不同的解剖片段/区域iseg,例如:胸部、颈部和颅部区域。这优选地通过用户交互来执行以定义平面sp。例如,用户可以定位与以下界标对准的至少一个分割平面:颅底(skull base)、颈椎、胸椎。图4描绘了根据本发明实施例的参考图像refi,其至少示出了患者的头部、颈部和胸部的骨以及血管结构。图5描绘了根据本发明的另一个实施例的目标图像ti,其表示相同的身体区域并且同样地至少表示骨和血管结构。此外,在参考和目标图像refi、ti两者中,描绘了两个分割平面sp,这两个分割平面sp用于将头部图像片段与颈部图像片段以及进一步与胸部图像片段分割开。然后,针对每个对应的解剖图像片段iseg执行基于强度的自动配准,该自动配准搜索3d cta与3d血管造影术之间的刚性运动变换,包括旋转、平移、缩放。配准准确度可以由用户来确认,其中可以允许微小的手动调整。配准矩阵regma(在这里,针对头部、颈部和胸部图像片段各一个)被单独地保存。每个配准矩阵regma稍后将被应用于参考图像refi的完整体积(即,每个个体图像元素)上,但是仅在其相应图像片段iseg中确保最高的配准准确度。更进一步,开始对患者的介入内二维荧光透视术以生成至少一个初始当前图像ci。优选地,使用针对胸部图像片段而建立的配准矩阵regma将3d参考图像refi配准到c形臂x射线血管造影设备的当前3d轴(如在从胸部到头部发生的随后导管运动中那样),并且然后将其叠加到初始当前图像ci上并将其显示以用于初始介入指导。例如,将参考图像refi虚拟地投影到针对c形臂x射线血管造影系统1的当前几何形状的2d检测器平面(其包括初始当前图像ci)上。还可以将分割平面sp的表示投影到当前图像ci上。因此可以并且必须在该过程中更进一步利用血管造影术系统1的几何改变来动态地更新3d参考图像refi。使用虚拟投影提供的光学指导,可以开始导管插入术,并且使用连续获取的当前图像ci来跟踪例如导管尖端位置ipos的连续移动。关于跟踪,文献中已经报告了大量方法,例如baert、s.a.m等人的“guide wire tracking during endovascular interventions”(in ieee trans. med. imaging;vol. 28,no. 8;第965
‑
972页;2003年),或wang、peng等人的“robust guidewire tracking in fluoroscopy”(in:proc. ieee comput. vis. pattern recognit;第691
‑
698页;2009年)。连续地检测并且记录导管尖端位置ipos以及移动方向。一旦器械位置ipos到达或穿过胸部与颈部之间的分割平面sp,就在如下意义上更新配准:激活并且使用该颈部图像片段的配准矩阵regma,以更新3d参考图像refi,并且通过将经变换的参考图像refi与当前图像ci叠加来生成结果图像resi。只要导管尖端位置ipos位于该颈部图像片段内,就应用该颈部图像片段的配准矩阵regma。一旦导管尖端再次移动超出分割平面sp,就再次更新配准。
46.本发明改进了针对外科手术器械当前所位于的特定感兴趣区域的每个当前图像ci的配准的准确度,并且因此增强了介入过程期间的3d指导的功效。不需要任何附加的对比剂注射或x射线曝光,从而改进了临床工作流程,并且为患者减少了碘化对比剂和辐射引发的副作用。
47.图3描绘了根据本发明实施例的医学成像设备1。该医学成像设备是采用c形臂x射
线设备形式的单平面血管造影x射线系统1。c形臂设备1包括支架(stand),该支架形成为包括六个轴的铰接机器人,并且被布置成保持c形臂2。c形臂2在其端部处分别包括x射线源3(例如,x射线管单元和准直仪)以及x射线检测器4。血管造影系统1被可旋转地安装,它可以围绕如下旋转中心和/或旋转轴而旋转:该旋转中心和/或旋转轴被布置在c形臂2的平面中和/或穿过c形臂2的平面。血管造影系统1本身可以以固定或可移动的方式来安装。患者工作台5位于x射线源3的射束路径中,以便放置要利用c形臂1来成像的患者6。根据该实施例的医学成像设备1包括形成为计算机的计算单元7。计算单元7可以在物理上是c形臂设备1的一部分。计算单元7通常被配置成接收和处理由x射线检测器4检测到的图像信号,例如当前图像ci和/或目标图像ti。然而,计算单元7同样地被配置成从内部或外部存储单元(例如,存储单元60或云存储装置)接收和/或加载医学图像。所处理和/或生成的图像(例如,当前图像ci和/或结果图像ri)可以显示在监视器单元9的显示屏上以供用户考虑。监视器单元9可以包括若干个屏幕监视器,特别是平板屏幕。计算单元7可以替代地被配置为没有在物理上连接到c形臂成像系统1的独立单元。计算单元7可以进一步与输出单元48和输入单元50连接,以用于数据交换。输出单元48和监视器单元9也可以被实现为仅一个单元。输出单元48可以例如用于目标图像ti的图形显示从而使得能够手动设置分割平面,和/或用于目标图像ti内的自动设置的分割平面和/或自动生成的配准矩阵的图形显示,然后用户可以使用输入单元50来确认或校正这些分割平面和/或配准矩阵。输入单元50因此用于选择/确认和/或校正经由输出单元48呈现的信息。输出单元48可以形成为lcd屏幕、等离子屏幕、或oled屏幕,其可以进一步是触摸屏,该触摸屏然后也用作输入单元50。输入单元50可以进一步实现为键盘、鼠标、麦克风或相机,麦克风或相机用于检测和处理由用户提供的听觉或视觉输入信号。
48.计算单元7可以连接到x射线检测器4和/或x射线管3以用于数据交换,其中该连接可以是有线或无线的。
49.计算单元7包括图像处理单元8。图像处理单元8进一步细分成定义单元81、配准单元82、检测单元83和生成单元84。图像处理单元8的子单元或模块81、82、83、84被配置成分析、操纵、处理或生成x射线图像,特别是参考图像refi、目标图像ti、当前图像ci和/或结果图像resi。例如,定义单元81可以被配置成对医学图像执行对象、界标和/或纹理分析等,并且对应地分割医学图像中的解剖结构,如器官或组织,特别是骨和血管系统。定义单元81进一步被配置成定义至少一个图像片段iseg,例如通过定义被对准到目标图像ti中所分割的解剖结构的至少一个分割平面sp。检测单元83被配置成检测当前图像ci中的外科手术器械。检测单元83特别地被配置成:使用多个连续的当前图像ci在外科手术介入过程中跟随移动的器械位置和/或移动的器械部件位置ipos,该器械部件例如导管尖端。配准单元82被配置成不仅将参考图像refi配准到目标图像ti,而且还在适用和必要的情况下将目标图像ti配准到当前图像ci。配准矩阵特别地被配置成针对在目标图像ti中定义的个体图像片段iseg建立个体配准矩阵,其中个体配准矩阵regma在每个配准矩阵regma仅计及位于相应图像片段iseg内的解剖结构的意义上是图像片段特定的。生成单元84被配置成通过如下方式来生成结果图像resi:标识与外科手术器械所位于的图像片段iseg相关的配准矩阵regma,并且然后应用所标识的配准矩阵regma来融合参考图像refi和当前图像ci。计算单元7还包括存储单元60。存储单元60用于存储关于分割平面sp、检测到的界标、器官、组织、结构等的
所定义的位置和/或取向、和/或所建立的配准矩阵regma的信息,每个信息用于本发明方法的过程中的后续使用。
50.计算单元7可以与计算机可读介质结合地起作用,特别是使用包括程序代码的计算机程序来执行本发明方法。计算机程序可以存储在计算机可读介质上。计算机可读介质可以特别地是cd、dvd、蓝光光盘、记忆棒或硬盘。计算单元7可以以硬件和/或软件的形式来实现。例如,计算单元7可以实现为fpga(“现场可编程门阵列”),或者包括算术逻辑单元。
51.在该实施例中,存储单元60存储至少一个计算机程序,当该计算机程序在计算单元7上执行时,该计算机程序执行本发明方法的所有步骤。该计算机程序可以包括程序代码。该计算机程序可以在单独的计算系统上实现。例如,医学成像设备1可以被配置成使得计算单元7经由互联网或内联网将该计算机程序加载到其内部随机存取存储器中,以用于执行根据本发明方法的步骤。
52.在任何适用的情况下,个体实施例、其个体方面和/或特征可以在不限制或扩大所描述的发明的范围的情况下彼此组合或交换,只要这种组合或交换是有意义的并且在本发明的意义内。关于本发明的一个实施例所描述的优点在任何适用的情况下也有利于本发明的其他实施例。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1