棉花抗坏血酸过氧化物酶基因APX及其应用的制作方法
本发明属于植物分子生物学和基因工程
技术领域:
,具体涉及一种棉花抗坏血酸过氧化物酶基因APX及其在提高植物抗黄萎病菌中的应用。
背景技术:
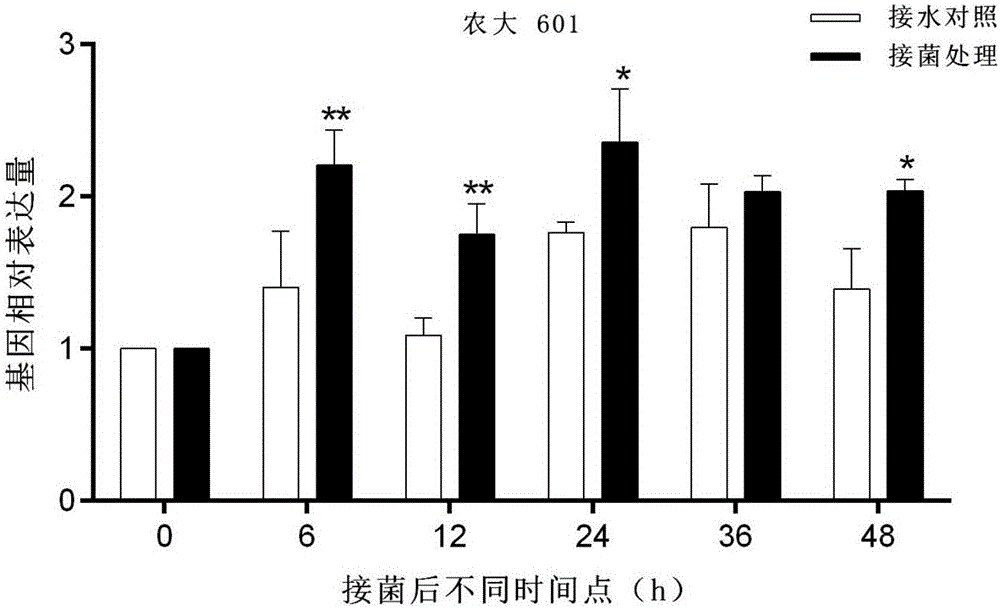
:棉花黄萎病极具传染性,可在世界范围内进行传播。自1935年美国斯字棉种被引入以来,黄萎病在我国逐渐传播扩散。该病原菌以微菌核的形式存在土壤数年,一旦条件适宜会再度爆发,因而难以根治。上世纪90年代,该病害已在我国各大棉区包括新疆在内大范围爆发。据不完全统计,每年其发病面积约300万hm2,我国每年因黄萎病导致的直接经济损失可达约20亿元。大丽轮枝菌是导致我国棉花黄萎病发生的首要病原菌,大丽轮枝菌的侵入位点是寄主植物的根尖部分,当病菌侵入寄主后,在导管内定殖,从而诱使寄主分泌细胞壁降解酶和毒素导致寄主细胞坏死,还会分泌胶状物质导致维管束堵塞,致使植物水分以及营养物质输送产生困难,叶片失水萎蔫、植株变形。棉花黄萎病严重制约着我国棉花的生产及发展,至今通过栽培研究、改进耕作方法还不能有效对黄萎病进行防控。目前最经济有效的措施之一是选育抗病品种。海岛棉相对于陆地棉对黄萎病的抗性较强,但利用海陆杂交等传统方法选育抗病品种效率低、耗时长、盲目性和不可预测性强,抗病杂交种质的获得极为困难。随着现代分子生物学的飞速发展,转基因技术以及大量抗病基因的挖掘为培育抗黄萎病新品种提供技术手段以及基因资源。因此,挖掘抗病基因并解析其抗病机制,对棉花现代分子育种以及抗病育种具有重要意义,也是棉花育种工作者不可轻视的紧要任务。植物在生长发育过程中受到一定的胁迫时,植物体内便会产生过量对植物本身有较强毒害作用的活性氧(Reactiveoxygenspecies,简称ROS),导致ROS在植物体内产生和清除之间的动态平衡遭到破坏,引起细胞损伤。H2O2是活性氧之一,病菌侵入植株以后,其中H2O2可以引发一系列反应进行防御,但H2O2过度积累,又不能被及时转换,就会引发细胞死亡。为了响应H2O2对植物体的毒害,在动植物以及微生物中广泛存在过氧化物酶类,其中抗坏血酸过氧化物酶APX与H2O2的亲和力最强。它以抗坏血酸作为电子供体来清除过氧化氢,反应为:2AsA+H2O2→2MDA-AsA(单脱氢抗坏血酸)+2H2O。APX(Ascorbateperoxidase)即维生素C过氧化物酶,它属于末端氧化酶的一种,已知其存在于细胞的叶绿体基质、类囊体膜、微体与细胞质,可以分解H2O2从而降低氧自由基浓度,减轻对植物细胞的损伤,具有重要的生物学保护功能。现在APX已经成为当今植物耐逆抗逆研究的热点。植物APX基因家族由细胞质、线粒体、过氧化物酶体和叶绿体这4个亚家族构成。据研究报道拟南芥(ArabidopsisthalianaL.)APX家族有6个基因,其中细胞质中有3个(APX1、APX2和APX6),过氧化物酶体存在3个(APX3、APX4和APX5),还有叶绿体基质的sAPX和结合在类囊体膜上的tAPX。水稻(Oryzasativa)APX家族也有8个成员,2个在细胞质、3个在叶绿体、2个在过氧化物酶体,另一个在线粒体上结合。李泽琴等研究表明,抗坏血酸过氧化物酶APX在多种非生物逆境胁迫应答调控网络中具有重要作用。冯晴等发现在小麦叶片衰老的中后期,APX在清除H2O2中起着更重要的作用。目前,已经从许多植物中克隆到APX基因。Sarowar等将辣椒的APX基因转入烟草,从而提高了转基因烟草的抗氧化胁迫与抗真菌能力。Kornyeyev将豌豆叶绿体APX基因转入棉花Coker312,提高了抗氧化能力和PSⅡ光化学活性。Murgia等过表达拟南芥tAPX基因增加对百草枯的氧逆境抗性。将拟南芥胞质APX3基因转入烟草超表达,在断水情况下可以增加种子数。Yabuta研究发现,转基因烟草和拟南芥植株的tAPX过量表达后对甲基紫精引起的氧化胁迫的抗性都有了明显的提高。迄今为止,关于APX基因在棉花中的功能研究还非常有限。前人报道APX基因可以增强植物耐逆性,增强抗氧化代谢水平,增强抗真菌病害能力。APX基因介导棉花黄萎病的抗病机制还不清楚。技术实现要素:本发明的目的是提供棉花抗坏血酸过氧化物酶基因APX及其应用。为了达到以上目的,本发明提供的棉花抗坏血酸过氧化物酶基因APX,是如下:1)SEQIDNo.1所示的核苷酸序,或2)在SEQIDNo.1所示的核苷酸序列中经取代、缺失或添加一个或几个核苷酸且具有同等功能的由1)衍生的核苷酸序列;或3)在严格条件下与SEQIDNO.1所示序列杂交且表达相同功能蛋白质的核苷酸序列,所述严格条件为在含0.1%SDS的0.1×SSPE或含0.1%SDS的0.1×SSC溶液中,在65℃下杂交,并用该溶液洗膜;或4)与1)、2)或3)的核苷酸序列具有80%以上同源性且表达相同功能蛋白质的核苷酸序列。其中3)所述的严格条件是指探针将与其靶序列杂交至可探测程度超过与其它序列杂交(如至少2倍于背景)的条件。严格条件具有序列依赖性,且因环境的不同而不同。通过控制杂交和/或洗涤条件的严格性,可以鉴定与探针100%互补的靶序列(同源探测)。可选择地,可以调节严格条件以允许一些序列错配,使得探测到较低程度的相似性(异源探测)。通常,探针长度短于大约1000个核苷酸,优选地短于500个核苷酸。典型地,严格条件是在pH值7.0-8.3下盐浓度低于大约1.5MNa离子,典型地大约0.01-1.0MNa离子浓度(或其它盐类),温度对短探针(如10-50个核苷酸)至少大约30℃,对长探针(如超过50个核苷酸)至少大约60℃。通过添加去稳定剂如甲酰胺也可获得严格条件。低严格条件,例如,包括在30-35%甲酰胺、1MNaCl、l%SDS(十二烷基磺酸钠)的缓冲溶液中37℃杂交,在1×至2×SSC(20×SSC=3.0MNaCl/0.3M柠檬酸三钠)中50-55℃洗涤。中度严格条件,例如,包括在40-45%甲酰胺、1.0MNaCl、l%SDS的缓冲溶液中37℃杂交,在0.5×至1×SSC中55-60℃洗涤。高度严格条件,例如,包括在50%甲酰胺、1MNaCl、l%SDS的缓冲溶液中37℃杂交,在0.1×SSC中60-65℃洗涤。非必要地,洗涤缓冲液可含有大约0.1%-1%的SDS。杂交时间一般少于大约24小时,通常大约4-12小时。本发明提供了棉花抗坏血酸过氧化物酶基因APX编码的蛋白,其氨基酸序列为:(a)由SEQIDNO.2所示的氨基酸序列组成的蛋白;或(b)将SEQIDNO.2的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加由SEQIDNO.2衍生的且保持SEQIDNO.2所示的蛋白功能的蛋白。本发明提供了含有棉花抗坏血酸过氧化物酶基因APX的生物材料,所述生物材料为重组表达载体、表达盒、重组菌或宿主细胞。本发明提供了上述棉花抗坏血酸过氧化物酶基因APX或含有该基因的生物材料在制备转基因植物中的应用。本发明提供了上述棉花抗坏血酸过氧化物酶基因APX或含有该基因的生物材料在制备抗黄萎病菌植物中的应用。本发明提供了上述棉花抗坏血酸过氧化物酶基因APX或含有该基因的生物材料在提高植物抗黄萎病菌中的应用。本发明还提供一种用于克隆棉花抗坏血酸过氧化物酶基因APX的引物对,其上下游引物的核苷酸序列分别如SEQIDNO.3-4所示。含有上述引物对的试剂盒属于本发明的保护范围。本发明提供了上述引物对或含有该引物对的试剂盒在制备抗黄萎病菌转基因植物中的应用。本发明提供了上述棉花抗坏血酸过氧化物酶基因APX或含有该基因的生物材料或本发明所述的引物对在作物种质资源改良中的应用。本发明的有益效果在于:本发明以构建的黄萎病菌胁迫海岛棉cDNA全长文库为基础,克隆棉花内源APX基因,利用实时定量PCR技术分析在黄萎病菌以及在SA、MeJA、ET等外源激素诱导下APX的时空表达差异,并利用VIGS技术负向验证APX基因功能,发现该基因对棉花黄萎病具有抗性;最后构建超表达载体将该基因转化烟草,验证APX基因具有抵抗棉花黄萎病的功能,本发明为揭示APX基因的抗黄萎病机制奠定基础,也为棉花抗黄萎病分子育种提供基因资源和理论依据。附图说明图1A-图1C分别是APX基因Pima90-53,农大601(Nongda601)和中棉所8号(CCRI8)接种黄萎病菌后的表达量变化,其中CK为不同品种接水对照,Vd为对应的接黄萎病菌的处理。Real-timePCR结果分析显示,以接水后APX基因的表达为对照,3个品种接菌后APX基因表达量均发生明显变化。在Pima90-53中接菌后6h和12h的表达量极显著上调,24h、36h和48h表达量相对于对照差异均不显著。农大601接菌后APX的表达量在6、12、24和48h等不同时间点均显著高于对照。中棉所8号接菌后6h和36hAPX基因的表达极显著下调,其它时间点与对照相比差异不显著。图2是沉默APX基因后植株对黄萎病的抗性表现。左图为沉默APX基因的棉苗,沉默棉苗在15d左右开始发病,表现为子叶开始发黄掉落,而真叶叶边缘变黄发枯,叶柄中心呈褐色;右图为沉默空载体对照,植株发病较晚,并且发病等级低,大部分植株症状较轻,部分植株子叶掉落,叶边缘泛黄。由此可见,沉默APX基因后(左图)棉苗对黄萎病的抗性较沉默空载体对照差。图3是沉默APX基因后接种黄萎病菌后不同时间点的APX酶活测定结果。结果表明,接菌后空载体对照植株中APX活性呈现升降升趋势且始终极显著高于沉默植株,沉默植株在接菌后APX酶活性很低甚至检测不到。图4是转APX基因的烟草接种黄萎病菌后的抗性表现。左图为转基因烟草叶片正常,右图为对照烟草植株下部叶片失绿发黄,转基因植株发病症状明显轻于野生型对照。图5是转基因烟草的APX酶活测定结果。转基因烟草在接种后APX活性极显著高于野生型烟草。具体实施方式以下实施例进一步说明本发明的内容,但不应理解为对本发明的限制。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明的范围。若未特别指明,实施例中所用的技术手段为本领域技术牛员所熟知的常规手段。若未特别指明,实施例中所用的试剂为市售。实施例1棉花抗坏血酸过氧化物酶基因APX基因的克隆及表达模式分析1.棉苗的种植将海岛棉Pima90-53,中棉所8号和农大601种子用浓硫酸脱绒,浸泡吸水催芽,待其根部生长至1cm转移到营养液浸湿的蛭石中,生长一周后,植株子叶展开,分别选取长势一致的植株,三棵为一组,三次生物学重复,按照根、茎、叶分别取样,冻入液氮。在无RNase环境下,用经高温高压灭菌的研钵,研棒充分研磨,超低温冰箱保存,备用。2.总RNA的提取和反转录上述-80℃保存组织用EasySpin植物RNA提取试剂盒提取总RNA(具体操作步骤见附录B),取2μL提取的RNA,1μLRNA用于琼脂糖凝胶电泳检测RNA的质量,1μLRNA用于RNA浓度检测。于冰上去除基因组DNA,反应体系为:5×gDNAEraserbuffer2μL,gDNAEraser1μL,TotalRNA1μg,RNasefreeH2O补齐至10μL,混匀,42℃2min,后置于冰上,进行反转录。上述去除基因组DNA的反应液进行反转录(PrimeScriptTMRTreagentKitwithgDNAEraser),反应体系为:反应液10μL,RTPrimerMix1μL,5×PrimerScriptBufferII4μL,PrimerScriptRTEnzymeMixI1μL,RNasefreeH2O4μL,混匀,37℃,15min。85℃,5S,4℃保存。3.PCR扩增基于实验室前期所构建的黄萎病菌诱导下的海岛棉全长cDNA文库,筛选获得APX的EST序列,以ORF两侧的序列设计引物得到857bp的克隆基因全长的特异性引物。引物序列如下:F1:5’-TGTGCTCAACTCGTGTCCATCG-3’R1:5’-CTTCTTCCTATTTTTGCAATCATC-3’4.APX基因开放阅读框(ORF)克隆:利用上述所设计的引物,以上述cDNA为模板使用高保真酶PhantaMastermix引物进行PCR扩增:2×PhantaMastermix25μL,QAPX-F(10U/μL)2μL,QC-APX-R(10U/μL)2μL,模板cDNA5μL,ddH2O补齐至50μL。PCR反应程序为94℃5min,94℃30s,54℃30s,72℃1min,共35个循环,72℃10min,4℃保温。PCR扩增产物经1%琼脂糖凝胶电泳检测,回收目的片段,具体操作步骤见附录C。胶回收的DNA片段(具体操作步骤见附录C),按照DNAA-TailingKit试剂盒(生工)使用说明进行加A反应,反应体系为10×A-TailingBuffer5μL,dNTPMixture4μL,A-TailingEnzyme0.5μL,胶回收产物3μL,ddH2O补齐至50μL。混匀后72℃反应20min,冰上静置2min。5.转化大肠杆菌,获得阳性克隆回收的A-TailingDNA产物与T-VectorPMD19(Simple)连接,反应体系:A-TailingDNA1μL,PMD19-TVector(50ng/μL)1μL,SolutionI5μL,ddH2O补齐至10μL。混匀,16℃30min。连接后转化大肠杆菌,具体操作步骤如下:(1)将DH5α大肠感受态细胞,置于冰盒上,在超净台中操作(2)将10μL上述连接产物加入DH5α感受态细胞中,轻弹混匀,冰浴30min;(3)将离心管置于42℃金属浴,热击90s,后立即冰浴3min(勿动);(4)加入500μLLB液体培养基,37℃摇床中(180rpm)活化45min;(5)吸取菌液200μL,加到已制好的LB/Amp/IPTG/X-gal(蓝白斑筛选)平板培养基上,用涂布器均匀涂开。超净吹干,培养皿盖向下倒置在37℃培养箱中过夜(约14h)。挑取白色单菌落于离心管,加入500μLLB/Amp液体培养基于37℃200rpm摇3~5h后进行PCR筛选,检测阳性转化子。阳性克隆检测PCR反应体系为:菌液模板1.5μL,M13F(10μM)1μL,M13R(10μM)1μL,2×EsTaqMasterMix12.5μL,ddH2O补齐至20μL。PCR反应程序为:95℃10min,95℃30s,54℃30s,72℃1min,共35个循环,72℃10min,4℃保温。检测阳性的克隆送测序,APX基因的核苷酸序列如SEQIDNO.1所示,其氨基酸序列如SEQIDNO.2所示。将测序结果进行比对,正确序列的菌液摇混,进行质粒提取,得到pMD19-APX的全长质粒。6.实时荧光定量PCRqRT-PCR采用PremixExTaqTM荧光定量试剂盒,于BIO-RADCFX96Real-TimePCRDetectionSystem中进行,以PP2A(正向引物5'-3':GATCCTTGTGGAGGAGTGGA,反向引物5'-3'CGAAACAGTTCGACGAGAT)为内参,所用染料为THUNDERBIRDTMqPCRMix(TOYOBO)。每个反应设置3次重复。反应体系为:cDNA模板(<100ng)1μL,正向引物(10μM)0.8μL,反向引物(10μM)0.8μL,PremixExTaq10μL,ddH2O补齐至20μL。扩增程序为95℃15s,95℃10s,56℃10s,72℃15s,共40个循环。实时定量PCR中相对表达量的计算采用2-ΔΔCt法,并且利用GraphPadPrism6软件进行统计分析并作图。7.黄萎病菌侵染下的表达分析(1)大丽轮枝菌孢子液制备将黄萎病菌临西2-1菌株接种于25%的马铃薯葡萄糖琼脂培养基(PDA),将平板倒置于25℃培养箱中暗培养一周后,将长有白色菌丝的培养基分成小块接种于上述液体培养基中,摇床中悬浮培养10天(25℃)后,用擦净纸作为过滤网,去除菌丝,将滤后的孢子液浓度调整为血球计数板最小格中有2-3个孢子即1.0×107cfu/mL为宜,现用现配。(2)黄萎病菌侵染材料的处理将3个品种种子催芽后,在蛭石中培养,待其子叶尚未完全展开,侧根未长出前,将其从蛭石中取出,在1/2MS培养液中生根,待其长至两叶一心时,将生长一致、健壮的棉花苗从培养基中连根小心移出后,使其根部浸泡于调试好浓度的黄萎病菌孢子悬浊液中蘸根1min(孢子悬浮液应置于水平摇床以保证孢子悬浮),再小心种于蛭石中。接菌后0h、6h、12h和24h分别取植株根组织,3棵为一组,3次生物学重复,且均以水处理作为对照,提取RNA并合成DNA,分析APX基因在黄萎病菌侵染后的表达情况。结果表明APX基因Pima90-53,农大601(Nongda601)和中棉所8号(CCRI8)接种黄萎病菌后的表达量发生变化(图1A-1C),其中CK为不同品种接水对照,Vd为对应的接黄萎病菌的处理。实施例2利用VIGS技术负向验证APX基因功能1.构建VIGS载体PYL156-APX选择酶切位点XbaI和BamHI,将pYL156载体质粒以及pMD19-APX中间重组子质粒进行双酶切,酶切反应为:10×FastBuffer2μL,质粒DNA1μg,XbaI1μL,BamHI1μL,ddH2O补至20μL。将酶切产物进行连接后转化到大肠杆菌,通过PCR和质粒酶切检测阳性克隆,送测序。经测序确定的菌液,摇混,提质粒转化到农杆菌GV3101中。2.棉花幼苗种植及菌液注射(1)将农大601棉花种子脱绒清洗,加水放置水平摇床,等待萌发,期间勤换水。(2)将露白的种子分散平铺在发芽盘中,湿毛巾覆盖,28℃暗培养。(3)将发芽一致的种子种于蛭石,浇上营养液,覆膜。(4)待种壳脱落子叶几乎平展后,揭掉膜,正常光照。(5)待棉苗两片子叶完全平展时开始注射,参照张桂荣(张桂荣.棉花PR蛋白家族分析及PR10、PR17的功能研究[D].河北农业大学,2015.)注射方法。3.黄萎病菌侵染、取样及抗病性鉴定对照PYL156-CLA1叶片出现白化后,检测目的基因沉默效果,待目的基因沉默后,接种黄萎病菌。接菌后0、6、12和24小时取第二片真叶,3株为一组样品,液氮研磨备用。棉苗接菌后每天观察其发病情况,分别在12d和15d时查看整体发病情况,侵染后分别在15d和20d调查病情指数,病情指数的调查方法参照王国宁(王国宁,赵贵元,岳晓伟,等.河北省棉花黄萎病菌致病性与ISSR遗传分化[J].棉花学报,2012,24(4):348-357.)、李社增(李社增,马平,陈新华,等.相对病情指数划分棉花品种杭病性的统计学基础[J].棉花学报,2003,15(6):344-347.)方法。沉默APX基因后植株对黄萎病的抗性表现见图2。表1是沉默植株接种黄萎病菌后病情指数调查结果。沉默APX基因的植株病情指数为73.66,明显高于空载体对照植株,且对黄萎病抗性低于对照,表现为更感病。表1农大601接菌后的病情指数类别0级1级2级3级4级总株树病指CK112013404834.48APX121127155673.664.APX酶活的测定将冻存样品按照APX酶活测定试剂盒(南京建成)说明书,并结合样品质量及紫外分光光度计测定的OD290的吸光值,计算得到基因沉默植株以及空载体对照植株在黄萎病菌侵染后不同时间点的APX酶活性。结果表明接菌后空载体对照植株中APX活性呈现升降升趋势且始终极显著高于沉默植株,沉默植株在接菌后APX酶活性很低甚至检测不到。沉默APX基因后接种黄萎病菌后不同时间点的APX酶活测定结果见图3。实施例3APX基因转化烟草正向验证其功能1.真核表达载体的构建选择超表达载体PC6的酶切位点为BamHI和KpnI并利用Primer5.0设计引物(Tm:58℃)如下:F(5'-3'):GGATCCATGACCAAGTGTTACCCR(5'-3'):GGTACCTTATGCATCAGCAAATCC进行PCR扩增,PCR反应体系:2×PhantaMastermix25μL,引物F(10U/μL)2μL,引物R(10U/μL)2μL,APX质粒5μL,ddH2O补齐至50μL。PCR反应程序为94℃5min,94℃30s,54℃30s,72℃1min,共35个循环,72℃10min,4℃保温。PCR产物胶回收转化大肠杆菌并送测序,将测序正确的序列提取质粒,然后将带有酶切位点的目的基因质粒及空载体质粒分别进行酶切、连接。连接产物转化大肠杆菌,并送测序。测序结果比对正确的提取质粒,即为PC6-APX2.烟草遗传转化及鉴定(1)烟草叶片准备与灭菌取幼嫩健康的烟草叶片,蒸馏水冲洗干净,70%乙醇浸泡45s,0.1%升汞灭菌6-8min,无菌水冲洗5次,无菌滤纸吸干水分;然后将处理过的无菌叶片剪成0.5cm×0.5cm的小块,叶片近轴面向下,接种在愈伤组织诱导或分化培养基上,预培养2-3天。(2)农杆菌侵染液的制备取10μLPC6-APX的GV3101农杆菌保存菌液接种于2mL液体LB培养基(Rif+,50mg/L;Kan+,100mg/L),于摇床(28℃,180rpm)振荡培养至OD值为0.6-0.8。按1%-2%的比例,转入新鲜的无抗菌素的LB培养液中,继续培养6h,当OD值为0.2-0.5时即可用于转化。(3)农杆菌介导转化烟草在超净工作台上,将与培养的外植体浸泡在盛有菌液的无菌培养皿5min,在无菌滤纸上吸去附着的菌液,然后接种在愈伤组织诱导或分化培养基(烟草的培养基为MS附加IAA0.5mg/L,BA2.0mg/L)上,共培养2d(28℃,黑暗)。将经过共培养的外植体转移到愈伤组织诱导培养基上(Kan100mg/L),25℃培养,每15-20d继代一次,待外植体分化出抗性不定芽或者产生抗性愈伤组织时,转移到生长或分化培养基中,令其生长或诱导分化。待不定芽长到1cm以上时,转入生根培养基上诱导生根,生根后炼苗移栽。(4)阳性植株的筛选与鉴定收获的转基因种子利用氯气杀菌后,用蒸馏水浸泡吸水,并均匀分散地平铺在1/2MS培养基(Kan+,100mg/L),25℃光照培养,约7~8天后即可筛选幼苗,绿色植株初步确定为阳性苗,移栽至无菌蛭石或营养土中。待移栽后幼苗长出真叶,用小剪刀剪取1cm2大小含有叶脉的顶部嫩叶,用GUS染液进行染色,呈现蓝色的进一步证实为阳性植株,然后采用DNA提取试剂盒提取转基因植株和未转化植株叶片总DNA,用如下跨载体引物进行PCR鉴定:K-F:5’-GGACCCCCACCCACGAGG-3’K-R:5’-GCAACAACACCAGCAAGC-3’反应体系包括10×buffer2μL、dNTP1.6μL、K-F引物1μL、K-R引物1μL、taq酶0.3μL、模板DNA1μL,ddH2O补齐至20μL。反应程序为:94℃预变性10min,94℃变性45s,56℃退火45s,72℃延伸1min;循环30次。最后72℃延伸10min,4℃保存。对PCR产物进行琼脂糖凝胶电泳(1%),并在凝胶成像系统中观察拍照。将PCR鉴定为阳性的植株按单株收获并作好标记,每个单株的后代将来成为一个株系。上述同样方法进行阳性苗的后代纯化,纯化后用于基因的功能研究。3.转基因烟草功能研究(1)黄萎病菌侵染、取样将纯合的株系与野生型的烟草的种子分别种于装满蛭石的大六棱钵中,培养至4-6片真叶时,用枪头扎入蛭石中伤根一次,每株再注射30mL的孢子液。接菌后,分别取0、6、12、24、36和48小时的新生嫩叶,三株为一组样品,液氮研磨样品后储存于-80℃备用。(2)黄萎病菌侵染后的抗病性鉴定侵染后分别在12d和15d时调查发病情况,并在15d时进行病情分级。分级标准为:0级:植株无病;1级:少数成叶干枯发黄;2级:30%~50%成叶干枯发黄,叶边缘焦黄或成褐色斑驳;3级:50%以上成叶表现全叶发黄或者黄褐色斑驳,枯落;4级:全株发病,叶片干枯和脱落或死亡。见图4。表2是转基因烟草与对照病情指数调查结果。野生型病情指数为62.67,转基因株系大多发病为1级,且病指为48.00。表明转基因烟草的黄萎病抗性明显比野生型烟草增强。表2转APX烟草与野生型拟南芥病级统计类别0级1级2级3级4级总株树病指CK0420102562.67APX2221002548.00(3)APX酶活的测定将冻存样品按照酶活试剂盒(南京建成)说明书测定APX酶活(图5)结果表明,接种黄萎病菌后转基因烟草不同时间点APX活性极显著高于野生型烟草。。虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。SEQUENCELISTING<110>河北农业大学<120>棉花抗坏血酸过氧化物酶基因APX及其应用<130>KHP161118783.4Q<160>10<170>PatentInversion3.5<210>1<211>753<212>DNA<213>棉花<400>1atgaccaagtgttacccaaccgttagcgaggagtaccaaaacgccgttcaaaaggctaag60aggaagctaagaggtctcatcgctgagaagaactgtgctccactcatgctccgtctagcg120tggcactcagctggaacttttgatgtcaagaccaagaccggaggtccattcggaaccatg180aagcaacctgctgagctcgctcatgctgctaacaacggtctcgatattgcagtcaggctt240ctcgagccgatcaaggagcagttccctatcctttcatacgctgacttctatcagcttgct300ggtgttgttgctgttgagatcaccggtgggcctgaaattccatttcatcctggaagagtg360gacaagcctcacccaccacctgagggtcgtcttcccaatgctactgagggagctgatcac420ttgaggcaggtgtttagtcatcaaatgggtcttagcgaccaggacattgttgctctttct480ggtggccacaccctgggaaggtgccacaaggagaggtctggatttgagggaccatggact540accaaccctcttatctttgacaactcttacttcaaggagctcttgactggagagaaggat600ggcctgttacagttgccaactgacaaagttctcctttccgaccctgttttccgtccattg660gccgacaaatatgcggctgatgaggatgctttctttgctgattacactgaagctcacctg720aagctgtctgagctaggatttgctgatgcataa753<210>2<211>250<212>PRT<213>棉花<400>2MetThrLysCysTyrProThrValSerGluGluTyrGlnAsnAlaVal151015GlnLysAlaLysArgLysLeuArgGlyLeuIleAlaGluLysAsnCys202530AlaProLeuMetLeuArgLeuAlaTrpHisSerAlaGlyThrPheAsp354045ValLysThrLysThrGlyGlyProPheGlyThrMetLysGlnProAla505560GluLeuAlaHisAlaAlaAsnAsnGlyLeuAspIleAlaValArgLeu65707580LeuGluProIleLysGluGlnPheProIleLeuSerTyrAlaAspPhe859095TyrGlnLeuAlaGlyValValAlaValGluIleThrGlyGlyProGlu100105110IleProPheHisProGlyArgValAspLysProHisProProProGlu115120125GlyArgLeuProAsnAlaThrGluGlyAlaAspHisLeuArgGlnVal130135140PheSerHisGlnMetGlyLeuSerAspGlnAspIleValAlaLeuSer145150155160GlyGlyHisThrLeuGlyArgCysHisLysGluArgSerGlyPheGlu165170175GlyProTrpThrThrAsnProLeuIlePheAspAsnSerTyrPheLys180185190GluLeuLeuThrGlyGluLysAspGlyLeuLeuGlnLeuProThrAsp195200205LysValLeuLeuSerAspProValPheArgProLeuAlaAspLysTyr210215220AlaAlaAspGluAspAlaPhePheAlaAspTyrThrGluAlaHisLeu225230235240LysLeuSerGluLeuGlyPheAlaAspAla245250<210>3<211>22<212>DNA<213>人工序列<400>3tgtgctcaactcgtgtccatcg22<210>4<211>24<212>DNA<213>人工序列<400>4cttcttcctatttttgcaatcatc24<210>5<211>20<212>DNA<213>人工序列<400>5gatccttgtggaggagtgga20<210>6<211>19<212>DNA<213>人工序列<400>6cgaaacagttcgacgagat19<210>7<211>23<212>DNA<213>人工序列<400>7ggatccatgaccaagtgttaccc23<210>8<211>24<212>DNA<213>人工序列<400>8ggtaccttatgcatcagcaaatcc24<210>9<211>18<212>DNA<213>人工序列<400>9ggacccccacccacgagg18<210>10<211>18<212>DNA<213>人工序列<400>10gcaacaacaccagcaagc18当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1