一种用于检测B族链球菌RNA的试剂盒及方法与流程
本发明涉及一种用于检测B族链球菌RNA的检测方法及试剂盒,属于生物技术、体外诊断试剂、检验医学等领域。
背景技术:
B族链球菌是一种条件致病菌,在围产期感染中排名第一位的致病菌,可导致围产儿死亡。同时也是孕产妇生殖道感染的重要致病菌,可以导致泌尿系统感染、孕产妇败血症等并发症。当细菌发展到泌尿生殖道,并常与念珠菌感染共存。孕妇阴道带菌率为5~30%,孕妇带菌率随人种、地区、年龄而不同。在一些特殊人群,如肥胖、糖耐量异常、多次妊娠以及性生活活跃的妇女中带菌率较高。围产期孕妇B族链球菌感染阳性明显增加宫内感染对妊娠结局造成不良影响:胎膜早破(发病率为35%)、羊膜腔感染(发病率为21%)、晚期流产、早产、产褥感染等。同时B族链球菌感染也会引起新生儿入侵性感染的发生。新生儿B族链球菌感染发生的时间分为早发型、晚发型及复发型。早发型指出生后7天内发病,占新生儿B族链球菌疾病的80%。通常发生在出生后24小时或72小时内,以爆发性肺炎和新生儿败血症为特征,由宫内垂直感染所致;晚发型感染通常指出生7~90天内的感染,可由产时垂直传播、院内感染或其他因素所致,90%为Ⅲ型B族链球菌,以脑膜炎为主。有产科并发症的早产儿易受感染,发病率是足月儿的7倍,因患脓毒血症的死亡者高达90%;复发性是指新生儿B族链球菌菌血症、脑膜炎等治愈后,经过一段时间间隔发生了与B族链球菌菌血症、脑膜炎有关的新的临床疾病,并从体液中找到B族链球菌。发病高峰在出生后90天内,发病率为0~8.8%。由于新生儿疾病的基础背景不同,预防感染的措施对于早发型感染有效,但是不能预防晚发型感染。因此,迫切需要有一种快速定量、准确、且低成本检测B族链球菌的实验方法,为临床早期诊断和早期治疗提供新的检测手段。
因此,对B族链球菌快速、定量诊断显得十分重要,能够及早制定准确使用抗生素治疗方案尤为重要。目前,对B族链球菌检测方法较多,最常用的检测方法有:细菌培养法、胶体金检测抗体法、PCR检测DNA方法等。细菌培养法操作繁琐复杂,培养B族链球菌需要的时间较长,常规为24~72小时、不能及时提供检验结果;胶体金检测抗体法为定性或半定量检测方法,在准确性、灵敏度上存在很大的局限性,不能提供准确、可靠检验结果;聚合酶链式反应(PCR)检测DNA方法需要提取DNA,操作繁琐复杂,费时费力,同时需要昂贵、特殊仪器/设备等,不能快速获得定量的结果。目前,已有PCR检测B族链球菌的DNA方法,但是由于设计引物存在很大的差异性,其特异性和敏感性有所不同。同时,体现出测定B族链球菌基因型也有不同。而本方法可达到分析速度快、准确可靠、低成本以及实时定量检测、自动化程度高等优点,在生物化学分析和临床分子诊断等领域可广泛应用。此外,通过检测B族链球菌RNA,既可作为早期诊断的实验指标,又可同时反映B族链球菌在体内活跃繁殖的状况,更具有临床价值,为指导临床医生治疗病人提供强有力的实验依据。PCR定性技术对B族链球菌中高保守特异性核酸序列进行扩增及检测,从而判断B族链球菌的存在。虽然其检测有一定的灵敏度和稳定性,但是,也存在较高的假阳性,死亡的B族链球菌和代谢分泌物也会影响到DNA检测的结果。同时,还会遇到一些棘手的问题:已凋亡的细胞和死亡的病原体、PCR产物污染等影响检验结果,PCR前处理步骤繁杂,缺乏准确定量分析等。实时荧光定量PCR技术综合生物学、酶学和荧光化学于一体,对荧光信号强弱进行检测就可以实现对PCR产物的准确定量分析。本发明利用恒温扩增技术结合实时荧光定量PCR技术,其优点是省去了传统PCR提取DNA等前处理过程以及减少实验室PCR产物的污染,实现检测的自动化,检测时间短,且具有可靠的灵敏度和特异性。
在核酸(DNA或RNA)检测中,引物设计为最关键的因素。引物设计需要选择靶点,然后设计出引物序列,引物的靶点选择直接关系到检测的灵敏度,即,靶点选择是基因检测的技术重点和难点。在确定B族链球菌序列的情况下,靶点选择还需要考虑引物长度、CG含量、碱基分布的随机性等因素。在设计B族链球菌的引物时,大多数都是考虑传统的基因型。而B族链球菌的传统基因型主要分布在欧美国家,近年来,在东南亚国家也出现一些新的B族链球菌的基因型;在新生儿感染B族链球菌中,有三份之一的病例出现大环内酯类耐药菌株;因此,在设计B族链球菌的引物时,要充分考虑新变异的基因型和耐药基因等多方面的因素。
专利号为CN201210384976.4的中国发明专利公开了“一种B族链球菌(GBS)核酸检测试剂盒”,该试剂盒的引物是选择B族链球菌(GBS)保守基因CAMP设计合成SPIA的引物。但是该发明专利中的技术缺陷为:①在设计引物时没有考虑新变异的基因型和耐药基因等多方面的因素。例如在孕妇和新生儿所携带的GBS基因型存在差异性,尤其在新生儿感染B族链球菌中,有三份之一的病例出现大环内酯类耐药菌株,因此其敏感性和特异性不高,还会出现漏检的情况;②需要提取DNA,才能进行实验检测。如果手工提取直肠和阴道分泌物的DNA,需要花较多的时间,要4~5小时才完成该实验(包括DNA的提取)。如果是采用仪器提取直肠和阴道分泌物的DNA,需要增加设备成本和试剂成本;③当使用该发明专利检测B族链球菌DNA时,因为在DNA中包括有一些已凋亡的细胞和死亡的病原体,故不能准确的反映孕妇或新生儿感染B族链球菌的真实状况,还会出现假阳性结果;④其提供的是定性检测结果,用阴性或阳性来表示,不能很好指导临床用药,限制了其本身在临床上的应用。
专利号为201310571103.9的中国发明专利公开了一种检测B族链球菌的方法,所述方法为从GenBank基因库下载基因序列,选择GBS保守基因CAMP设计引物,针对传统GBS的基因型,在设计引物时,同样也没有考虑新变异的基因型和耐药基因等多方面的因素。所述的实验方法同样也需要提取DNA,才能进行实验检测,其实验流程复杂,耗费时间长,同样需要4~5小时才完成实验(包括DNA的提取);其检测的是B族链球菌的DNA,同样不能准确的反映孕妇或新生儿感染B族链球菌的真实状况,还会出现假阳性结果,故不能很好指导临床用药,限制了其本身在临床上的应用。
技术实现要素:
本发明的目的在于克服上述现有技术的不足之处而提供一种快速定量检测B族链球菌RNA的实验方法,所述方法具有灵敏度高、特异性强、稳定性好等优点,有着广阔的市场应用前景;根据本发明所述方法研制成的用于检测B族链球菌的试剂盒,操作简单、简便快速、特异性好、灵敏性高、且符合临床诊断率高的要求、能广泛应用于临床,尤其是适合在基层医院使用。
为实现上述目的,本发明采取的技术方案为:一种用于检测B族链球菌RNA的靶序列,其具有SEQ ID NO.1所示的核苷酸序列。
引物设计需要选择靶点,然后设计出引物序列,引物的靶点选择直接关系到检测的灵敏度,即靶点选择是基因检测的技术重点和难点,本发明的靶点是根据GenBank基因库的GBS 388/90株编码SIP蛋白的基因序列,设计引物选择在413-520。
本发明专利申请根据GenBank基因库的GBS 388/90株编码SIP蛋白的基因序列设计引物,包括S.agalactiae基因型、Ia serotype、III serotype、V serotypeST17clone、mefA/E gene、erm B gene的菌株均有表达;同时,在Ia/c、Ib、1//R、III、V和VI血清型的菌株中也均有表达,SIP蛋白基因被证实是具有保守性的四大编码GBS的表面蛋白基因之一,可用于作为检测GBS表达的靶基因。因此,本发明在设计引物时,已经考虑传统的和新变异的基因型以及耐药基因等多方面的因素,而现有技术所设计的引物针对GBS基因型没有任何的陈述,这是一个根本的不同。
另一方面,本发明提供一种上述所述靶序列在检测B族链球菌中的应用。
再一方面,本发明提供一种用于检测B族链球菌上述所述靶序列的特异性引物对,其上游引物具有SEQ ID NO.2所示的核苷酸序列、下游引物具有SEQ ID NO.3所示的核苷酸序列。
本发明所述引物是在根据GenBank基因库的GBS 388/90株编码SIP蛋白的基因序列基础上,分析确定B族链球菌的特异性、稳定的序列。为利用恒温扩增技术结合实时荧光定量PCR技术,经过计算、设计、实验及筛选,提供了一对优选的针对B族链球菌设计的特异性引物。所述特异性引物,既考虑传统的基因型,又考虑新变异的B族链球菌的基因型,同时结合新生儿感染B族链球菌大环内酯类耐药菌株等因素。
B族链球菌RNA在实时荧光定量PCR体系中成功扩增,关键在于针对靶序列的引物设计,而靶序列的选择更是B族链球菌RNA在实时荧光定量PCR体系扩增的关键技术。本发明通过精确的计算和设计以及实验筛选等,确定了理想的靶序列及引物,本发明所选的靶点目前尚未见有报道,与至今收到的国际报道已知序列比较,其稳定、无突变、且该基因检测适合在临床分子诊断和食品检测等生物化学分析中的应用,具有广阔的应用前景。
另一方面,本发明提供一种上述所述特异性引物对在制备检测B族链球菌试剂盒中的应用。
再一方面,本发明提供一种用于检测B族链球菌的探针,所述探针具有SEQ ID NO:4所示的核苷酸序列。
Taqman探针是RNA探针,TaqMan荧光探针是一种寡核苷酸探针,荧光基团连接在探针的5’末端(5’端标记荧光基团为FAM),而淬灭剂则在3’末端(3’端标记荧光基团为TAMRA)。实时荧光定量PCR体系扩增时在加入一对引物的同时加入一个特异性的荧光探针。
另一方面,本发明提供一种用于检测B族链球菌RNA的试剂盒,所述试剂盒包括以上所述的特异性引物对、以上所述的探针。
作为本发明所述用于检测B族链球菌的试剂盒的优选实施方式,所述试剂盒还包括细胞裂解液、RNA恒温扩增反应液、阳性对照模板、阴性对照模板。
作为本发明所述用于检测B族链球菌的方法的优选实施方式,细胞裂解液的成分包括了Tris-HCl、EDTA和NaCl。其具体为50mM Tris-HCl、PH7.4~8.0缓冲体系、150mM NaCl等渗体系、1mM PMSF强大的蛋白抑制剂、1mM EDTA变性剂和稳定剂、5μg/ml Aprotinin(抑肽酶)蛋白酶抑制剂、5μg/ml Leupetin蛋白酶抑制剂、1%Triton x-100破坏细胞、1%Sodium deoxycholate中度变性剂和蛋白溶解剂。采用细胞裂解液直接裂解细胞,无需RNA分离和提取RNA,直接用细胞裂解液进行预扩增,保证了用于实验检测的RNA的完整性。
作为本发明所述用于检测B族链球菌方法的优选实施方式,恒温扩增反应液的成分包括上游引物400nMol/L、下游引物400nMol/L、Taqman探针200nMol/L、dTTP 200umol/L、dATP 200umol/L、dGTP 200umol/L、dCTP 200umol/L、3.5mMol/L MgCl2、16mMol/L(NH4)2SO4、10mMol/L Tris-HCl PH8.3、T7RNA聚合酶、逆转录酶和无菌双蒸水。
作为本发明所述用于检测B族链球菌方法的优选实施方式,所述阳性对照模板为含有长180bp的B族链球菌CAMP基因序列,所述序列具有SEQ ID NO:5所示的核苷酸序列。
作为本发明所述用于检测B族链球菌方法的优选实施方式,所述阳性模板的制备方法为:以包含扩增区域的B族链球菌CAMP基因片段为模板,通过两条引物进行PCR扩增获得目的基因;利用PCR纯化试剂盒对PCR扩增产物进行纯化;将纯化后的扩增产物通过T-easy质粒转染试剂盒构建完整的含有目的基因的质粒序列,用分光光度计对所抽提的质粒测A280定量并稀释至10个拷贝/μl,-20℃保存。
本发明所述用于检测B族链球菌的试剂盒,对不同的反应条件进行了优化,如引物和探针的浓度、Mg2+浓度、反应流程等,建立B族链球菌RNA恒温扩增定量检测的方法,所述试剂盒的灵敏度可在每个反应体系中检出100多个拷贝,可以满足快速检测B族链球菌的要求。
另一方面,本发明提供一种检测B族链球菌的方法,所述方法为:将标本中的细胞经细胞裂解液裂解,释放病原体核酸RNA,利用以上所述的特异性引物对及以上所述的检测探针进行恒温扩增反应,根据上机检测结果诊断是否感染B族链球菌。
具体地,上述所述检测B族链球菌的方法包括以下步骤:
a)采用细胞裂解液裂解样本中的细胞;
b)直接将步骤a)通过细胞裂解液得到样本中细胞的RNA模板,直接进行预扩增,,将其加入到装有恒温扩增反应液的PCR扩增管中,在36~42℃下扩增反应45分钟;阳性对照PCR管中加入标准阳性模板,阴性对照PCR管中加入标准阴性模板;其中,所述阳性模板为含有B族链球菌CAMP基因片段的质粒,所述阴性模板为无菌双蒸水;
c)将步骤b)中的PCR扩增管放置到PCR仪上进行检测及分析各样本的RNA含量,根据数字判断检测结果。
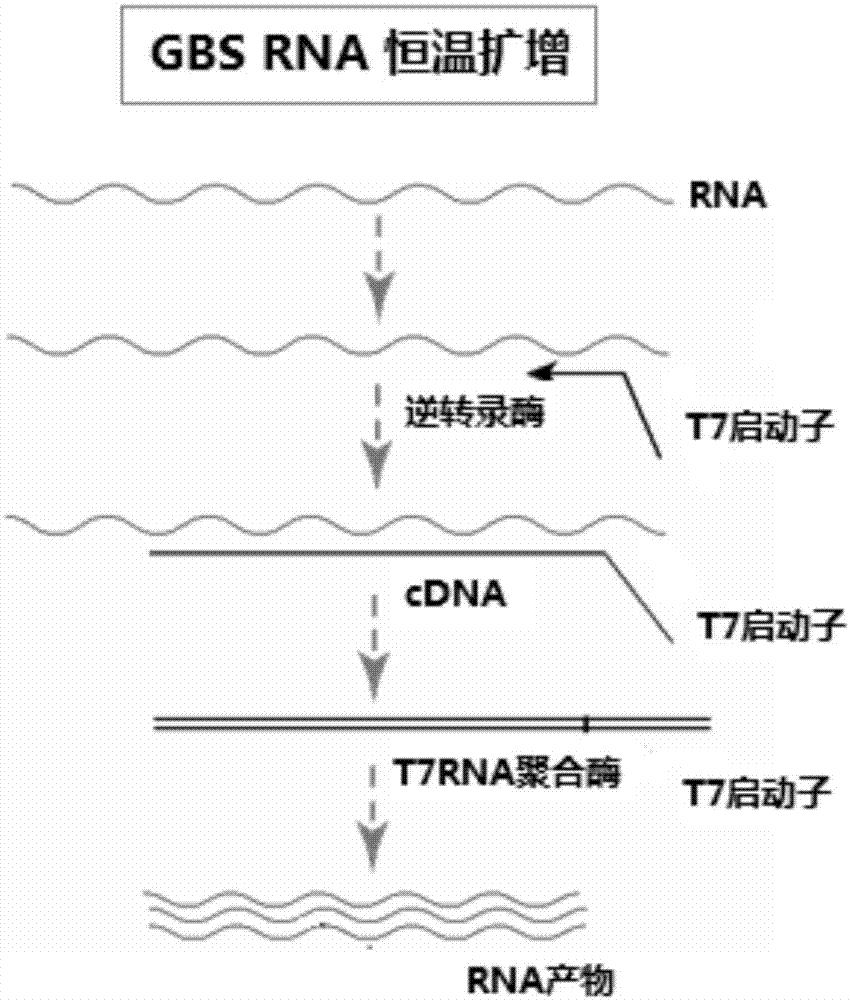
本发明所述用于检测B族链球菌的方法采用恒温扩增技术检测阴道和直肠分泌物的细胞中的B族链球菌RNA含量,所述分泌物中的细胞经细胞裂解液裂解,释放病原体核酸RNA,在逆转录酶和T7RNA聚合酶的作用下,经逆转录和转录过程,实现B族链球菌RNA的恒温扩增。
本发明所述用于检测B族链球菌的检测样品包括阴道分泌物、直肠分泌物、尿液、脑脊液等。
本发明的有益效果在于:
(1)从多方面因素(包括传统和新变异的基因型和血清型及耐药基因等)考虑设计特异性引物和探针,本发明所设计特异性引物目前国内外尚未见有报道;
(2)直接裂解样本中的细胞,无需RNA分离和提取RNA,直接采用存放有RNA模板和细胞裂解液的试管进行预扩增,保证了RNA的完整性用于实验检测,同时也节省实验时间;
(3)本发明所述B族链球菌RNA恒温扩增检测试剂盒的特异性好、灵敏度高、步骤简单、可重复性好;
(4)反应速度快,单个样本从样本处理到完成检测,仅需1小时30分钟左右;
(5)整个扩增和检测过程中不需要打开PCR管盖,减少了扩增产物污染的机会;
(6)检测B族链球菌RNA含量,作为早期诊断的实验指标,同时反映B族链球菌在体内活跃繁殖状况,更具有临床价值,同时为指导临床医生使用抗菌素提供强有力的实验依据和指导。
附图说明
图1为本发明所述用于检测B族链球菌方法的流程示意图;
图2为本发明所述用于检测B族链球菌方法的恒温扩增流程示意图;
图3为本发明所述用于检测B族链球菌的探针通过氢键与其互补的靶序列结合的示意图;
图4为本发明所述检测B族链球菌的性能评估曲线图;
图5为本发明所述检测B族链球菌的试剂盒的敏感性曲线图。
具体实施方式
为更好的说明本发明的目的、技术方案和优点,下面将结合具体实施例及附图对本发明作进一步说明。
实施例1检测B族链球菌的方法
所述方法如附图1所示,
一、设计引物及探针
本发明所涉及的引物是根据GenBank基因库的GBS 388/90株编码SIP蛋白的基因序列基础上,分析确定B族链球菌的特异性、且稳定性好的序列,为利用恒温扩增技术结合实时荧光定量PCR技术,经过计算、设计、实验及筛选,提供了一对优选的针对B族链球菌设计的特异性引物。
上游引物:5’-AGT AAC CGT CAC CTT ATT CTA G-3’(SEQ ID NO:2)
下游引物:5’-TCC GTA CTA TTG CAG TGG CAT C-3’(SEQ ID NO:3)
所述探针的序列为:
Taqman探针:5’FAM-TCA AGCCCAGCAAATGGCTCA-TAMRA 3’(SEQ ID NO:4),Taqman探针是RNA探针,TaqMan荧光探针是一种寡核苷酸探针,荧光基团连接在探针的5’末端(5’端标记荧光基团为FAM),而淬灭剂则在3’末端(3’端标记荧光基团为TAMRA)。
PCR扩增时在加入一对引物的同时加入一个特异性的荧光探针。
二、制备细胞裂解液、恒温扩增反应液、阳性模板
细胞裂解液的成分具体为50mM Tris-HCl、PH7.4~8.0缓冲体系、150mM NaCl等渗体系、1mM PMSF强大的蛋白抑制剂、1mM EDTA变性剂和稳定剂、5μg/ml Aprotinin(抑肽酶)蛋白酶抑制剂、5μg/ml Leupetin蛋白酶抑制剂、1%Triton x-100破坏细胞、1%Sodium deoxycholate中度变性剂和蛋白溶解剂。采用细胞裂解液直接裂解细胞,无需RNA分离和提取RNA,直接采用存放有RNA模板和细胞裂解液的试管进行预扩增,保证了用于实验检测的RNA的完整性。
恒温扩增反应液的成分具体为上游引物400nMol/L、下游引物400nMol/L、Taqman探针200nMol/L、dTTP 200umol/L、dATP 200umol/L、dGTP 200umol/L、dCTP 200umol/L、3.5mMol/L MgCl2、16mMol/L(NH4)2SO4、10mMol/L Tris-HCl PH8.3、T7RNA聚合酶、逆转录酶和无菌双蒸水。
阳性模板为含有长180bp的B族链球菌CAMP基因序列,所述序列为:TCACATCTGTTAAGGCTTCTACACGACTACCAATAGAATTCAAATCATAAACTGTCTCAGGGTTGGCACGCAATGAAGTCTTTAATTTTTCAACACTAGTAAT(SEQ ID NO:5)。其中阳性模板的制备方法为:以包含扩增区域的B族链球菌CAMP基因片段为模板,通过两条引物进行PCR扩增获得目的基因;利用PCR纯化试剂盒对PCR扩增产物进行纯化;将纯化后的扩增产物通过T-easy质粒转染试剂盒构建完整的含有目的基因的质粒序列,用分光光度计对所抽提的质粒测A280定量并稀释至10个拷贝/μl,-20℃保存。
阴性模板为无菌双蒸水。
三、将标本中的细胞经细胞裂解液裂解,释放病原体核酸RNA。
四、取标本RNA作为模板加入到装有B族链球菌恒温扩增反应液的PCR扩增管中,其中标本RNA 5μl,反应液20μl,45℃下扩增反应40分钟;阳性和阴性对照PCR管中加入标准阳性模板和阴性模板,其恒温扩增反应的流程示意图如图2所示,其探针通过氢键与其互补的靶序列结合的示意图如图3所示。
五、将反应的PCR扩增管放置到PCR仪上进行检测及分析各样本,根据数字判断结果。
检测结果:反复重复实验3次,检测结果无显著性差异,说明本试剂盒的不同批次间的检测结果具有可比性,具有良好的重复性。上述实施例说明,用本发明的试剂盒来检测重复性好,且对样本的检测仅仅需要1个小时30分钟左右就能完成,大大缩短检测时间。
实施例2本发明所述用于检测B族链球菌RNA的方法用于检验病人(孕妇和新生儿)和生物样品中的B族链球菌
其包括以下步骤:
(1)样本采集:对于被检测者阴道和直肠的样本需用涤纶拭子,首先擦去被检测者阴道内过多的分泌物,将拭子小心地插入被检测者的阴道,采取阴道低位1/3处粘膜分泌物样本,再将另一个拭子小心地插入被检测者的肛门,在肛门括约肌以上约2-5厘米处轻轻旋转取得样本,按照医院样本输送程序送至实验室,注意防止运送中的过热温度(一般不超过30℃);
(2)样本保存:将步骤(1)采集到的样本在室温下保存,24小时内检测,原则上样本在5-25℃可保存6天,如果不能在24小时内检测,应该立即置于冰箱(4℃)保存;
(3)制备RNA模板:将拭子样本放入采用实施例1所述的细胞裂解液管中,加入细胞裂解液后静置10分钟,震荡25秒,离心5~10分钟;
(4)采用实施例1所述方法进行RNA扩增处理;
(5)检验结果报告:实时荧光定量法检测目的是找到特有序列,检测结果在分娩前4~5小时报告,此检测结果对于决定选用抗生素治疗,进行分娩前预防,是及时而有必要的。
实施例3本发明所述检测B族链球菌RNA试剂盒的性能评估
按照实施例1和2所述方法检测B族链球菌RNA,其性能评估如附图4所示,从左到右的曲线分别代表1×106拷贝/微升、1×105拷贝/微升、1×104拷贝/微升、1×103拷贝/微升、1×102拷贝/微升。
对B族链球菌RNA进行定量分析,分别稀释至浓度为106TCID50/mL、105TCID50/mL、104TCID50/mL、103TCID50/mL、102TCID50/mL、101TCID50/mL、100TCID50/mL,采用实施例1和2中所述方法来确定本发明试剂盒用于检测B族链球菌RNA的灵敏度。
结果如附图5所示,图中1-7分别表示106TCID50/mL、105TCID50/mL、104TCID50/mL、103TCID50/mL、102TCID50/mL、101TCID50/mL、100TCID50/mL,可以看出该试剂盒具有很高的灵敏度,可以满足快速检测B族链球菌RNA的要求。
实施例4本发明所述检测B族链球菌RNA试剂盒与现有技术中检测测B族链球菌的试剂盒的检测结果对比
本发明所述试剂盒按照本发明实施例1和2中所述方法进行检测,现有技术中检测B族链球菌的试剂盒,按照福建泰普DNA法试剂盒说明中所述方法进行检测对比。
检测结果如表1所示:
在102例样本中有85名孕妇和17名新生儿,其中新生儿阳性结果为8例,携带基因型分别是Ia serotype、III serotype、V serotype、ST17clone、mefA/E gene、erm B gene均是本发明所述试剂盒检测出来的,然而采用现有技术中的试剂盒检测结果为阴性。在本发明所述试剂盒检测的85名孕妇和17名新生儿中,有30例为阳性结果,携带GBS基因型分别为S.agalactiae基因型、Ia serotype、erm B gene、mefA/E、ST17clone、III serotype;而采用现有技术中的试剂盒检测102份样本只能检测21份为阳性结果,在检测III serotype样本有3份阳性结果不能检测,在Ia serotype的样本也有2份阳性结果不能检测,在ST17clone的样本也有2份阳性结果不能检测,在S.agalactiae基因型样本也有1份阳性结果不能检测,erm B gene样本也有1份阳性结果不能检测。在培养基培养GBS也显示有3份阳性结果不能检测。
上述结果表明本发明所述试剂盒具有高度的敏感性(93%)和特异性(97%),适合在临床上应用,且具有广阔的应用前景。
最后应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
序列表
<110> 何凤屏,刘布
<120> 一种用于检测B族链球菌的试剂盒及方法
<130> 2016-11-03
<160> 4
<170> PatentIn version 3.3
<210> 1
<211> 180
<212> DNA
<213> B族链球菌
<400> 1
tagtacaaaa tcacgaagtc gacagcatca cacgaaaaat acaaatatta ttttaatgct 60
gtttgaagtg ctgcttgtaa tgttacaatc tcttgatcaa cttgttgtac cgtaacattt 120
ggattcaact gaactccaac agcatgtgtg attgctttat ttaaagtatt gtaaacttta 180
<210> 2
<211> 22
<212> DNA
<213> 人工序列
<400> 2
agtaaccgtc accttattct ag 22
<210> 3
<211> 22
<212> DNA
<213> 人工序列
<400> 3
tccgtactat tgcagtggca tc 22
<210> 4
<211> 21
<212> DNA
<213> 人工序列
<400> 4
tcaagcccag caaatggctc a 21
<210> 5
<211> 103
<212> DNA
<213> B族链球菌
<400> 5
tcacatctgt taaggcttct acacgactac caatagaatt caaatcataa actgtctcag 60
ggttggcacg caatgaagtc tttaattttt caacactagt aat 103
- 还没有人留言评论。精彩留言会获得点赞!