黄酮苷类化合物、紫枝玫瑰活性提取物及制备方法和应用与流程
本发明涉及一种天然药物化学领域,特别是涉及一种黄酮苷类化合物、紫枝玫瑰活性提取物及制备方法和应用。
背景技术:
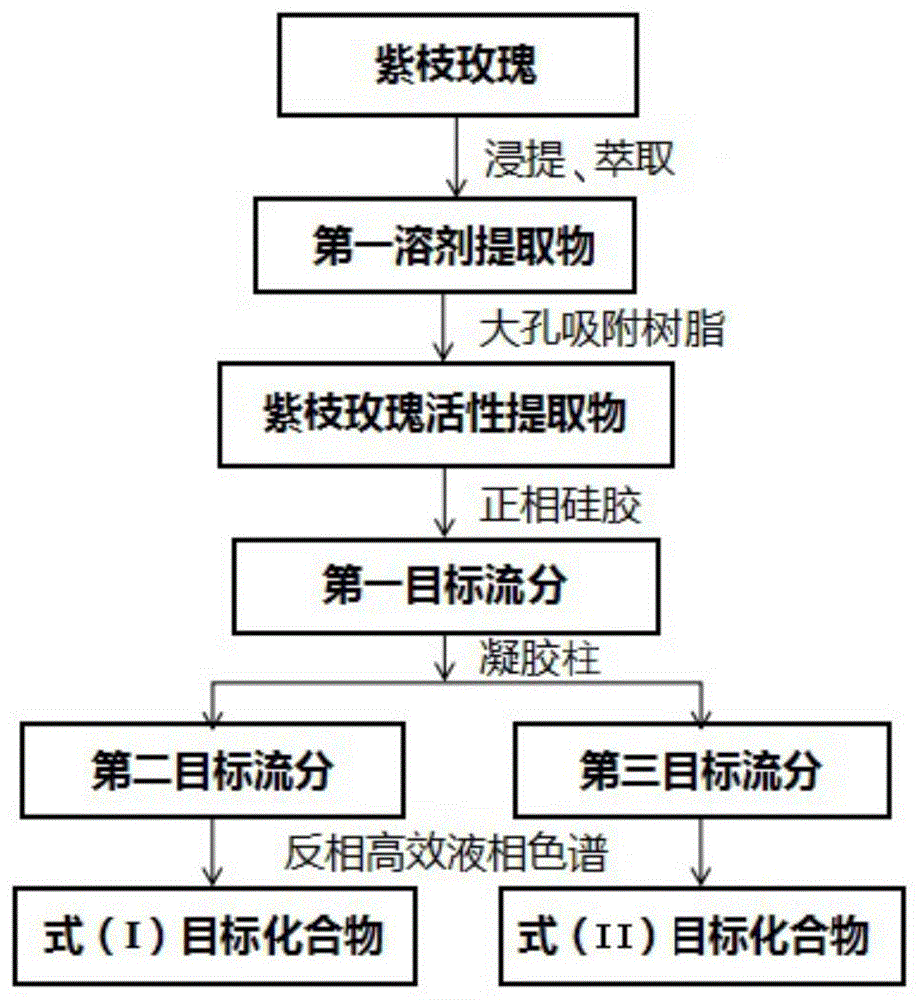
:皮肤衰老主要分为内源性衰老和外源性衰老。其中,内源性衰老是由于人体内的激素随着人年龄的增长而发生变化,从而导致的自然衰老过程。其中,外源性衰老主要是受过多紫外线的辐射,从而导致体内过多自由基或活性氧(ros)的产生,对机体造成氧化损伤,造成光老化,进而使皮肤会出现如皮肤松弛、皱纹、干燥等衰老症状。因此,研发含有自由基清除活性的抗氧化剂而应用于护肤品对皮肤抗衰老具有重要意义。此外,抗氧化剂在食品中也具有广泛应用,例如抗氧化剂可用于防治食物因氧化变质。除了抗氧化剂,抗菌剂同样具有广泛的应用价值,例如抗菌剂在护肤品及食品中用于防腐剂。另外,酪氨酸酶作为一种催化黑色素细胞内黑色素合成的关键调节酶,可催化生成黑色素。虽然黑色素可以保护皮肤免受紫外线的伤害,但是过量产生的黑色素会导致皮肤产生雀斑、黄褐斑、皮肤癌和老年斑等一系列的问题;同时,酪氨酸酶表达和/或活性失调也会引起皮肤色素沉着障碍。因此,酪氨酸酶抑制剂因其对色素沉着障碍和皮肤衰老的预防作用,在化妆品和制药工业中引起了极大的关注,一定程度上抑制酪氨酸酶可以改善皮肤色素沉着,达到皮肤美白的作用。护肤品的发展历经从天然原料到合成原料再回归到天然原料这样的一个过程,添加天然活性成分的护肤品因为具有刺激性小、渗透性佳、安全性高、疗效显著等优势,受到越来越多人的青睐。目前,护肤品中所添加的活性成分(如,抗衰老剂、美白剂等)并非天然来源,可能会存在安全性、致敏性等问题。此外,在护肤品、食品及药品中使用的非天然来源的防腐剂也存在安全隐患。而植物中含有活性多样的次生代谢产物,因此从植物中寻找天然活性成分(如,抗氧化剂、美白剂、抗衰老成分、抗菌剂等)是一个行之有效的方式。技术实现要素:有鉴于此,本发明提供一种黄酮苷类化合物、紫枝玫瑰活性提取物及制备方法和应用,主要目的在于提供或制备一种黄酮苷类化合物及含有黄酮苷类化合物的紫枝玫瑰活性提取物;其中,该黄酮苷类化合物及紫枝玫瑰活性提取物,可制备或作为抗菌剂、抗氧化剂、酪氨酸酶抑制剂中的一种或几种,而应用于护肤品、食品、药品中的一个或多个领域中。为达到上述目的,本发明主要提供如下技术方案:一方面,本发明的实施例提供一种黄酮苷类化合物,其中,所述黄酮苷类化合物的结构如式(i)或式(ii)所示:另一方面,所述的式(i)结构的黄酮苷类化合物在作为或制备抗菌剂、抗氧化剂、酪氨酸酶抑制剂中的一种或几种中的应用;优选的,所述抗菌剂为金黄色葡萄球菌抗菌剂;优选的,所述抗氧化剂为dpph自由基清除剂。另一方面,所述的式(ii)结构的黄酮苷类化合物作为或制备抗菌剂的应用;优选的,所述抗菌剂为金黄色葡萄球菌抗菌剂;另一方面,上述的黄酮苷类化合物的制备方法,其中,所述黄酮苷类化合物从第一植物中分离出;其中,所述第一植物为含有所述黄酮苷类化合物的植物;优选的,所述第一植物为紫枝玫瑰。优选的,从所述紫枝玫瑰中分离出所述黄酮苷类化合物,包括如下步骤:1)对紫枝玫瑰花进行浸提、萃取及后处理后,得到第一溶剂提取物;2)对所述第一溶剂提取物进行大孔吸附树脂柱层析分离,分离出含有所述黄酮苷类化合物的紫枝玫瑰活性提取物;3)对所述紫枝玫瑰活性提取物进行正相硅胶柱层析分离,得到含有所述黄酮苷类化合物的第一目标流分;4)对所述第一目标流分进行凝胶柱层析分离,得到含有式(i)所示结构的黄酮苷类化合物的第二目标流分、含有所述式(ii)所示结构黄酮苷类化合物的第三目标流分;5)所述第二目标流分经反相高效液相色谱纯化后,分离出式(i)所示结构的黄酮苷类化合物;所述第三目标流分经反相高效液相色谱纯化后,分离出式(ii)所示结构的黄酮苷类化合物。优选的,所述步骤1)中的第一溶剂提取物为乙醇提取物;进一步优选的,所述步骤1)具体为:采用体积分数为90-100%,优选为95%的乙醇-水溶液对紫枝玫瑰花进行浸泡设定时间后过滤,并将得到的滤液浓缩后得到第一溶剂提取浸膏;向所述第一溶剂提取浸膏中加水形成悬浮液后,采用第二溶剂对所述悬浮液进行萃取处理以除去小极性组分,将萃取后的剩余物进行冷冻干燥;得到第一溶剂提取物;优选的,设定时间为2-10天,优选为6-7天;优选的,所述第二溶剂为石油醚。优选的,在所述步骤2)中,将所述第一溶剂提取物溶于水后,经大孔吸附树脂柱层析分离,以甲醇-水溶剂系统进行梯度洗脱;其中,在梯度洗脱时,甲醇的起始体积分数为0-5%,优选为0%、甲醇的最终体积分数为90-100%,优选为100%;将甲醇体积分数为65-75%,优选为70%时的洗脱流分进行合并、回收溶剂浓缩后,得到含有所述黄酮苷类化合物的紫枝玫瑰活性提取物。优选的,所述步骤3)包括:对所述紫枝玫瑰活性提取物进行正相硅胶柱层析,以氯仿-甲醇溶剂系统进行梯度洗脱;其中,在梯度洗脱时,氯仿和甲醇的起始体积比为29:1-31:1,优选30:1,氯仿和甲醇的最终体积比为1:1-3:1,优选2:1;将氯仿和甲醇体积比为9:1-11:1,优选为10:1时的洗脱流分进行合并,得到第一目标流分。优选的,所述步骤4)包括:所述第一目标流分经凝胶柱层析,优选纯甲醇溶剂系统洗脱;收集0-30min间的经凝胶柱层析流出的组分,得到含有式(i)所示结构的黄酮苷类化合物的第二目标流分、收集30-60min间的经凝胶柱层析流出的组分,得到含有所述式(ii)所示结构黄酮苷类化合物的第三目标流分。优选的,在所述步骤5)中:所述第三目标流分经过反相高效液相色谱纯化(色谱柱类型:ymc-packods-aq,10mm×250mm,5μm;流速3ml/min),流动相为体积比在9:1-3:7的甲醇-水洗脱系统,优选体积比为3:2的甲醇-水洗脱系统,收集出峰时间为33-35min时的色谱峰,回收溶剂浓缩后,得到式(ii)所示结构的黄酮苷类化合物。所述第二目标流分经过反相高效液相色谱纯化(色谱柱类型:ymc-packods-aq,10mm×250mm,5μm;流速3ml/min),流动相为体积比在9:1-3:7的甲醇-水系统,优选体积比为9:11的甲醇-水洗脱系统,收集出峰时间为12-13min时的色谱峰,回收溶剂浓缩后,得到式(i)所示结构的黄酮苷类化合物。在此需要说明的是:对于步骤5)中所采用的甲醇-水洗脱系统可以为等度洗脱(即,在洗脱过程中,甲醇和水的体积比始终为一个定值),也可以为梯度洗脱系统(即,在洗脱过程中,在一定时间范围内甲醇的浓度从一浓度值变到另一浓度值)。优选的,从所述紫枝玫瑰中分离出所述黄酮苷类化合物的步骤,具体为:选取紫枝玫瑰干花,粉碎后,加体积分数为95%乙醇在室温下浸泡7天后过滤,重复三次,得到的滤液经浓缩后得到95%乙醇提取浸膏;95%乙醇浸膏加水悬浮后,以石油醚室温下萃取两次,除去小极性组分后冻干,最终得到95%乙醇提取物。95%乙醇提取物溶于水,经大孔吸附树脂(填料:hp-20)柱层析分离,以甲醇-水溶剂系统(0-100%m/h)梯度洗脱,分别合并70%甲醇-水洗脱部分,回收溶剂得到含有所述黄酮苷类化合物的紫枝玫瑰活性提取物。紫枝玫瑰活性提取物。经过正相硅胶柱层析,以氯仿-甲醇溶剂系统(体积比30-2:1)洗脱,合并洗脱剂为氯仿-甲醇体积比10:1的流分,得到第一目标流分。e1再经凝胶柱层析(sephadexlh-20),以甲醇溶剂系统洗脱,分别得到亚组分e1a(第三目标流分)与e1b(第二目标流分)。e1a亚组分再经过反相高效液相色谱纯化(色谱柱类型:ymc-packods-aq,10mm×250mm,5μm;流速3ml/min),流动相为体积比3:2的甲醇-水洗脱系统,收集出峰时间为33-35min时的色谱峰,回收溶剂得式(ii)所示结构的黄酮苷类化合物;e1b亚组分再经过反相高效液相色谱纯化(色谱柱类型:ymc-packods-aq,10mm×250mm,5μm;流速3ml/min),流动相为体积比9:11的甲醇-水等度洗脱,收集出峰时间为12-13min时的色谱峰,回收溶剂得式(i)所示结构的黄酮苷类化合物。再一方面,本发明的实施例还提供一种紫枝玫瑰活性提取物,其中,所述紫枝玫瑰活性提取物包括上述的黄酮苷类化合物。优选的,所述紫枝玫瑰活性提取物包括所述式(i)所示结构的黄酮苷类化合物和式(ii)所示结构的黄酮苷类化合物。再一方面,上述的紫枝玫瑰活性提取物在作为或制备抗氧化剂、酪氨酸酶抑制剂、抗菌剂中的一种或几种中的应用;优选的,所述抗菌剂为金黄色葡萄球菌抗菌剂;优选的,所述抗氧化剂为dpph自由基清除剂。再一方面,上述的紫枝玫瑰活性提取的制备方法,包括如下步骤:制备第一溶剂提取物:对紫枝玫瑰花进行浸提、萃取及后处理后,得到第一溶剂提取物;柱层析分离:对所述第一溶剂提取物进行大孔吸附树脂柱层析分离,分离出含有所述黄酮苷类化合物的紫枝玫瑰活性提取物。优选的,在所述制备第一溶剂提取物的步骤中的第一溶剂提取物为乙醇提取物;进一步优选的,所述制备第一溶剂提取物的步骤,具体为:采用体积分数为90-100%,优选为95%的乙醇-水溶液对紫枝玫瑰花进行浸泡设定时间后过滤,并将得到的滤液浓缩后得到第一溶剂提取浸膏;向所述第一溶剂提取浸膏中加水形成悬浮液后,采用第二溶剂对所述悬浮液进行萃取处理以除去小极性组分,将萃取后的剩余物进行冷冻干燥;得到第一溶剂提取物;优选的,设定时间为2-10天,优选为6-7天;优选的,所述第二溶剂为石油醚。优选的,在所述柱层析分离的步骤中,将所述第一溶剂提取物溶于水后,经大孔吸附树脂柱层析分离,以甲醇-水溶剂系统进行梯度洗脱;其中,在梯度洗脱时,甲醇的起始体积分数为0-5%,优选为0%、甲醇的最终体积分数为90-100%,优选为100%;将甲醇体积分数为65-75%,优选为70%时的洗脱流分进行合并、进一步浓缩后,得到含有所述黄酮苷类化合物的紫枝玫瑰活性提取物。再一方面,本发明提供一种组合物,其中,所述组合物包括上述的黄酮苷类化合物或上述的紫枝玫瑰活性提取物;优选的,所述组合物为药品、护肤品、食品中的任一种。优选的,当所述组合物包括式(i)所述的黄酮苷类化合物或紫枝玫瑰活性提取物时,所述组合物具有抗菌功效、抗氧化功效、酪氨酸酶抑制功效中的一种或多种功效;优选的,当所述组合物仅包括式(ii)所述的黄酮苷类化合物时,所述组合物具有抗菌功效。与现有技术相比,本发明的黄酮苷类化合物、紫枝玫瑰活性提取物及制备方法和应用至少具有下列有益效果:一方面,本发明首次提出一种新型的黄酮苷类化合物,该黄酮苷类化合物的结构如式(i)或式(ii)所示,其中,式(i)所示的黄酮苷类化合物具有抗氧化活性、抗菌活性、酪氨酸酶抑制活性多重功效;式(ii)所示的黄酮苷类化合物具有优异的抗菌活性。因此,本发明提出的黄酮苷类化合物可作为抗氧化剂、抗菌剂、酪氨酸酶抑制剂中的一种或者几种应用于护肤品、药品及食品中。由于该黄酮苷类化合物属于天然来源,可以从植物(如,紫枝玫瑰)中提取出,因此其用作抗氧化剂、抗菌剂、酪氨酸酶抑制剂时具有安全、无毒的优点。进一步地,本发明提出的黄酮苷类化合物可以从紫枝玫瑰中提取出,具体提取方法如下:采用体积分数为95%的乙醇-水溶液对紫枝玫瑰花进行浸提、萃取及后处理,得到乙醇提取物;然后再对乙醇提取物进行大孔吸附树脂柱层析分离得到紫枝玫瑰活性提取物;对紫枝玫瑰活性提取物进行正相硅胶柱层析分离得到第一目标流分;第一目标流分经凝胶柱层析分离后,得到含式(i)所示结构化合物的第二目标流分和含式(ii)所示结构的第三目标流分;最后对第二目标流分、第三目标流分分别进行纯化后,即可分离得到式(i)所示黄酮苷类化合物、式(ii)所示结构的黄酮苷类化合物。通过上述步骤之间的协同配合可以实现从紫枝玫瑰中提取出黄酮苷类化合物。另一方面,本发明还提供一种紫枝玫瑰活性提取物,该紫枝玫瑰活性提取物包括上述的黄酮苷类化合物。因此,本发明提供的紫枝玫瑰提取物可以作为抗氧化剂、酪氨酸酶抑制剂、抗菌剂中的一种或几种,应用于护肤品、药品及食品中,且属于天然来源,安全、无毒。再一方面,本发明还提供一种组合物,该组合物包括上述的黄酮苷类化合物或紫枝玫瑰活性提取物;该组合物为护肤品、食品及药品中的任一种;在此,黄酮苷类化合物或紫枝玫瑰活性提取物作为添加剂,以使组合物具有抗氧化(防衰老)、美白、抗菌防腐等功效。上述说明仅是本发明技术方案的概述,为了能够更清楚了解本发明的技术手段,并可依照说明书的内容予以实施,以下以本发明的较佳实施例并配合附图详细说明如后。附图说明图1是本发明式(i)与式(ii)所示结构的黄酮苷类化合物的分离流程图;图2是本发明的式(i)所示结构的黄酮苷类化合物的1h-nmr谱图;图3是本发明的式(i)所示结构的黄酮苷类化合物的13c-nmr谱和dept谱图;图4是本发明的式(i)所示结构的黄酮苷类化合物的1h-1hcosy谱图;图5是本发明的式(i)所示结构的黄酮苷类化合物的hsqc谱图;图6是本发明的式(i)所示结构的黄酮苷类化合物的hmbc谱图;图7是本发明的式(ii)所示结构的黄酮苷类化合物的1h-nmr谱图;图8是本发明的式(ii)所示结构的黄酮苷类化合物的13c-nmr谱和dept谱图;图9是本发明的式(ii)所示结构的黄酮苷类化合物的1h-1hcosy谱图;图10是本发明的式(ii)所示结构的黄酮苷类化合物的hsqc谱图;图11是本发明的式(ii)所示结构的黄酮苷类化合物的hmbc谱图。具体实施方式为更进一步阐述本发明为达成预定发明目的所采取的技术手段及功效,以下结合附图及较佳实施例,对依据本发明申请的具体实施方式、结构、特征及其功效,详细说明如后。在下述说明中,不同的“一实施例”或“实施例”指的不一定是同一实施例。此外,一个或多个实施例中的特定特征、结构、或特点可由任何合适形式组合。植物中含有活性多样的次生代谢产物,从植物中寻找天然抗氧化剂、美白剂、抗菌剂是一个行之有效的方式。其中,紫枝玫瑰(rosarugosacv.“zizhi”),属于蔷薇科蔷薇属玫瑰花的一个品种,因当年抽生枝条霜降后呈亮紫红色而得名,是由山东平阴玫瑰研究所的科研人员经种间杂交选育出的新品种,其亲本分别为平阴玫瑰与山刺玫。紫枝玫瑰因具有花期长、花形大、香味浓郁等特点,观赏价值高,在南北方多地均有种植,多以园林绿化中观赏为主。目前对紫枝玫瑰的化学成分及生物活性的研究较少,本发明借助天然药物化学研究手段,对其中的抗氧化活性、酪氨酸酶抑制活性及抗菌活性成分进行研究。本发明首次从紫枝玫瑰中提取出一种新的化合物,即黄酮苷类化合物;其中,该黄酮苷类化合物的结构如式(i)或式(ii)所示:进一步地,本发明首次提出了上述的黄酮苷类化合物在抗菌剂、抗氧化剂、酪氨酸酶抑制剂中的一种或几种中的应用(即,上述的黄酮苷类化合物可直接作为抗菌剂、抗氧化剂、酪氨酸酶抑制剂中的一种或几种,或上述的黄酮苷类化合物用于制备抗菌剂、抗氧化剂、酪氨酸酶抑制剂中的一种或几种)。另外,包含上述黄酮苷类化合物的紫枝玫瑰活性提取物,也具有抗氧化活性、酪氨酸酶抑制活性、抗菌活性。因此,该紫枝玫瑰活性提取物可直接作为可直接作为抗菌剂、抗氧化剂、酪氨酸酶抑制剂,或该紫枝玫瑰活性提取物用于制备抗菌剂、抗氧化剂、酪氨酸酶抑制剂中的一种或几种。上述的黄酮苷类化合物、紫枝玫瑰活性提取物可作为抗菌剂、抗氧化剂、酪氨酸酶抑制剂中的一种或几种应用于护肤品、药品及食品(包括保健品)等领域中,以使护肤品、药品及食品等领域具有美白、抗氧化及抗菌防腐的功效。本发明中的术语“护肤品”指的是可以是护肤水、护肤乳液、护肤面膜、护肤霜等;本发明实施例的护肤品也可以指化妆品。下面通过具体实施例对本发明进一步详细说明如下:实施例1实施例1制备一种紫枝玫瑰活性提取物,具体包括如下步骤:制备乙醇提取物:选取紫枝玫瑰干花,将其粉碎后,向其中加入体积分数为95%的乙醇(乙醇-水溶液),在室温下浸泡7天后过滤,重复过滤三次。滤液经浓缩后,得到乙醇提取浸膏。乙醇浸膏加水悬浮后,在室温下用石油醚对悬浮液进行萃取两次,除去小极性组分(即,石油醚萃取物),将萃取后的剩下物(即,水相)冷冻干燥,得到乙醇提取物。柱层析分离:将乙醇提取物溶于水后,经大孔吸附树脂(填料:hp-20)进行柱层析分离,以甲醇-水溶剂系统(0-100%m/h)进行梯度洗脱(甲醇的起始体积分数为0%、甲醇的最终体积分数为100%),合并甲醇体积分数为70%时的洗脱部分,回收溶剂(浓缩)后,得到紫枝玫瑰活性提取物。实施例2实施例2主要是从紫枝玫瑰中分离出所述的黄酮苷类化合物;参见图1所示,对紫枝玫瑰进行浸提、萃取处理,得到第一溶剂提取物;第一溶剂提取物经大孔树脂层析分离后,得到紫枝玫瑰活性提取物。然后,紫枝玫瑰活性提取物经过正相硅胶柱层析处理后得到第一目标流分;第一目标流分经凝胶柱层析处理后得到第二目标流分和第三目标流分。第二目标流分、第三目标流分经反相高效液相色谱处理后,得到式(i)目标化合物、式(ii)目标化合物。其中,具体的步骤如下:1)制备紫枝玫瑰活性提取物:该步骤具体参见实施例1,在此不重复赘述。2)紫枝玫瑰活性提取物2.3g经正相硅胶柱层析,以氯仿-甲醇溶剂系统进行梯度洗脱(在梯度洗脱时,氯仿和甲醇的起始体积比为30:1、最终体积比为2:1),合并氯仿和甲醇体积比为10:1的洗脱流分,得到第一目标流分。第一目标流分经凝胶柱层析(sephadexlh-20),以纯甲醇溶剂系统洗脱;收集0-30min间经凝胶柱层析流出的组分,得到含有式(i)所示结构的黄酮苷类化合物的第二目标流分;收集30-60min间经凝胶柱层析流出的组分,得到含有所述式(ii)所示结构黄酮苷类化合物的第三目标流分;。第三目标流分再经过反相高效液相色谱纯化(色谱柱类型:ymc-packods-aq,10mm×250mm,5μm;流速3ml/min),流动相为体积比3:2的甲醇-水等度洗脱系统,收集出峰时间为33-35min时的色谱峰,回收溶剂,得到目标活性化合物c(15mg)(即,式(ii)所示的黄酮苷类化合物)。第二目标流分再经过反相高效液相色谱纯化(色谱柱类型:ymc-packods-aq,10mm×250mm,5μm;流速3ml/min),流动相为体积比9:11的甲醇-水等度洗脱系统,收集出峰时间为12-13min时的色谱峰,回收溶剂,得到目标活性化合物b(8mg)(即,式(i)所示的黄酮苷类化合物)。3)对目标活性化合物b进行结构鉴定:目标活性化合物b的分子式通过高分辨质谱hr-esi-msm/z629.1143[m-h]-(calculatedc29h26o16m/z629.1148[m-h]-)]可确定为c29h26o16。根据一维核磁共振1h,13c和dept以及二维核磁共振相关信号,可推断化合物b的结构式如下:其二维相关信号(关键1h-1hcosy和hmbc相关信号)参见如下标注:目标活性化合物b(即,式(i)所示结构的黄酮苷类化合物)的核磁共振数据及信号归属见表1。表1为目标活性化合物b的nmr(δinppm,jinhz)数据归属no.δh(δinppm,jinhz)δc2158.2,s3134.83,s4179.02,s5163.14,s66.17(1h,d,j=1.8hz)99.72,d7165.73,s86.35(1h,d,j=1.5hz)94.58,d9158.33,s10105.92,s1’123.74,s2’7.81(1h,d,j=2.0hz)114.04,d3’148.4,s3’-och33.98(3h,s)56.73,q4’150.7,s5’6.86(1h,d,j=8.4hz)116.0,d6’7.51(1h,dd,j=8.4,2.0hz)123.1,dglu-1”5.84(1h,d,j=8.0hz)100.53,d2”5.13(1h,dd,j=9.5,8.1hz)75.93,d3”3.68(1h,t,j=9.1hz)76.41,d4”3.42(1h,t,j=9.2hz)71.73,d5”3.36(1h,m)78.83,d6”3.82(1h,dd,j=12.0,1.8hz),3.61(1h,dd,j=11.8,5.4hz)62.48,t2”-o-galloyl1”’121.49,s2”’,6”’7.10(2h,s)110.52,d3”’,5”’146.31,s4”’139.8,s7”’(c=o)167.63,s另外,目标活性化合物b的1h-nmr谱图(600mhzmethanol-d4)参见图2所示;目标活性化合物b的13c-nmr谱和dept谱图(150mhzmethanol-d4)参见图3所示;目标活性化合物b的1h-1hcosy谱图(600mhzmethanol-d4)参见图4所示;目标活性化合物b的hsqc谱图(600mhzmethanol-d4)参见图5所示;目标活性化合物b的hmbc谱图(600mhzmethanol-d4)参见图6所示。综上,通过上述测试鉴定出本实施例分离出的目标活性化合物b为式(i)结构所示的黄酮苷类化合物。3)对目标活性化合物c进行结构鉴定:目标活性化合物c的分子式通过高分辨质谱hr-esi-ms[m/z755.1824[m-h]-(calculatedc36h36o18755.1825[m-h]-)]可确定为c36h36o18。根据一维核磁共振1h,13c和dept以及二维核磁共振相关信号,可推断化合物c的结构式如下:其二维相关信号(关键1h-1hcosy和hmbc相关信号)参见如下标注:目标活性化合物c(即,式(ii)所示结构的黄酮苷类化合物)的核磁共振数据及信号归属见表2。表2为目标活性化合物c的nmr(δinppm,jinhz)数据归属no.δh(δinppm,jinhz)δc2159.2,s3134.57,s4179.56,s5163.00,s66.09(d,j=2.1hz,1h)99.98,d7165.77,s86.30(d,j=2.1hz,1h)94.72,d9158.39,s10105.64,s1’122.81,s2’,6’7.99(d,j=8.9hz,2h)132.24,d3’,5’6.81(m,j=8.9hz,2h)116.78,d4’161.48,sglu-1”5.41(d,j=7.7hz,1h)100.81,d2”3.78(m,1h)82.28,d3”3.64(s,1h)77.81,d4”3.40(d,j=4.5hz,1h)71.3,d5”3.34(d,j=2.9hz,1h)78.28,d6”4.29(dd,j=11.7,2.1hz,1h),4.17(m,1h)64.08,tglu-1”’4.78(d,j=6.9hz,1h)104.64,d2”’3.39(d,j=7.1hz,1h)75.5,d3”’3.42(d,j=3.4hz,1h)77.89,d4”’3.36(d,j=7.8hz,1h)71.64,d5”’3.45(ddd,j=7.1,5.5,2.2hz,1h)75.64,d6”’3.82(dd,j=11.9,2.4hz,1h),3.71(dt,j=11.9,4.3hz,1h)62.63,t6”-trans-p-coum1””127.03,s2””,6””7.29(d,j=8.6hz,2h)131.17,d3””.5””6.88(m,j=8.6hz,2h)116.16,d4””161.18,s7””7.37(d,j=15.9hz,1h)146.48,d8””6.01(d,j=15.9hz,1h)114.57,d9””168.62,s另外,目标活性化合物c的1h-nmr谱图(500mhzmethanol-d4)参见图7所示;目标活性化合物c的13c-nmr谱和dept谱图(150mhzmethanol-d4)参见图8所示;目标活性化合物c的1h-1hcosy谱图(500mhzmethanol-d4)参见图9所示;目标活性化合物c的hsqc谱图(500mhzmethanol-d4)参见图10所示;目标活性化合物c的hmbc谱图(500mhzmethanol-d4)参见图11所示。综上,通过上述测试鉴定出本实施例分离出的目标活性化合物c为式(ii)结构所示的黄酮苷类化合物。实施例3实施例3主要是对实施例2所制备的黄酮苷类化合物、实施例1所制备的紫枝玫瑰活性提取物进行抗氧化活性的测定实验,测定方法如下:抗氧化活性的测定采用dpph自由基清除活性试验。在96孔板上,将一定浓度的待测样品与dpph(终浓度为100mm)混合反应,设置3个重复孔,同时设置不含药物的空白对照和trolox阳性对照,在30℃下放置1h后,采用酶标仪测定od值,检测波长为515nm。其中,抗氧化率按以下计算公式计算:抗氧化率(%)=(1-实验孔od515nm/空白孔od515nm)×100%。其中,抗氧化活性的测定结果参见表3所示。表3为黄酮苷类化合物、紫枝玫瑰活性提取物的抗氧化活性测定结果浓度(μg/ml)抗氧化率(%)ic50(μg/ml)trolox2594.980±0.20式(i)所示结构的黄酮苷类化合物10091.079±06.659±0.228式(ii)所示结构的黄酮苷类化合物10010.53±0.954紫枝玫瑰活性提取物10089.154±1.232从表3可以看出:式(i)所示结构的黄酮苷类化合物、紫枝玫瑰活性提取物均具有显著的抗氧化活性,而式(ii)所示结构的黄酮苷类化合物也具有抗氧化活性,但是其抗氧化活性较低。实施例4实施例4主要是对实施例2制备的黄酮苷类化合物、实施例1所制备的紫枝玫瑰活性提取物进行酪氨酸酶抑制活性的测定实验,测定方法如下:向96孔的酶标板中加入20μl样品溶液(终浓度为100μg/ml)、105μl的pbs缓冲液,每个样品设置3个重复孔,同时设置不含样品的空白对照、α-熊果苷(终浓度为100μg/ml)作为阳性对照。50μll-dopa(5mm),混合均匀后,加入25μl的酪氨酸酶溶液(200u/ml)。在室温或25℃下放置5min后,酶标仪测定od值,检测波长为490nm。其中,酪氨酸酶活性抑制率计算方法:抑制率(%)=(1-样品od490nm/实验对照孔od490nm)×100%。其中,酪氨酸酶抑制活性结果见表4。表4为黄酮苷类化合物、紫枝玫瑰活性提取物的酪氨酸酶抑制活性测定结果浓度(μg/ml)酪氨酸酶抑制率(%)α-arbutin10021.487±1.665式(i)所示结构的黄酮苷类化合物10020.160±1.836式(ii)所示结构的黄酮苷类化合物100-27.097±1.549紫枝玫瑰活性提取物10045.170±1.384从表4中可以看出:式(i)所示结构的黄酮苷类化合物具有较好的酪氨酸酶抑制活性,而紫枝玫瑰活性提取物具有尤其显著的酪氨酸酶抑制活性。式(ii)所示结构的黄酮苷类化合物不具有酪氨酸酶抑制活性。实施例5实施例5主要是对实施例2制备的黄酮苷类化合物进行抗菌活性的测定实验,测定方法如下:菌悬液配置:实验前一天,取出保存的金黄色葡萄球菌(staphylococcusaureus),并放置至室温。用接种环从中分别挑取少量菌落,接种于lb培养基平面上,置于35℃的恒温箱中培养。用接种环挑取少量活化细菌菌落转移至已灭菌的干燥比浊管中,用0.9%无菌生理盐水稀释,根据2017版clsi相关文件方法标准,配制细菌菌悬液浓度至0.5号麦氏比浊管(1×108cfu/ml),再将配制好的菌悬液用0.9%无菌生理盐水做1:100的稀释,得到浓度为1×106cfu/ml的菌悬液。抗细菌实验:配置体系混合溶液(mh肉汤90ul+样品10ul+菌悬液100ul),然后再分装到各反应管中,样品终浓度为128ug/ml,菌终浓度为5×105cfu/ml,每个样品设置3个重复;取96孔培养板,将混合液分别放置各孔中,在37℃培养24h后,在625nm下测定吸光值。实验同时设置培养基空白对照、细菌对照以及庆大霉素阳性药对照(终浓度5ug/ml)。抑制率按下式方法计算;其中,抗菌活性结果见表5。表5为黄酮苷类化合物、紫枝玫瑰活性提取物的抗菌活性测定结果浓度(μg/ml)金黄色葡萄球菌抑制率(%)庆大霉素5100.923±0.149式(i)所示结构的黄酮苷类化合物12853.447±0.991式(ii)所示结构的黄酮苷类化合12864.720±0.749从表5可以看出:本发明的式(i)、式(ii)所示的黄酮苷类化合物具有优异的抗菌活性。综上,本发明实施例提出的黄酮苷类化合物、紫枝玫瑰活性提取物具有抗氧化活性、酪氨酸酶抑制活性、抗菌活性多重功效,可以作为抗氧化剂、酪氨酸酶抑制剂、抗菌剂中的一种或几种而应用于护肤品、食品、药品等产品中。以上所述,仅是本发明的较佳实施例而已,并非对本发明作任何形式上的限制,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与修饰,均仍属于本发明技术方案的范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1