一株耐盐高自聚集能力的解淀粉芽孢杆菌及其在脱氮中的应用
本发明属于环境微生物领域,具体涉及一株耐盐高自聚集能力的解淀粉芽孢杆菌及其在脱氮中的应用。
背景技术:
目前,随着水产养殖业向现代化水平发展,循环水养殖系统(ras)以其占地面积小、节约水资源、保护环境等特点,逐渐成为中国水产养殖业现代化的支撑技术力量。良好的水质是ras的技术核心和关键优势,其中氨氮浓度是影响水质的最关键因素。此外,养殖过程中亚硝酸盐氮积累造成的危害也比较严重。同时,在很多文献中也报道了高浓度的硝酸盐对海洋和淡水生物的致命的或接近致命的影响。因此,维持低浓度的氨氮、亚硝酸盐和硝酸盐是实现水产养殖业可持续发展的重要目标。生物脱氮是改善水质最常见、最有效、成本最低的方法,也是目前ras最流行的三态氮控制方法。
传统的生物脱氮方法需要将好氧和缺氧相分离,导致脱氮效率低。相比之下,异养硝化-好氧反硝化细菌由于其高效的脱氮特性而受到关注。
技术实现要素:
本发明的目的在于提供一株解淀粉芽孢杆菌(bacillusamyloliquefaciens)n8,该菌株在一定的盐度下、在三态氮存在时有不错的聚集能力,能起到脱氮作用。
本发明的目的通过下述技术方案实现:
解淀粉芽孢杆菌(bacillusamyloliquefaciens)n8,已于2021年6月1日保藏于广东省微生物菌种保藏中心(gdmcc),地址为广州市先烈中路100号大院59号楼5楼广东省微生物研究所,保藏编号为:gdmccno.61606。
上述菌株n8是从石斑鱼养殖水体中富集、分离、筛选后得到。结合16srdna序列和菌落形态、生理生化特征鉴定为解淀粉芽孢杆菌(bacillusamyloliquefaciens)。
一种微生物脱氮制剂,为上述的解淀粉芽孢杆菌(bacillusamyloliquefaciens)n8,还可以包含其他微生物。
本发明的解淀粉芽孢杆菌(bacillusamyloliquefaciens)n8及其制剂可以应用在含有一定盐度的含氮废水的脱氮处理中;
所述的含氮是指含有氨氮(nh4+-n)、硝态氮(no3--n)或亚硝态氮(no2--n)中的一种以上;
所述的含氮废水尤其指含氮水产养殖用水、工业废水和生活污水;
所述的含氮废水中,nh4cl的初始浓度为0.193g/l,nano2的初始浓度为0.246g/l,kno3的初始浓度为0.361g/l;
所述的盐度,是指nacl浓度≤30‰(w/v),优选≤20‰,特别优选≤10‰;
优选地,在常温(20-30℃)下,将1%的解淀粉芽孢杆菌(bacillusamyloliquefaciens)n8种子液加入到含氮废水中,经过充分扩散和培养,能起到脱氮效果;
所述的种子液,是将n8接种到lb培养基,培养至od600为1时,作为种子液。
本发明相对于现有技术具有如下的优点及效果:
1、本发明筛选出一株解淀粉芽孢杆菌(bacillusamyloliquefaciens)n8,其具有高效去除氨氮的硝化能力和高效去除亚硝和硝酸盐氮的反硝化能力;进一步发现这种细菌具有一定的耐盐性,在含盐条件中能有效发挥其脱氮能力。利用这类具有耐盐硝化和反硝化能力的细菌的生理生化特性和代谢机理,能够较好地解决在含盐条件下去除废水中氨氮、亚硝和硝态氮存在的难题。同时,所述菌种可以在三态氮存在下,具有较高的自聚集能力,一定情况下解决菌种在水体环境中的定植问题。
2、本发明提供的解淀粉芽孢杆菌bacillusamyloliquefaciensn8,当接种量为1%(v/v)时,其对nh4+-n、no2--n和no3--n都有较高去除率,说明bacillusamyloliquefaciensn8具有高效的硝化和反硝化性能。此外,通过耐盐性测定结果判定bacillusamyloliquefaciensn8具有一定的耐盐性,但盐度过高会导致其生长速度缓慢。在0-30‰盐度条件下,bacillusamyloliquefaciensn8具有较好的生长和较高的脱氮性能。同时,bacillusamyloliquefaciensn8可以在三态氮存在下,具有较高的自聚集能力。因此,本发明菌株bacillusamyloliquefaciensn8在处理高浓度氨氮、亚硝酸盐和硝酸盐废水中具有很好的实用价值和应用前景。
附图说明
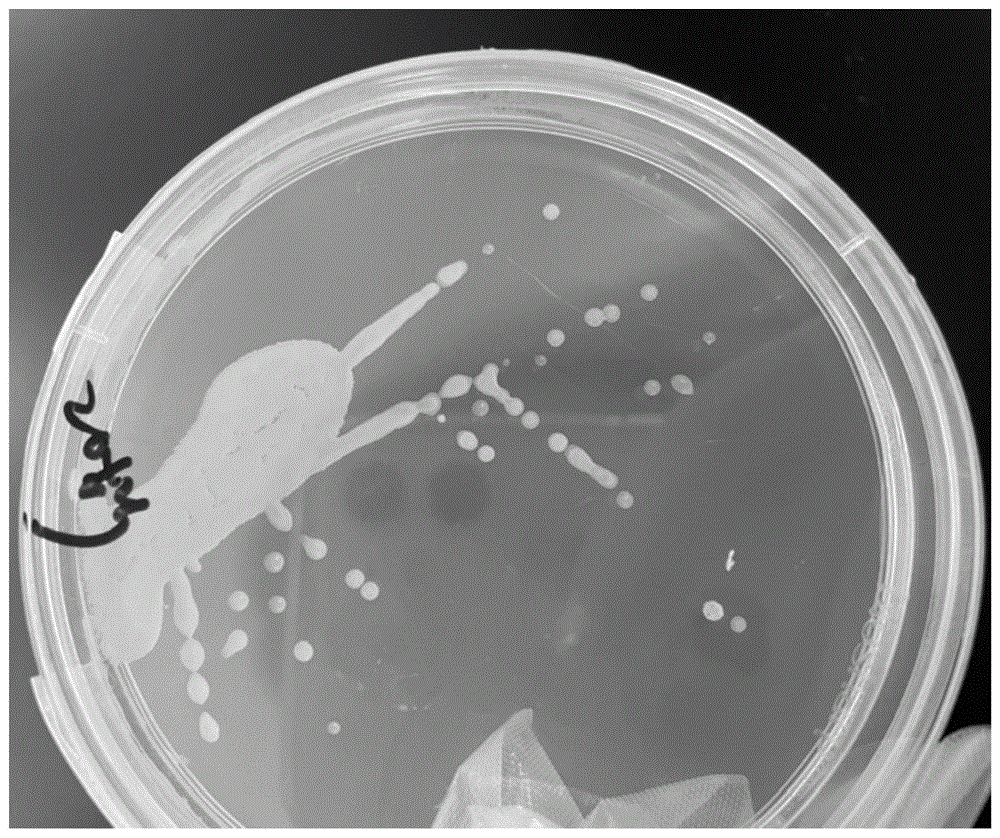
图1是菌株n8的菌落形态图。
图2是pcr扩增产物电泳图谱。
图3是解淀粉芽孢杆菌n8在不同盐度培养基中的od600值。
图4是解淀粉芽孢杆菌n8在不同盐度下的脱氮效果图。
图5是解淀粉芽孢杆菌n8以氨氮为氮源的异养硝化能力。
图6是解淀粉芽孢杆菌n8以硝态氮为氮源的好氧反硝化能力。
图7是解淀粉芽孢杆菌n8以亚硝态氮为氮源的好氧反硝化能力
图8是解淀粉芽孢杆菌n8在三态氮下的自聚集能力。
具体实施方式
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
实施例1
菌株n8的筛选,按以下步骤进行:
(1)取高密度石斑鱼养殖水体于50ml无菌离心管中,4℃保藏备用。取1ml水样品放入250ml锥形瓶中,加入100ml的硝化富集培养基;充分摇匀,30℃、180r·min-1条件下培养,2d后取1ml重新接种至新鲜硝化富集培养基,如此连续富集培养5次。
(2)在无菌条件下,用移液枪吸取lml上述最后一代的液体富集培养液,加入盛有9ml无菌水的20ml试管中,用移液管吹洗3次,充分混匀,即制成10-1浓度的菌液,重复以上操作,最终制成10-3、10-4、10-5、10-6和10-7稀释度不同的菌液。用移液枪分别吸取不同稀释度菌液0.1ml,分别移入相应的溴百里酚蓝(btb)固体培养基中,并用无菌玻璃涂布棒涂布均匀,静置5min,使菌液完全吸附,每个稀释度的菌液做3个平行。将接种好的固体平板培养基放到30℃光照培养箱中倒置培养18-24h,在不同稀释度的固体平板培养基中得到单菌落。
(3)观察菌落表面结构、形态、颜色、透明度以及边缘等状况,选取生长良好、形成蓝色透明圈的目标菌落,采用平板划线分离法进行分离纯化,具体操作步骤如下:在超净工作台中,将接种环在酒精灯下灼烧几分钟,以杀死细菌,待冷却后,用其挑取单菌落,先在固体培养基的一边将接种环上的菌落涂于培养基上,尽量使其均匀,同时作第一次平行划线,约3~4条,再转动平板约70°角,同时将接种环上剩余的菌落烧掉,待冷却后,通过第一次划线部分作第二次平行划线,且两次的平行划线不重叠,再用同样的方法以此类推做出第三次、第四次平行划线。最后将接种过的固体分离培养基依次编号,于30℃的光照培养箱中倒置培养。培养1~2天后,每组分别进行接种。用酒精灯外焰灼烧接种环灭菌,将接种环接触试管内壁,再选取单一完整的菌落。各组分别接种2组平板btb固体培养基,另外接种2组硝化富集培养基。在纯化的过程中要特别注意的是当接种环上的菌不易脱落时,将其置于液体培养基表面处与试管内壁不断摩擦,直至菌体脱落到液体中为止,然后做好标记,置于光照培养箱中培养1-2天后,保存于4℃冰箱中备用。利用平板划线法纯化后的菌落通过甘油(25%)保种法保存于-80冰箱中,完成初筛,以备后期使用。
(4)把初筛菌株分别放到以氨氮为氮源的硝化基础培养基和以亚硝酸盐为氮源的反硝化培养基中培养,以nh4+-n和no2--n的去除率作为指标进行筛选,选取nh4+-n和no2--n去除率均较高的菌液,经分离、纯化后,获得一株具有高效脱氮功能的菌株n8,其菌落形态如图1所示。
其中,所述硝化富集培基基配方:(nh4)2so40.5g/l,kh2po41.0g/l,fecl2·6h2o0.5g/l,cacl2·7h2o0.2g/l,mgso4·7h2o1.0g/l,na3c6h5o7·2h2o4.08g/l,ph值7.0~7.5,温度为121℃高压条件下灭菌30min制成;
btb固体培养基配方:kno31.0g/l,l-天冬酰胺1.0g/l,用酒精稀释0.1%的溴百里酚蓝(btb)5ml,na3c6h5o7·2h2o8.5g/l,kh2po41.0g/l,mgso4·7h2o1.0g/l,cacl2·6h2o0.2g/l,fecl2·6h2o0.05g/l,琼脂20g/l,ph值7.0~7.5,温度为121℃高压条件下灭菌30min制成。
其中,以氨氮为氮源的硝化基础培养基的配方为:nh4cl0.193g/l,c4h4na2o44.08g/l,50ml微量元素溶液,定容至1l,ph值7.5。
其中,以亚硝酸盐为氮源的反硝化培养基的配方为nano20.246g/l,c4h4na2o44.08g/l,50ml微量元素溶液,定容至1l,ph值7.5。
微量元素溶液配方为:k2hpo45g/l,mgso4·7h2o2.5g/l,nacl2.5g/l,mnso4·4h2o0.05g/l,feso4·7h2o0.05g/l。
实施例2
菌株n8的有关性状特征和鉴定
菌株n8菌落较小,较湿润,光滑,较透明,易挑取,边缘整齐,表面光滑,有光泽。显微镜下观察菌体杆状,为革兰氏阴性菌。其有关生理生化特征如表1所示,v-p实验、明胶液化、淀粉水解实验呈阳性;硝酸盐还原实验呈阴性,可利用柠檬酸盐、丙酸盐、l-阿拉伯糖、d-甘露醇作为碳源,不能利用d-木糖。7%nacl中不能生长,在ph值5.7和厌氧条件下能生长。
表1菌株n8的生理生化特征
+:生长或阳性;-:未生长或阴性
16srdna基因测序及多重pcr鉴定:
菌株n8基因组dna的pcr扩增:以菌株n8总dna为模板,扩增引物为一对通用引物;
正向引物f为:5’-actcctacgggaggcagcag-3’(seq.id.no.1);
反向引物r为:5'-ggactachvgggtwtctaat-3’(seq.id.no.2)。
pcr反应体系如下:pcr反应在25μl体系中进行。反应体系的组成为:mix12ul+dna模板2ul+引物f1ul+引物r1ul+无菌超纯水9ul。
pcr扩增程序为:94℃预变性5min,94℃变性60s,55℃退火60s,72℃延伸90s,共30个循环,72℃修复延伸10min,4℃终止反应,将获得片段用于测序。
pcr扩增产物取5μl用1%琼脂糖凝胶电泳检测。pcr扩增产物电泳图谱如图2所示。
验证后切下胶条,用dna凝胶回收试剂盒(vazyme)纯化pcr产物。然后将纯化后的pcr产物送公司测序,测序工作由深圳华大基因公司完成。菌株n8的16srdna基因序列如seq.id.no.3所示。
将测序结果在genbank进行比对,与芽孢杆菌属bacillus的多个种群的16srdna序列的同源性为100%。
参照《常见细菌系统鉴定手册》和《伯杰细菌鉴定手册》,结合生理生化特征、16srdna基因测序和多重pcr鉴定结果,鉴定该菌株n8为解淀粉芽孢杆菌(bacillusamyloliquefaciens),命名菌株n8为:bacillusamyloliquefaciensn8,保藏日期为2021年6月1日,保藏于广东省微生物菌种保藏中心(gdmcc),地址为广州市先烈中路100号大院59号楼5楼,广东省微生物研究所,保藏编号为:gdmccno.61606。
实施例3
解淀粉芽孢杆菌bacillusamyloliquefaciensn8的耐盐性试验
将在斜管培养基上保存的bacillusamyloliquefaciensn8用接种环刮取2环菌苔,接种入装有100ml已灭菌的lb培养基的250ml锥形瓶中,30℃、140r·min-1条件下培养,待培养基od600为1时,作为种子液。
配制不同盐度梯度的硝化基础培养基,其中nacl浓度分别为0、10‰、20‰、30‰、40‰和50‰(w/v);将bacillusamyloliquefaciensn8种子液接种1%(v/v)至装有300ml硝化基础培养基的500ml锥形瓶中;充分摇匀,30℃、140r·min-1条件下培养48h,以菌株生长状况(od600)作为该菌株是否耐相应盐度的依据;以未接种细菌的培养基作为空白对照,每组3个平行。
图3为bacillusamyloliquefaciensn8在不同盐度梯度的硝化基础培养基中生长情况。经48h培养后,各盐度培养基的菌液浓度均有增长,在含0~40‰nacl的培养基中,所述菌株的生长无显著性差异(p>0.05)。但在盐度为50‰时,所述菌株的生长受到了明显的抑制,od600仅为0.065,显著低于其他组(p<0.05)。在盐度为0~30‰时,od600均大于0.25,证明bacillusamyloliquefaciensn8具有一定的耐盐性,但盐度过高会导致其生长速度缓慢,甚至抑制生长。
其中,硝化基础培养基的配方为nh4cl0.193g/l(nh4+-n50mg/l),c4h4na2o44.08g/l,50ml微量元素溶液,定容至1l,ph值7.5。
微量元素溶液的配方是:k2hpo45g/l,mgso4·7h2o2.5g/l,nacl按实验要求添加,mnso4·4h2o0.05g/l,feso4·7h2o0.05g/l。
实施例4
不同盐度下解淀粉芽孢杆菌bacillusamyloliquefaciensn8的异养硝化性能试验
配制不同盐度梯度的硝化基础培养基,其中nacl浓度分别为0、10‰、20‰、30‰、40‰和50‰;以1%种子液(种子液同实施例3)接种量转移至已灭菌的各盐度培养基中,30℃、140r·min-1条件下培养48h;测定培养基中nh4+-n浓度变化,检测该菌株的硝化性能。以未接种细菌的培养基作为空白对照,每组3个平行。
结果如图4所示,经48h培养后,bacillusamyloliquefaciensn8在各盐度条件下均具有一定的nh4+-n去除能力,但盐度过高抑制菌株生长,从而降低其对nh4+-n去除能力。在0~20‰nacl盐度条件下,bacillusamyloliquefaciensn8具有高效的nh4+-n去除能力,去除率均在70%以上。其中,10‰和20‰的去除率分别是74%和70.39%。
在盐度为30‰,去除率为63.54%。在40‰~50‰盐度条件下,盐度过高抑制菌株生长,导致bacillusamyloliquefaciensn8对nh4+-n去除能力显著降低(p<0.05)。
其中,硝化基础培养基的配方为nh4cl0.193g/l(nh4+-n50mg/l),c4h4na2o44.08g/l,50ml微量元素溶液,定容至1l,ph值7.5。
微量元素溶液的配方是:k2hpo45g/l,mgso4·7h2o2.5g/l,nacl按实验要求添加,mnso4·4h2o0.05g/l,feso4·7h2o0.05g/l。
实施例5
解淀粉芽孢杆菌bacillusamyloliquefaciensn8的异养硝化性能实验
将bacillusamyloliquefaciensn8接种在lb培养基,30℃、140r·min-1条件下培养,待培养基od600为1时;以1%接种量接种于装有300ml已灭菌的硝化基础培养基的500ml锥形瓶中,30℃、140r·min-1条件下培养;每12h取定量的培养液测定od值,离心后测定培养液中nh4+-n,检测该菌株的硝化性能。以未接种细菌的培养基作为空白对照,每组3个平行。
结果如图5所示,在培养36h后,硝化基础培养基中的nh4+-n浓度快速下降;在培养72h后,bacillusamyloliquefaciensn8对nh4+-n的去除率为95.44%,培养液中nh4+-n浓度由最初的48.45mg/l降至2.21mg/l。
其中lb培养基为胰蛋白胨10g/l,酵母提取物5g/l,nacl10g/l。
其中,硝化基础培养基的配方为nh4cl0.193g/l(nh4+-n50mg/l),c4h4na2o44.08g/l,50ml微量元素溶液,定容至1l,ph值7.5。
微量元素溶液的配方是:k2hpo45g/l,mgso4·7h2o2.5g/l,nacl2.5g/l,mnso4·4h2o0.05g/l,feso4·7h2o0.05g/l。
实施例6
解淀粉芽孢杆菌bacillusamyloliquefaciensn8以硝酸盐为氮源的好氧反硝化性能试验
将bacillusamyloliquefaciensn8接种至lb培养基中进行培养,30℃、140r·min-1条件下培养,待培养基od600为1时;以1%接种量接种于装有300ml已灭菌反硝化培养基的500ml锥形瓶中,30℃、140r·min-1条件下培养;每12h取定量的培养液测定od值,离心后测定培养液中no3--n,检测该菌株的好氧反硝化性能。以未接种细菌的培养基作为空白对照,每组3个平行。
结果如图6所示,在培养72h后,反硝化培养基中的no3--n浓度由最初的51.89mg/l降至14.75mg/l,bacillusamyloliquefaciensn8对no3--n的去除率为71.55%。
其中,以硝酸盐为氮源的反硝化培养基的配方为kno30.361g/l(no3--n50mg/l),c4h4na2o44.08g/l,50ml微量元素溶液,定容至1l,ph值7.5。
微量元素溶液的配方是:k2hpo45g/l,mgso4·7h2o2.5g/l,nacl2.5g/l,mnso4·4h2o0.05g/l,feso4·7h2o0.05g/l。
实施例7
解淀粉芽孢杆菌bacillusamyloliquefaciensn8以亚硝酸盐为氮源的好氧反硝化性能试验
将bacillusamyloliquefaciensn8接种至lb培养基中进行培养,30℃、140r·min-1条件下培养,待培养基od600为1时;以1%接种量接种于装有300ml已灭菌反硝化培养基的500ml锥形瓶中,30℃、140r·min-1条件下培养;每12h取定量的培养液测定od值,离心后测定培养液中no2--n,检测该菌株的好氧反硝化性能。以未接种细菌的培养基作为空白对照,每组3个平行。
结果如图7所示,在培养72h后,反硝化培养基中的no2--n浓度由最初的53.93mg/l降至0.62mg/l,bacillusamyloliquefaciensn8对no2--n的去除率为98.85%。
其中,反硝化培养基的配方为nano20.246g/l(no2--n50mg/l),c4h4na2o44.08g/l,50ml微量元素溶液,定容至1l,ph值7.5。
微量元素溶液的配方是:k2hpo45g/l,mgso4·7h2o2.5g/l,nacl2.5g/l,mnso4·4h2o0.05g/l,feso4·7h2o0.05g/l。
实施例8
解淀粉芽孢杆菌bacillusamyloliquefaciensn8在三态氮存在下自聚集能力
将bacillusamyloliquefaciensn8接种在lb培养基中进行培养,30℃、140r·min-1条件下培养,待培养基od600为1时;以1%接种量接种于装有300ml已灭菌硝化和反硝化培养基的500ml锥形瓶中,30℃、140r·min-1条件下培养。将经过不同时间培养后的菌液分装至若干无菌的50ml离心管中,5000rpm离心10min收集菌体,再用pbs缓冲液冲洗两次后重悬,分别制备成菌悬液,然后分别取6ml分装于10ml无菌离心管中,在涡流振荡器上振荡2min,室温条件下静置150min后取4ml上清液测定其在600nm处的吸光度,并以振荡2min后的悬浮液od600作为初始值,以静置前后的吸光度值变化表征菌株n8的自聚集能力。
计算公式为:自聚集能力(%)=(1–振荡静置后的上清液od600/初始菌悬液od600)×100%。
结果如图8所示,在硝化基础培养基、亚硝酸盐为氮源的反硝化培养基和以硝酸盐为氮源的反硝化培养基下,bacillusamyloliquefaciensn8均表现出了一定的自聚集能力。在以nh4+-n、no2--n和no3--n为氮源时,在培养9h后均表现出较好的自聚集能力。说明bacillusamyloliquefaciensn8在异养硝化和好氧反硝化过程中,均可以保持不错的自聚集能力,意味着菌种在水体环境中可以更好的定植。
其中,硝化培养基的配方为:nh4cl0.193g/l,c4h4na2o44.08g/l,50ml微量元素溶液,定容至1l,ph值7.5。
其中,以亚硝酸盐为氮源的反硝化培养基的配方为nano20.246g/l,c4h4na2o44.08g/l,50ml微量元素溶液,定容至1l,ph值7.5。
其中,以硝酸盐为氮源的反硝化培养基的配方为kno30.361g/l,c4h4na2o44.08g/l,50ml微量元素溶液,定容至1l,ph值7.5。
微量元素溶液配方为:k2hpo45g/l,mgso4·7h2o2.5g/l,nacl2.5g/l,mnso4·4h2o0.05g/l,feso4·7h2o0.05g/l。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
序列表
<110>华南师范大学
<120>一株耐盐高自聚集能力的解淀粉芽孢杆菌及其在脱氮中的应用
<160>3
<170>siposequencelisting1.0
<210>1
<211>20
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>正向引物f
<400>1
actcctacgggaggcagcag20
<210>2
<211>20
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>反向引物r
<400>2
ggactachvgggtwtctaat20
<210>3
<211>456
<212>dna
<213>解淀粉芽孢杆菌(bacillusamyloliquefaciens)
<220>
<223>16srdna
<400>3
tactcctacgggaggcagcagtagggaatcttccgcaatggacgaaagtctgacggagca60
acgccgcgtgagtgatgaaggttttcggatcgtaaagctctgttgttagggaagaacaag120
tgccgttcaaatagggcggcaccttgacggtacctaaccagaaagccacggctaactacg180
tgccagcagccgcggtaatacgtaggtggcaagcgttgtccggaattattgggcgtaaag240
ggctcgcaggcggtttcttaagtctgatgtgaaagcccccggctcaaccggggagggtca300
ttggaaactggggaacttgagtgcagaagaggagagtggaattccacgtgtagcggtgaa360
atgcgtagagatgtggaggaacaccagtggcgaaggcgactctctggtctgtaactgacg420
ctgaggagcgaaagcgtggggagcgaacaggattag456
- 还没有人留言评论。精彩留言会获得点赞!