抗B7-H3抗体及其用途的制作方法
抗b7-h3抗体及其用途
技术领域
1.本发明涉及生物医药领域,特别是涉及抗b7-h3抗体及其用途。
背景技术:
2.b7-h3是一种i型跨膜蛋白,属于b7免疫共刺激和共抑制分子家族。在人类中有2ig-b7-h3和4ig-b7-h3两种亚型,在小鼠中只有2ig-b7-h3亚型。在非恶性组织中,b7-h3主要发挥免疫抑制作用,抑制t细胞的活化和增殖,抑制自然杀伤细胞的细胞毒活性。b7-h3蛋白在许多不同类型的人类恶性肿瘤中均高表达。在恶性组织中,b7-h3抑制肿瘤抗原特异性免疫反应,促进肿瘤细胞的迁移和侵袭、血管生成、化疗耐药性和内皮细胞向间质转化,影响肿瘤细胞的代谢等。此外,肿瘤相关血管也会过表达b7-h3。b7-h3在肿瘤细胞中的过表达与肿瘤浸润淋巴细胞的减少、癌症恶化进程加快和一些恶性肿瘤的不良临床后果相关,如胰管腺癌、前列腺癌、卵巢癌、肺癌和透明细胞肾癌。因此,b7-h3是非常有潜力的肿瘤免疫治疗靶点,开发靶向b7-h3的治疗符合当下的需求。
技术实现要素:
3.鉴于以上所述现有技术的缺点,本发明的目的在于提供抗b7-h3抗体及其用途,用于解决现有技术中的问题。
4.为实现上述目的及其他相关目的,本发明提供一种抗b7-h3的抗体,所述抗b7-h3抗体包括重链可变区和轻链可变区,所述抗b7-h3抗体具有如下技术特征中的一个或多个;《1》 重链可变区包括氨基酸序列如seq id no.5所示的cdr-h1;《2》 重链可变区包括氨基酸序列如seq id no.6所示的cdr-h2;《3》 重链可变区包括氨基酸序列如seq id no.7所示的cdr-h3;《4》 轻链可变区包括氨基酸序列如seq id no.8所示的cdr-l1;《5》 轻链可变区包括氨基酸序列如seq id no.9所示的cdr-l2;《6》 轻链可变区包括氨基酸序列如seq id no.10所示的cdr-l3。
5.优选的,所述抗b7-h3抗体为单链抗体。
6.优选的,抗b7-h3单链抗体的氨基酸序列如seq id no.23所示。
7.本发明还提供所述抗b7-h3抗体在制备或筛选肿瘤治疗药物中的用途,或制备肿瘤诊断药物中的用途。
8.本发明还提供一种分离的多肽,所述多肽包括跨膜域、胞内域和胞外域,所述胞外域包括所述抗b7-h3抗体。
9.本发明还提供一种分离的多核苷酸,编码所述抗b7-h3抗体的重链可变区和/或轻链可变区,或编码所述分离的多肽。
10.本发明还提供一种核酸构建体,所述核酸构建体含有所述分离的多核苷酸。
11.本发明还提供一种t淋巴细胞,所述t淋巴细胞表达所述多肽。
12.如上所述,本发明的抗b7-h3抗体及其用途,具有以下有益效果:更佳的细胞杀伤
效果。
附图说明
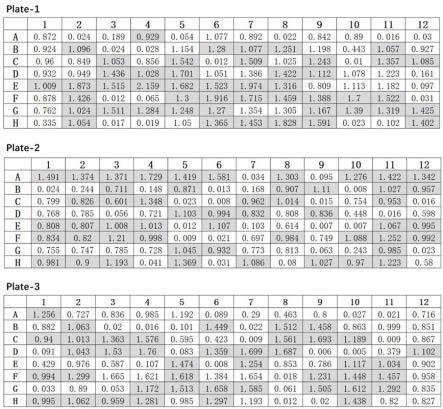
13.图1提供了抗人b7-h3 fc单克隆噬菌体elisa 96孔板的读数。
14.图2提供了用于b7-h3 car mrna生成的pca70-car载体结构示意图。
15.图3提供了多种肿瘤细胞相对于jeko1细胞的b7-h3 mrna表达水平。
16.图4提供了多种肿瘤细胞表面b7-h3蛋白表达水平。
17.图5提供了b7-h3 car mrna电穿孔后的t细胞与不同浓度人2ig-b7-h3-fc蛋白的结合。
18.图6提供了b7-h3 car mrna电穿孔后的t细胞表达b7-h3 car的比例。
19.图7提供了b7-h3 car mrna电穿孔后的t细胞对多种b7-h3阳性肿瘤细胞的杀伤曲线。
20.图8提供了b7-h3 car mrna电穿孔后的t细胞表达b7-h3 car的比例。
21.图9提供了b7-h3 car mrna电穿孔后的t细胞对多种肿瘤细胞的杀伤曲线。
22.图10提供了不同量的b7-h3 mrna电穿孔的jeko1细胞表达b7-h3的水平。
23.图11提供了b7-h3 car mrna电穿孔后的t细胞表达b7-h3 car的比例。
24.图12提供了b7-h3 car mrna电穿孔的t细胞与不同量b7-h3 mrna电穿孔的jeko1细胞共培养后表达cd107a的比例。
25.图13提供了b7-h3 car mrna电穿孔后的t细胞对抗原表达水平不同的肿瘤细胞的杀伤曲线。
具体实施方式
26.术语“抗b7-h3抗体”和“anti-b7-h3 antibody”在本文中可互换使用。
27.本文中术语“抗体”使用其最广泛的含义,具体覆盖完整单克隆抗体、多克隆抗体、由至少两种完整抗体形成的多特异性抗体(如双特异性抗体)和抗体片段,只要它们显示所需生物学活性即可。
[0028]“结合”目的抗原,如b7-h3抗原的抗体指能够以足够亲和力结合抗原的抗体,以便该抗体可用作靶向表达该抗原的细胞的治疗剂。如果抗体是结合b7-h3的抗体,那么它通常优先结合b7-h3,而非其它抗体。
[0029]
术语“单克隆抗体”在用于本文时指由基本上同质的抗体群获得的抗体,即构成群体的各个抗体相同,除了可能的天然存在的突变外,它们通常以极少量存在。单克隆抗体是高度特异的,即针对单一抗原位点。另外,与包含针对不同决定簇(表位)的不同抗体的多克隆抗体制品不同,每种单克隆抗体针对抗原上的单一决定簇。除了它们的特异性以外,单克隆抗体的优越性体现在可以合成它们而不受其它抗体的污染。修饰语“单克隆”指示抗体由基本上同质的抗体群获得的特征,并不解释为需要通过任何特定方法来生产抗体。
[0030]
本文中的单克隆抗体明确包括“嵌合”抗体,其中重链和/或轻链的一部分与衍生自特定物种或属于特定抗体类别或亚类的抗体中的相应序列相同或同源,而链的剩余部分与衍生自另一物种或属于另一抗体类别或亚类的抗体中的相应序列相同或同源,以及这类抗体的片段,只要它们显示所需生物学活性即可。
[0031]“完整”抗体为包含抗原结合可变区以及轻链恒定区(c)和重链恒定区ch1、ch2和ch3的抗体。恒定区可以为天然序列恒定区(例如人天然序列恒定区)或其氨基酸序列变体。优选的是,完整抗体具有一种或多种效应器功能。
[0032]“抗体片段”包含完整抗体的一部分,优选包含其抗原结合或可变区。抗体片段的例子包括fab、fab
′
、f(ab
′
)2、fv片段、线性抗体、单链抗体(single chain fv, scfv)。
[0033]“fv”片段是包含完整的抗原识别和结合位点的抗体片段。此区域由一个重链的和一个轻链的可变区紧密连接的二聚体组成,该连接(如在scfv中)可以是共价的。在此构型中,每个可变区的三个cdr相互作用来限定vh-vl二聚体表面上的抗原结合位点。
[0034]“fab”片段包括轻链的可变区和恒定区以及重链的可变区和第一恒定区(ch1)。f(ab’)2抗体片段包含一对fab片段,其通常在它们的羧基末端附近通过它们之间的铰链半胱氨酸来共价连接。抗体片段的其它化学偶联法也是本领域已知的。
[0035]“单链抗体”或称为“scfv”抗体片段包含抗体的vh和vl结构域。通常,单链抗体还包含vh和vl结构域之间的多肽接头(linker),该接头使scfv形成结合抗原的理想结构。
[0036]
术语“线性抗体”包含成对的串联fd节段(vh-ch1-vh-ch1),它与互补轻链多肽一起形成成对的抗原结合区。线性抗体可以是双特异性的或单特异性的。
[0037]
本文所用的术语“抗体可变区”指抗体分子的轻链和重链的部分,其包括互补决定区(cdrs:即cdr1,cdr2和cdr3)和框架区(frs)的氨基酸序列。vh指重链的可变区。vl指轻链的可变区。根据本发明所用方法,cdrs和frs指定的氨基酸位点可以通过kabat等(sequences of proteins of immunological interest,第5版,public health service national institutes of health,bethesda,md(1991)中描述的编号系统)来限定。
[0038]
本文所用的术语“互补决定区”(cdrs:即cdr1,cdr2和cdr3)指抗体可变区的氨基酸残基,其存在对于抗原结合是必需的。每个可变区通常具有鉴定为cdr1,cdr2和cdr3的三个cdr区。每个互补决定区可包含来自kabat所限定的“互补决定区”的氨基酸残基(即大约为轻链可变区中的残基24-34(l1),50-56(l2)和89-97(l3)以及重链可变区中的31-35(h1),50-65(h2)和95-102(h3)。
[0039]“框架区”(后文称为fr)是cdr残基之外的那些可变区残基。每个可变区通常具有fr1,fr2,fr3和fr4的四个fr。如果所述cdr根据kabat来限定,轻链fr残基大致位于残基1-23(lcfr1),35-49(lcfr2),57-88(lcfr3),和98-107(lcfr4),并且重链fr残基大致位于重链残基的残基1-30(hcfr1),36-49(hcfr2),66-94(hcfr3),和103-113(hcfr4)。如果所述cdr包含来自高变环的氨基酸残基,轻链fr残基大致位于轻链中的残基1-25(lcfr1),33-49(lcfr2),53-90(lcfr3),和97-107(lcfr4),且重链fr残基大致位于重链残基的残基1-25(hcfr1),33-52(hcfr2),56-95(hcfr3),和102-113(hcfr4)。有些情况下,当cdr包含来自根据kabat限定的cdr和高变环的那些氨基酸时,fr残基会相应调节。例如,当cdrh1包括氨基酸h26-h35时,重链fr1残基在位点1-25且fr2残基在位点36-49。
[0040]“t细胞抗原表位”(t cell epitope)用于本文是指单克隆抗体本身作为蛋白质抗原时可被mhc分子结合和提呈,并被t细胞抗原受体所识别的可能肽段。单克隆治疗抗体所含的这些肽段会增加患者对治疗抗体的免疫反应。这些肽段数量越多,引起免疫反应的几率越高。
[0041]
非人(如啮齿类)抗体的“人源化”形式指最低限度包含衍生自非人免疫球蛋白的
序列的嵌合抗体。在极大程度上,人源化抗体指人免疫球蛋白(受体抗体)中的高变区残基用具有所需特异性、亲和力和能力的非人物种(供体抗体)诸如小鼠、大鼠、兔或非人灵长类的高变区残基替换的免疫球蛋白。在有些情况中,将人免疫球蛋白的构架区(fr)残基用相应的非人残基替换。而且,人源化抗体可包含在受体抗体或供体抗体中没有发现的残基。进行这些修饰是为了进一步改进抗体的性能。通常,人源化抗体将包含基本上不少于至少一个、通常两个下述可变区,其中所有或基本上所有的高变环对应于非人免疫球蛋白的高变环,且所有或基本上所有的fr是人免疫球蛋白序列的fr。任选的是,人源化抗体还将包含至少部分的免疫球蛋白恒定区(fc),通常是人免疫球蛋白的恒定区。
[0042]
本发明提供一种抗b7-h3的抗体,所述抗b7-h3抗体包括重链可变区和轻链可变区,所述抗b7-h3抗体具有如下技术特征中的一个或多个;《1》 重链可变区包括氨基酸序列如seq id no.5所示的cdr-h1;《2》 重链可变区包括氨基酸序列如seq id no.6所示的cdr-h2;《3》 重链可变区包括氨基酸序列如seq id no.7所示的cdr-h3;《4》 轻链可变区包括氨基酸序列如seq id no.8所示的cdr-l1;《5》 轻链可变区包括氨基酸序列如seq id no.9所示的cdr-l2;《6》 轻链可变区包括氨基酸序列如seq id no.10所示的cdr-l3。
[0043]
在本发明某些实施方式中,所述抗b7-h3抗体的重链可变区的互补决定区包括氨基酸序列如seq id no.5所示的cdr-h1、氨基酸序列如seq id no.6所示的cdr-h2和氨基酸序列如seq id no.7所示的cdr-h3。
[0044]
在本发明某些实施方式中,所述抗b7-h3抗体的轻链可变区的互补决定区包括氨基酸序列如seq id no.8所示的cdr-l1、氨基酸序列如seq id no.9所示的cdr-l2和氨基酸序列如seq id no.10所示的cdr-l3。
[0045]
在本发明某些实施方式中,重链可变区的互补决定区包括氨基酸序列如seq id no.5所示的cdr-h1、氨基酸序列如seq id no.6所示的cdr-h2和氨基酸序列如seq id no.7所示的cdr-h3,轻链可变区的互补决定区包括氨基酸序列如seq id no.8所示的cdr-l1、氨基酸序列如seq id no.9所示的cdr-l2和氨基酸序列如seq id no.10所示的cdr-l3。
[0046]
在本发明某些实施方式中,重链可变区和轻链可变区中还包括框架区。在本发明某些具体实施方式中,所述框架区的序列为人源单抗可变区,或为鼠源单抗可变区的框架区序列经过取代、缺失或者添加一个或多个(具体可以是1-50、1-30个、1-20个、1-10个、1-5个、或1-3个)氨基酸而得到的框架区序列,该框架区序列与人源单抗可变区序列的框架区序列可以具有80%、85%、90%、93%、95%、97%、或99%以上的同源性。
[0047]
在本发明某些实施方式中,hcfr1的氨基酸序列如seq id no.11所示,hcfr2的氨基酸序列如seq id no.12所示,hcfr3的氨基酸序列如seq id no.13所示, hcfr4的氨基酸序列如seq id no.14所示。lcfr1的氨基酸序列如seq id no.15所示,lcfr2的氨基酸序列如seq id no.16所示,lcfr3的氨基酸序列如seq id no.17所示, lcfr4的氨基酸序列如seq id no.18所示。
[0048]
在本发明某些实施方式中,所述抗b7-h3抗体为单链抗体(single chain fv, scfv)。所述抗b7-h3单链抗体包括vh和v
l
,vh和v
l
之间设有连接肽,所述抗b7-h3单链抗体自n端至c端可以依次包括 v
l
、连接肽和vh,所述抗b7-h3单链抗体自n端至c端也可以依次包括
vh、连接肽和v
l
。所述连接肽可以是本领域中各种适用于形成scfv的连接肽,例如,所述连接肽可以是g4s3 linker,所述g4s3 linker的选择或设计可以参考文献michel sadelain etc,science translational medicine,2013;carl h .june etc, science translational medicine ,2015。
[0049]
在本发明某些实施方式中,所述抗b7-h3单链抗体从人源噬菌体抗体展示库中通过筛选得到。所述抗b7-h3单链抗体的轻链可变区和重链可变区氨基酸序列如seq id no.19和seq id no.20所示。所述抗b7-h3单链抗体的重链可变区和轻链可变区核苷酸序列分别如seq id no.21和 seq id no.22所示。
[0050]
在本发明某些实施方式中,所述抗b7-h3单链抗体的氨基酸序列如seq id no.23所示。
[0051]
本发明还提供所述抗b7-h3抗体在制备或筛选治疗药物中的用途,或制备诊断药物中的用途。
[0052]
所述治疗药物可以是以b7-h3抗原为作用靶标,结合或作用于所述b7-h3抗原,从而治疗和/或预防适应症的药物。
[0053]
在本发明某些实施方式中,所述治疗药物可以是肿瘤治疗药物。所述肿瘤治疗药物可以是以肿瘤细胞表面功能性表面的b7-h3抗原为靶标,结合或作用于b7-h3抗原,从而治疗和/或预防肿瘤的药物。所述肿瘤可以是b7-h3表达阳性的实体瘤或血液瘤。所述实体瘤例如为肺癌、卵巢癌、乳腺癌、胰腺癌。所述血液瘤包括但不限于非霍奇金淋巴瘤、慢性淋巴细胞白血病、急性淋巴细胞白血病、人b细胞前体白血病、多发性骨髓瘤、恶性淋巴瘤等。
[0054]
在本发明某些实施方式中,所述治疗药物为嵌合抗原受体细胞治疗药物。
[0055]
所述嵌合抗原受体细胞治疗药物通常包括嵌合抗原受体细胞,所述嵌合抗原受体细胞可以是嵌合抗原受体t细胞、嵌合抗原受体nk细胞等。所述嵌合抗原受体t细胞通常包括t淋巴细胞和嵌合抗原受体。所述嵌合抗原受体nk细胞通常包括nk细胞和嵌合抗原受体。所述嵌合抗原受体包括跨膜域、胞内域和胞外域。在本发明某些实施方式中,所述胞外域包括所述抗b7-h3抗体,即所述嵌合抗原受体细胞可以在细胞表面表达所述抗b7-h3抗体,从而可以引导该细胞对表达b7-h3抗原的细胞(例如肿瘤细胞)进行作用的药物。所述对表达b7-h3抗原的细胞进行作用可以是杀伤表达b7-h3抗原的细胞等。
[0056]
所述诊断药物具体指针对作用靶标b7-h3抗原,以b7-h3抗原作为生物标志物进行诊断的试剂。
[0057]
本发明还提供一种分离的多肽,所述多肽包括跨膜域、胞内域和胞外域,所述胞外域包括所述抗b7-h3抗体。
[0058]
在本发明某些实施方式中,所述多肽为嵌合抗原受体。
[0059]
在本发明某些实施方式中,所述跨膜域可以包括cd8α、cd28、dap 10等蛋白分子的跨膜结构域。
[0060]
例如,cd8α的氨基酸序列如seq id no.31所示。cd8α的核苷酸序列如seq id no.26所示。再例如,cd8α的序列可参照nm_001145873,cd28的序列可参照nm_006139,dap10的序列可参照nm_014266。
[0061]
在本发明某些实施方式中,所述胞内域可以包括共刺激结构域和/或信号结构域,例如,所述胞内域可以包括4-1bb、cd28、ox40、icos、cd3 zeta、dap 10等蛋白分子的信号转
导结构域。例如4-1bb的氨基酸序列如seq id no.32所示。4-1bb的核苷酸序列如seq id no.27所示。cd3 zeta的氨基酸序列如seq id no.33所示。cd3 zeta的核苷酸序列如seq id no.28所示。再例如,4-1bb的序列可参照nm_001561,cd28的序列可参照nm_006139,ox40的序列可参照nm_003327,icos的序列可参照nm_012092,cd3 zeta的序列可参照nm_198053、dap 10的序列可参照nm_014266。在本发明一具体实施方式中,所述胞内域自n端至c端依次包括4-1bb和cd3 zeta。
[0062]
在本发明某些实施方式中,所述胞外域还包括铰链区,所述铰链区选自cd8。cd8铰链的氨基酸序列如seq id no.30所示。cd8铰链的核苷酸序列如seq id no.25所示。
[0063]
在本发明某些实施方式中,所述胞外域还包括信号肽(signal peptide,sp),所述信号肽选自cd8 sp。cd8 sp的氨基酸序列如seq id no.29所示。cd8 sp的核苷酸序列如seq id no.24所示。
[0064]
在本发明某些实施方式中,所述多肽自n端至c端依次包括所述抗b7-h3单链抗体、跨膜域、胞内域。在本发明一些具体实施方式中,所述多肽自n端至c端依次包括抗b7-h3单链抗体、cd8α跨膜区、4-1bb共刺激结构域、cd3 zeta信号结构域。在本发明一具体实施方式中,所述多肽自n端至c端依次包括所述抗b7-h3单链抗体、cd28跨膜区、cd28共刺激结构域、cd3 zeta信号结构域。在本发明另一具体实施方式中,所述多肽自n端至c端依次包括所述抗b7-h3单链抗体、cd8α跨膜区、ox40共刺激结构域、cd3 zeta信号结构域。在本发明另一具体实施方式中,所述多肽自n端至c端依次包括所述抗b7-h3单链抗体、cd8α跨膜区、icos共刺激结构域、cd3 zeta信号结构域。在本发明另一具体实施方式中,所述多肽自n端至c端依次包括所述抗b7-h3单链抗体、cd8α跨膜区、4-1bb共刺激结构域、cd3 zeta。在本发明另一具体实施方式中,所述多肽自n端至c端依次包括所述抗b7-h3单链抗体、cd28跨膜区、cd28共刺激结构域、ox40共刺激结构域、cd3 zeta信号结构域。
[0065]
本发明还提供一种分离的多核苷酸,编码所述抗b7-h3抗体的重链可变区和/或轻链可变区,或编码所述分离的多肽。
[0066]
所述多核苷酸为dna或rna。
[0067]
本发明还提供一种核酸构建体,所述核酸构建体含有所述分离的多核苷酸。
[0068]
术语“核酸构建体”是指可以被引入靶细胞或组织中的人工构建的核酸区段。所述核酸构建体为病毒载体或非病毒载体。病毒载体或非病毒载体均包括空载体和表达框架。所述病毒载体可以为慢病毒载体或腺相关病毒载体。所述非病毒载体可以为mrna载体。
[0069]
本发明还提供一种慢病毒,所述慢病毒由慢病毒载体系统经病毒包装而成。所述慢病毒可以用于感染t细胞来制备cart细胞,或用于感染nk细胞来制备car-nk 细胞。
[0070]
本发明还提供一种细胞,所述细胞表达有所述多肽。
[0071]
在本发明某些实施方式中,所述细胞为car t细胞。
[0072]
在本发明某些实施方式中,所述多肽为嵌合抗原受体。
[0073]
所述cart细胞通常可以表达所述多肽,其通常可以结合于b7-h3抗原,更具体可以通过包含所述抗b7-h3抗体的胞外域结合于b7-h3抗原,当所述多肽结合于所述b7-h3抗原时,所述cart细胞通常可以活化和/或刺激从而得以增殖。在本发明某些实施方式中,所述胞外域包括所述抗b7-h3抗体,即所述car t细胞可以在t淋巴细胞表面表达所述抗b7-h3抗体,从而可以引导t淋巴细胞对表达b7-h3抗原的细胞(例如肿瘤细胞)进行作用的,所述作
用可以是杀伤表达b7-h3抗原的细胞等。
[0074]
在本发明某些实施方式中,所述细胞为car nk细胞。
[0075]
在本发明某些实施方式中,所述多肽为嵌合抗原受体。
[0076]
所述car nk细胞通常可以表达所述多肽,并通常可以结合于b7-h3抗原,更具体可以通过包含所述抗b7-h3抗体的胞外域结合于b7-h3抗原,当所述多肽结合于所述抗原时,所述car nk细胞通常可活化和/或刺激从而得以增殖。在本发明某些实施方式中,所述胞外域包括所述抗b7-h3抗体,即所述car nk细胞可以在nk细胞表面表达所述抗b7-h3抗体,从而可以引导nk细胞对表达b7-h3抗原的细胞(例如肿瘤细胞)进行作用的,所述作用可以是杀伤表达b7-h3抗原的细胞等。
[0077]
本发明还提供所述细胞的制备方法,所述制备方法包括将所述核酸构建体转移至宿主细胞。
[0078]
在本发明某些实施方式中,转移方法可以是电穿孔或病毒转导。
[0079]
在本发明某些实施方式中,所述宿主细胞为t细胞或nk细胞。
[0080]
所述t细胞为细胞毒性t细胞、辅助性t细胞、γδ细胞、cd4 +/cd8+双阳性t细胞、cd4+t细胞、cd8+t细胞、cd4/cd8双阴性t细胞、cd3+t细胞、初始t细胞、效应t细胞、辅助性t细胞、记忆t细胞、调节t细胞、th0细胞、th1细胞、th2细胞、th3(treg)细胞、th9细胞、th17细胞、thαβ辅助细胞、tfh细胞、干细胞记忆tscm细胞、中枢记忆tcm细胞、效应记忆tem细胞,或效应记忆temra细胞。
[0081]
本发明还提供所述分离的多肽、t淋巴细胞、nk细胞在制备或筛选治疗药物中的用途、或制备诊断药物中的用途。
[0082]
所述治疗或诊断药物可以是以b7-h3抗原为作用靶标,结合或作用于所述b7-h3抗原,从而治疗和/或预防适应症的药物。
[0083]
在本发明某些实施方式中,所述治疗药物可以是肿瘤治疗药物。所述肿瘤治疗药物可以是以肿瘤细胞表面功能性表达的b7-h3抗原为靶标,结合或作用于b7-h3抗原,从而治疗和/或预防肿瘤的药物。所述肿瘤可以是乳腺癌、卵巢癌、肺癌等b7-h3表达阳性的肿瘤。
[0084]
本发明还提供一种诊断试剂盒,包含诊断有效剂量的所述抗b7-h3抗体或其免疫偶联物。有效量通常指能够提供诊断效益的量。
[0085]
所述诊断试剂盒通常可以针对作用靶标b7-h3抗原,以b7-h3抗原作为生物标志物进行诊断。所述诊断试剂盒还可以包括抗b7-h3抗体的标记物,所述抗b7-h3抗体的标记物通常可以用于标记抗b7-h3抗体,可选用的标记物的种类包括但不限于荧光标记物、放射性标记物、酶标标记物、化学发光性标记物等中的一种或多种的组合。根据试剂盒的检测原理,所述试剂盒通常还可包含检测所需的一种或多种试剂。此外,所述试剂盒中还可根据需要包括:容器、对照物(阴性或阳性对照)、缓冲剂、助剂等,本领域技术人员可根据具体情况对其进行选择。
[0086]
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
[0087]
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围;在本发明说明书和权利要求书中,除非文中另外明确指出,单数形式“一个”、“一”和“这个”包括复数形式。
[0088]
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
[0089]
实施例1 人抗b7-h3抗体的制备采取以下步骤制备全人抗b7-h3抗体:1)噬菌体展示文库的表达和纯化:用新鲜解冻的m13k07辅助噬菌体感染对数期tg1文库培养物,多重感染率为20:1(噬菌体与细胞之比),并用iptg诱导过夜;用peg/nacl沉淀法纯化噬菌体文库,然后测定噬菌体效价。
[0090]
2)b7-h3特异性scfv-噬菌体的选择:在第一轮选择中,在maxisorp平板上在4
°
c下用20 μg/ml的b7-h3-6his蛋白包被过夜,用pbs洗涤,用5% 牛奶 + 1% bsa在1
×
pbs中封闭,在噬菌体溶液中孵育2小时,用pbst清洗10次。使用酸洗脱缓冲液 (ph2.2) 洗脱与抗原结合的scfv噬菌体,中和,接种于15毫升的对数期的tg1培养(od600=0.5)中,在37
°
c下静置30分钟并摇动30分钟培养,接种到2xyt-ga琼脂平板上,并在30
°
c下培养过夜以供后续选择。在随后的几轮选择中,使用了更严格的选择条件,包括降低包被的蛋白质浓度(第二轮为2μg/ml,第三轮为0.5μg/ml)和增加洗涤周期(第二轮为20次,第三轮为30次)。
[0091]
3)mpelisa筛选:经过三轮筛选后,选出288个阳性菌落进行单克隆噬菌体elisa(mpelisa)筛选。将单个菌落克隆生成的噬菌体上清液与包被有2 μg/ml b7-h3-6his蛋白的预封闭maxisorp板共同孵育。洗涤三次后,加入100μl/孔 的hrp缀合抗m13抗体,所述hrp缀合抗m13抗体在封闭缓冲液(5%牛奶+1%bsa,1
×
pbs)中经1:5000的比例稀释,然后在常温下孵育60分钟。用pbst洗板5次后,添加100
µ
l/孔的tmb底物溶液,并孵育10-30 min,直至出现蓝色。通过添加50μl/孔 的终止溶液 (2n h2so4)来终止反应。在微孔板读取器中读取450 nm处的吸光度。图1显示了mpelisa筛选所得的吸光度读数。如图所示,一些阳性菌落(450nm吸光度≥0.5)被鉴定为产生了能够结合b7-h3-6his蛋白的抗b7-h3抗体(图1)。
[0092]
4)克隆和序列分析:根据elisa结果筛选阳性克隆,并作为scfv序列的pcr克隆的模板(正向引物序列如seq id no:1所示:tgcagctggcacgacaggtttc,反向引物序列如seq id no:2所示:cgtcagactgtagcacgtt)。然后通过sanger测序方法对pcr产物进行测序(正向引物序列如seq id no:3所示:aacaattgaattcaggagga,反向引物序列如seq id no:4所示:cctcctaagaagcgtagtc)。通过abysis网站(http://abysis.org/)分析scfv的cdr区域,cdr的氨基酸序列如seq id no:5~10所示,框架区的氨基酸序列如seq id no:11~18所示,轻链可变区和重链可变区的氨基酸序列分别如seq id no:19~20所示,轻链可变区和重链可变区核苷酸序列分别如seq id no.21和 seq id no.22所示。scfv的氨基酸序列如seq id no:23所示。
[0093]
实施例2b7-h3car的制备构建用于产生抗b7-h3carmrna的载体。首先,通过pcr扩增核苷酸序列如seqidno:24所示的cd8signalpeptide(即cd8sp)、car片段(包括核苷酸序列如seqidno:25所示的cd8铰链、核苷酸序列如seqidno:26所示的cd8跨膜结构域、核苷酸序列如seqidno:27所示的4-1bb共刺激结构域、核苷酸序列如seqidno:28所示的cd3zeta信号结构域)和scfv序列,cd8signalpeptide、cd8铰链、cd8跨膜结构域、4-1bb共刺激结构域、cd3zeta信号结构域的氨基酸序列如seqidno:29~33所示,scfv的核苷酸序列如seqidno:34所示,扩增后经同源重组克隆到pca70载体的carscfv位置。图2提供了用于生成carmrna的pca70-car载体的示意图,pca70-car载体的核苷酸序列如seqidno:35所示。其次,通过体外转录(ivt)制备b7-h3carmrna。pca70-car质粒通过bspq1酶切线性化,并通过运行琼脂糖dna凝胶检查后,按照制造商的操作指南(thermofisher,catno:am13455)进行ivt。通过nanodrop测定rna产物的浓度,并运行page凝胶进行检查。
[0094]
实施例3肿瘤细胞b7-h3表达水平检测1)通过rt-qpcr测量不同肿瘤细胞b7-h3mrna转录水平:将多种肿瘤细胞的cdna稀释10倍,取1μl稀释后cdna作为模板在348孔板中配制10μl/孔rt-qpcr反应液,使用引物(序列如seqidno:36~37所示)检测b7-h3基因,1对引物(序列如seqidno:38~39所示)检测β-actin基因(作为内参),每对引物三个复孔,运行rt-qpcr程序:95℃,2分钟
→
(95℃,10秒
→
60℃,30秒)40个循环
→
curve。计算所有肿瘤细胞系b7-h3mrna相对于jeko1细胞的表达量。如图3所示,jeko1,molm14,nalm6和raji细胞不表达b7-h3mrna,rpmi8226极低量表达b7-h3mrna,其他细胞系均高水平表达b7-h3mrna。
[0095]
2)通过facs染色测量不同肿瘤细胞表面b7-h3蛋白水平:收集多种肿瘤细胞,与apc-同种型抗体和apc-anti-humanb7-h3抗体共孵育染色,流式细胞仪检测染色结果。如图4所示,jeko1,molm14,nalm6,rpmi8226和raji细胞表面无法检测到b7-h3蛋白,其他细胞系均高水平表达b7-h3蛋白,isotypecontrol为同种型抗体。
[0096]
实施例4b7-h3carts的制备和表征通过以下步骤利用电转技术将b7-h3carmrna引入t细胞:收集t细胞,用opti-mem培养基清洗,并用opti-mem培养基以5
×
107/ml重悬;将5
µ
grna与100
µ
lt细胞等分,混合均匀进行电穿孔,参数如下(btx电转仪):500v,0.7ms;然后将细胞转移到预热的培养基上,在37℃下培养。
[0097]
通过facs染色测量b7-h3cart细胞与2ig-b7-h3-fc重组蛋白的结合以及b7-h3car阳性的细胞比例。表达不同b7-h3scfv的cart细胞分别与0μg/ml,0.25μg/ml,0.5μg/ml和1μg/ml2ig-b7-h3-fc重组蛋白(图5)或只与1μg/ml2ig-b7-h3-fc重组蛋白(图6,8,11)共孵育30分钟后,再和pe-anti-humaniggfcantibody共孵育染色,流式细胞仪检测染色结果。c503是已发表的抗b7-h3scfv,作为阳性对照。ntd是没有转染的对照t细胞。
[0098]
如图5所示,表达不同抗b7-h3scfv的cart细胞与2ig-b7-h3-fc重组蛋白有不同程度的结合,且结合程度与2ig-b7-h3-fc重组蛋白的浓度和亲和力相关。
[0099]
如图6,8,11所示,不同b7-h3carmrna电穿孔的t细胞表达car的细胞比例不同,car-574、-c503t细胞群均有较高比例的car阳性细胞。
[0100]
实施例5表达不同量b7-h3蛋白水平的jeko1细胞系的制备和表征
用不同量(0μg,0.4 μg,2μg和10μg)的b7-h3 mrna电穿孔1
×
10
7 jeko1肿瘤细胞。电穿孔过程与上述过程相同,仅改变了参数,使用的参数为300v,0.5ms。通过apc-同种型抗体和apc-anti-human b7-h3抗体对不同量b7-h3 mrna电穿孔的jeko1细胞进行facs染色,以测量jeko1肿瘤细胞中b7-h3的表达。如图10所示,jeko1细胞不表达内源性b7-h3,并且b7-h3的异位表达水平与电穿孔到jeko1细胞中的b7-h3 mrna的量相关。
[0101]
实施例6 体外细胞毒性实验在体外细胞毒性实验中测量了b7-h3 car t细胞对肿瘤细胞的细胞毒性。将表达egfp的肿瘤细胞或用不同量b7-h3 mrna电穿孔的egfp-jeko1细胞以10000 细胞/100 ul/孔接种在平底96孔板上;将car t细胞稀释至适当浓度,并以1:1的e/t比例和肿瘤细胞共培养,然后将培养板放入incucyte s3机器中,并设置扫描参数。扫描3天后,分析总绿色细胞积分强度 (gcu x
ꢀµm²
/孔) 或总绿色细胞积分强度的增长倍数以计算杀灭效率。
[0102]
图7显示了第一次杀伤实验中基于mrna的抗b7-h3 car t细胞在e/t比值为1:1时对skov3-cbg,a549-cbg,caski-cbg肿瘤细胞的杀伤曲线(c503为阳性对照)。如图所示,表达car-574,
ꢀ‑
c503 的car t细胞不同程度地阻止了三种b7-h3阳性肿瘤细胞生长,甚至消除了肿瘤细胞,这表明这些基于scfv的car t细胞对肿瘤细胞具有较高的细胞毒性。
[0103]
图9显示了第二次杀伤实验中基于mrna的抗b7-h3 car t细胞在e/t比值为1:1时对内源表达和不表达b7-h3的肿瘤细胞的杀伤曲线。如图所示,表达car-574,
ꢀ‑
c503的car t细胞有效地阻止了内源高水平表达b7-h3的肿瘤细胞生长,而且car-574的car t细胞对内源不表达和极低表达b7-h3的肿瘤细胞生长无抑制作用。
[0104]
图13显示了第三次杀伤实验中不同的基于mrna的抗b7-h3 car t细胞在e/t比值为1:1时对内源不表达和表达b7-h3的肿瘤细胞以及外源不同水平表达b7-h3的jeko1细胞的杀伤曲线。如图所示,表达car
‑‑
574的car t细胞有效地阻止了高水平表达b7-h3的肿瘤细胞的生长,而且对不表达b7-h3的肿瘤细胞生长无抑制作用,对极低表达b7-h3的肿瘤细胞有较低的抑制作用或无抑制作用,证实了它杀死高表达b7-h3的肿瘤细胞的同时也防止了对极低表达b7-h3的正常组织的伤害。
[0105]
实施例7 car t细胞cd107a染色cd107a是t细胞的早期活化标记。通过以下步骤使用cd107a染色测量表达不同水平b7-h3的jeko1肿瘤细胞对b7-h3 car t细胞的活化:将20μl pe-cd107a mab添加到96孔板的每个孔中;将肿瘤细胞稀释至1
ꢀ×ꢀ
106/ml,并接种在96孔圆板上 (100 μl/孔);将car t细胞稀释至1
ꢀ×ꢀ
106/ml,接种于96孔圆板 (100 μl/孔)中;将平板以500 rpm
ꢀ×ꢀ
5分钟离心,使细胞附着良好,并在37 ℃下培养1小时;将golgi stop用培养基稀释1500倍后,添加到每个孔(20μl/孔)中;细胞在37℃下再培养2.5小时,用抗cd3-apc和抗cd8-fitc抗体在37℃下染色30分钟,洗净后用流式细胞仪进行分析。
[0106]
在本研究中,通过cd107a染色测量了(0μg,0.4 μg,2μg和10μg )b7-h3 mrna电穿孔的jeko1肿瘤细胞对b7-h3 car t细胞 (car-574)的激活。如图12所示,car t细胞可以被转染了 b7-h3的jeko1细胞特异性活化,但不被未转染b7-h3的jeko1细胞特异性活化。这些结果表明,表达b7-h3的肿瘤细胞可以活化上述b7-h3 car t细胞。
[0107]
以上的实施例是为了说明本发明公开的实施方案,并不能理解为对本发明的限制。此外,本文所列出的各种修改以及发明中方法的变化,在不脱离本发明的范围和精神的
前提下对本领域内的技术人员来说是显而易见的。虽然已结合本发明的多种具体优选实施例对本发明进行了具体的描述,但应当理解,本发明不应仅限于这些具体实施例。事实上,各种如上所述的对本领域内的技术人员来说显而易见的修改来获取发明都应包括在本发明的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1