一种秋水仙碱和厚朴酚复合物及其合成方法以及在抗新冠病毒方面的应用与流程
1.本发明涉及秋水仙碱改性技术领域,尤其涉及一种秋水仙碱和厚朴酚复合物及其合成方法以及在抗新冠病毒方面的应用。
背景技术:
2.秋水仙碱是从百合科植物秋水仙的球茎、种子提取的一种生物碱,亦存在于百合科植物嘉兰和丽江山慈菇中。其结构式如式a所示:
[0003][0004]
秋水仙碱本身具有良好的临床疗效,在治疗急性痛风、白塞病、家族性地中海热、软骨钙质沉着病、系统性硬皮病、淀粉样变性等方面发挥着至关重要的作用;而且在心血管疾病、皮炎、原发性胆汁性肝硬化、sweet’s综合征、牛皮癣、慢性感染、淀粉样变性、复发性多软骨炎、阿尔茨海默症、癫痫、过敏性疾病、坏死性和白细胞破坏性血管炎等多种疾病治疗中都有应用价值(j.med.chem.2020,63,10618)。值得注意的是,在新冠肺炎重症患者的治疗中,秋水仙碱能够有效降低重症患者的死亡率(ann.rheum.dis., 2020,79,1286),表现出了极大地应用潜力。
[0005]
但是临床用药时,秋水仙碱容易带来腹泻、呕吐等剧烈的副作用,而且在抗肿瘤研究方面,秋水仙碱因为对正常细胞的较大的毒性而导致其难以直接应用,因此对秋水仙碱进行合适的结构改造,以减弱甚至消除副作用显得至关重要。
[0006]
厚朴酚(magnolol),分离自中药厚朴,具有明显的、持久的中枢性肌肉松弛,中枢神经抑制作用,抗炎,抗菌,抗病原微生物,抗溃疡,抗氧化,抗肿瘤,抑制吗啡戒断反应,可抑制血小板聚集等药理作用。结构式如式b 所示:
[0007][0008]
目前秋水仙碱和厚朴酚拼接的技术尚未见报道。
技术实现要素:
[0009]
本发明的目的在于提供一种秋水仙碱和厚朴酚复合物及其合成方法以及在抗新冠病毒方面的应用,以弥补现有技术的空白。
[0010]
为了实现上述发明目的,本发明提供以下技术方案:
[0011]
本发明提供了一种秋水仙碱和厚朴酚复合物的化学合成方法,包含如下步骤:
[0012]
(1)将秋水仙碱、氨基酸、碱溶液和乙醇混合后进行反应,生成氨基酸改性秋水仙碱;
[0013]
(2)将氨基酸改性秋水仙碱、厚朴酚、二氯甲烷、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐和4-二甲氨基吡啶混合后进行反应,生成秋水仙碱和厚朴酚复合物。
[0014]
优选的,所述氨基酸的结构式为其中,n≥1。
[0015]
优选的,所述秋水仙碱和氨基酸的摩尔比为5:(8~12);
[0016]
所述秋水仙碱和乙醇的摩尔体积比为5mmol:(8~13)ml;
[0017]
所述碱溶液中碱和水的质量体积比为(0.3~0.6)g:10ml,所述碱溶液为氢氧化钠水溶液或者氢氧化钾水溶液;
[0018]
所述碱溶液和乙醇的体积比为10:(8~13)。
[0019]
优选的,步骤(1)所述反应的温度为60~70℃,时间为3~7小时。
[0020]
优选的,所述秋水仙碱和厚朴酚的摩尔比为5:(8~12);
[0021]
所述秋水仙碱和1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐的摩尔比为5:(8~12);
[0022]
所述秋水仙碱和4-二甲氨基吡啶的摩尔比为5:(0.3~0.8);
[0023]
所述秋水仙碱和二氯甲烷的摩尔体积比为5mmol:(40~60)ml。
[0024]
优选的,步骤(2)所述反应的温度为室温,时间为10~15小时。
[0025]
优选的,所述步骤(1)反应结束后对所得产物体系进行纯化处理,得到纯净的氨基酸改性秋水仙碱用于步骤(2);
[0026]
所述纯化处理包含如下步骤:
[0027]
将所得产物体系进行旋转蒸发,除去乙醇,得到固体物质;
[0028]
将所得固体物质用乙酸乙酯洗涤,保留水相,加酸调节ph至4~5,析出白色固体;
[0029]
将所得白色固体用二氯甲烷洗涤三次,采用无水硫酸钠干燥后浓缩,得到纯净的氨基酸改性秋水仙碱;
[0030]
所述乙酸乙酯和步骤(1)中乙醇的体积比为15:(8~13);
[0031]
每次洗涤所用二氯甲烷和步骤(1)中乙醇的体积比独立的为30:(8~13)。
[0032]
优选的,所述步骤(2)反应结束后对产物体系进行后处理,得到纯净的秋水仙碱和厚朴酚复合物;
[0033]
所述后处理包含如下步骤:
[0034]
加水淬灭反应后洗涤分液,得到水相;
[0035]
所得水相用二氯甲烷萃取三次,合并有机相,无水硫酸钠干燥,浓缩,经硅胶柱层析,得到纯净的秋水仙碱和厚朴酚复合物;
[0036]
每次萃取所用二氯甲烷和步骤(1)中乙醇的体积比独立的为50:(8~13);
[0037]
硅胶柱层析所用洗涤剂为乙酸乙酯和甲醇的混合物,乙酸乙酯和甲醇的体积比为(8~12):1。
[0038]
本发明还提供了所述的方法得到的秋水仙碱和厚朴酚复合物。
[0039]
本发明还提供了所述秋水仙碱和厚朴酚复合物在制备抗新冠病毒药物中的应用。
[0040]
本发明首次采用厚朴酚对秋水仙碱进行改性。本发明提供的秋水仙碱和厚朴酚复合物的化学合成方法操作简单,收率高。得到的秋水仙碱和厚朴酚复合物能够用于制备抗新冠病毒药物。
附图说明
[0041]
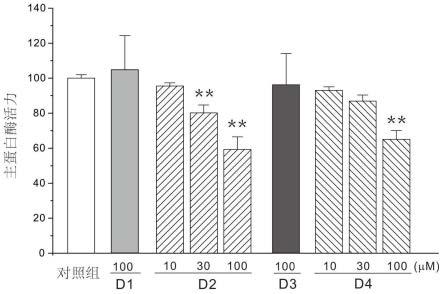
图1为秋水仙碱和厚朴酚复合物显著抑制主蛋白酶活力图;
[0042]
图2为秋水仙碱和厚朴酚复合物显著抑制中性粒细胞弹性蛋白酶蛋白酶活力图。
具体实施方式
[0043]
本发明提供了一种秋水仙碱和厚朴酚复合物的化学合成方法,包含如下步骤:
[0044]
(1)将秋水仙碱、氨基酸、碱溶液和乙醇混合后进行反应,生成氨基酸改性秋水仙碱;
[0045]
(2)将氨基酸改性秋水仙碱、厚朴酚、二氯甲烷、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐和4-二甲氨基吡啶混合后进行反应,生成秋水仙碱和厚朴酚复合物。
[0046]
在本发明中,所述氨基酸的结构式为其中,n≥1,优选为1~20,进一步优选为1~10,更优选为1~4,可具体为1、2、3或4。
[0047]
在本发明中,所述秋水仙碱和氨基酸的摩尔比为5:(8~12),优选为 5:(9~11),进一步优选为5:10;所述秋水仙碱和乙醇的摩尔体积比为5mmol: (8~13)ml,优选为5mmol:(9~12)ml,进一步优选为5mmol:(10~11) ml;所述碱溶液中碱和水的质量体积比为(0.3~0.6)g:10ml,优选为 (0.4~0.5)g:10ml;所述碱溶液和乙醇的体积比为10:(8~13),优选为10: (9~12),进一步优选为10:(10~11)。
[0048]
在本发明中,步骤(1)所述反应的温度为60~70℃,,优选为64~68℃,进一步优选为65~66℃;时间为3~7小时,优选为4~6小时,进一步优选为 5小时。
[0049]
在本发明中,所述秋水仙碱和厚朴酚的摩尔比为5:(8~12),优选为 5:(9~11),进一步优选为5:10;所述秋水仙碱和1-乙基-(3-二甲基氨基丙基) 碳酰二亚胺盐酸盐的摩尔比为5:(8~12),优选为5:(9~11),进一步优选为5:10;所述秋水仙碱和4-二甲氨基吡啶的摩尔比为5:(0.3~0.8),优选为5:(0.4~0.7),进一步优选为5:(0.5~0.6);所述秋水仙碱和二氯甲烷的摩尔体积比为5mmol: (40~60)ml,优选为5mmol:(45~55)ml,进一步优选为5mmol:(50~53) ml。
[0050]
在本发明中,步骤(2)所述反应的温度为室温,时间为10~15小时,优选为11~14小时,进一步优选为12~13小时。
[0051]
在本发明中,所述步骤(1)反应结束后对所得产物体系进行纯化处理,得到纯净的氨基酸改性秋水仙碱用于步骤(2);
[0052]
所述纯化处理包含如下步骤:
[0053]
将所得产物体系进行旋转蒸发,除去乙醇,得到固体物质;
[0054]
将所得固体物质用乙酸乙酯洗涤,保留水相,加酸调节ph至4~5,析出白色固体;调节ph值所用酸为稀盐酸、稀硫酸或硫酸氢钾水溶液;
[0055]
将所得白色固体用二氯甲烷洗涤三次,采用无水硫酸钠干燥后浓缩,得到纯净的氨基酸改性秋水仙碱;
[0056]
所述乙酸乙酯和步骤(1)中乙醇的体积比为15:(8~13),优选为15: (10~11);
[0057]
每次洗涤所用二氯甲烷和步骤(1)中乙醇的体积比独立的为30:(8~13),优选为30:(10~12)。
[0058]
在本发明中,所述步骤(2)反应结束后对产物体系进行后处理,得到纯净的秋水仙碱和厚朴酚复合物;
[0059]
所述后处理包含如下步骤:
[0060]
加水淬灭反应后洗涤分液,得到水相;具体的,结束后加跟体系相当的水,洗涤反应溶液;再分液,保留有机相;
[0061]
所得水相用二氯甲烷萃取三次,合并有机相,无水硫酸钠干燥,浓缩,经硅胶柱层析,得到纯净的秋水仙碱和厚朴酚复合物;
[0062]
每次萃取所用二氯甲烷和步骤(1)中乙醇的体积比独立的为50:(8~13),优选为50:(10~12);
[0063]
硅胶柱层析所用洗涤剂为乙酸乙酯和甲醇的混合物,乙酸乙酯和甲醇的体积比为(8~12):1,优选为(9~10):1。
[0064]
下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
[0065]
本发明各实施例的反应如下:
[0066][0067]
其中,d1为实施例1,d2为实施例2,d3为实施例3,d4为实施例4。
[0068]
秋水仙碱(2.0g,5mmol)和不同链长的氨基酸(10mmol)加入乙醇(10 ml),再加入氢氧化钠(0.4g,用10ml水溶解),在70℃下反应5小时。旋转蒸发除去乙醇溶剂,加乙酸乙酯(15ml)洗涤一次,保留水相,加酸调节ph至4.5,白色固体析出,加二氯甲烷(每次30ml)萃取洗涤三次。无水硫酸钠干燥,浓缩。得到的固体产品c加二氯甲烷(50ml)溶解,加入厚朴酚(2.6g,10mmol),1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐 (edci,1.9g,10mmol)和4-二甲氨基吡啶(dmap,61mg,0.5mmol)。继续在室温下反应12小时,加水淬灭,洗涤分液,水相用二氯甲烷(每次50ml) 萃取三次。合并有机相,无水硫酸钠干燥,浓缩,经硅胶柱层析(乙酸乙酯 /甲醇,体积比10:1)得到棕黄色固体产品d。
[0069]
d1:2.9g,收率84%;rf=0.4(乙酸乙酯/甲醇,体积比10:1);1h nmr (400mhz,dmso-d6)δ9.36(s,1h),8.57(d,j=7.6hz,1h),7.77(t,j=6.3hz, 1h),7.25
–
7.10(m,4h),
7.06(d,j=11.0hz,1h),6.96(dd,j=8.3,2.3hz,1h), 6.90
–
6.81(m,2h),6.76(s,1h),6.12(d,j=11.2hz,1h),5.98(ddt,j=16.9, 10.0,6.8hz,1h),5.85(ddt,j=16.8,9.9,6.8hz,1h),5.13(dq,j=17.1,1.7hz, 1h),5.06(ddd,j=10.0,2.2,1.2hz,1h),4.98(dt,j=17.0,1.8hz,1h),4.93 (ddt,j=10.0,2.4,1.4hz,1h),4.37(dt,j=12.1,7.2hz,1h),4.30(dd,j=18.5, 6.2hz,1h),4.18(dd,j=18.4,6.3hz,1h),3.84(s,3h),3.82(s,3h),3.48(s, 3h),3.41(d,j=6.9hz,2h),3.21(d,j=6.8hz,2h),2.55(dd,j=12.9,6.1hz, 1h),2.16(td,j=12.9,7.0hz,1h),2.08
–
1.99(m,1h),1.85(s,4h);
[0070]
hrms(esi):m/z calcd for c
19h18
no4cl[m-cl]
+
:*,found:*
[0071]
d2:3.2g,收率90%;rf=0.4(乙酸乙酯/甲醇,体积比10:1);1h nmr (400mhz,dmso-d6)δ9.33(s,1h),8.57(d,j=7.7hz,1h),7.64(t,j=6.1 hz,1h),7.26
–
7.16(m,2h),7.16
–
7.07(m,3h),6.94(dd,j=8.2,2.3hz,1h), 6.87
–
6.80(m,2h),6.76(s,1h),6.54(d,j=11.4hz,1h),6.07
–
5.94(m,1h), 5.94
–
5.83(m,1h),5.14(dq,j=17.0,1.5hz,1h),5.06(ddt,j=10.0,2.3,1.2 hz,1h),5.04
–
4.98(m,1h),4.96(ddt,j=10.0,2.2,1.2hz,1h),4.37(dt,j= 12.0,7.1hz,1h),3.83(s,3h),3.79(s,3h),3.49(s,3h),3.49
–
3.43(m,2h), 3.40(d,j=6.9hz,2h),3.23(d,j=6.7hz,2h),2.69(t,j=7.1hz,2h), 2.60
–
2.52(m,1h),2.18(td,j=12.9,7.1hz,1h),1.85(s,4h).
[0072]
d3:3.3g,收率92%;rf=0.4(乙酸乙酯/甲醇,体积比10:1);1h nmr (400mhz,dmso-d6)δ9.26(s,1h),8.56(d,j=7.7hz,1h),7.65(t,j=6.2 hz,1h),7.19
–
7.14(m,2h),7.13
–
7.07(m,3h),6.90(dd,j=8.4,2.2hz,1h), 6.81
–
6.77(m,2h),6.75(s,1h),6.58(d,j=11.4hz,1h),5.98(ddt,j=16.8, 10.0,6.8hz,1h),5.85(ddt,j=16.7,10.0,6.7hz,1h),5.13(dq,j=17.0,1.5 hz,1h),5.06(ddd,j=10.0,2.2,1.2hz,1h),5.01
–
4.91(m,2h),4.37(dt,j= 10.2,7.1hz,1h),3.82(s,3h),3.78(s,3h),3.47(s,3h),3.39(d,j=6.8hz, 2h),3.24
–
3.16(m,4h),2.56(d,j=6.3hz,1h),2.38(t,j=7.2hz,2h),1.85 (s,4h),1.75(p,j=7.1hz,2h).
[0073]
d4:3.1g,收率86%;rf=0.4(乙酸乙酯/甲醇,体积比10:1);1h nmr (400mhz,dmso-d6)δ9.24(s,1h),8.56(d,j=7.7hz,1h),7.57(t,j=6.0 hz,1h),7.19(d,j=11.1hz,1h),7.16(dd,j=8.2,2.2hz,1h),7.13
–
7.09(m, 2h),7.06(d,j=8.2hz,1h),6.93(dd,j=8.3,2.3hz,1h),6.85
–
6.78(m,2h), 6.75(s,1h),6.62(d,j=11.4hz,1h),6.07
–
5.93(m,1h),5.87(ddt,j=16.8, 10.0,6.6hz,1h),5.13(dq,j=17.1,1.7hz,1h),5.06(ddt,j=10.0,2.3,1.2 hz,1h),5.03
–
4.93(m,2h),4.38(dt,j=12.1,7.1hz,1h),3.82(s,3h),3.78(s, 3h),3.48(s,3h),3.39(d,j=7.0hz,2h),3.26(d,j=6.1hz,2h),3.21(d,j= 6.7hz,2h),2.61
–
2.52(m,1h),2.41
–
2.27(m,2h),2.23
–
2.12(m,1h), 2.09
–
1.99(m,1h),1.85(s,4h),1.48(dd,j=6.7,3.6hz,4h).
[0074]
实验例1:秋水仙碱和厚朴酚复合物对新冠病毒主蛋白酶(main protease, mpro)的抑制作用。
[0075]
采用碧云天试剂盒(p0315m)检测,在96孔黑板中,设置空白组、对照组和样品组,检测体系为100μl。空白组中加入96μl缓冲液,对照组中加入1μl主蛋白酶和95μl缓冲液,样品组中加入1μl主蛋白酶、90μl 缓冲液和5μld1溶液(100μm),或d2溶液(10μm、30μm、100μm),或d3溶液(100μm),或d4溶液(10μm、30μm、100μm),37℃孵育 10分钟。而后每孔中加入4μ
l底物,混匀后立即于ex/em=325/393nm处检测各孔的荧光值,每隔20秒检测一次,检测30分钟。计算每个组的平均荧光值,分别记录为rfu空白、rfu对照、rfu样品,计算相对酶活力,公式如下,酶活力=(rfu样品-rfu空白)/(rfu对照-rfu空白)
×
100%
[0076]
结果:如图1所示,4种复合物均可显著抑制主蛋白酶活力。
[0077]
实验例2:秋水仙碱和厚朴酚复合物对人源的中性粒细胞弹性蛋白酶 (neutrophil elastase,ne)的抑制作用
[0078]
采用abcam试剂盒(ab118971)检测,在96孔黑板中,设置空白组、对照组和样品组,检测体系为100μl。空白组中加入75μl缓冲液,对照组中加入50μlne蛋白酶和25μl缓冲液,样品组中加入50μlne蛋白酶和25μl复合物溶液(10μm、30μm),37℃孵育5分钟。而后每孔中加入25μl底物,混匀后立即于ex/em=400/505nm处检测各孔的荧光值,每隔20秒检测一次,观测0-40分钟内的动力学过程。在动力学过程的线性范围内,选取两个不同时间点(t1和t2),获得时间点对应的荧光值(rfut1 和rfut2),计算其斜率,斜率可看作是各孔的酶活力。斜率= (rfut2-rfut1)/(t2-t1)。最后以阴性对照孔的酶活力为100%,计算各组相对于阴性对照孔的相对酶活力。
[0079]
结果:如图2所示,4种复合物d1、d2、d3、d4均可显著抑制中性粒细胞弹性蛋白酶活力。
[0080]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1