香樟的愈伤组织培养方法与流程
本发明属于成体植株离体培养技术领域,具体涉及一种香樟的愈伤组织培养方法。
背景技术:
香樟是我国的珍贵树种,优点众多,其木材坚硬,纹理雅致,可用于制作家具。整棵植株都具有独特的香氛,有驱虫等功效,是提取纯天然香料重要的材料。香樟枝叶茂密,树形优美,是一种优良的城市绿化和园林景观用树种。
但香樟生长不耐寒冷,在北方推广困难,且采用种子繁殖的方式发芽缓慢,繁殖周期较长,苗木参差不齐,采用扦插、嫁接等无性繁殖方式也比较困难,而香樟母株材料来源也有限。
技术实现要素:
针对现有技术的不足,本发明的目的在于提供一种香樟的愈伤组织培养方法,该愈伤组织培养方法利用植物组织培养诱导获得香樟的愈伤组织,便于对其进行繁殖或进行其他相关研究,进而发掘其更多的利用价值,得到更高的经济效益。
为此,本发明的技术方案如下:
一种香樟的愈伤组织培养方法,按照下述步骤进行:
步骤1,将香樟叶柄和茎部冲洗干净,得到基础材料,将所述基础材料用体积浓度为80~85%的乙醇水溶液浸泡10~15秒后取出,用15~20wt%的次氯酸钠水溶液浸泡10~15分钟并同时搅拌,得到脱毒材料;
步骤2,用无菌水冲洗步骤1所得脱毒材料3~5次,吸干脱毒材料表面的无菌水,将该脱毒材料剪切成块状后放到灭菌后的诱导培养基中,于20~25℃培养7~14天(每天24小时),得到愈伤组织;
其中,所述诱导培养基的配制方法如下:
将ms培养基与6-苄氨基腺嘌呤(6-ba)和萘乙酸(naa)均匀混合,调整ph至6.9~7.1,再加入琼脂,其中,所述ms培养基的体积份数、6-苄氨基腺嘌呤的质量份数、萘乙酸的质量份数和琼脂的质量份数的比为1000:(1~1.5):0.2:(6300~6500);
在上述技术方案中,当所述体积份数的单位为ml时,所述质量份数的单位为mg。
在所述步骤2中,光照周期16小时/天。
在所述步骤2中,所述ms培养基的配制方法如下:
将大量母液、微量母液、铁盐母液、有机母液和蔗糖均匀混合,再用去离子水定容,以使1000体积份数的所述ms培养基中,所述大量母液的体积份数为100,所述微量母液的体积份数为10,所述铁盐母液的体积份数为10,所述有机母液的体积份数为5,所述蔗糖的质量份数为14500~15500;
所述大量母液的组成如下:
所述微量母液的组成如下:
所述铁盐母液的组成如下:
na2-edta1.853~1.859g/l
feso4·7h2o1.387~1.393g/l
去离子水溶剂,
所述有机母液的组成如下:
在上述技术方案中,所述大量母液的配方如下:
所述微量母液的配方如下:
所述铁盐母液的配方如下:
na2-edta1.856g/l
feso4·7h2o1.390g/l
去离子水溶剂,所述有机母液的配方如下:
在上述技术方案中,所述6-苄氨基腺嘌呤通过6-苄氨基腺嘌呤溶液引入,所述萘乙酸通过萘乙酸溶液引入,所述诱导培养基的配制方法如下:
将ms培养基与6-苄氨基腺嘌呤溶液和萘乙酸溶液均匀混合,调整ph至6.9~7.1,再加入琼脂,其中,
所述6-苄氨基腺嘌呤溶液的制备方法:将所述6-苄氨基腺嘌呤加入naoh水溶液以使其均匀分散,再加入去离子水配制成1.2~1.5g/l的所述6-苄氨基腺嘌呤溶液,所述6-苄氨基腺嘌呤溶液中naoh的浓度为0.02~0.1mol/l,所述naoh水溶液中naoh的浓度为0.1~0.5mol/l。
所述萘乙酸溶液的制备方法:将所述萘乙酸加入乙醇以使其均匀分散,再加入去离子水配制成0.2g/l的所述萘乙酸溶液,所述萘乙酸溶液中乙醇的体积浓度为18~20%。
在上述技术方案中,所述诱导培养基还包括:活性炭粉末,所述诱导培养基的配制方法如下:将ms培养基与6-苄氨基腺嘌呤溶液、萘乙酸溶液和活性炭粉均匀混合,再加入琼脂,所述ms培养基的体积份数:活性炭的质量份数为1000:(150~250)。
在所述步骤1中,诱导培养基灭菌的方法为:将所述诱导培养基置于高温灭菌锅中灭菌20~25分钟,灭菌压力为100~120kpa,灭菌温度为120~125℃。
本发明的有益技术效果为:
1、本发明首创利用植物生长调节剂诱导香樟叶柄与茎段产生愈伤组织,便于为研究香樟香气来源等其它机构机理提供原料;
2、比起传统的种子繁殖和扦插、嫁接繁殖,利用本方法培养香樟的愈伤组织具有操作简便易行,条件易于控制,周期短的优点。
附图说明
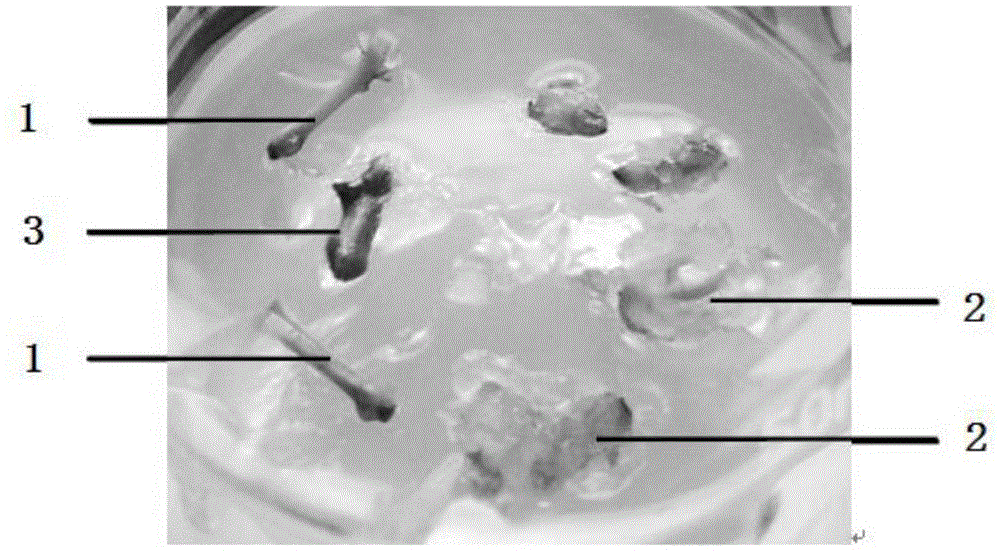
图1为本发明方法的实施例1得到的叶柄及茎段的愈伤组织照片;
图2为本发明方法的实施例1得到的叶柄及茎段的愈伤组织照片;
图3为本发明方法的实施例2得到的叶柄及茎段的愈伤组织照片;
图4为本发明方法的实施例3得到的叶柄及茎段的愈伤组织照片。
其中,1:香樟叶柄部位,2:愈伤组织块,3:香樟茎段部位,4:菌落,5:褐化的愈伤组织。
具体实施方式
在本发明的具体实施方式中,香樟采集自浙江农林大学校园,使用的化合物药品均购买自天津市西青区塔科拉实验用品经营部,纯度均为99.5%。
下述实施例中体积份数的单位为ml,质量份数的单位为mg。
下述实施例1~2中所使用诱导培养基的配制方法如下:
将1lms培养基与1ml6-苄氨基腺嘌呤溶液(6-ba溶液)、1ml萘乙酸溶液(naa溶液)和0.2g活性炭粉均匀混合,用盐酸和/或氢氧化钠调整ph至7.0,然后加入6.4g琼脂,
6-ba溶液的配制方法:先将60mg的6-ba加入到10ml0.1mol/l的naoh水溶液中预溶解,然后加入去离子水稀释,配制成1.2g/l的6-ba溶液,6-苄氨基腺嘌呤溶液中naoh的浓度为0.02mol/l。
naa溶液的配制方法:先将naa加入到乙醇中预溶解,然后加入去离子水稀释,配制成萘乙酸浓度为0.2g/l的naa溶液,萘乙酸溶液中乙醇的体积浓度为19.8%。
ms培养基的配制方法如下:将大量母液、微量母液、铁盐母液、有机母液和蔗糖均匀混合,再用去离子水定容,以使1000ml的ms培养基中,大量母液为100ml,微量母液为10ml,铁盐母液为10ml,有机母液为5ml,蔗糖的质量份数为15g;
大量母液如下:
微量母液如下:
铁盐母液如下:
na2-edta1.856g/l
feso4·7h2o1.390g/l
去离子水溶剂,
有机母液如下:
灭菌后的诱导培养基:先取500ml诱导培养基装入15个50ml锥形瓶,每个锥形瓶装30~35ml的诱导培养基,然后放置在高温灭菌锅中灭菌,灭菌压力为0.12mpa,温度为121℃,灭菌时间为20分钟。
实施例1
一种香樟的愈伤组织培养方法,按照下述步骤进行:
步骤1,选取健壮的香樟叶柄和茎部,将香樟叶柄和茎部用洗洁精和自来水冲洗干净,得到基础材料,将基础材料泡在去离子水中备用。
脱毒:将基础材料用体积浓度为80%的乙醇水溶液浸泡10秒后取出,用15wt%的次氯酸钠水溶液浸泡10分钟并同时搅拌使脱毒更充分,得到脱毒材料;
步骤2,将步骤1的脱毒材料用无菌水冲洗3次,用灭菌的滤纸吸干脱毒材料表面的无菌水,将该脱毒材料剪切成0.8~0.9cm块状后放到灭菌后的诱导培养基中(每个锥形瓶中放5~7块),于24℃培养11天,光照周期16小时/天,得到愈伤组织,其中,培养期间观察愈伤组织生长情况并及时清理染菌的材料。
通过图1~2可以看出,本方法利用6-苄氨基腺嘌呤和萘乙酸可有效诱导香樟叶柄与茎部产生愈伤组织。切取的香樟叶柄部位1可观察到叶柄端部已开始出现膨大迹象,愈伤组织正在生成,部分已经长出透明愈伤组织块2,还有的叶柄已经膨大并外翻;切取的香樟茎段部位3稍有膨大,说明正在产生愈伤组织,但长出愈伤组织的速度较叶柄部位稍慢。
综上所述,香樟的叶柄与茎部均先发生不同程度的膨大,然后外翻,产生了愈伤组织并逐渐长大。因茎段角质层较厚且材料体积较大,6-苄氨基腺嘌呤和萘乙酸的诱导作用及效果不如叶柄明显。叶柄较茎段更为幼嫩,所以其诱导效果优于茎段。
实施例2(对比)
一种香樟的愈伤组织培养方法,按照下述步骤进行:
步骤1,选取健壮的香樟叶柄和茎部,将香樟叶柄和茎部用洗洁精和自来水冲洗干净,得到基础材料,将基础材料泡在去离子水中备用。
脱毒:将基础材料用15wt%的次氯酸钠水溶液浸泡10分钟并同时搅拌使脱毒更充分,得到脱毒材料;
步骤2,将步骤1的脱毒材料用无菌水冲洗3次,用灭菌的滤纸吸干脱毒材料表面的无菌水,将该脱毒材料剪切成0.8~0.9cm块状后放到灭菌后的诱导培养基中(每个锥形瓶中放5~7块),于24℃培养11天,光照周期16小时/天,得到愈伤组织,其中,培养期间观察愈伤组织生长情况并及时清理染菌的材料。
作为对比,本实施例在脱毒过程中仅用15wt%的次氯酸钠溶液浸泡10分钟。此方法培养过程中基础材料多出现长菌情况,污染较严重,如图3所示,可观察到外植体上覆盖绒毛状杂菌,说明此方法脱毒效果较差,组织染菌几率较高。由此可知,在脱毒过程中,用体积浓度为80%的乙醇水溶液浸泡为必要步骤,乙醇与次氯酸钠溶液相配合的脱毒效果最佳。
实施例3
一种香樟的愈伤组织培养方法,按照下述步骤进行:
步骤1,选取健壮的香樟叶柄和茎部,将香樟叶柄和茎部用洗洁精和自来水冲洗干净,得到基础材料,将基础材料泡在去离子水中备用。
脱毒:将基础材料用体积浓度为80%的乙醇水溶液浸泡10秒后取出,用15wt%的次氯酸钠水溶液浸泡10分钟并同时搅拌使脱毒更充分,得到脱毒材料;
步骤2,将步骤1的脱毒材料用无菌水冲洗3次,用灭菌的滤纸吸干脱毒材料表面的无菌水,将该脱毒材料剪切成0.8~0.9cm块状后放到灭菌后的诱导培养基中(每个锥形瓶中放5~7块),于24℃培养11天,光照周期16小时/天,得到愈伤组织,其中,培养期间观察愈伤组织生长情况并及时清理染菌的材料。
实施例3中所使用诱导培养基的配制方法如下:
其中,所述诱导培养基的配制方法如下:
将1lms培养基与1ml6-苄氨基腺嘌呤溶液(6-ba溶液)和1ml萘乙酸溶液(naa溶液)均匀混合,用盐酸和/或氢氧化钠调整ph至7.0,然后加入6.4g琼脂,
6-ba的溶液的配制方法:先将60mg6-ba加入到10ml0.1mol/l的naoh水溶液中预溶解,然后加入去离子水稀释,配制成1.2g/l的6-ba溶液,6-苄氨基腺嘌呤溶液中naoh的浓度为0.02mol/l。
naa的溶液的配制方法:先将naa加入到乙醇中预溶解,然后加入去离子水稀释,配制成0.2g/l的溶液,萘乙酸溶液中乙醇的体积浓度为19.8%。
ms培养基的配制方法如下:将大量母液、微量母液、铁盐母液、有机母液和蔗糖均匀混合,再用去离子水定容,以使1000ml的ms培养基中,大量母液为100ml,微量母液为10ml,铁盐母液为10ml,有机母液为5ml,蔗糖的质量份数为15g;
大量母液如下:
微量母液如下:
铁盐母液如下:
na2-edta1.856g/l
feso4·7h2o1.390g/l
去离子水溶剂,
有机母液如下:
灭菌后的诱导培养基:先取500ml诱导培养基装入15个50ml锥形瓶,每个锥形瓶30至35ml,然后放置在高温灭菌锅中灭菌,灭菌压力为0.12mpa,温度为121℃,灭菌时间为20分钟。
本实施例作为对比,与实施例1的不同之处在于:诱导培养基中未加入活性炭粉末。如图4所示,未加入活性炭的培养基中愈伤组织整体颜色较深,说明愈伤组织褐化严重,由此可知,在诱导培养基中加入活性炭具有减缓愈伤组织后续生长的褐化程度的效果。
以上对本发明做了示例性的描述,应该说明的是,在不脱离本发明的核心的情况下,任何简单的变形、修改或者其他本领域技术人员能够不花费创造性劳动的等同替换均落入本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!