伴刀豆球蛋白A诱导的小鼠干眼症模型的构建方法及应用与流程
伴刀豆球蛋白a诱导的小鼠干眼症模型的构建方法及应用
技术领域
1.本发明属于动物实验模型构建技术领域,涉及伴刀豆球蛋白a诱导的小鼠干眼症模型的构建方法及应用。
背景技术:
2.干眼症,即角膜干燥症,是一种由于某种原因引起泪液量或质异常及动力学异常,从而使泪膜不稳定,并伴有眼表炎症,导致眼部不适甚至视力受损的疾病。目前使用的干眼症动物模型可以分为五类,包括泪液不足型干眼症、蒸发过强型干眼症、黏蛋白缺乏型干眼症、泪液动力学异常型干眼症以及混合型干眼症。包括使用原发性的动物模型和药物诱导模型以及手术模型。
3.原发性的动物模型虽然往往最贴合临床特征,但是这一类往往模型制备复杂,或者成模率低;手术模型一般采取泪腺摘除的方法,但是动物泪腺代偿的存在使的成模率往往不高,且模型稳定性不够;药物诱导模型一般作为实验室优先考虑的造模方法,包括使用东莨菪碱对泪腺造成损伤、使用雄激素受体拮抗剂等或者以扰乱睑板腺对动物泪膜的脂质层造成损伤、或利用维生素a缺乏对动物杯状细胞和黏蛋白表达造成影响,或利用光刺激使动物泪液动力学异常。
4.目前虽然使用的动物模型十分广泛,但尚未有一种理想的模型作为研究工具。
技术实现要素:
5.针对上述问题,本发明的目的在于提供伴刀豆球蛋白a诱导的小鼠干眼症模型的构建方法及应用。
6.为了实现上述技术目的,本发明采用的技术方案为:
7.本发明提供了伴刀豆球蛋白a诱导的小鼠干眼症模型的构建方法,包括:配制10mg/ml至15mg/ml的刀豆球蛋白a pbs溶液,分装为20
±
2μl/滴,使用时用胰岛素注射针吸取一滴,注射到小鼠一侧泪腺即可。
8.优选地,所述小鼠为成年balb/c小鼠。
9.优选地,上述方法还包括造模后第三天进行模型验证。
10.优选地,所述模型验证的方法包括:在全身麻醉和无局部麻醉状态下利用酚红棉线对小鼠泪液分泌量进行检测,酚红棉线染色长度达5mm认为小鼠泪液分泌正常,染色长度为2mm则认为小鼠泪液分泌不足,造模成功。
11.优选地,所述模型验证的方法包括:采用3%lissamine green b染色剂对小鼠进行滴眼,持续1min,纱布吸去多余染液,此后在显微镜下观察小鼠角膜染色情况,正常小鼠眼球不着色,成模小鼠角膜染为蓝色。
12.优选地,所述模型验证的方法包括:使用rt
‑
pcr对小鼠泪腺rna进行检测,泪腺萎缩后rna含量将降低,体现在rt
‑
pcr目的扩增片段ct值增加。
13.本发明还提供了上述构建方法的应用,所述应用包括在用于治疗干眼症的药物研
发中的应用。
14.优选地,所述应用包括:构建干眼症动物模型后,根据分组对动物执行治疗方案,待治疗方案周期结束后,通过包括病理、生化检测在内的相关检测来确认治疗药物是否有效。
15.更优选地,所述分组包括模型组、正常对照组、阳性药物组和阴性药物组。
16.本方法在分类上为药物诱导致泪液分泌不足类型,但相对于传统方法,有如下优点:
17.一)使用小鼠品系为普通balb/c小鼠,价格较低,且成模率为70%以上。
18.二)本方法为单次注射方法,相对传统的多次长时间诱导,具有药物使用率低,造模周期短的优点。
19.三)此方法诱导的干眼症模型,模型出现泪腺萎缩,泪腺炎症的病理特征,符合该症的部分临床特征。
20.四)干眼症小鼠模型可以应用于治疗干眼症药物的研发,如药物研发公司制备了某种药物,则可以通过设计不同分组,最后检测出该药物是否有效。
附图说明
21.图1为本发明实施例中透皮注射造模药物的照片。
22.图2为本发明实施例中利用酚红棉线检测小鼠泪液分泌量的照片。
23.图3为本发明实施例中角膜染色的结果照片。
24.图4为本发明实施例中荧光定量pcr曲线图。
具体实施方式
25.为了更清楚地说明本发明,下面结合实施例并对照附图对本发明作进一步详细说明。本领域技术人员应当理解,下面所具体描述的内容是说明性的而非限制性的,不应以此限制本发明的保护范围。
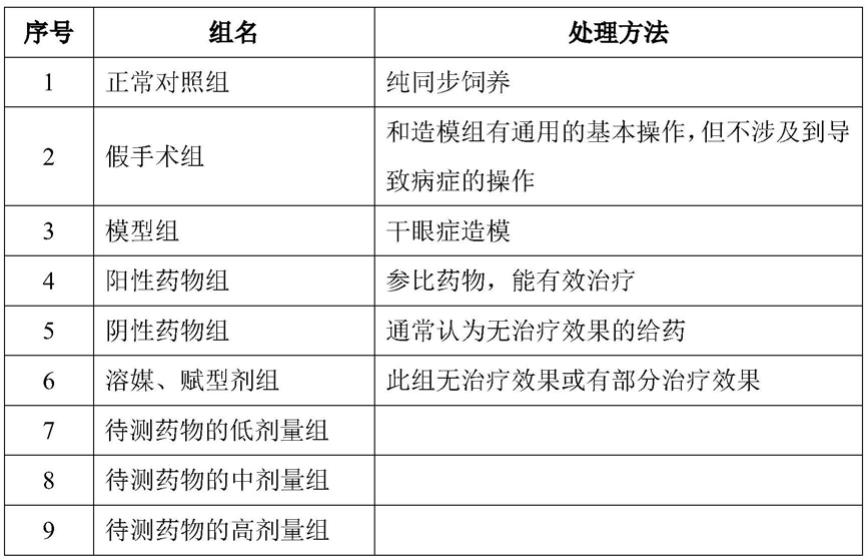
26.实施例
27.一、实验准备
28.动物:成年balb/c小鼠体重为20
‑
25g,雌雄不限。
29.试剂与耗材:刀豆球蛋白a(源叶生物),pbs缓冲溶液,一次性胰岛素注射针,100μl移液器(含吸头),酚红棉线,3%lissamine green b染色剂。
30.二、实验方法
31.配制10mg/ml的刀豆球蛋白a pbs溶液,分装为20μl/滴,使用时用胰岛素注射针吸取一滴,注射到小鼠一侧泪腺即可,如图1所示。
32.该方法的实验原理在于,刀豆球蛋白a可以导致泪腺炎症的发生,引起mmp
‑
9及细胞因子il
‑
8水平的升高,同时造成泪腺萎缩和泪液减少。
33.三、模型验证
34.造模后第三天使用多种不同的方法对造模效果进行综合评价:
35.1.在全身麻醉和无局部麻醉状态下利用酚红棉线对小鼠泪液分泌量进行检测:酚红棉线染色长度达5mm认为小鼠泪液分泌正常,染色长度为2mm则认为小鼠泪液分泌不足,
造模成功。如图2中的箭头所示。
36.2. 3%lissamine green b染色剂对小鼠进行滴眼,持续1min,纱布吸去多余染液,此后再显微镜下观察小鼠角膜染色情况,正常小鼠眼球不着色(pbs),成模小鼠(cona)角膜染为蓝色,如图3中的箭头所示。
37.3.使用rt
‑
pcr对小鼠泪腺rna进行检测,泪腺萎缩后rna含量将降低,体现在rt
‑
pcr目的扩增片段ct值增加。
38.四、应用
39.本发明构建的干眼症小鼠模型可以应用于治疗干眼症药物的研发,如药物研发公司制备了某种药物,则可以通过设计不同分组,最后检测出该药物是否有效。分组设计如表1所示:
40.表1.药物研发实验中的分组设计
[0041][0042]
假手术组、阴性对照组和溶媒组可以根据客户的具体要求和模型的特性,有些组可以删减。
[0043]
按本发明构建干眼症动物模型后,即可根据分组对动物执行治疗方案,待治疗方案周期结束后,通过病理、生化和其他相关检测来确认治疗药物是否有效。
[0044]
显然,本发明的上述实施例仅仅是为更清楚地说明本发明所作的举例,而并非是对本发明的实施方式的限定,对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其他不同形式的变化或变动,这里无法对所有的实施方法予以穷举,凡是属于本发明的技术方案所引申出的显而易见的变化或变动仍处于本发明的保护范围之列。
技术特征:
1.伴刀豆球蛋白a诱导的小鼠干眼症模型的构建方法,包括:配制10
‑
15mg/ml的刀豆球蛋白a pbs溶液,分装为20
±
2μl/滴,使用时用胰岛素注射针吸取一滴,注射到小鼠一侧泪腺即可。2.根据权利要求1所述的伴刀豆球蛋白a诱导的小鼠干眼症模型的构建方法,其特征在于,所述小鼠为成年balb/c小鼠,体重为20
‑
25g。3.根据权利要求1所述的伴刀豆球蛋白a诱导的小鼠干眼症模型的构建方法,其特征在于,还包括造模后第三天进行模型验证。4.根据权利要求3所述的伴刀豆球蛋白a诱导的小鼠干眼症模型的构建方法,其特征在于,所述模型验证的方法包括:在全身麻醉和无局部麻醉状态下利用酚红棉线对小鼠泪液分泌量进行检测,酚红棉线染色长度达5mm认为小鼠泪液分泌正常,染色长度为2mm则认为小鼠泪液分泌不足,造模成功。5.根据权利要求3所述的伴刀豆球蛋白a诱导的小鼠干眼症模型的构建方法,其特征在于,所述模型验证的方法包括:采用3%lissamine green b染色剂对小鼠进行滴眼,持续1min,纱布吸去多余染液,此后在显微镜下观察小鼠角膜染色情况,正常小鼠眼球不着色,成模小鼠角膜染为蓝色。6.根据权利要求3所述的伴刀豆球蛋白a诱导的小鼠干眼症模型的构建方法,其特征在于,所述模型验证的方法包括:使用rt
‑
pcr对小鼠泪腺rna进行检测,泪腺萎缩后rna含量将降低,体现在rt
‑
pcr目的扩增片段ct值增加。7.权利要求1
‑
6任意一项所述的伴刀豆球蛋白a诱导的小鼠干眼症模型的构建方法的应用,包括在用于治疗干眼症的药物研发中的应用。8.根据权利要求7所述的伴刀豆球蛋白a诱导的小鼠干眼症模型的构建方法的应用,其特征在于,所述应用包括:构建干眼症动物模型后,根据分组对动物执行治疗方案,待治疗方案周期结束后,通过包括病理、生化检测在内的相关检测来确认治疗药物是否有效。9.根据权利要求8所述的伴刀豆球蛋白a诱导的小鼠干眼症模型的构建方法的应用,其特征在于,所述分组包括模型组、正常对照组、阳性药物组和阴性药物组。
技术总结
本发明提供了伴刀豆球蛋白A诱导的小鼠干眼症模型的构建方法及应用。伴刀豆球蛋白A诱导的小鼠干眼症模型的构建方法包括:配制10mg/ml的刀豆球蛋白A PBS溶液,分装为20μl/滴,使用时用胰岛素注射针吸取一滴,注射到小鼠一侧泪腺即可。使用小鼠品系为普通BALB/c小鼠,价格较低,且成模率为70%以上。本方法为单次注射方法,药物使用率低,造模周期短;此方法诱导的干眼症模型,符合该症的部分临床特征;干眼症小鼠模型可以应用于治疗干眼症药物的研发。研发。研发。
技术研发人员:江斌 袁永明
受保护的技术使用者:江西中洪博元生物技术有限公司
技术研发日:2021.07.06
技术公布日:2021/10/23
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1