一种降糖复合植物酵素、制备方法及应用
15g/100g、马齿苋5-15g/100g、枸杞5-10g/100g、柚子5-15g/100g、南瓜5-15g/100g、生姜5-10g/100g、芹菜5-15g/100g、山药5-15g/100g。
8.本技术中的降糖复合植物酵素对α-葡萄糖苷酶、α-淀粉酶均有抑制作用,同时还能够降低大鼠空腹血糖值,抑制大鼠对蔗糖、淀粉的吸收作用。
9.本技术还提供降糖复合植物酵素的制备方法,该方法包括:
10.s01:将红参、玉竹、马齿苋、枸杞、柚子、南瓜、生姜、芹菜、山药粉碎,得到固体粉碎物。
11.将配制好的红参、玉竹、马齿苋、枸杞、柚子、南瓜、生姜、芹菜、山药进行粉碎处理,得到固体粉碎物。
12.s02:向蒸馏水中添加所述固体粉碎物,在12000r条件下均质5min,得到均质混合液。
13.向蒸馏水中添加固体粉碎物,在12000r条件下均质5min,得到均质混合液。其中,固体粉碎物与蒸馏水的质量比为3:10。
14.s03:所述均质混合液灭菌后冷却至室温。
15.将均质混合液在115℃条件下灭菌处理30min。灭菌处理后的均质混合液冷却至室温。
16.s04:向冷却至室温的所述均质混合液中添加复合乳酸菌粉,在28-40℃条件下发酵0-84h,得到发酵酵素。
17.向冷却至室温的均质混合液中添加复合乳酸菌粉,在28-40℃条件下发酵0-84h,得到发酵酵素。其中,复合乳酸菌粉包括乳双歧杆菌、嗜酸乳杆菌、干酪乳杆菌、鼠李糖乳杆菌、植物乳杆菌。复合乳酸菌的添加量为均质混合液质量的0-0.4%。
18.s05:所述发酵酵素在无菌条件下离心过滤,得到降糖复合植物酵素。
19.将发酵酵素在无菌条件下离心过滤,得到降糖复合植物酵素。其中,离心转速为4500r、离心时间为3min。
20.本技术还对制备方法中的制备要素进行试验,以确定最佳制备工艺,进而达到最佳降糖效果。下述具体描述。
21.1、发酵时间对降糖复合植物酵素的影响
22.本技术中以α-淀粉酶的抑制率作为优化条件,以确定发酵时间对降糖复合植物酵素的影响。具体的,按照上述制备方法以不同的发酵时间制备降糖复合植物酵素,其中,发酵时间分别为0h、12h、24h、36h、48h、60h、72h、84h。同时,除发酵时间外,其余制备工艺条件相同。
23.采用本领域内常用的α-淀粉酶的抑制率测定方法测定发酵时间对α-淀粉酶的抑制作用。具体的,取28μl酵素上清与100μlα-淀粉酶溶液加入到1ml、ph6.8的pbs(英文全称:phosphate buffered saline;中文全称:磷酸盐缓冲液)溶液中,在37℃水浴中加热20min。加热结束后,加入5ml、浓度1%的可溶性淀粉溶液,继续水浴加热5min。加热结束后,取1ml样液沸水浴中加热5min。加热结束后,加入1ml蒸馏水、1.5ml dns(英文全称:3,5-dinitrosalicylic acid,中文全称:3,5-二硝基水杨酸)继续沸水浴加热5min。冷却后加6.5ml蒸馏水,同时在540nm处测量吸光度,以确定α-淀粉酶的抑制率,用pbs代替酵素作为空白组测定a
空白
,用pbs代替α-淀粉酶作为样品对照测定a
样品对照
,用pbs代替酵素和α-淀粉酶
作为空白对照测定a
空白对照
。。其中,α-淀粉酶的抑制率以吸光度计算得到,该计算公式为
[0024][0025]
根据发酵时间、ph、α-淀粉酶的抑制率绘制曲线图,得到图1。由图1可见,当发酵时间大于48h时,α-淀粉酶的抑制率、ph基本稳定,由此,降糖复合植物酵素的最佳发酵时间为48h。
[0026]
2、发酵温度对降糖复合植物酵素的影响
[0027]
本技术中以α-淀粉酶的抑制率作为优化条件,以确定发酵温度对降糖复合植物酵素的影响。具体的,按照上述制备方法以不同的发酵温度制备降糖复合植物酵素,其中,发酵温度分别为28℃、31℃、34℃、37℃、40℃。同时,除发酵温度外,其余制备工艺条件相同。
[0028]
采用本领域内常用的α-淀粉酶的抑制率测定方法测定发酵温度对α-淀粉酶的抑制作用。测定方法同上。根据发酵温度、ph、α-淀粉酶的抑制率绘制曲线图,得到图2。由图2可见,当发酵温度在37℃时,α-淀粉酶的抑制率最高,由此,降糖复合植物酵素的最佳发酵时间为37℃。
[0029]
3、复合乳酸菌粉添加量对降糖复合植物酵素的影响
[0030]
本技术中以α-淀粉酶的抑制率作为优化条件,以确定复合乳酸菌粉添加量对降糖复合植物酵素的影响。具体的,按照上述制备方法以不同的复合乳酸菌粉添加量制备降糖复合植物酵素,其中,复合乳酸菌粉添加量分别为0%、0.025%、0.05%、0.1%、0.2%、0.3%、0.4%。同时,除复合乳酸菌粉添加量外,其余制备工艺条件相同。
[0031]
采用本领域内常用的α-淀粉酶的抑制率测定方法测定复合乳酸菌粉添加量对α-淀粉酶的抑制作用。测定方法同上。根据复合乳酸菌粉添加量、ph、α-淀粉酶的抑制率绘制曲线图,得到图3。由图3可见,当复合乳酸菌粉添加量在0.1%时,α-淀粉酶的抑制率最高,且当复合乳酸菌粉添加量大于0.1%时,α-淀粉酶的抑制率基本不变。由此,降糖复合植物酵素的最佳复合乳酸菌粉添加量为0.1%。
[0032]
根据上述实验验证,降糖复合植物酵素制备的最佳工艺条件为:发酵时间为48h、发酵温度为37℃、复合乳酸菌粉添加量为0.1%。
[0033]
本发明的实施例提供的技术方案可以包括以下有益效果:
[0034]
本发明提供一种降糖复合植物酵素、制备方法及应用。该降糖复合植物酵素采用“药食同源”中药材与蔬菜、水果等植物复合发酵制备而成,其具备降低血糖的功效,同时具有食用性,而非药类,安全可靠,成本低廉。降糖复合植物酵素制备过程中,通过优化其发酵时间、发酵温度、复合乳酸菌的添加量达到最佳降血糖的效果,发酵时间短,且能够有效抑制α-淀粉酶和α-葡萄糖苷酶活性,发酵工艺成熟,简便,适合工业规模化生产。本技术提供的降糖复合植物酵素能够使得大鼠血糖下降率为55.70%,高于市面上的大部分酵素产品,具有较强的降血糖效果。由此,该降糖复合植物酵素能够解决目前市场上降血糖功能性食品短缺的问题,同时减少用药对身体造成的不适症状,延缓并发症的发生。
[0035]
应当理解的是,以上的一般描述和后文的细节描述仅是示例性和解释性的,并不能限制本发明。
附图说明
[0036]
为了更清楚地说明本技术的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,对于本领域普通技术人员而言,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
[0037]
图1为本发明实施例提供的发酵时间对α-淀粉酶抑制率、ph的影响曲线图;
[0038]
图2为本发明实施例提供的发酵温度对α-淀粉酶抑制率、ph的影响曲线图;
[0039]
图3为本发明实施例提供的复合乳酸菌粉添加量对α-淀粉酶抑制率、ph的影响曲线图;
[0040]
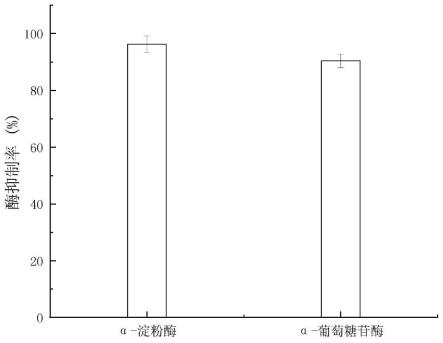
图4为本发明实施例提供的α-淀粉酶抑制率、α-葡萄糖苷酶抑制率的对比图;
[0041]
图5为本发明实施例提供的酵素对大鼠口服葡萄糖耐受量的结果图;
[0042]
图6为本发明实施例提供的酵素对大鼠口服淀粉耐受量的结果图;
具体实施方式
[0043]
本技术提供一种降糖复合植物酵素及制备方法,下述以具体实施例的方式对本技术进行具体描述。
[0044]
实施例1
[0045]
本技术实施例提供一种降糖复合植物酵素,该降糖复合植物酵素的制备原料包括:红参5g/100g、玉竹5g/100g、马齿苋10g/100g、枸杞10g/100g、柚子15g/100g、南瓜15g/100g、生姜10g/100g、芹菜15g/100g、山药15g/100g。
[0046]
本技术实施例还提供降糖复合植物酵素的制备方法,该方法包括:
[0047]
s101:将配制好的红参、玉竹、马齿苋、枸杞、柚子、南瓜、生姜、芹菜、山药进行粉碎处理,得到固体粉碎物。
[0048]
s102:向蒸馏水中添加固体粉碎物,在12000r条件下均质5min,得到均质混合液。其中,固体粉碎物与蒸馏水的质量比为3:10。
[0049]
s103:将均质混合液在115℃条件下灭菌处理30min。灭菌处理后的均质混合液冷却至室温。
[0050]
s104:向冷却至室温的均质混合液中添加复合乳酸菌粉,在28℃条件下发酵0h,得到发酵酵素。其中,复合乳酸菌粉包括乳双歧杆菌、嗜酸乳杆菌、干酪乳杆菌、鼠李糖乳杆菌、植物乳杆菌。复合乳酸菌的添加量为均质混合液质量的0%。
[0051]
s105:将发酵酵素在无菌条件下离心过滤,得到降糖复合植物酵素。其中,离心转速为4500r、离心时间为3min。
[0052]
实施例2
[0053]
本技术实施例提供一种降糖复合植物酵素,该降糖复合植物酵素的制备原料包括:红参10g/100g、玉竹15g/100g、马齿苋15g/100g、枸杞5g/100g、柚子10g/100g、南瓜10g/100g、生姜10g/100g、芹菜10g/100g、山药15g/100g。
[0054]
本技术实施例还提供降糖复合植物酵素的制备方法,该方法包括:
[0055]
s201:将配制好的红参、玉竹、马齿苋、枸杞、柚子、南瓜、生姜、芹菜、山药进行粉碎处理,得到固体粉碎物。
[0056]
s202:向蒸馏水中添加固体粉碎物,在12000r条件下均质5min,得到均质混合液。
其中,固体粉碎物与蒸馏水的质量比为3:10。
[0057]
s203:将均质混合液在115℃条件下灭菌处理30min。灭菌处理后的均质混合液冷却至室温。
[0058]
s204:向冷却至室温的均质混合液中添加复合乳酸菌粉,在40℃条件下发酵84h,得到发酵酵素。其中,复合乳酸菌粉包括乳双歧杆菌、嗜酸乳杆菌、干酪乳杆菌、鼠李糖乳杆菌、植物乳杆菌。复合乳酸菌的添加量为均质混合液质量的0.4%。
[0059]
s205:将发酵酵素在无菌条件下离心过滤,得到降糖复合植物酵素。其中,离心转速为4500r、离心时间为3min。
[0060]
实施例3
[0061]
本技术实施例提供一种降糖复合植物酵素,该降糖复合植物酵素的制备原料包括:红参10g/100g、玉竹15g/100g、马齿苋15g/100g、枸杞10g/100g、柚子15g/100g、南瓜15g/100g、生姜10g/100g、芹菜5g/100g、山药5g/100g。
[0062]
本技术实施例还提供降糖复合植物酵素的制备方法,该方法包括:
[0063]
s301:将配制好的红参、玉竹、马齿苋、枸杞、柚子、南瓜、生姜、芹菜、山药进行粉碎处理,得到固体粉碎物。
[0064]
s302:向蒸馏水中添加固体粉碎物,在12000r条件下均质5min,得到均质混合液。其中,固体粉碎物与蒸馏水的质量比为3:10。
[0065]
s303:将均质混合液在115℃条件下灭菌处理30min。灭菌处理后的均质混合液冷却至室温。
[0066]
s304:向冷却至室温的均质混合液中添加复合乳酸菌粉,在35℃条件下发酵40h,得到发酵酵素。其中,复合乳酸菌粉包括乳双歧杆菌、嗜酸乳杆菌、干酪乳杆菌、鼠李糖乳杆菌、植物乳杆菌。复合乳酸菌的添加量为均质混合液质量的0.2%。
[0067]
s305:将发酵酵素在无菌条件下离心过滤,得到降糖复合植物酵素。其中,离心转速为4500r、离心时间为3min。
[0068]
实施例4
[0069]
本技术实施例提供一种降糖复合植物酵素,该降糖复合植物酵素的制备原料包括:红参10g/100g、玉竹15g/100g、马齿苋5g/100g、枸杞10g/100g、柚子5g/100g、南瓜15g/100g、生姜10g/100g、芹菜15g/100g、山药15g/100g。
[0070]
本技术实施例还提供降糖复合植物酵素的制备方法,该方法包括:
[0071]
s401:将配制好的红参、玉竹、马齿苋、枸杞、柚子、南瓜、生姜、芹菜、山药进行粉碎处理,得到固体粉碎物。
[0072]
s402:向蒸馏水中添加固体粉碎物,在12000r条件下均质5min,得到均质混合液。其中,固体粉碎物与蒸馏水的质量比为3:10。
[0073]
s403:将均质混合液在115℃条件下灭菌处理30min。灭菌处理后的均质混合液冷却至室温。
[0074]
s404:向冷却至室温的均质混合液中添加复合乳酸菌粉,在30℃条件下发酵72h,得到发酵酵素。其中,复合乳酸菌粉包括乳双歧杆菌、嗜酸乳杆菌、干酪乳杆菌、鼠李糖乳杆菌、植物乳杆菌。复合乳酸菌的添加量为均质混合液质量的0.3%。
[0075]
s405:将发酵酵素在无菌条件下离心过滤,得到降糖复合植物酵素。其中,离心转
速为4500r、离心时间为3min。
[0076]
实施例5
[0077]
本技术实施例提供一种降糖复合植物酵素,该降糖复合植物酵素的制备原料包括:红参10g/100g、玉竹15g/100g、马齿苋15g/100g、枸杞10g/100g、柚子10g/100g、南瓜5g/100g、生姜5g/100g、芹菜15g/100g、山药15g/100g。
[0078]
本技术实施例还提供降糖复合植物酵素的制备方法,该方法包括:
[0079]
s501:将配制好的红参、玉竹、马齿苋、枸杞、柚子、南瓜、生姜、芹菜、山药进行粉碎处理,得到固体粉碎物。
[0080]
s502:向蒸馏水中添加固体粉碎物,在12000r条件下均质5min,得到均质混合液。其中,固体粉碎物与蒸馏水的质量比为3:10。
[0081]
s503:将均质混合液在115℃条件下灭菌处理30min。灭菌处理后的均质混合液冷却至室温。
[0082]
s504:向冷却至室温的均质混合液中添加复合乳酸菌粉,在37℃条件下发酵48h,得到发酵酵素。其中,复合乳酸菌粉包括乳双歧杆菌、嗜酸乳杆菌、干酪乳杆菌、鼠李糖乳杆菌、植物乳杆菌。复合乳酸菌的添加量为均质混合液质量的0.1%。
[0083]
s505:将发酵酵素在无菌条件下离心过滤,得到降糖复合植物酵素。其中,离心转速为4500r、离心时间为3min。
[0084]
为验证本技术提供的降糖复合植物酵素对α-葡萄糖苷酶、α-淀粉酶均有抑制作用,本技术以实施例5制备的降糖复合植物酵素为例进行实验测试,其中,对α-淀粉酶抑制率的测定方法同上,此处不再赘述。
[0085]
α-葡萄糖苷酶抑制率的测定方法具体为:取40μl酵素和40μl的α-葡萄糖苷酶37℃加热10min,加热结束后,加入20μlpnpg溶液(英文全称:4-nitrophenyl-α-d-glucopyranoside;中文全称:4-硝基苯-α-d-吡喃葡萄糖苷),继续水浴加热10min。加热结束后,加入100μl、浓度0.1mol/l的naco3溶液,然后在405nm处测量吸光度,以确定α-葡萄糖苷酶的抑制率,用pbs代替酵素作为空白组测定a
空白
,用pbs代替α-葡萄糖苷酶作为样品对照测定a
样品对照
,。其中,α-葡萄糖苷酶的抑制率以吸光度计算得到,该计算公式为
[0086][0087]
根据α-淀粉酶抑制率、α-葡萄糖苷酶抑制率绘制关系图,得到附图4。由附图4可见,本技术实施例提供的降糖复合植物酵素对α-淀粉酶的抑制率为96.3%,对α-葡萄糖苷酶的抑制率为90.4%。由此可见,本技术实施例提供的降糖复合植物酵素对α-淀粉酶、α-葡萄糖苷酶有明显的抑制作用。同时,与市售产品相比,本技术实施例提供的降糖复合植物酵素对α-淀粉酶、α-葡萄糖苷酶的抑制率远高于同类酵素产品。
[0088]
另外,本技术实施例还对大鼠的空腹血糖、口服葡萄糖耐受量和口服淀粉耐受量的影响进行相关试验,具体试验过程如下:
[0089]
6周龄级雄性wister大鼠饲养于spf级实验室,普通饲料适应性喂养一周后称重,随机编号。随机选取10只实验大鼠纳入正常对照组,给予大鼠正常饲料进行喂养,其余大鼠给予高脂饮食喂养,诱导模型建立。喂养4周后,腹腔注射剂量为30mg/kg的链脲佐菌素stz,建立2型糖尿病大鼠模型。正常对照组大鼠腹腔注射等量的缓冲液。注射72小时后尾尖取血
测其空腹血糖水平,并将最后空腹血糖值≥16.7mmol/l的大鼠视为造模成功,再将其随机分为模型组、中药组、西药组、原料组和酵素组。分组结束后,对不同组别进行剂量相同、剂型不同的干预。具体的,模型组:浓度10ml/kg
·
d-1
的生理盐水灌胃;中药组:浓度10ml/kg
·
d-1
的中药复方益糖康灌胃;西药组:浓度10mg/kg的阿卡波糖灌胃;原料组:浓度10ml/kg
·
d-1
的酵素原料灌胃;酵素组:浓度10ml/kg
·
d-1
的降糖复合植物酵素灌胃。分别记录干预前、干预2周、干预4周、干预6周、干预8周后各组大鼠尾尖取血的空腹血糖数值,测量前禁食12h,得到表1所示的大鼠空腹血糖值。
[0090]
另外,在干预第6周时,将各组大鼠禁食16h、灌胃30min后,按2g/kg体重灌胃蔗糖溶液;然后,分别于0、30、60、120min从尾尖采血,用葡萄糖过氧化物酶法测定血糖,得到图5所示的时间-血糖值图。在干预第7周时,将各组大鼠禁食16h、灌胃30min后,按2g/kg体重灌胃淀粉溶液;然后,分别于0、30、60、120min从尾尖采血,用葡萄糖过氧化物酶法测定血糖,得到图6所示的时间-血糖值图。
[0091]
表1:各组大鼠的空腹血糖值/mmol/l
[0092][0093][0094]
注:与正常对照组比较,*p<0.05,**p<0.01;与模型组比较,
#
p<0.05,
##
p<0.01
[0095]
由表1可见,相对于干预前,酵素组的大鼠干预8周后,其血糖明显下降,且下降率为55.7%。由于本技术提供的降糖复合植物酵素并非治疗药物,因而降血糖效果不如中药和西药,但是效果明显好于同类酵素产品。
[0096]
由附图5可见,相较于正常组大鼠,摄入蔗糖30min后,所有干预组均有明显抑制作用,酵素组的血糖降低效果也优于原料组。由附图6可见,酵素组对血糖的干预作用能达到中药组结果。
[0097]
本领域技术人员在考虑说明书及实践这里发明的公开后,将容易想到本发明的其它实施方案。本技术旨在涵盖本发明的任何变型、用途或者适应性变化,这些变型、用途或者适应性变化遵循本发明的一般性原理并包括本发明未公开的本技术领域中的公知常识或惯用技术手段。说明书和实施例仅被视为示例性的,本发明的真正范围和精神由下面的权利要求指出。
[0098]
应当理解的是,诸如“第一”和“第二”等之类的关系术语仅仅用来将一个实体或者操作与另一个实体或操作区分开来,而不一定要求或者暗示这些实体或操作之间存在任何这种实际的关系或者顺序。本发明并不局限于上面已经描述并在附图中示出的精确结构,并且可以在不脱离其范围进行各种修改和改变。本发明的范围仅由所附的权利要求来限制。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1