包括防漏近端轴的导管的制作方法
本公开涉及医用导管。
背景技术:
限定至少一个管腔的医用导管已被提议与各种医疗程序一起使用。例如,在一些情况下,医用导管可用来接近和处理血管中的缺陷,诸如但不限于血管中的损伤或闭塞。
技术实现要素:
在一些方面中,本公开描述示例性导管,所述示例性导管包括海波管和附接到海波管的内圆周表面并且延伸超过海波管的端部的内衬。内衬可包括含氟聚合物。导管还可包括附接到海波管的外圆周表面的单个粘结层。粘结层可将毂粘结到海波管。在一些实例中,粘结层和内衬可各自延伸超过海波管的端部,并且粘结层可附接到内衬。本公开还描述形成导管的示例性方法和使用导管的方法。
条款1:在一些实例中,导管包括限定内圆周表面、外圆周表面和端部的海波管。所述海波管可包括金属或合金。导管还可包括附接到海波管的内圆周表面并且延伸超过海波管的端部的内衬,并且所述内衬可包括含氟聚合物。导管还可包括毂和附接到海波管的外圆周表面并且粘结到所述毂的单个粘结层。单个粘结层可包括聚酰胺或聚醚-共-聚酰胺,并且是海波管的外圆周表面与毂之间的仅有的层。
条款2:在条款1的导管的一些实例中,所述单个粘结层基本上由聚酰胺或聚醚-共-聚酰胺组成。
条款3:在条款1的导管的一些实例中,所述单个粘结层基本上由聚醚-共-聚酰胺组成。
条款4:在条款1至3中任一项的导管的一些实例中,所述毂包括聚丙烯。
条款5:在条款1至4中任一项的导管的一些实例中,所述毂被包覆模制或胶着地粘结到单个粘结层。
条款6:在条款1至5中任一项的导管的一些实例中,所述内衬包括聚四氟乙烯(PTFE)。
条款7:在条款1至6中任一项的导管的一些实例中,所述单个粘结层延伸超过海波管的端部并且粘结到内衬。
条款8:在条款7的导管的一些实例中,其中所述单个粘结层延伸超过海波管的端部与内衬延伸超过海波管的端部基本上相同的距离。
条款9:在条款1至8中任一项的导管的一些实例中,所述金属或合金包括不锈钢或镍钛合金中的至少一种。
条款10:在条款1至9中任一项的导管的一些实例中,所述海波管包括螺旋切管或开槽管。
条款11:在一些实例中,导管包括限定内圆周表面、外圆周表面和端部的海波管。所述海波管可包括不锈钢或镍钛合金。导管还可包括附接到海波管的内圆周表面并且延伸超过海波管的端部的内衬。所述内衬可包括聚四氟乙烯。导管还可包括毂和附接到海波管的外圆周表面并且粘结到所述毂的单个粘结层。所述单个粘结层可基本上由聚酰胺或聚醚-共-聚酰胺组成,所述单个粘结层可延伸超过海波管的端部与内衬延伸超过海波管的端部基本上相同的距离并且粘结到内衬,并且所述单个粘结层可以是海波管的外圆周表面与毂之间的仅有的层以及内衬与毂之间的仅有的层。
条款12:在条款11的导管的一些实例中,所述毂可包括聚丙烯。
条款13:在条款11或12的导管的一些实例中,所述海波管可包括螺旋切管或开槽管。
条款14:在一些实例中,一种方法可包括将内衬附接到海波管的内圆周表面。所述内衬可延伸超过海波管的端部并且可包括含氟聚合物。所述内衬还可限定外圆周表面和端部。所述海波管可包括金属或合金。所述方法还可包括将单个粘结层附接到海波管的外圆周表面。所述单个粘结层可包括聚酰胺或聚醚-共-聚酰胺。所述方法还可包括将毂附接到单个粘结层的外表面。所述单个粘结层可以是海波管与毂之间的仅有的层。
条款15:在条款14的方法的一些实例中,所述单个粘结层基本上由聚酰胺或聚醚-共-聚酰胺组成。
条款16:在条款14的方法的一些实例中,所述单个粘结层基本上由聚醚-共-聚酰胺组成。
条款17:在条款14至16中任一项的方法的一些实例中,所述毂包括聚丙烯。
条款18:在条款14至17中任一项的方法的一些实例中,将毂附接到单个粘结层的外表面包括将所述毂包覆模制或胶着地粘结到所述单个粘结层的所述外表面。
条款19:在条款14至18中任一项的方法的一些实例中,所述内衬包括聚四氟乙烯(PTFE)。
条款20:在条款14至19中任一项的方法的一些实例中,所述单个粘结层延伸超过海波管的端部并且粘结到内衬。
条款21:在条款20的方法的一些实例中,所述单个粘结层延伸超过海波管的端部与内衬延伸超过海波管的端部基本上相同的距离。
条款22:在条款14至21中任一项的方法的一些实例中,所述金属或合金包括不锈钢或镍钛合金中的至少一种。
条款23:在条款14至22中任一项的方法的一些实例中,将单个粘结层附接到海波管的外圆周表面包括将所述单个粘结层层压到所述海波管的所述外圆周表面。
条款24:在一些实例中,一种方法可包括将导管主体的远端引入患者体内。所述导管主体可包括限定内圆周表面、外圆周表面和近端的海波管。所述海波管可包括金属或合金。所述导管主体还可包括附接到海波管的内圆周表面并且延伸超过海波管的近端的内衬,其中所述内衬包括含氟聚合物。所述内衬可限定至少一个内管腔。所述导管主体还可包括毂和附接到海波管的外圆周表面并且粘结到所述毂的单个粘结层。所述单个粘结层可包括聚酰胺或聚醚-共-聚酰胺,并且所述单个粘结层可以是海波管的外圆周表面与毂之间的仅有的层。所述方法还可包括将导管主体的远端引导到患者体内的靶组织位点。
条款25:在条款24的方法的一些实例中,所述方法还可包括在患者体内引入导丝,并且将导管主体的远端引导到靶组织位点可包括将导管主体的远端经过导丝引导到靶组织位点。
条款26:在条款24或25的方法的一些实例中,所述单个粘结层基本上由聚酰胺或聚醚-共-聚酰胺组成。
条款27:在条款24或25的方法的一些实例中,所述单个粘结层基本上由聚醚-共-聚酰胺组成。
条款28:在条款24至27中任一项的方法的一些实例中,所述毂包括聚丙烯。
条款29:在条款24至28中任一项的方法的一些实例中,所述内衬包括聚四氟乙烯(PTFE)。
条款30:在条款24至29中任一项的方法的一些实例中,所述单个粘结层延伸超过海波管的端部并且粘结到内衬。
条款31:在条款30的方法的一些实例中,所述单个粘结层延伸超过海波管的端部与内衬延伸超过海波管的端部基本上相同的距离。
条款32:在条款24至31中任一项的方法的一些实例中,所述金属或合金包括不锈钢或镍钛合金中的至少一种。
一个或多个实例的细节在附图和以下描述中阐明。其他特征、目标和优势将从说明书和附图并且从权利要求书中显而易见。
附图说明
图1是示例性导管的侧正视图,所述示例性导管包括导管主体(包括内衬和海波管)、毂和将所述毂附接到所述导管主体的单个粘结层。
图2是图1的导管的近侧部分的截面图。
图3是示出用于形成导管的示例性技术的流程图,所述导管包括导管主体(包括内衬和海波管)、毂和将所述毂附接到所述导管主体的单个粘结层。
图4是示出用于利用导管的示例性技术的流程图,所述导管包括导管主体(包括内衬和海波管)、毂和将所述毂附接到所述导管主体的单个粘结层。
具体实施方式
本公开描述用于将毂附接到导管主体以形成导管的组件、系统和技术。在一些实例中,导管可包括导管主体与毂之间的单个粘结层。单个粘结层的组合物可选择来紧密地(例如,形成耐流体界面)粘结到导管主体和毂。例如,单个粘结层可粘结到导管主体的海波管和毂。在一些实例中,单个粘结层还可粘结到附接到海波管的内圆周表面的内衬。
通过利用被选择来紧密地粘结到导管主体和毂的单个粘结层,导管中可存在更少的材料之间的界面(例如,与利用导管主体与毂之间的多个层的导管相比)。更少的界面可产生更少的潜在故障点,在所述潜在故障点处不良粘附、分层或泄漏可能发生。此外,选择单个粘结层的组合物以在导管主体与毂之间形成紧密粘结可减少或基本上防止(例如,防止或几乎防止)界面处所存在的不良粘附、分层或泄漏。以此方式,导管主体与毂之间的单个粘结层可减少或基本上防止(例如,防止或几乎防止)在导管的毂处或其附近的不良粘附、分层或泄漏的事件。
在一些实例中,单个粘结层可包括聚酰胺或聚醚-共-聚酰胺。海波管可包括金属,诸如钛或不锈钢。内衬可包括聚四氟乙烯,并且毂可包括聚丙烯。聚酰胺或聚醚-共-聚酰胺可有利地粘结到多种类型的材料,包括钛或不锈钢、聚丙烯以及任选的聚四氟乙烯,以将毂接合到海波管和任选的内衬。
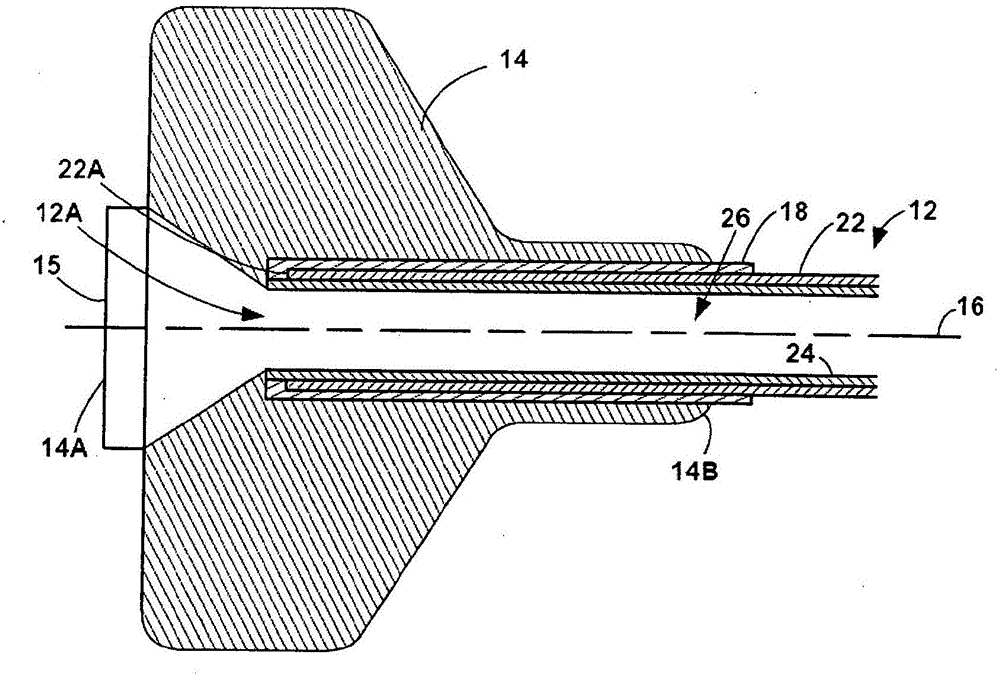
图1是示例性导管10的侧正视图,所述导管10包括导管主体12和毂14。导管毂14定位在导管主体12的近端12A处并且限定开口15,导管主体12的至少一个内管腔26(在图2中示出)通过所述开口15可进入并且在一些实例中可关闭。例如,导管毂14可包括用于连接到另一个装置(止血阀)或者另一个机构或机构的组合的路厄(luer)连接器。在一些实例中,导管10包括应变消除构件,所述应变消除构件可以是毂14的一部分或者可与毂14分开。在其他实例中,导管10可不包括应变消除构件。
导管主体12是从近端12A延伸到远端12B的细长主体,并且限定在由导管主体12限定的远侧开口13处终止的至少一个内管腔26(例如,一个内管腔、两个内管腔、三个内管腔或更多个内管腔)。在图1中示出的实例中,导管主体12的近端12A接收在毂14内,并且通过单个粘结层18机械地连接到毂14。由毂14限定并且位于毂14的近端14A处的开口15与导管主体12的至少一个内管腔26对准,以使得导管主体12的内管腔可通过开口15进入。
导管主体12具有用于从血管进入点进入患者体内的靶组织位点的合适长度。所述长度可沿着导管主体12的纵向轴线16测量。靶组织位点可取决于导管10所用于的医疗程序。例如,如果导管10是用来从患者的腹股沟处的股动脉进入点来进入患者的脑部中的脉管系统的远侧进入导管,那么导管主体12可具有大约129厘米(cm)至大约135cm的长度,诸如大约132cm,尽管可使用其他长度。
在一些实例中,导管主体12可用来进入患者体内相对远侧的位置,诸如患者的脑部中的大脑中动脉(MCA)。所述MCA以及脑部或其他(例如,相对于血管进入点)相对远侧的组织位点中的其他脉管系统至少部分地由于穿过脉管系统以触及这些组织位点的曲折的路径(例如,包括相对急剧的扭曲和/或转弯)而可能相对难以利用导管触及。导管主体12可在结构上被配置成相对柔性、可推动并且相对耐扭结和耐屈曲,以使得导管主体12可在将推力施加到导管的相对近侧部分以远侧地推进导管主体穿过脉管系统时抵抗屈曲,并且以使得导管主体12可在穿过脉管系统中的急转弯时抵抗扭结。导管主体12的扭结和/或屈曲可阻碍临床医生远侧地(例如,经过转弯)推动导管主体的努力。
在一些实例中,导管主体12的至少一个内管腔26(图2中示出)的直径(本文也称为导管主体12的内径)可以从近端12A到远端12B是基本上恒定的。在其他实例中,导管主体12的内径可从包括近端12A的近侧部分处的第一内径逐渐减小到包括远端12B的远侧部分处的第二内径,所述第二内径小于所述第一内径。
在一些实例中,导管主体12的外表面的至少一部分包括至少一个涂层,包括但不限于可有助于减少体外血栓的形成的抗血栓形成涂层;抗菌涂层;或润滑涂层。当导管主体12被推进穿过脉管系统时,润滑涂层可被配置来减少导管主体12与患者的组织之间的静摩擦动摩擦或两者。润滑涂层可以是例如亲水性涂层。在一些实例中,导管主体12的整个工作长度(从毂14的远侧部分14B到远端12B)涂覆有亲水性涂层。在其他实例中,导管主体12的工作长度的仅一部分涂覆有亲水性涂层。这可提供毂14的远端14B远侧的导管主体12的一段长度,临床医生可利用所述长度握住导管主体12,例如以旋转导管主体12或推动导管主体12穿过脉管系统。
根据本公开的一些实例,毂14可使用单个粘结层18附接到导管主体12。单个粘结层18可基本上沿着毂14的轴向长度(沿着纵向轴线16测量)在毂14的内圆周表面与导管主体12的外圆周表面之间延伸。在一些实例中,单个粘结层18可稍微延伸超过毂14的远端14B,并且可基本上与毂14内的导管主体12的端部对准。在单个粘结层18延伸超过毂14的远端14B的一些实例中,单个粘结层18可充当应变消除件。
单个粘结层18可包括被选择来紧密地粘结到导管主体12和毂14的组合物。如本文所使用的,紧密地粘结是指沿着界面足够紧密地粘结以抵抗流体流动的界面。例如,单个粘结层18可包括聚酰胺、聚醚-共-聚酰胺、聚氨酯或丙烯酸丁二烯苯乙烯共聚物。可在单个粘结层18中使用的示例性聚酰胺包括可购自美国南卡罗来纳州的Orangeburg的股份有限公司的基于尼龙12的材料的以商标可获得的那些。可在单个粘结层18中使用的示例性聚醚-共-聚酰胺包括以商标可购自法国Arkema Technical Polymers公司的那些。可在单个粘结层18中使用的示例性聚氨酯弹性体包括以商标2363-75D可购自俄亥俄州Lubrizol Thermedics公司的那些。
通过利用被选择来紧密地粘结到导管主体和毂的单个粘结层18,导管10中可存在更少的材料之间的界面(例如,与利用导管主体12与毂14之间的多个层的导管相比)。更少的界面可产生更少的潜在故障点,在所述潜在故障点处不良粘附、分层或泄漏可能发生。此外,选择单个粘结层18的组合物以在导管主体12与毂14之间形成紧密粘结可减少或基本上防止(例如,防止或几乎防止)界面处所存在的不良粘附、分层或泄漏。以此方式,单个粘结层18可减少或基本上防止(例如,防止或几乎防止)在导管10的毂14处或其附近的不良粘附、分层或泄漏的事件。
图2是图1的导管10的近侧部分的截面视图,所述导管10包括导管主体12(包括内衬24和海波管22)、毂14和将毂14附接到导管主体12的单个粘结层18。如图2中所示,导管主体12包括内衬24和海波管22。任选地,导管主体还可包括沿着导管主体的一些或所有长度覆盖在海波管22上的外护套(未示出)。例如,这种外护套可能从定位在粘结层18的远端的远侧和/或邻近粘结层18的远端定位的近侧护套端延伸朝向或延伸到导管主体12的远端12B。代替或除了外护套之外,导管主体12还可包括其他任选层。海波管22被配置来增加导管主体12的一部分的导管主体12的结构完整性,同时允许导管主体12保持相对柔性。例如,海波管22可被配置来有助于导管主体12基本上维持其截面形状,或者至少有助于防止导管主体12在由临床医生操纵时屈曲或扭结。海波管22连同内衬24可有助于沿着导管主体12的长度的至少一部分分配推力和旋转力,这可有助于防止在主体12旋转时导管主体12的扭结或者有助于防止在将推力施加到导管主体12时导管主体12的屈曲。因此,临床医生可将推力、旋转力或两者施加到导管主体12的近侧部分,并且此类力可分别引起导管主体12的远侧部分远侧地推进、旋转或两者。
在图1和图2示出的实例中,海波管22可沿着导管主体12的长度的仅一部分延伸。例如,海波管22的近端可在毂14的远端14B的近侧终止,并且海波管22的远端可在毂14的远端14B的远侧终止。如图2中所示,海波管22的近端22A在毂14内延伸并且在导管主体12的近端12A的稍远侧终止。
海波管22可包括金属、合金或聚合物。在一些实例中,金属、合金或聚合物可为对于用在患者体内临床上接受的生物相容性金属、合金或聚合物。例如,海波管22可包括不锈钢或镍钛合金中的至少一种。
在一些实例中,海波管22可限定基本上连续的(例如,连续的或几乎连续的)圆筒,如图2中所示。在其他实例中,海波管22可包括螺旋切管或开槽管,以使得海波管22包括间隙并且不是基本上连续的。所述螺旋切管或开槽管可有效地沿着导管主体12的长度转移轴向力、旋转力或弯曲力中的至少一种,但是可拥有比基本上连续的圆筒更大的柔性。
导管主体12还可包括内衬24。内衬24可限定导管主体12的至少一个内管腔26,所述至少一个内管腔26从近端12A延伸到远端12B,并且限定从近端12A延伸到导管主体12的远端12B处的远侧开口13的通道。至少一个内管腔26的大小可以被设定成接收医疗装置(例如,另一根导管、导丝、血栓切除术装置、栓塞保护装置、支架、用于支架或植入物的递送系统或它们的任何组合),治疗剂等。至少限定至少一个内管腔26的内衬24的内表面在一些实例中可以是光滑的,以便有助于装置、治疗剂等穿过至少一个内管腔26的引入和通行。例如,整个内衬24由其形成的材料可以是光滑的,或者内衬24可以由两种或更多种材料形成,其中限定至少一个内管腔26的材料可以比与海波管22对接的材料更光滑。除了或替代由光滑材料形成之外,在一些实例中,内衬24的内表面涂覆有光滑的涂层。
内衬24可由其形成的示例性材料包括但不限于含氟聚合物,诸如聚四氟乙烯(PTFE)、全氟烷氧基烷烃(PFA)、氟化乙烯丙烯(FEP)或它们的任何组合。例如,内衬24可由蚀刻的PTFE形成,例如可基本上由蚀刻的PTFE组成。
在一些实例中,内衬24限定沿着内衬24的整个长度的基本上恒定(例如,不变的或几乎不变的)的内径,而在其他实例中,内衬24可限定变化的内径。
与由彼此化学地或机械地连接的两个或更多个纵向区段形成的导管相比,无缝内衬24可以更容易地在另一个装置(例如,另一根导管或导丝)上滑动,因为无缝内衬可限定更平滑的内管腔24。相比之下,由两个或更多个纵向区段形成的内衬的区段之间的接头可限定沿着至少一个内管腔26的表面突起或其他不规则部分,所述表面突起或其他不规则部分可妨碍装置穿过至少一个内管腔26。此外,无缝内衬24可有助于沿着导管主体12的长度分配推力和旋转力。因此,无缝内衬24可有助于促成导管主体12的可推动性。
如图2中所示,在一些实例中,内衬24可在海波管22的近端22A的近侧延伸。内衬24的这个部分因此可限定外圆周表面,所述外圆周表面被暴露出并且可用来粘结到单个粘结层18。
导管10还包括毂14。如图2中所示,毂14通过单个粘结层18附接到导管主体12。在一些实例中,毂14可以由聚烯烃(诸如聚丙烯)形成。
如图2中所示,毂14限定开口15,并且可包括从毂14的可限定连接器(诸如螺纹或滑动类型的路厄连接器)的近端14A到毂14的接触导管主体12的近端12A的部分的锥形部分。以此方式,开口15可包括锥形部分并且可与内衬24的限定至少一个内管腔26的内表面基本上对准(例如,对准或几乎对准)。基本上对准毂14和导管主体12的近端12A处的至少一个内衬24的内表面可减少通过开口15引入至少一个内管腔26中的医疗器械可能卡在导管主体12的近端12A上的机会。
在图2中示出的实例中,毂14使用单个粘结层18附接到导管主体12。例如,单个粘结层18可例如通过热粘结或其他类型的粘结来将毂14附接到海波管22的外圆周表面。单个粘结层18可沿着毂14的轴向长度在毂14的内圆周表面与导管主体12的外圆周表面之间延伸。在一些实例中,单个粘结层18可以是海波管22的外圆周表面与毂14的内圆周表面之间的仅有的层。
在一些实例中,单个粘结层18可延伸超过毂14的远端14B,如图2中所示。在一些实例中,单个粘结层18的近端可基本上与毂14内的导管主体12的近端12A对准。例如,单个粘结层18的近端可基本上与内衬24的近端对准。换句话说,单个粘结层18可延伸超过海波管22的近端22A与内衬24延伸超过海波管22的近端22A基本上相同的距离。以此方式,在一些实例中,单个粘结层18可例如通过热粘结或其他类型的粘结而在导管主体12的近端12A附近附接到内衬24。通过附接或粘结到内衬24的近端,单个粘结层18可机械地稳固内衬24的近端。在一些实例中,单个粘结层18和内衬24可在导管主体12的近端12A处基本上包封海波管22。在一些实例中,这可减少(例如,当医疗装置通过开口15装载到内管腔26中用于通过导管主体12递送到患者体内时)内衬24从海波管22拆离的机会,因为单个粘结层18与内衬24之间的粘结可有助于保持内衬24抵靠海波管22。
单个粘结层18可包括被选择来紧密地粘附到海波管22、毂14和(在一些实例中)内衬24的组合物。例如,单个粘结层18可包括聚酰胺或聚醚-共-聚酰胺。作为另一个实例,单个粘结层18可基本上由聚酰胺或聚醚-共-聚酰胺组成,或者可基本上由聚醚-共-聚酰胺组成。
在一些实例中,通过利用单个粘结层18而不是包括被选择来形成与海波管22和毂14的粘结的不同材料的多个层,海波管22与毂14之间的结构的总厚度可减小。例如,通过利用单个粘结层18,海波管22与毂14之间的间隔(单个粘结层18的厚度)可以是千分之一英寸的数量级,诸如小于大约千分之10英寸(大约0.010英寸;大约254微米),诸如大约千分之5英寸(大约0.005英寸;大约127微米)。
此外,在一些实例中,毂14可围绕导管主体12模制。包括聚酰胺或聚醚-共-聚酰胺的单个粘结层18可承受用来模制毂14(例如,聚丙烯毂)的温度,而没有显著量的降解。这还可支持海波管22与毂14之间的相对紧密的(例如,耐流体)粘结的形成。在其他实例中,毂14可使用单个粘结层18胶着地粘结到导管主体12。
通过利用被选择来紧密地粘结到海波管22毂14的单个粘结层18,导管10中可存在更少的材料之间的界面(例如,与利用海波管22与毂14之间的多个层的导管相比)。更少的界面可产生更少的潜在故障点,在所述潜在故障点处不良粘附、分层或泄漏可能发生。此外,选择单个粘结层18的组合物以在海波管22与毂14之间形成紧密粘结可减少或基本上防止(例如,防止或几乎防止)界面处所存在的不良粘附、分层或泄漏。以此方式,单个粘结层18可减少或基本上防止(例如,防止或几乎防止)在导管10的毂14处或其附近的不良粘附、分层或泄漏的事件。此外,利用海波管22与毂14之间的单个粘结层18可减少用来制造导管10的许多处理步骤,这可减少针对导管10的制造成本。
图3是示出用于形成导管的示例性技术的流程图,所述导管包括导管主体(包括内衬和海波管)、毂和将所述毂附接到所述导管主体的单个粘结层。将参考图1和图2的导管10来描述图3的技术。然而,将理解,导管10可使用其他技术形成,图3的技术可用来形成其他导管或两者。
图3的技术包括将内衬24附接到海波管22的内圆周表面(30)。在一些实例中,内衬24可独立于海波管22形成,并且内衬24的外圆周表面可被蚀刻以有助于将内衬24附接到海波管22。例如,内衬24的外圆周表面可使用钠和氨的混合物来蚀刻,以使内衬24的外圆周表面用于附接到海波管22的内圆周表面。在其他实例中,内衬24可使用其他技术(诸如涂布技术等)附接到海波管22的内圆周表面。
图3的技术还可包括将单个粘结层18附接到海波管22的外圆周表面(32)。在一些实例中,单个粘结层18可独立于海波管22形成并且层压到海波管22的外圆周表面。例如,单个粘结层18可通过形成材料片、利用所述材料片包裹海波管22、加热所述材料片并且抵靠海波管22的外圆周表面按压所述材料片以将所述材料片附接到海波管22并形成单个粘结层18而附接到海波管22的外圆周表面。在其他实例中,单个粘结层18可使用其他技术(诸如涂布技术等)附接到海波管22的外圆周表面。
图3的技术还可包括将毂14附接到单个粘结层18的外表面(34)。在一些实例中,毂14可模制在单个粘结层18上方。例如,包括海波管22、单个粘结层18和(在一些实例中)内衬24的导管主体12可放置在限定毂14的形状的模具中,并且毂14可模制到导管主体12。在其他实例中,毂14可在使用粘合剂(例如通过加热毂14或单个粘结层18中的一个或两者以使得毂14或单个粘结层18中的一个或两者发黏、使用溶剂来使得毂14或单个粘结层18中的一个或两者发黏等)来附接到单个粘结层18时单独地形成。
图4是示出用于利用导管的示例性技术的流程图,所述导管包括导管主体(包括内衬和海波管)、毂和将所述毂附接到所述导管主体的单个粘结层。将参考图1和图2的导管10来描述图4的技术。然而,将理解,导管10可使用其他技术来利用,图4的技术可用来利用其他导管或两者。
图4的技术任选地包括在患者体中引入导丝(40)。导丝可限定用于导管主体12穿过患者的脉管系统的路径,并且可有助于导管10穿过脉管系统的导航(例如,转向和操纵)。在一些实例中,导丝可通过进入点(例如,股动脉)引入患者的脉管系统(例如,颅内血管)。例如,导管主体12的内管腔26可被配置来接收导丝,以使得导管主体12可通过导丝被引导穿过脉管系统。
在一些情况下,除了任选地在患者体中引入导丝(40)之外,图4的技术可包括通过导丝推进内导管。内导管可具有比导管主体12更小的外径。内导管可例如有助于填满导丝与导管主体12的内表面之间的间隔,以便有助于最小化边缘效应,所述边缘效应可在导管主体12的远侧尖端(特别是跟踪由主体12形成的弯曲的外侧的尖端的边缘的部分)在导管主体12通过导丝被推进通过脉管系统中的弯曲时而接合或磨损脉管系统壁时发生。边缘效应可至少部分归因于导丝与导管主体12的内管腔26之间的未抑制的空间。
图4的技术还可包括将导管主体12的远端12B引入患者体内(42),并且将导管主体12的远端12B引导至患者体内的靶组织位点(44)。在一些实例中,导管的远端12B可围绕导丝或内导管引入,所述导丝或内导管可在导管主体12被推进到患者体内时引导导管10的远端12B。
一旦导管主体12的远端12B定位在靶组织位点处(其可靠近血栓栓塞材料(例如,血栓)),所述血栓栓塞材料通过导管主体12从脉管系统中移除。例如,血栓栓塞材料可通过至少将真空力通过毂14(和/或近端12A)施加到导管主体12的内管腔24而从脉管系统吸出,这可引起血栓栓塞材料通过远侧开口13引入内管腔24中。任选地,真空或抽吸可继续来由此沿着内管腔24朝近侧拉动血栓栓塞材料全部或部分到近端12A或毂14。作为另一选项,抽吸或真空可引起血栓栓塞材料附接或粘附到远端尖端;在这种情况下导管10或导管主体12以及血栓栓塞材料可作为一个单元一起例如通过围绕导管10或导管主体12的另一根导管而从脉管系统撤回。
作为另一个实例,血栓栓塞材料可使用另一种技术从脉管系统移除,诸如通过被递送通过导管主体12的内管腔26的血管内取回装置。在这种方法中,导管主体12可(例如使用本文公开的任何技术)插入脉管系统中,并且所述取回装置被推进穿过内管腔26(或者穿过另一根导管,诸如微导管,通过内管腔26插入脉管系统中),以使得所述装置接合血栓栓塞材料。取回装置和由此接合的材料(与任何其他导管或微导管一起)可随后缩回到内管腔26中并从患者体内移除。任选地,在取回装置和血栓栓塞材料缩回导管主体12中的过程中,可利用或通过导管主体12来执行抽吸。脉管系统可包括神经血管系统、周围血管系统或心血管系统。血栓栓塞材料可使用任何合适的技术来定位,诸如荧光镜检查、血管内超声或颈动脉多普勒成像技术。
在其他实例中,代替或者除了使用导管10来将血栓栓塞材料从脉管系统移除之外,导管10可用来将医疗装置(例如,另一根导管、导丝、血栓切除术装置、栓塞保护装置、支架、用于支架或植入物的递送系统或它们的任何组合)通过内管腔26递送到治疗位点,将治疗剂(诸如液体栓塞材料、或诸如血液稀释剂或溶栓剂的药物)通过内管腔26递送到治疗位点等。
在一些实例中,导管10或导管主体12可以是包括例如导丝和/或另一根导管的组件的一部分。在这种组件中,导管10或导管主体12可以是本文公开的导管10或导管主体12的任何实施方案或实例。导丝可用来将导管10引导至患者的脉管系统内的靶组织位点。此外,在一些实例中,所述组件的附加导管也可被配置来将导管10或主体12引导至患者的脉管系统内的靶组织位点。所述组件的附加导管可以在结构上基本上类似于(例如,相同或几乎相同)导管10(包括本文公开的导管10的任何实施方案或实例),但是可具有按比例更大或更小的尺寸,以使得导管的导管主体可嵌套在一起。例如,所述组件的附加导管可具有比导管主体12更小的外径,并且可通过导丝放置和/或引导,并且随后导管10或导管主体12可通过附加的导管进行引导。所述组件因此可包括带有定位在导管10的内管腔26中的附加导管的导管10,并且还可包括定位在附加导管的内管腔中的导丝。
已经描述各种实例。这些和其他实例在以下权利要求书的范围内。
- 还没有人留言评论。精彩留言会获得点赞!