微藻蛋白酶解肽在制备预防及治疗肠炎药物中的应用的制作方法
本发明属于生物医药技术领域,具体涉及了一种微藻蛋白酶解肽在制备预防及治疗肠炎药物中的应用。
背景技术:
急性肠道炎症特别是结肠炎是指各种原因引起的结肠炎症性病变。主要临床表现为腹泻、腹痛、黏液便及脓血便、里急后重、甚则大便秘结、数日内不能通大便;常伴有消瘦乏力等,多反复发作。根据不同病因,结肠炎可分为溃疡性结肠炎、缺血性结肠炎、伪膜性结肠炎等。依照现有的医学技术,很难根治,主要靠预防。因此寻找安全、有效的新治疗和预防炎症药物尤为重要。
海洋藻类中蕴含着各种各样的生物活性物质,在医药保健方面,海藻生物活性肽的筛选与分子结构鉴定为海洋新药合成研发奠定基础,因此从海洋藻类中寻找到新型的更具活性的抗炎新药逐渐成为研究热点。本发明通过合适的酶解纯化方法得到海藻小肽或者蛋白混合物,含有丰富的蛋白质,多肽,寡肽,氨基酸以及多糖类等,是一种食品源的医药提取原材料,已经被证实其无毒无害无副作用。因此开发其预防或者抗炎应用,具有重要的社会和经济价值。
技术实现要素:
本发明提供一种微藻蛋白酶解肽在制备预防及治疗肠炎药物中的应用。通过利用裂殖壶菌藻粕的下脚料为原料,经酶解、离心、超滤等步骤,获得分子量为300~850da的生物活性肽。经该方法得到的生物活性肽抗炎活性高,在预防或治疗肠炎中有显著作用,能有效防止肠炎患者体重下降,缓解便血情况,并且还具有修复和/或防止肠道黏膜被破坏,促进杯状细胞增殖存活的功效。
为实现此目的,本发明采用如下技术方案:
一种微藻蛋白酶解肽的应用:用于制备预防及治疗肠炎的药物;所述的微藻蛋白酶解肽是以裂殖壶菌粕的下脚料为原料,经胰蛋白酶和胃蛋白酶进行双酶酶解,制得的分子量为300~850da生物活性肽。
所述的肠炎包括结肠炎。
所述的微藻蛋白酶解肽的制备方法,具体包括以下步骤:
1)将裂殖壶菌粕的下脚料粉碎,过120目筛,得裂殖壶菌粕粉末;
2)在磷酸缓冲液体系中,加入步骤1)制得的裂殖壶菌粕粉末,然后加入胰蛋白酶和胃蛋白酶进行双酶酶解,酶解后离心,取上清液,除腥,超滤,除盐;
3)取滤液,喷雾干燥至粉末状,即得微藻蛋白酶解肽。
步骤2)中,裂殖壶菌藻粕粉末的加入量为缓冲液质量的8%~12%,胰蛋白酶和胃蛋白酶的质量比为1:1,双酶的加入量是裂殖壶菌藻粕粉末质量的3%~5%,酶解时间为6~8小时。
步骤2)中,所述的超滤的截留分子量为1000da以上的物质,步骤3)所制得的酶解肽的分子量为300~850da。
具体应用:通过dss建立c57bl/6小鼠的急性肠道炎症模型。
具体实施步骤如下:
1)本模型替代饮用水的dss溶液浓度为2.5%,供给3组小鼠(阳性对照组、阴性对照组、实验组)自由饮用,每天对每只小鼠的状态如:体重、便血等情况进行观察记录,以确保模型成功建立;
2)本实验的小鼠先进行5~7天的饮用水来适应环境,再进行5天的2.5%dss溶液建立急性肠道炎症模型,之后再更换为饮用水供小鼠自由饮用;
3)给药剂量:阳性对照组(诺氟沙星),剂量8mg·kg-1,阴性对照组(0.01mpbs),实验组(裂殖壶菌生物活性肽),剂量400~600mg·kg-1;
4)实验第一天开始,每组每只小鼠给药规格是100μl/20g,每天在同一时间对每组小鼠定量灌胃如上指定的药品(其中药品的配置溶剂为0.01mpbs溶液),通过与阳性对照组和阴性对照组结果的比对,验证其喷雾干燥后的裂殖壶菌生物活性肽,在治疗肠道炎症的生物活性功效;
5)记录并测试以下指标:小鼠体重变化、肠道便血情况、肠炎疾病的临床评分和肠道病理切片上分析,测试出裂殖壶菌生物活性肽具有抗炎的生物活性。
本发明的显著优点是:
本发明所制得的微藻蛋白酶解肽无毒无害无副作用,治理肠道炎症效果优于诺氟沙星,且功效显著,是一种绿色的药物辅料,具有显著的经济和社会价值。
附图说明
图1是小鼠体重变化曲线图;
图2是小鼠不同时间段便血情况对比图;
图3是小鼠临床评分曲线图;
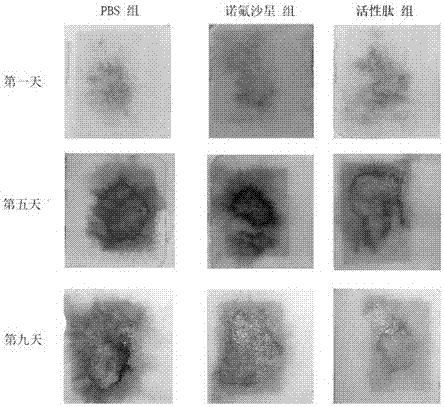
图4是小鼠肠黏膜形态对比图。
具体实施方式
下面结合实施例,进一步阐述本发明。这些实施举例仅用于说明本发明而不用于限制本发明的范围。
实施例1
微藻蛋白酶解肽的制备方法,具体包括以下步骤:
1)将裂殖壶菌粕的下脚料粉碎,过120目筛,得裂殖壶菌粕粉末;
2)在磷酸缓冲液体系中,加入步骤1)制得的裂殖壶菌粕粉末,然后加入胰蛋白酶和胃蛋白酶进行双酶酶解,酶解后离心,取上清液,除腥,超滤,除盐;
3)取滤液,喷雾干燥至粉末状,即得微藻蛋白酶解肽。
步骤2)中,裂殖壶菌藻粕粉末的加入量为缓冲液质量的10%,胰蛋白酶和胃蛋白酶的质量比为1:1,双酶的加入量是裂殖壶菌藻粕粉末质量的4%,酶解时间为7小时。
步骤2)中,所述的超滤的截留分子量为1000da以上的物质,步骤3)所制得的酶解肽的分子量为300~850da。
应用实施例1
将上述制得的生物活性肽用于具体实施:
本实验的小鼠先进行5~7天的饮用水来适应环境,再进行5天的2.5%dss溶液建立急性肠道炎症模型,之后再更换为tapwater供小鼠自由饮用。从实验第一天开始,按表1所示,每组每只小鼠给药规格是100μl/20g,每天在同一时间对每组小鼠定量灌胃表中指定的药品(其中药品的配置溶剂为0.01mpbs溶液),通过与阳性对照组和阴性对照组结果的比对,验证其喷雾干燥后的裂殖壶菌生物活性肽,在治疗肠道炎症的生物活性功效,模型建立完成的小鼠会因肠炎的发炎而出现食欲不振或无法正常进食的情况,不同组的小鼠因为给药的不同出现病情轻重的差异,而这个差异通过体重变化上直观的表现出来。体重变化的计算公式如公式所示:其中w0为初始体重(即跟换dss溶液时小鼠的体重),wx为更换dss溶液后第x天小鼠的体重,体重变化情况如图1所示。
表1是dss小鼠模型给药情况表
应用实施例2
众所周知,肠道炎症引发病变会导致粪便中含有隐血,病情的轻重可以通过检测卡检测粪便中的隐血进行检测。本实验选择便隐血(ob)试剂(匹拉米洞半定量检测法),进行粪便隐血的半定量检测,该检测卡可与粪便隐血发生显色反应,且颜色深浅与隐血含量呈正相关,隐血含量越高,显色越深,从而直观反映出被检测小鼠肠道炎症病情程度。
该检测方法采用原理是利用匹拉米洞当作呈色指示剂,在酸及h2o2的作用下,与血红蛋白反应,产生紫蓝→紫红的颜色。具体实验方法及判定为:
(1)将测试卡背面朝上,打开印有“developmentwindow”的封盖;
(2)取每只待测小鼠的新鲜粪便,迅速均匀涂抹在测试区域;
(3)向粪便样品上滴一滴显色剂a,待试剂完全渗透以后,再滴加一滴显色剂b;
(4)加入显色剂b后,于2min内判读完毕;
(5)检验结果的判定:
当加入显色剂b后,立即产生蓝紫色,报告为(4+);
当加入显色剂b后,10s内产生蓝紫色,报告为(3+);
当加入显色剂b后,1min内产生蓝紫色,报告为(2+);
当加入显色剂b后,1~2min内才逐渐产生紫红色,报告为(1+);
当加入显色剂b后,判读时间内无任何紫蓝或紫红的颜色反应,报告为(-)。
据此来进行判读并对阳性结果半定量。每天同一时间对每只小鼠的粪便进行隐血检测,并对数据进行分析比对,临床评分做参考(图2,图3)。
应用实施例3
每天对每只小鼠的生活状况进行观察,在pbs组小鼠平均体重降至最低点时,将所有组别的小鼠,进行乙醚麻醉后断颈处死,解剖取其肠道,进行肠道组织的病理学实验。具体操作方法如下:
取肛门端至盲肠部分,伸直后放置在倒扣的培养皿上,用pbs清洗掉肠道内残留的粪便、血液等杂质,用刀片纵向将肠道剖开,用双层滤纸(预先使用pbs充分浸湿)和载玻片夹紧,橡皮筋固定夹紧,并做好标记,浸泡在预先配置好的甲醛固定液中,室温保存,留待后续进行病理学组织切片实验时使用(图4)。
应用实施例4
疾病临床评分是临床上较为常用的用来表明病情严重程度的指标,它是结合机体的体重损失、粪便松散情况和便血情况进行综合计算得到的一个分数,用以表现不同组别之间病情的严重程度差异,每个指标对应的分数如表2所示,按照得到的分数进行临床评分,具体计算公式如公式2所示:
其中,scoreweight、scorestool、scoreblood分别指根据表1所示,由小鼠体重损失、粪便状态和便血判定结果的综合情况打出的分数。
表2疾病临床评分指标
- 还没有人留言评论。精彩留言会获得点赞!