一种电荷反转介导的可注射型胶体粒药物凝胶缓释植入剂及其制备方法与流程
本发明属纳米材料制备及生物医药领域,涉及一种电荷反转介导的可注射型胶体粒药物凝胶缓释植入剂及其制备方法
背景技术:
癌症严重损害人的身体健康,阻碍了社会的发展,已经成为了我国乃至世界均不容忽视的公共健康问题。临床上用于治疗肿瘤的常规方法包括手术疗法、放射疗法和化学疗法。虽然这些疗法在一定程度上能够有效地杀死肿瘤组织,但是每种疗法均存在着很多的缺点和局限性。光热治疗的方法是通过向体内注入具有较高光热转换效率的光热试剂,这些光热试剂通过靶向性识别技术富集在肿瘤组织周围,在外部光源的照射下,它能将吸收的光能转换成热量,在肿瘤区域产生高温,从而杀伤癌细胞。与传统的肿瘤治疗方法相比,光热治疗拥有对肿瘤特异性高、使用范围广、创伤小和对正常组织损伤小等优点。然而目前常用的纳米光热转换材料往往具有光热稳定性差、生物相容性差、在体内难以代谢掉等缺点。水凝胶由于其独特的物理化学性质,如独特的亲水保水与仿生特性、良好的生物相容性、特殊的流体动力学性质、以及多重的环境响应性,已被广泛应用于药物传递与组织修复工程,但在癌症治疗等领域的研究则相对较少。因此,利用亲水性胶体凝胶进行肿瘤的光热治疗及肿瘤术后的复发预防,具有良好的研发与应用前景。
肿瘤微环境在肿瘤增殖、侵袭和转移中发挥关键性作用,肿瘤微环境响应性纳米制剂的研究日益受到关注。研究发现,以基质金属蛋白酶(matrixmetalloproteinase,mmp)为代表的酶类在多种肿瘤微环境中高度表达,其底物可被设计应用于药物传递及成像系统,并显示出了对肿瘤微环境内mmp的高度响应。目前针对肿瘤微环境的主动靶向纳米制剂研究很多,但并没有上市的产品。以肿瘤微环境的高表达的酶为药物释放的引发剂在肿瘤成像和治疗方面已有一定的研究积累和成果。但主要问题是肿瘤微环境的酶在不同肿瘤类型和不同肿瘤部位甚至肿瘤的不同时期表达都不尽相同,这要求对肿瘤部位酶的水平有充分的了解。而解决了不同时间、部位肿瘤微环境内酶的表达水平,将有助于设计药物更精准得靶向和治疗肿瘤,以期实现纳米制剂对肿瘤的临床应用。另外,克服肿瘤部位胞外基质致密和高渗透压的特点实现纳米制剂的高渗透性,以及克服恶性肿瘤易产生耐药性的问题同样是实现纳米制剂临床应用的关键。
针对在癌症治疗中,传统的肿瘤治疗方法存在的机体侵入性,会伤害到体内正常的组织以及造成的其他副作用等问题,合理设计基于水凝胶的药物递送系统是实现药物精确缓释这一目的的有效途径,将水凝胶的药物负载性能和光热转换性能结合并应用于肿瘤的热化疗,将有助于解决肿瘤单一疗法面临的耐药、耐热性问题。其原理是高热处理后的肿瘤细胞一般对化疗药物的敏感程度提升,因此可以减少化疗药物的剂量;同时,热响应的水凝胶可调节化疗药物的释放速率,实现可控药物释放。当肿瘤组织温度上升到有效治疗温度,并维持一定时间,利用正常组织和肿瘤细胞对温度和药物耐受能力的差异,达到既能使肿瘤细胞凋亡、又不损伤正常组织的治疗目的。
技术实现要素:
本发明的目的是提供一种电荷反转介导的可注射型胶体粒药物凝胶缓释植入剂及其制备方法,从而解决传统临床实践中无法诊断和单一光热或化疗效果差带来的种种不便,用一种复合制剂同时实现诊断和治疗两种功能,同时解决传统单一治疗效果不佳的问题。
为达到上述目的,本发明采取如下技术方案:
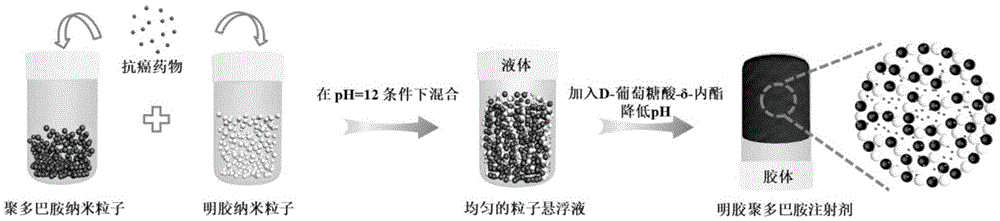
本发明首先公开了一种电荷反转介导的可注射型胶体粒药物凝胶缓释植入剂,其特点在于:是将带正电荷的明胶纳米粒子和带负电荷的聚多巴胺纳米粒子分别分散在碱性溶液中,然后混合获得ph大于明胶纳米粒子等电点的碱性混合悬浮液,使明胶纳米粒子转化为带负电荷,明胶纳米粒子和聚多巴胺纳米粒子同电荷相斥;然后向溶液中加入成酸剂,成酸剂在碱性条件下缓慢水解酸化,使碱性条件缓慢转化为中性或弱酸性条件,明胶纳米粒子重新转化为带正电荷,明胶纳米粒子和聚多巴胺纳米粒子异电荷相吸,利用相互的静电作用力,从而形成可注射型胶体粒药物凝胶缓释植入剂;
或者,在将明胶纳米粒子和聚多巴胺纳米粒子的碱性溶液混合之前,先吸附与纳米粒子异种电荷的药物,则形成包载药物的可注射型胶体粒药物凝胶缓释植入剂。
进一步地,所述明胶纳米粒子和所述聚多巴胺纳米粒子的直径在0.05~0.2μm。
进一步地,所述ph大于明胶纳米粒子等电点的条件为ph在9~12。
进一步地,所述中性或弱酸性条件是指ph在3~7。
进一步地,所述成酸剂为d-葡萄糖酸-δ-内酯、柠檬酸、乳酸、磷酸、酒石酸、苹果酸或富马酸,最优为d-葡萄糖酸-δ-内酯。d-葡萄糖酸-δ-内酯在碱性条件可以缓慢水解酸化为d-葡萄糖酸,可以使产物分散更均匀。且d-葡萄糖酸-δ-内酯可同时起到蛋白絮凝剂和乳化剂的作用,使产物的粘性和弹性更优。
进一步地,聚多巴胺纳米粒子和明胶纳米粒子的质量比为0.05~1:1。随着聚多巴胺纳米粒子含量的增加,所得植入剂的光热性能会提高。
本发明还公开了所述可注射型胶体粒药物凝胶缓释植入剂的制备方法,其特点在于:
将明胶纳米粒子和聚多巴胺纳米粒子分别分散在碱性溶液中,制成浓度为50~150mg/ml的悬浮液,然后按照聚多巴胺纳米粒子和明胶纳米粒子的质量比为0.05~1:1,将二者混合均匀,得ph在9~12的碱性混合悬浮液;向混合悬浮液中加入成酸剂,使ph降至3~7;根据明胶纳米粒子在等电点电荷反转的原理,通过加入成酸剂促使粒子由碱性条件下的带同种电荷相斥变为中性和弱酸性条件下的带异种电荷相吸,利用相互的静电作用力形成凝胶,获得可注射型胶体粒药物凝胶缓释植入剂;
或者,在将明胶纳米粒子和聚多巴胺纳米粒子的碱性溶液混合之前,先吸附与纳米粒子异种电荷的药物,则形成包载药物的可注射型胶体粒药物凝胶缓释植入剂。
本发明的明胶纳米粒子是利用明胶溶液在酸性ph条件下,在水与丙酮中溶解性不同的原理以及戊二醛交联法制得。
本发明的聚多巴胺纳米粒子是利用多巴胺单体在碱性条件下聚合的原理制得。
本发明所述可注射型胶体粒药物凝胶缓释植入剂可用于同时作为光热治疗剂和药物载体,通过t2加权核磁成像诊断并实现酸、热和/或酶响应性药物释放以及光热治疗的协同治疗,达到癌症诊疗一体化的目的。
本发明的热化疗治疗可以用在包括但不限于肿瘤、痤疮及各种炎症等一些病变组织和细胞上。本发明的植入剂可包载多种类型的药物,只要满足电荷要求。如明胶纳米粒子可包载带负电的药物,如双氯芬酸、羟基喜树碱;聚多巴胺纳米粒子可包载带正电的药物,如盐酸阿霉素、盐酸多柔比星。
本发明的植入剂是指将明胶和聚多巴胺制成了可植入体内的无菌胶体制剂。植入剂可采用特制的注射器植入,也可用手术切开植入。本发明的植入剂还包括以液体形式注射于体内、在生理条件下转变为胶体或半固体药物贮库的植入剂形式,即注射型原位形成植入剂。
本发明的可注射型胶体粒药物凝胶缓释植入剂,可先将明胶纳米粒子和聚多巴胺纳米粒子冷冻干燥,置于安剖瓶中,临用前再将其制成胶体。
与已有技术相比,本发明的有益效果体现在:
1、本发明电荷反转介导的可注射型胶体粒药物凝胶缓释植入剂具有很好的生物相容性。
2、本发明电荷反转介导的可注射型胶体粒药物凝胶缓释植入剂的制备条件简单而温和,储存运输也极其方便。
3、本发明电荷反转介导的可注射型胶体粒药物凝胶缓释植入剂具有良好的注射性能和自愈合性能,以及稳定的光热性能,非常有利于临床应用。
4、本发明电荷反转介导的可注射型胶体粒药物凝胶缓释植入剂具有多重响应性,可以在酸、热、酶等刺激作用下响应性释放药物。
5、本发明将t2加权核磁成像和热化疗过程合二为一,化繁为简,节省时间,增加效率。
附图说明
图1为一种电荷反转介导的可注射型胶体粒药物凝胶缓释植入剂的合成示意图。
图2为具体实施方式中得到的明胶纳米粒子、聚多巴胺纳米粒子在不同ph值条件下的zeta电位值。
图3为实施例1得到的明胶纳米粒子、聚多巴胺纳米粒子、电荷反转介导的可注射型胶体粒药物凝胶缓释植入剂的扫描电镜图。
图4为实施例1得到的电荷反转介导的可注射型胶体粒药物凝胶缓释植入剂具有可注射、自愈合性能的流体动力学表征图。
图5为实施例1得到的电荷反转介导的可注射型胶体粒药物凝胶缓释植入剂植入小鼠皮下后所得t2加权核磁成像图。
图6为实施例2得到的包载阿霉素的电荷反转介导的可注射型胶体粒药物凝胶缓释植入剂在不同激光功率条件下的热成像图片(a)与升温曲线(b)。
图7为实施例2得到的包载阿霉素的电荷反转介导的可注射型胶体粒药物凝胶缓释植入剂在明胶水解酶和胰蛋白酶作用下的明胶降解曲线(a)以及降解过程中的阿霉素累积释放曲线(b)。
图8为实施例2得到的包载阿霉素的电荷反转介导的可注射型胶体粒药物凝胶缓释植入剂在37℃,ph分别为5、6、7.4条件的阿霉素累积释放曲线。
图9为实施例2得到的包载阿霉素的电荷反转介导的可注射型胶体粒药物凝胶缓释植入剂在ph=7,温度分别为25、37、50℃条件下的阿霉素累积释放曲线。
图10为实施例2得到的包载阿霉素的电荷反转介导的可注射型胶体粒药物凝胶缓释植入剂在小鼠4t1肿瘤模型治疗中,利用热化疗协同杀伤的肿瘤体积抑制曲线。
具体实施方式
下面对本发明的实施例作详细说明,本实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实施例。
下述实施例所用明胶纳米粒子按如下步骤制得;
(1)称取50g的a型明胶加入到1l去离子水中,置于50℃中搅拌溶解。待其完全溶解后,向体系中加入1l的丙酮沉淀高分子量的明胶。沉淀2h后,去掉上清液,将其溶解在去离子水中后冻干备用。
(2)称取5g冻干的明胶粉末,加入100ml去离子水,40℃溶解半小时。然后加入稀盐酸调ph至2.5,接着以4ml/min的速度向体系中逐滴滴入300ml丙酮溶液以形成明胶纳米粒子。待其冷却至室温,向其中加入660μl浓度为25%的戊二醛溶液稳定明胶纳米粒子。交联16小时后,向其中加入400ml浓度为100mm的盐酸胍溶液用于去除未反应完全的戊二醛并使得明胶纳米粒子带有较高的正电。用8000rpm离心10min,水洗多次后,收集沉淀,得到稳定分散性良好的明胶纳米粒子。
下述实施例所用聚多巴胺纳米粒子按如下步骤制得;
将5ml浓度为28-30%的氨水溶液加入至40ml乙醇和90ml去离子水的混合溶液中搅拌30分钟。向体系中加入10ml浓度为50mg/ml的多巴胺单体溶液,室温聚合24h后离心洗涤得到单分散的聚多巴胺纳米粒子。
实施例1:制备一种电荷反转介导的可注射型胶体粒药物凝胶缓释植入剂
配制ph=12、浓度为100mg/ml的明胶纳米粒子和聚多巴胺纳米粒子的悬浮液,按聚多巴胺纳米粒子悬浮液与明胶纳米粒子悬浮液1:4的体积比,将二者混合均匀。然后向其中加入研磨好的d-葡萄糖酸-δ-内酯,使其浓度为50mg/ml,室温条件下酸化絮凝1h,此时ph降为6~7,即得到一种电荷反转介导的可注射型胶体粒药物凝胶缓释植入剂。
利用tadiscoverydhr-3型旋转流变仪对可注射型胶体粒药物凝胶缓释植入剂(1ml)进行可注射性能与自愈合性能评价:测试温度为25℃,测试间隙为1000μm。将1ml样品在时间扫描模式下以1%的压力下测试5分钟,然后在1000%压力下测试3分钟,最后再恢复到1%的压力下测试5分钟,即得到该植入剂储能模量与损耗模量的变化图。由图4可以看出,该植入剂在较高压力下储能模量与损耗模量实现反转,植入剂由胶体变为液体,在恢复1%的压力后又转变为胶体,回复的储能模量高达80%,证明该植入剂具有较好的可注射与自愈合能力。
利用西门子核磁共振仪进行小鼠t2加权核磁成像。如图5所示,由于凝胶中含有大量的水分,该植入剂可清晰呈现患处t2加权核磁图像,且患处周围并没有植入剂的扩散或堆积,表现出良好的生物相容性。
实施例2:制备一种包载阿霉素的电荷反转介导的可注射型胶体粒药物凝胶缓释植入剂配制ph=12、浓度为100mg/ml的明胶纳米粒子和聚多巴胺纳米粒子的悬浮液。向200μl聚多巴胺纳米粒子悬浮液中加入120μg阿霉素,室温搅拌30分钟。然后按聚多巴胺纳米粒子悬浮液与明胶纳米粒子悬浮液1:4的体积比,将二者混合均匀。再向其中加入研磨好的d-葡萄糖酸-δ-内酯,使其浓度为50mg/ml,室温条件下酸化絮凝1h,此时ph降为6~7,即得到一种包载阿霉素的电荷反转介导的可注射型胶体粒药物凝胶缓释植入剂。
利用mdl-iii-808-2激光器和fluketi400ir型热成像仪对本实施例包载阿霉素的可注射型胶体粒药物凝胶缓释植入剂(1ml)进行光热性能评价,同时以含相同明胶量的明胶凝胶作为对比。由图6可以看出,该植入剂具有良好的光热转化能力,并呈现出功率响应性。
图7为本实施例包载阿霉素的可注射型胶体粒药物凝胶缓释植入剂在体外模拟降解以及阿霉素累积释放曲线。其具体表征方式为:将1ml载有120μg阿霉素的植入剂放置于透析袋,并浸入30ml磷酸盐缓冲液中,在1.5天后加入400ng/ml的明胶水解酶和胰酶,每隔一段时间取3ml溶液用于检测,并补充3ml新鲜的磷酸盐缓冲液。如图7所示,包载阿霉素的可注射型胶体粒药物凝胶缓释植入剂在酶的作用下明显降解,且伴随着大量阿霉素的释放,表现出极好的酶响应药物释放性能。
图8为包载阿霉素的可注射型胶体粒药物凝胶缓释植入剂在ph值为5、6、7.4条件下阿霉素累积释放曲线。其具体表征方式为:将1ml载有120μg阿霉素的植入剂放置于透析袋,并浸入ph值分别为5、6、7.4的30ml磷酸盐缓冲液中,每隔一段时间取3ml溶液用于检测,并补充3ml对应ph值的磷酸盐缓冲液。如图8所示,包载阿霉素的可注射型胶体粒药物凝胶缓释植入剂在较低ph条件下表现出更好的阿霉素释放效果,显示出极好的酸响应药物释放性能。
图9为包载阿霉素的可注射型胶体粒药物凝胶缓释植入剂在温度值为25、37、50℃条件下阿霉素累积释放曲线。其具体表征方式为:将1ml载有120μg阿霉素的植入剂放置于透析袋,并浸入保温在25、37、50℃的磷酸盐缓冲液中,每隔一段时间取3ml溶液用于检测,并补充3ml对应温度值的磷酸盐缓冲液。如图9所示,植入剂在较高温度条件下表现出更好的阿霉素释放效果,显示出极好的热响应药物释放性能。
图10为包载阿霉素的可注射型胶体粒药物凝胶缓释植入剂在小鼠4t1肿瘤模型治疗中,利用热化疗协同杀伤的肿瘤体积抑制曲线。其具体表征方式为:将40只4t1模型肿瘤鼠分为5个实验组,即磷酸盐缓冲液注射组、未载药的可注射型胶体粒药物凝胶缓释植入剂组、载阿霉素的可注射型胶体粒药物凝胶缓释植入剂组、未载药的可注射型胶体粒药物凝胶缓释植入剂+激光组和载阿霉素的可注射型胶体粒药物凝胶缓释植入剂+激光组。然后对每组小鼠给与名称所对应的注射和激光照射处理,其中注射剂量为50μl(阿霉素含量为120μg/ml),激光照射为10min,激光功率为0.5w/cm2,注射处理后,用游标卡尺量取在不同天数(0,2,4,6,8,10,12,14)各组中老鼠肿瘤的体积。如图10所示,从肿瘤体积变化可以看出(图中v是测试时的肿瘤体积,v0是处理前所有小鼠的平均肿瘤初始体积),载药的可注射型胶体粒药物凝胶缓释植入剂+激光组小鼠肿瘤体积明显减小并消失,表现出极好的协同杀伤效果,体现了包载阿霉素的植入剂较强的热化疗能力。
- 还没有人留言评论。精彩留言会获得点赞!