一种miR-451a反义链抑制剂及其应用的制作方法
本发明属于生物医学技术领域,具体涉及一种mir-451a反义链抑制剂及其应用。
背景技术:
酒精性脂肪肝在西方国家是常见的肝脏疾病,属于酒精性肝病(alcoholicliverdisease,ald)中的一个分型。近年我国酒精性肝病发病率呈明显上升趋势,且常常合并肝炎病毒感染,给人们健康造成严重危害。目前,其发病机制尚未明确,仍缺乏有效的治疗手段。
肝脏是乙醇代谢的主要场所。机体摄入的酒精约90%经肝脏进行代谢。酒精在肝内主要经三种酶系统代谢:乙醇脱氢酶体系(adh)、微粒体乙醇氧化系统(meos)和过氧化物酶体中的过氧化物酶。酒精可抑制adh活性。酒精的氧化使nad+转变为nadh,从而使nad+/nadh比值下降,这促使一些以nad+为辅酶的反应受阻,影响代谢。另外进入线粒体的nadh增多,可抑制三羧酸循环(tca)和脂肪酸的β-氧化,从而使肝内脂肪酸蓄积;nadh还可促进α-磷酸甘油的生成,使脂肪合成酶活性亢进,这些可促进肝脂肪的形成。有研究表明,乙醇的摄入可直接或者间接地提高脂代谢相关的转录因子并抑制了脂肪酸的β氧化。乙醇还可抑制细胞核激素受体ppar-α,影响游离脂肪酸的氧化和转运。此外,酒精还可以通过抑制腺苷酸活化蛋白激酶(ampk)途径来提高肝脏中脂肪累积。you等报道[youm,fischerm,deegma,crabbdw.ethanolinducesfattyacidsynthesispathwaysbyactivationofsterolregulatoryelement-bindingprotein(srebp).journalofbiologicalchemistry,2002,277(32):29342-29347.]乙醇可以直接活化肝细胞中固醇调节元件结合蛋白-1c(srebp-1c),上调脂肪生成相关基因的活力,促使脂肪的大量生成。尽管ald的发病机制有多种理论和假说,但其发生发展的机制仍有许多未知的环节。
近些年,小分子rna在ald中的作用越来越受到关注。微小rna(micrornas,mirnas)是一类长约21个核苷酸的内源性非蛋白质编码的小分子rna,它通过对目标mrna的剪切和翻译抑制,发挥对基因表达的转录后调控作用,具有重要生物学功能。研究发现:ald肝组织存在mirnas的失调,并且不同的mirnas通过不同的机制参与ald的发病机制。肝脏中mir-122参与调控胆固醇和脂类代谢的各种基因,与肝脏脂质代谢相关。在酒精喂养的小鼠模型中,mir-217会促进酒精性脂肪肝的形成,并且调节sirt1-lipin1信号通路在酒精性肝炎中发挥重要作用。以上研究结果说明mirna在ald的发生发展中具有重要的作用,但目前mir-451a在酒精性肝病中的作用及机制尚未见报道。
技术实现要素:
本发明的目的是提供一种可以保护肝功能和减轻酒精性脂肪肝病的mir-451a反义链抑制剂及其应用。
本发明的第一个目的是提供一种mir-451a反义链抑制剂,其为seqidno.2所示的核苷酸序列或者在seqidno.2所示的核苷酸序列的5'端和/或3'端添加有修饰序列的核苷酸序列。
所述的在seqidno.2所示的核苷酸序列的5'端和/或3'端添加有修饰序列的核苷酸序列,其核苷酸序列如seqidno.3所示。
本发明的第二个目的是提供mir-451a的抑制剂在制备预防或治疗酒精性脂肪肝病药物或保健品中的应用,所述的mir-451a的核苷酸序列如seqidno.1所示。
所述的mir-451a的抑制剂为mir-451a反义链抑制剂,其为上述mir-451a反义链抑制剂。
本发明的第三个目的是提供一种预防或治疗酒精性脂肪肝病药物或保健品,其特征在于,含有mir-451a的抑制剂作为活性成分,所述的mir-451a的核苷酸序列如seqidno.1所示。
本发明的有益效果为:本发明通过建立小鼠酒精性肝病模型,对酒精性肝病小鼠肝组织和正常对照肝组织进行小分子rna深度测序,通过分析差异表达的小分子rna,筛选得到mir-451a,并利用qrt-pcr进行验证。通过甲基化和胆固醇修饰以及在两端添加修饰序列,化学合成mir-451a反义链抑制剂,进行小鼠体内实验,结果表明mir-451a反义链抑制剂有效地降低酒精性脂肪肝病小鼠血清中的谷丙转氨酶(alt)和谷草转氨酶(ast),同时明显降低肝脏中脂肪累积,说明mir-451a反义链抑制剂可以保护肝功能和减轻酒精性脂肪肝病。人体中mir-451a序列与小鼠是相同的,因此,mir-451a反义链抑制剂有望开发成为一种新的治疗酒精性脂肪肝病的小分子rna药物。
附图说明
图1是酒精性肝病小鼠和对照组小鼠血清中alt和ast的含量检测结果,其中,etoh-fed为酒精喂养实验组,pair-fed为对照饲料喂养组。
图2是酒精性肝病小鼠和对照组小鼠的肝组织脂肪变性和甘油三酯(tg)含量检测结果,其中,a为小鼠肝脏组织进行he染色,b为小鼠肝组织进行油红o染色,c为小鼠血清和肝组织中甘油三酯含量的检测结果,etoh-fed为酒精喂养实验组,pair-fed为对照饲料喂养组。
图3是实时定量pcr检测mir-451a在酒精性肝病小鼠和对照组小鼠的肝组织中表达水平,etoh-fed为酒精喂养实验组,pair-fed为对照饲料喂养组。
图4是mir-451a反义链抑制剂对酒精性肝病小鼠血清中alt和ast的含量影响结果,其中,etoh-fed+control为注射对照rna并进行酒精饲料喂养对照组,etoh-fed+inhibitor为注射mir-451a反义链抑制剂并进行酒精饲料喂养实验组。
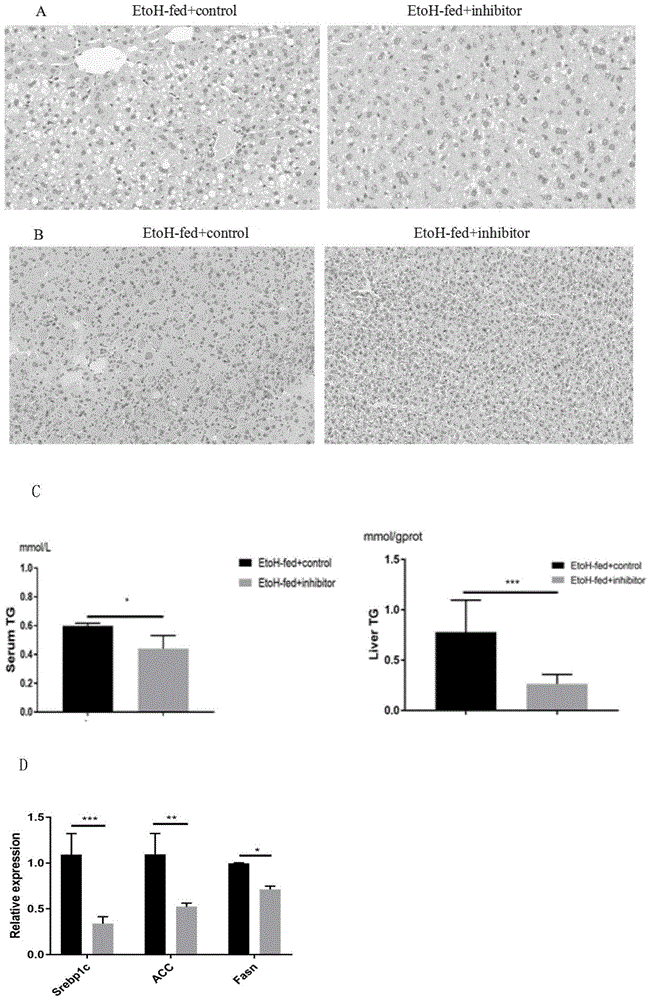
图5是mir-451a反义链抑制剂对小鼠酒精性脂肪肝组织中的脂肪累积的影响,其中,a为小鼠肝脏组织进行he染色,b为小鼠肝组织进行油红o染色,c为小鼠血清和肝组织中甘油三酯含量的检测结果,d为qrt-pcr检测小鼠肝组织中脂肪合成酶(srebp1c、acc、fasn)的相对表达量,etoh-fed+control为注射对照rna并进行酒精饲料喂养对照组,etoh-fed+inhibitor为注射mir-451a反义链抑制剂并进行酒精饲料喂养实验组。
具体实施方式
以下实施例是对本发明的进一步说明,而不是对本发明的限制。
实施例1
1.小鼠酒精性肝病(ald)模型的制备及肝功能指标检测
(1)参照niaaa法。选取12只雌性野生型c57bl/6,约8周龄,小鼠随机分成两组。实验组小鼠(etoh-fed)以lieber-decarli液体饲料适应喂养5天,含5%酒精的lieber-decarli液体饲料喂养10天。麻醉处死前9小时加一次灌胃(31.5%乙醇,20μl/g小鼠)。对照组小鼠(pair-fed)饲喂不含酒精的lieber-decarli液体饲料,麻醉处死前9小时加一次灌胃(45%的糊精,20μl/g小鼠)。整个过程包括液体饲料适应期(5天)、造模期(10天)、灌胃(1次)及取标本。
(2)取小鼠静脉血,分离获得血清,通过全自动生化仪检测肝功能生化指标ast和alt的含量,结果见图1。由图1可知,相较于对照料喂养小鼠(pair-fed),酒精饲料喂养的小鼠(etoh-fed)血清中的alt和ast含量均显著升高。
(3)麻醉处死小鼠,取肝脏组织并进行冰冻切片,用油红o染色,检测脂肪变性,以及将肝脏组织进行福尔马林固定后,石蜡包埋,切片,进行he染色,观察检测肝组织形态学,结果见图2。由图2a的小鼠肝脏组织he染色,可以看出经酒精饲料喂养的小鼠(etoh-fed)肝脏有明显的脂肪空泡,肝脏脂质淤积明显,而对照料喂养小鼠(pair-fed)的肝组织中无脂肪空泡,肝细胞形态完整。由图2b的小鼠肝组织油红o染色,可以进一步确认经酒精饲料喂养的小鼠(etoh-fed)肝脏有大片脂滴沉积,而对照料喂养小鼠(pair-fed)的肝组织几乎没有。
并对小鼠血清和肝组织中的甘油三酯(tg)含量进行检测,结果见图2c。由图2c可知,相较于对照料喂养小鼠(pair-fed),酒精喂养实验组小鼠(etoh-fed)血清和肝组织中的tg水平均显著升高。
2.小鼠肝组织中的小分子rna深度测序
分别取酒精性肝病模型小鼠(etoh-fed)和对照料喂养小鼠(pair-fed)的肝组织进行小分子rna深度测序(序列长度为18-40nt)。对测序结果进行生物信息学分析,筛选在酒精性肝病中特异表达的小分子rna。经过分析,发现与对照料喂养小鼠(pair-fed)比较,酒精性肝病模型小鼠(etoh-fed)的肝组织中mir-451a表达异常升高,mir-451a的核苷酸序列为aaaccguuaccauuacugaguu(seqidno.1)。
3.mir-451a在酒精性肝病小鼠和对照组小鼠的肝组织中的表达水平
分别取酒精性肝病模型小鼠(etoh-fed)和对照料喂养小鼠(pair-fed)的肝组织0.1g,提取总rna,反转录后定量rt-pcr检测,验证肝组织中mir-451a的表达水平,结果见图3。由图3可知,经酒精饲料喂养的野生型c57小鼠(etoh-fed)肝脏组织中mir-451a的表达量明显高于对照料喂养小鼠(pair-fed),表达量几乎是对照的10倍左右。
4.mir-451a反义链抑制剂对酒精性肝病小鼠的肝功能及脂代谢的影响
(1)化学合成随机对照序列rna(control)和mir-451a反义链抑制剂(mir-451a-in),mir-451a反义链抑制剂的核苷酸序列为:guaaaacucaguaaugguaacgguuuacaa(如seqidno.3所示,下划线为修饰序列,未下划线的序列,即aacucaguaaugguaacgguuu,如seqidno.2所示),并经过甲基化和胆固醇修饰。把合成的mir-451a反义链抑制剂及对照rna分别腹腔注射到酒精液体饲料喂养的小鼠体内,从酒精液体饲料喂养开始,每2天腹腔注射一次,每次注射量为20nmol/只,共注射6次;麻醉处死前9小时加一次灌胃(31.5%乙醇,20μl/g小鼠)。取小鼠静脉血,分离获得血清,通过全自动生化仪检测肝功能生化指标ast和alt的含量,结果见图4。由图4可知,酒精饮食的mir-451a-in组小鼠(etoh-fed+inhibitor)相对于酒精饮食的control组小鼠(etoh-fed+control)血清中的alt和ast含量均明显下降,以上结果表明抑制mir-451a对小鼠酒精性肝病的肝损伤有保护作用。
(2)麻醉处死小鼠后,取肝脏组织进行10%福尔马林固定,石蜡包埋制备蜡块,切片,用he染色,观察检测肝组织形态学,结果见图5a;取肝脏组织并进行冰冻切片,用油红o染色,检测脂肪变性,结果见图5b;检测小鼠血清和肝组织中甘油三酯(tg)含量,结果见图5c;取肝脏组织提取总rna,进行qrt-pcr检测参与脂肪合成的相关酶srebp1c、acc、fasn的相对表达量,结果见图5d。由图5a可知,腹腔注射mir-451a抑制剂的酒精饲料喂养组小鼠(etoh-fed+inhibitor)比对照组小鼠(etoh-fed+control)的肝脏脂肪滴明显变小而且数量也明显减少,表明mir-451a反义链抑制剂可以降低肝脏中的脂肪积累。由图5b可知,相较于etoh-fed+control组小鼠,etoh-fed+inhibitor组小鼠的肝组织中脂滴累积变少,脂滴大小变小。由图5c可知,当抑制了小鼠体内mir-451a后,酒精饮食组小鼠的血清和肝组织中的tg含量也明显降低。由图5d可知,相较于etoh-fed+control组小鼠,etoh-fed+inhibitor组小鼠的脂肪合成酶srebp1c、acc、fasn的相对表达量明显降低,尤其是srebp1c、acc的相对表达量的降低具有显著性差异。
以上仅是本发明的优选实施方式,应当指出的是,上述优选实施方式不应视为对本发明的限制,本发明的保护范围应当以权利要求所限定的范围为准。对于本技术领域的普通技术人员来说,在不脱离本发明的精神和范围内,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
序列表
<110>广西医科大学第一附属医院
<120>一种mir-451a反义链抑制剂及其应用
<160>3
<170>siposequencelisting1.0
<210>1
<211>22
<212>rna
<213>人工序列(artificialsequence)
<400>1
aaaccguuaccauuacugaguu22
<210>2
<211>22
<212>rna
<213>人工序列(artificialsequence)
<400>2
aacucaguaaugguaacgguuu22
<210>3
<211>30
<212>rna
<213>人工序列(artificialsequence)
<400>3
guaaaacucaguaaugguaacgguuuacaa30
- 还没有人留言评论。精彩留言会获得点赞!