包含嘧啶和/或嘌呤衍生物和B族维生素的多层药物或营养固体剂型及其制备和用途的制作方法
包含嘧啶和/或嘌呤衍生物和b族维生素的多层药物或营养固体剂型及其制备和用途
1.本技术要求2019年5月6日提交的欧洲专利申请ep19382340.8的权益。
技术领域
2.本发明涉及包含至少一种嘧啶衍生物、嘌呤衍生物或其任何盐或溶剂化物和至少一种b族维生素的多层药物或营养固体剂型,其有利地提供高的嘧啶和/或嘌呤衍生物量,同时确保所述固体剂型对湿度和/或酸性条件增强的化学稳定性。本发明还提供了用于生产所述多层药物或营养固体剂型的方法。
3.此外,本发明还涉及所述多层药物或营养固体剂型,特别是用于治疗和/或预防周围神经病变的治疗用途。
背景技术:
4.神经性疼痛是由中枢或周围神经系统的原发性病变或损伤引起的。具体而言,周围神经系统(pns)损伤牵涉轴突损害,因此不仅必须消除损害才能完全恢复,还需要恢复结构和功能。然而,与中枢神经系统(cns)轴突不同,pns的轴突不能自发再生(huebner,e.a.;st rittmatter,s.m.cell biology of the axon 2009;springer berlin hei delberg;305
‑
60)。
5.关于后者,已知与人体其它区域的细胞修复不同,周围神经损伤不牵涉有丝分裂和细胞增殖(burnett,m.g.;zager,e.l.neurosurg.focus 2004;16(5):e1)。此外,分子生物学进展证明周围神经对损伤的反应超出了损害部位并且实际上牵涉脊髓和神经节中的神经细胞。因此,受损的周围神经试图通过使未受损的途径加强和重新编程来补偿丧失的功能(burnett,m.g.;zager,e.l.neurosurg.focus 2004;16(5):e1),但是实际的完全恢复机制仍然未知。
6.嘧啶和/或嘌呤衍生物,尤其是嘧啶和/或嘌呤核苷和核苷酸是已知的核酸前体,它们与膜受体相互作用并激活许多细胞内信号途径。更具体地,本领域已知嘧啶核苷酸除了作为dna组分和参与基因组转录和翻译,还在细胞代谢中发挥多种基本作用,包括用于化学键合的能量转移、神经传递和来自中间代谢的生物化学自由基的转移。
7.具体而言,胞苷和尿苷对于糖脂、磷脂和糖蛋白的合成是必需的,糖脂、磷脂和糖蛋白是神经膜的已知成分。已证实它们在膜合成、转录、翻译、细胞分裂和周围神经再生等几个过程中发挥着重要作用。
8.已证实尿苷衍生物,尤其是尿苷核苷酸,在伤口愈合过程中以及在生长因子的激活和调节中发挥重要的共同刺激作用,这证实了核苷酸在组织再生过程中的首要重要性。
9.还已证明胞苷衍生物,尤其是胞苷核苷酸,对各种中枢神经系统病理以及神经退行性疾病的治疗有益。
10.然而,已知周围神经系统轴突不能合成修复损害所需的核苷酸,特别是嘧啶核苷酸。由于这个原因,在pns损害后施用外源性核苷酸变得对结构和功能恢复至关重要。
11.自1972年将5'
‑
三磷酸腺苷(atp)鉴定为豚鼠结肠带中的非肾上腺素能、非胆碱能抑制性神经中的递质后提出了嘌呤能神经传递以来,嘌呤核苷酸在周围和中枢神经系统中的重要作用也受到越来越多的关注(burnstock g.pharmacol rev.1972,24,509
–
581)。腺苷及其磷酸化核苷酸在神经系统中充当神经递质或营养剂,鸟苷及其核苷酸也存在类似作用。
12.另一方面,已经证实b族维生素复合物,尤其是维生素b1、维生素b6和维生素b
12
在维持正常神经功能的许多生物途径中发挥关键作用(corinne,g.;mizisin,l.m.;austin,n.b.eur.j.pharmacol.2009;612;41
–
47)。事实上,某些b族维生素的缺乏与大量神经病变密切相关,因此在诊断出患有这些病状的患者中补充这些维生素变得越来越重要。
13.举例来说,生物化学证据表明,补充高剂量的甲钴胺可以上调基因转录并由此上调蛋白质合成,从而有助于增强周围神经再生(watanabe;t.e.j neurol sci.1994;12;140
–
143)。
14.同样,由于几种b6维生素相关的神经病变的严重程度,这种维生素的膳食摄入变得至关重要,这是由于它在吸收后会转化为磷酸吡哆醛(吡哆醇的活性形式),这是许多代谢反应中的重要辅因子,并且也因为人类无法合成磷酸吡哆醛。这种维生素的缺乏显示感觉神经动作电位(snap)严重降低并且可能导致小的和大的有髓纤维的轴索变性。
15.还已知维生素b1是对pns健康的重要贡献者,因为它参与神经递质乙酰胆碱的合成。硫胺素也促进神经冲动通过周围神经的传导,并且被认为有助于髓磷脂产生。
16.存在许多目前可用的包含核苷酸和维生素混合物的配制品,旨在治疗神经痛,所有这些配制品都牵涉核苷酸和维生素的直接混合物。然而,发明人已经发现嘧啶和/或嘌呤衍生物,尤其是核苷酸和核苷成分(通常包括大量的水)由于它们与维生素b1、b6和b
12
密切接触,所以会引起它们降解。还已发现酸性条件对维生素稳定性有负面影响。就这一点而言,令人惊讶地发现包含嘧啶和/或嘌呤衍生物或其任何盐或溶剂化物,尤其是核苷酸或核苷或其任何盐或溶剂化物,以及b族维生素的组合物的稳定性用本发明得以增强。
17.目前市场上销售的配制品包括许多防腐剂,即使在那些情况下,它们也需要低于25℃的严格储存条件,并且还牵涉在它们的包装中使用干燥剂材料,例如带有硅胶干燥剂的hdpe瓶。
18.发明人已经意识到,当嘧啶和/或嘌呤衍生物,尤其是嘧啶和/或嘌呤核苷酸或核苷的量增加时,稳定性问题尤其具有限制性。事实上,现有配制品仅包含减少量的核苷酸,这是在神经损伤恢复方面实现最大结果的显著限制,因为需要更高量的嘧啶和/或嘌呤衍生物,更特别是嘧啶和/或嘌呤核苷酸或核苷。
19.因此,本领域越来越需要找到一种新的技术解决方案,可以克服上述与湿度和/或酸性条件相关的稳定性问题,并且也提供嘧啶和/或嘌呤衍生物或其任何盐或溶剂化物,还包含b族维生素的新的高剂量剂型,该剂型可以更有效的方式处理周围神经病变,尤其是新的高剂量核苷酸和b族维生素剂型。
技术实现要素:
20.在第一方面,本发明提供了一种用于口服施用的多层药物或营养固体剂型,其包含:
21.‑
第一层,所述第一层包含至少一种嘧啶衍生物、嘌呤衍生物或其任何盐或溶剂化物;和
22.‑
第二层,所述第二层包含选自b族微生素的至少一种维生素。
23.在第二、第三和第四方面,本发明提供了用于生产根据本发明第一方面的多层药物或营养固体剂型,尤其是根据本发明第一方面的双层或三层药物或营养固体剂型的三种方法。
24.根据本发明的第五方面,提供了根据本发明第一方面的多层药物或营养固体剂型,其可通过根据本发明第二方面的工艺获得。
25.在本发明的第六方面,提供了根据本发明第一方面的多层药物或营养固体剂型,其可通过根据本发明第三方面的工艺获得。
26.在本发明的第七方面,提供了根据本发明第一方面的多层药物或营养固体剂型,其可通过根据本发明第四方面的工艺获得。
27.在本发明的第八方面,提供了根据本发明第一方面的多层药物或营养固体剂型,分别用于制造用于治疗和/或预防周围神经病变的药剂或营养产品。
28.根据第九方面,提供了用于治疗和/或预防周围神经病变的多层药物或营养固体剂型。
29.在本发明的第十方面,提供了根据本发明第一方面的多层营养固体剂型在治疗和/或预防周围神经病变中的用途。
具体实施方式
30.本发明涉及用于口服施用的多层药物或营养固体剂型,其包含至少一种嘧啶衍生物、嘌呤衍生物或其任何盐或溶剂化物,和至少一种b族维生素,尤其是至少一种嘧啶衍生物和至少一种b族维生素,其有利地提供对湿度和/或酸性条件增强的化学稳定性,尤其是b族维生素对湿度和/或酸性条件增强的化学稳定性。因此,本文提供的固体剂型需要较少的防腐剂或不需要防腐剂,同时与已经存在的配制品相比,在温度、相对湿度和包装条件方面需要的储存条件限制较少。
31.如本文所用,表述“酸性条件”可以指存在一定量的酸形式的化合物,诸如酸形式的嘧啶或嘌呤衍生物(例如酸形式的ump或cmp)。
32.如本文所用,表述“营养固体剂型”应理解为意指该配制品提供整体健康益处或触发生理反应。此类配制品也可以称为膳食补充剂,也称为食物补充剂或营养补充剂,并且通常旨在进一步支持饮食并提供在人的饮食中可能缺失或者可能无法以足够量消耗的营养素。
33.在第一方面,本发明提供了一种用于口服施用的多层药物或营养固体剂型,其包含:
34.‑
第一层,所述第一层包含至少一种嘧啶衍生物、嘌呤衍生物或其任何盐或溶剂化物;和
35.‑
第二层,所述第二层包含选自b族微生素的至少一种维生素。
36.本发明的嘧啶衍生物包括但不限于尿苷、尿苷酯、磷酸尿苷、胞苷、胞苷酯、磷酸胞苷、胸苷、胸苷酯和磷酸胸苷。本发明的嘌呤衍生物包括但不限于腺苷、腺苷酯、磷酸腺苷、
鸟苷、鸟苷酯、磷酸鸟苷、肌苷(次黄嘌呤核苷)、肌苷酯、磷酸肌苷、黄苷、黄苷酯和磷酸黄苷。
37.磷酸嘧啶衍生物(例如磷酸尿苷、磷酸胞苷、磷酸胸苷)和磷酸嘌呤衍生物(例如磷酸腺苷、磷酸鸟苷、磷酸肌苷和磷酸黄苷)在本领域中也称为核苷酸并且由至少三个亚基组成,即,通常为核糖的五碳糖部分、通常为嘌呤或嘧啶的含氮碱基和至少一个磷酸基团。关于后者,核苷酸可以是单磷酸、二磷酸或三磷酸核苷酸,这取决于分子中存在的磷酸基团的数目。
38.磷酸尿苷的具体实例包括但不限于单磷酸尿苷,尤其是5'
‑
单磷酸尿苷(ump);二磷酸尿苷(udp)和三磷酸尿苷(utp)。磷酸胞苷的具体实例包括但不限于单磷酸胞苷,尤其是5'
‑
单磷酸胞苷(cmp);二磷酸胞苷(cdp)和三磷酸胞苷(ctp)。磷酸胸苷的具体实例包括但不限于单磷酸胸苷,尤其是5'
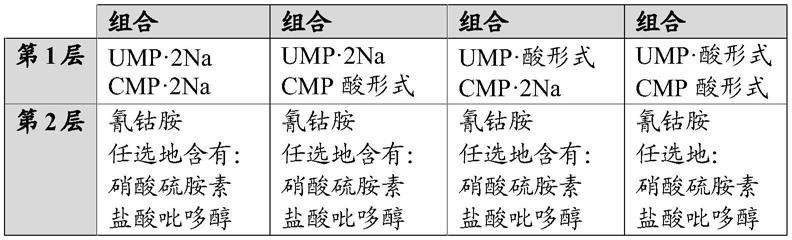
‑
单磷酸胸苷(tmp);二磷酸胸苷(tdp)和三磷酸胸苷(ttp)。本发明的磷酸嘌呤衍生物的实例包括但不限于5'
‑
单磷酸腺苷(amp);二磷酸腺苷(adp);三磷酸腺苷(atp);5'
‑
单磷酸鸟苷(gmp);二磷酸鸟苷(gdp);三磷酸鸟苷(gtp);5'
‑
单磷酸肌苷(imp);二磷酸肌苷(idp);三磷酸肌苷(itp);5'
‑
单磷酸黄苷(xmp);二磷酸黄苷(xdp)和三磷酸黄苷(xtp)。
39.另一方面,嘧啶和嘌呤衍生物尿苷、胞苷、胸苷、腺苷、鸟苷、肌苷和黄苷在本领域中称为核苷,并且由至少两个亚基组成,即通常是核糖的五碳糖部分和通常是嘌呤或嘧啶的含氮碱基。
40.根据一个优选的实施方案,所述至少一种嘧啶衍生物、嘌呤衍生物或其任何盐或溶剂化物选自尿苷、尿苷酯、磷酸尿苷、胞苷、胞苷酯、磷酸胞苷、胸苷、胸苷酯、磷酸胸苷、腺苷、腺苷酯、磷酸腺苷、鸟苷、鸟苷酯、磷酸鸟苷、肌苷、肌苷酯、磷酸肌苷、黄苷、黄苷酯、磷酸黄苷及其任何盐或溶剂化物。更优选地,所述至少一种嘧啶衍生物、嘌呤衍生物或其任何盐或溶剂化物选自尿苷、磷酸尿苷、胞苷、磷酸胞苷、胸苷、磷酸胸苷、腺苷、磷酸腺苷、鸟苷、磷酸鸟苷、肌苷、磷酸肌苷、黄苷、磷酸黄苷及其任何盐或溶剂化物。还更优选地,所述至少一种嘧啶衍生物、嘌呤衍生物或其盐或溶剂化物选自尿苷、磷酸尿苷、胞苷、磷酸胞苷、胸苷、磷酸胸苷、腺苷、磷酸腺苷、鸟苷、磷酸鸟苷及其任何盐或溶剂化物。还甚至更优选地,所述至少一种嘧啶衍生物、嘌呤衍生物或其盐或溶剂化物选自尿苷、磷酸尿苷、胞苷、磷酸胞苷、胸苷、磷酸胸苷、腺苷、磷酸腺苷及其任何盐或溶剂化物。
41.合适的嘧啶衍生物盐或嘌呤衍生物盐的实例包括但不限于碱金属盐(例如钠盐或钾盐);碱土金属盐(例如钙盐、镁盐或钡盐);碱性氨基酸盐(例如精氨酸盐或赖氨酸盐);铵盐(例如铵盐或三环己基铵盐);链烷醇胺盐(例如单乙醇胺盐、二乙醇胺盐、三乙醇胺盐、单异丙醇胺盐、二异丙醇胺盐或三异丙醇胺盐)或其任何混合物。
42.在另一个优选实施方案中,本发明提供了一种用于口服施用的多层药物或营养固体剂型,其包含:
43.‑
第一层,所述第一层包含至少一种嘧啶衍生物或其任何盐或溶剂化物;和
44.‑
第二层,所述第二层包含选自b族微生素的至少一种维生素。
45.在一个优选的实施方案中,所述至少一种嘧啶衍生物选自尿苷、尿苷酯、磷酸尿苷、胞苷、胞苷酯和磷酸胞苷。更优选地,所述至少一种嘧啶衍生物选自尿苷、磷酸尿苷、胞苷和磷酸胞苷。
46.在一个优选的实施方案中,本发明的多层药物或营养固体剂型的第二层中存在的所述至少一种维生素选自维生素b1、b6和b
12
。优选地,本发明的多层药物或营养固体剂型的第二层包含维生素b
12
;更优选地,本发明的多层药物或营养固体剂型的第二层包含选自维生素b1、b6和b
12
的至少两种维生素。在另一个优选的实施方案中,本发明的多层药物或营养固体剂型的第二层包含维生素b1和维生素b
12
。还更优选地,本发明的多层药物或营养固体剂型的第二层包含维生素b1、b6和b
12
。
47.维生素b1,也称为硫胺素,可以任何合适的形式包含在本发明的配制品中,诸如盐酸硫胺素、硝酸硫胺素、焦磷酸硫胺素或二水合硫胺素单磷酸氯化物。优选地,它作为盐酸硫胺素或硝酸硫胺素存在。更优选地,维生素b1作为硝酸硫胺素存在。
48.类似地,维生素b6可以任何合适的形式包含在本发明的固体剂型中,诸如盐酸吡哆醇或吡哆醇活性形式,即磷酸吡哆醛。
49.至于维生素b
12
,它也可以本领域已知的任何合适的形式包含在本发明的固体剂型中,诸如氰钴胺、羟钴胺或甲钴胺。优选地,维生素b
12
为氰钴胺或羟钴胺;更优选地,维生素b
12
为氰钴胺。
50.在本发明的多层药物或营养固体剂型的优选实施方案中,第二层包含作为氰钴胺的维生素b
12
。更优选地,第二层包含作为氰钴胺的维生素b
12
和作为盐酸吡哆醇的维生素b6。在一个替代实施方案中,第二层可以包含作为氰钴胺的维生素b
12
和作为盐酸硫胺素或硝酸硫胺素的维生素b1;更优选地,第二层可以包含作为氰钴胺的维生素b
12
和作为硝酸硫胺素的维生素b1。在一个优选的实施方案中,本发明固体剂型的第二层可以包含作为氰钴胺的维生素b
12
、作为盐酸吡哆醇的维生素b6和作为盐酸硫胺素或硝酸硫胺素的维生素b1。优选地,本发明固体剂型的第二层可以包含作为氰钴胺的维生素b
12
、作为盐酸吡哆醇的维生素b6和作为硝酸硫胺素的维生素b1。
51.任选地,维生素b1和b6可以微囊化形式提供以确保更进一步的抗降解性。在本发明的上下文中,对于技术人员显而易见的是,任何合适的可商购的微囊化维生素b1或b6都可以容易地掺入本发明的多层药物或营养固体剂型中。举例而言,维生素b1和b6可以以胶囊化形式提供,胶囊包含麦芽糖糊精和棕榈油甘油单酯和/或甘油二酯,诸如可商购的“b1‑
33 lp硝酸盐”或“b6‑
33 lp硝酸盐”微囊化产品,其分别含有单硝酸硫胺素或盐酸吡哆醇,以及作为包衣剂的来自棕榈油的麦芽糖糊精和甘油单酯和甘油二酯。
52.在一个优选实施方案中,本发明提供了一种用于口服施用的多层药物或营养固体剂型,其包含:
53.‑
第一层,所述第一层包含第一嘧啶衍生物或其任何盐或溶剂化物和第二嘧啶衍生物或其任何盐或溶剂化物;和
54.‑
第二层,所述第二层包含选自b族微生素的至少一种维生素。
55.在一个更优选的实施方案中,本发明提供了一种用于口服施用的多层药物或营养固体剂型,其包含:
56.‑
第一层,所述第一层包含选自尿苷、磷酸尿苷、胞苷、磷酸胞苷、胸苷、胸苷磷酸或其任何盐或溶剂化物的至少两种嘧啶衍生物;和
57.‑
第二层,所述第二层包含选自微生素b1、b6和b
12
的至少一种b族维生素。
58.在另一个优选实施方案中,本发明提供了一种用于口服施用的多层药物或营养固体剂型,其包含:
59.‑
第一层,所述第一层包含选自尿苷、磷酸尿苷、胞苷、磷酸胞苷或其任何盐或溶剂化物的至少两种嘧啶衍生物;和
60.‑
第二层,所述第二层包含选自微生素b1、b6和b
12
的至少一种b族维生素。
61.在一个还更优选的实施方案中,本发明提供了一种用于口服施用的多层药物或营养固体剂型,其包含:
62.‑
第一层,所述第一层包含选自磷酸尿苷、磷酸胞苷、胸苷磷酸或其任何盐或溶剂化物的至少两种嘧啶衍生物;和
63.‑
第二层,所述第二层包含选自微生素b1、b6和b
12
的至少一种b族维生素。
64.在一个还甚至更优选的实施方案中,本发明提供了一种用于口服施用的多层药物或营养固体剂型,其包含:
65.‑
第一层,所述第一层包含选自磷酸尿苷、磷酸胞苷或其任何盐或溶剂化物的至少两种嘧啶衍生物;和
66.‑
第二层,所述第二层包含选自微生素b1、b6和b
12
的至少一种b族维生素。
67.在一个甚至更优选的实施方案中,用于口服施用的多层药物或营养固体剂型的第一层可以包含至少两种嘧啶衍生物,其可以是例如磷酸尿苷和胞苷盐;磷酸尿苷和磷酸胞苷盐;尿苷盐和磷酸胞苷;磷酸尿苷盐和磷酸胞苷;磷酸尿苷和磷酸胞苷;或尿苷盐和胞苷盐;磷酸尿苷盐和磷酸胞苷盐。还更优选地,用于口服施用的多层药物或营养固体剂型的第一层可包含单磷酸尿苷和单磷酸胞苷,它们中的每一种呈盐形式(例如ump
·
2na或cmp
·
2na)或酸形式。
68.在另一个优选实施方案中,本发明提供了一种用于口服施用的多层药物或营养固体剂型,其包含:
69.‑
第一层,所述第一层包含选自磷酸尿苷、磷酸胞苷或其任何盐或溶剂化物的至少两种嘧啶衍生物;和
70.‑
第二层,所述第二层包含维生素b
12
。
71.这种优选的固体剂型还可优选在第二层中包含维生素b1和/或维生素b6。在另一个优选的实施方案中,这种固体剂型可包含维生素b1和维生素b
12
。
72.本发明的多层药物或营养固体剂型可以以几种不同形式提供,诸如多层片剂,其可以是层压多层片剂(诸如双层或三层片剂)或同心多层片剂(也称为嵌入片剂)或压缩包衣片剂;同心分层珠粒;或薄膜包衣片剂、珠粒、颗粒或球粒。优选地,本发明的多层药物或营养固体剂型以层压多层片剂的形式提供。
73.另一方面,对于技术人员来说还显而易见的是,多层药物或营养固体剂型不限于仅存在两层(即双层药物或营养固体剂型),而是可以直接调整为含有两层以上的层数。
74.举例而言,根据另一个优选实施方案中,本发明提供了一种用于口服施用的多层药物或营养固体剂型,其包含:
75.‑
第一层,所述第一层包含至少一种嘧啶衍生物或其任何盐或溶剂化物;
76.‑
第二层,所述第二层包含选自b族微生素的至少一种维生素;和
77.‑
第三层,所述第三层分别包含至少一种合适的药物或营养赋形剂。
78.在本发明的这个示例性实施方案中,第三层可以放置在与第一层或第二层相邻的位置,或者可替代地,它可以与两者相邻放置。
79.如本文所用,“药物或营养赋形剂”应理解为本领域已知的任何物质,诸如分别用于药物或营养组合物的稀释剂、粘合剂、着色剂、调味剂、表面活性剂、润滑剂/助流剂或增塑剂。
80.对于技术人员来说,本发明的多层药物或营养固体剂型中存在的任何层可以任选地分别包含至少一种如上文所定义的合适的药物或营养赋形剂也将变得显而易见。
81.合适的赋形剂的实例包括但不限于合适的粘合剂,其中优选干燥粘合剂,并且粘合剂可包括纤维素粉末和微晶纤维素。合适的崩解剂是例如羟基乙酸淀粉钠、交聚维酮、交联羧甲基纤维素、羧甲基纤维素钠和干玉米淀粉。乳糖(例如无水乳糖)也可用作合适的填充剂。
82.除了别的以外,合适的粘合剂和载体还可包括纤维素粉末、微晶纤维素、纤维素衍生物(如羟甲基纤维素、羟乙基纤维素、羟丙基纤维素和羟丙基甲基纤维素)、磷酸氢钙、玉米淀粉、预胶化淀粉和聚乙烯吡咯烷酮(聚维酮)。也可以有利地使用润滑剂,诸如硬脂酸、硬脂酸镁、硬脂基富马酸钠和甘油三二十二烷酸酯。
83.可以在本发明的固体剂型中使用的其它合适的赋形剂以非限制的方式包括:流控剂,诸如胶体二氧化硅(也称为胶态氧化硅;例如)或滑石;着色剂,包括染料和颜料,诸如氧化铁红或氧化铁黄或二氧化钛;ph控制剂,诸如柠檬酸、酒石酸、富马酸、柠檬酸钠、磷酸氢钙、磷酸氢二钠等。
84.在另一个实施方案中,本发明提供了一种用于口服施用的多层药物或营养固体剂型,其中第一层包含至少一种嘧啶衍生物或其任何盐或溶剂化物,以及至少一种嘌呤衍生物或其任何盐或溶剂化物。优选地,本发明提供了一种用于口服施用的多层药物或营养固体剂型,其中第一层包含至少一种嘧啶衍生物或其任何盐或溶剂化物,其选自尿苷、尿苷酯、磷酸尿苷、胞苷、胞苷酯、磷酸胞苷、胸苷、胸苷酯、磷酸胸苷及其任何盐或溶剂化物,以及至少一种嘌呤衍生物或其任何盐或溶剂化物,其选自腺苷、腺苷酯、磷酸腺苷、鸟苷、鸟苷酯、磷酸鸟苷、肌苷、肌苷酯、磷酸肌苷、黄苷、黄苷酯、磷酸黄苷及其任何盐或溶剂化物。更优选地,本发明提供了一种用于口服施用的多层药物或营养固体剂型,其中第一层包含至少一种嘧啶衍生物或其任何盐或溶剂化物,其选自尿苷、磷酸尿苷、胞苷、磷酸胞苷、胸苷、磷酸胸苷及其任何盐或溶剂化物,以及至少一种嘌呤衍生物或其任何盐或溶剂化物,其选自腺苷、磷酸腺苷、鸟苷、磷酸鸟苷、肌苷、磷酸肌苷、黄苷、磷酸黄苷及其任何盐或溶剂化物。还更优选地,本发明提供了一种用于口服施用的多层药物或营养固体剂型,其中第一层包含至少一种嘧啶衍生物或其任何盐或溶剂化物,其选自尿苷、磷酸尿苷、胞苷、磷酸胞苷、胸苷、磷酸胸苷及其任何盐或溶剂化物,以及至少一种嘌呤衍生物或其任何盐或溶剂化物,其选自腺苷、磷酸腺苷、鸟苷、磷酸鸟苷及其任何盐或溶剂化物。还甚至更优选地,本发明提供了一种用于口服施用的多层药物或营养固体剂型,其中第一层包含至少一种嘧啶衍生物或其任何盐或溶剂化物,其选自尿苷、磷酸尿苷、胞苷、磷酸胞苷、胸苷、磷酸胸苷及其任何盐或溶剂化物,以及至少一种嘌呤衍生物或其任何盐或溶剂化物,其选自腺苷、磷酸腺苷及其任何盐或溶剂化物。还甚至更优选地,本发明提供了一种用于口服施用的多层药物或营养固体剂型,其中第一层包含至少一种嘧啶衍生物或其任何盐或溶剂化物,其选自尿苷、磷
酸尿苷、胞苷、磷酸胞苷及其任何盐或溶剂化物,以及至少一种嘌呤衍生物或其任何盐或溶剂化物,其选自腺苷、磷酸腺苷及其任何盐或溶剂化物。
85.根据另一个实施方案,本发明提供了一种用于口服施用的多层药物或营养固体剂型,其中第一层包含至少一种嘌呤衍生物或其任何盐或溶剂化物。优选地,本发明提供了一种用于口服施用的多层药物或营养固体剂型,其中第一层包含至少一种嘌呤衍生物或其任何盐或溶剂化物,其选自腺苷、腺苷酯、磷酸腺苷、鸟苷、鸟苷酯、磷酸鸟苷、肌苷、肌苷酯、磷酸肌苷、黄苷、黄苷酯、磷酸黄苷及其任何盐或溶剂化物。更优选地,本发明提供了一种用于口服施用的多层药物或营养固体剂型,其中第一层包含至少一种嘌呤衍生物或其任何盐或溶剂化物,其选自腺苷、磷酸腺苷、鸟苷、磷酸鸟苷、肌苷、磷酸肌苷、黄苷、磷酸黄苷及其任何盐或溶剂化物。还更优选地,本发明提供了一种用于口服施用的多层药物或营养固体剂型,其中第一层包含至少一种嘌呤衍生物或其任何盐或溶剂化物,其选自腺苷、磷酸腺苷、鸟苷、磷酸鸟苷及其任何盐或溶剂化物。还甚至更优选地,本发明提供了一种用于口服施用的多层药物或营养固体剂型,其中第一层包含至少一种嘌呤衍生物或其任何盐或溶剂化物,其选自腺苷、磷酸腺苷及其任何盐或溶剂化物。
86.本文提供的多层药物或营养固体剂型有利地提供了大量嘧啶衍生物和/或嘌呤衍生物,尤其是嘧啶和/或嘌呤核苷酸或核苷,从而可以实现用于周围神经损伤修复的最佳方法。由于这个事实,本发明的固体剂型还有助于在其中由于病状的严重程度而需要大量核苷酸或核苷和维生素b,并且通常规定每天服用可变数目的片剂的情况下减少患者的依从性缺乏。
87.在一个优选的实施方案中,本发明的上述多层药物或营养药物固体剂型包含总量为至少200mg,更优选总量在200mg至450mg的范围内,更优选在250mg至430mg的范围内,还更优选在300mg至420mg的范围内,甚至更优选在350mg至410mg的范围内的所述嘧啶衍生物、嘌呤衍生物及其任何盐或溶剂化物,其中总量是考虑到所述嘧啶衍生物、嘌呤衍生物及其盐或溶剂化物中的每一种的相应等效碱形式来计算的。
88.在一个特定实施方案中,本发明的上述多层药物或营养药物固体剂型可包含总量为至少200mg,更优选总量在200mg至450mg的范围内,还更优选在250mg至450mg的范围内,还甚至更优选在250mg至430mg的范围内,更优选在300mg至420mg的范围内,以及甚至更优选在350mg至410mg的范围内的所述嘧啶衍生物、嘌呤衍生物及其任何盐或溶剂化物,其中总量是考虑到所述嘧啶衍生物及其盐或溶剂化物中的每一种的相应等效碱形式来计算的。
89.同样,根据另一个实施方案,本发明的上述多层药物或营养药物固体剂型可包含总量为至少200mg,更优选总量在200mg至450mg的范围内,还更优选在250mg至450mg的范围内,还甚至更优选在250mg至430mg的范围内,更优选在300mg至420mg的范围内,以及甚至更优选在350mg至410mg的范围内的所述嘌呤衍生物及其任何盐或溶剂化物,其中总量是考虑到所述嘌呤衍生物及其盐或溶剂化物中的每一种的相应等效碱形式来计算的。
90.在根据本发明第一方面的优选实施方案中,多层药物或营养固体剂型在25℃和60%相对湿度下储存至少3个月,优选至少6个月,更优选至少12个月后是稳定的。
91.在另一个优选实施方案中,根据本发明第一方面提供的多层药物或营养固体剂型在40℃和75%相对湿度下储存至少3个月,优选至少6个月后是稳定的。
92.在还有另一个优选的实施方案中,根据本发明第一方面的多层药物或营养固体剂
型,当包装在pvc/pvdc(即聚氯乙烯/聚二氯乙烯)铝箔泡罩中时,在25℃和60%相对湿度下储存至少3个月,更优选在25℃和60%相对湿度下储存至少6个月,还更优选在25℃和60%相对湿度下储存至少12个月后是稳定的。
93.本发明提供了具有增强的抵抗水分和/或酸性条件的抗性的多层药物或营养固体剂型,其有利地需要较少限制的储存条件,从而允许在高于当前市售配制品的温度和相对湿度下储存产品。就这一点而言,本发明的技术方案即使在使用本领域已知部分透水的pvc/pvdc铝箔泡罩时,也提供极好的稳定性结果。
94.如本文所用,术语“稳定”是指在上述稳定性测定条件下,就组合物中存在的每种维生素b而言,b族维生素相对损失等于或小于15%;优选地,在稳定性测定条件下,就组合物中存在的每种维生素b而言,b族维生素相对损失等于或小于10%。所述b族维生素损失可以通过hplc分析测定。在一个优选的实施方案中,稳定性测定条件是25℃和60hr至少3个月,并且更优选为25℃和60hr至少6个月。在另一个优选的实施方案中,稳定性测定条件是40℃和75hr至少3个月,并且更优选为40℃和75hr至少6个月。根据再另一个优选的实施方案,稳定性测定条件还包括将本发明的药物或营养固体剂型包装在alu
‑
alu泡罩或pvc/pvdc铝箔泡罩中;更优选地,稳定性测定条件还包括将本发明的药物或营养固体剂型包装在pvc/pvdc铝箔泡罩中。
95.在第二方面,本发明提供了一种用于生产根据本发明第一方面的多层药物或营养固体剂型的方法。
96.根据这第二方面,本发明提供了一种用于生产根据本发明第一方面的多层药物或营养固体剂型的方法,其包括:
97.(i)通过筛分至少一种嘧啶衍生物、嘌呤衍生物或其任何盐或溶剂化物提供包含所述至少一种嘧啶衍生物、嘌呤衍生物或其任何盐或溶剂化物以及任选地至少一种合适的药物或营养赋形剂的第一层组合物,然后掺混所得混合物直至均匀;
98.(ii)通过筛分选自b族微生素的至少一种维生素来提供包含选自b族微生素的所述至少一种维生素和任选地至少一种合适的药物或营养赋形剂的第二层组合物,然后掺混所得混合物直至均匀;并且
99.(iii)压制所述第一层或第二层组合物中的一种,然后在前一层的上面或周围压制所述第一层或第二层组合物中的另一种以形成药物或营养固体剂型。
100.在特定实施方案中,本发明提供了一种用于生产根据本发明第一方面的多层药物或营养固体剂型的方法,其包括:
101.(i)通过筛分至少一种嘧啶衍生物或其任何盐或溶剂化物提供包含所述至少一种嘧啶衍生物或其任何盐或溶剂化物以及任选地至少一种合适的药物或营养赋形剂的第一层组合物,然后掺混所得混合物直至均匀;
102.(ii)通过筛分选自b族微生素的至少一种维生素和任选地至少一种合适的药物或营养赋形剂来提供包含选自b族微生素的所述至少一种维生素和任选地至少一种合适的药物或营养赋形剂的第二层组合物,然后掺混所得混合物直至均匀;并且
103.(iii)压制所述第一层或第二层组合物中的一种,然后在前一层的上面或周围压制所述第一层或第二层组合物中的另一种以形成药物或营养固体剂型。
104.对技术人员来说将变得显而易见的是,步骤(iii)中的压制可以以本领域已知的
任何常用方式进行,例如使用高速旋转压制机或多层压片机,并且上述工艺也可以容易地适用于本发明的不同实施方案,因此还包括添加更多层以生产多层剂型的可能性。
105.在任选的实施方案中,其中每层可以使用多于一种合适的药物或营养赋形剂,该工艺每个步骤中所得混合物的筛分和混合可以在添加每种单独的赋形剂或一组赋形剂之后依次进行。
106.在另一个优选的实施方案中,其中提供了根据本发明第一方面的三层药物或营养固体剂型,根据本发明第二方面的方法包括另一步骤,其中提供了包含至少一种合适的药物或营养赋形剂的第三层,该赋形剂是一种惰性赋形剂。即,根据该特定实施方案,根据本发明第二方面的方法包括以下步骤:
107.(i)通过筛分至少一种嘧啶衍生物、嘌呤衍生物或其任何盐或溶剂化物提供包含所述至少一种嘧啶衍生物、嘌呤衍生物或其任何盐或溶剂化物以及任选地至少一种合适的药物或营养赋形剂的第一层组合物,然后掺混所得混合物直至均匀;
108.(ii)通过筛分选自b族微生素的至少一种维生素来提供包含选自b族微生素的所述至少一种维生素和任选地至少一种合适的药物或营养赋形剂的第二层组合物,然后掺混所得混合物直至均匀;
109.(iii)提供包含至少一种合适的药物或营养赋形剂的第三层组合物;并且
110.(iv)压制第一或第二层组合物中的一种,然后在前一层的上面或周围压制第三层组合物,接着在第三层组合物的上面或周围压制第一或第二层组合物中的另一种。
111.在第三方面,本发明提供了另一种用于生产根据本发明第一方面的多层药物或营养固体剂型的方法。
112.具体地,提供了一种用于生产根据本发明第一方面的多层药物或营养固体剂型的方法,其包括:
113.(i)通过筛分至少一种嘧啶衍生物、嘌呤衍生物或其任何盐或溶剂化物提供包含所述至少一种嘧啶衍生物、嘌呤衍生物或其任何盐或溶剂化物以及任选地至少一种合适的药物或营养赋形剂的第一层组合物,然后掺混所得混合物直至均匀;
114.(ii)通过筛分选自b族微生素的至少一种维生素来提供包含选自b族微生素的所述至少一种维生素的第二层组合物,然后使其在水的存在下进行制粒;并且
115.(iii)压制所述第一层或第二层组合物中的一种,然后在前一层的上面或周围压制所述第一层或第二层组合物中的另一种以形成药物或营养固体剂型。
116.该工艺的步骤(ii)还可任选地包括将所得颗粒与至少一种合适的药物或营养赋形剂掺混至均匀。
117.对技术人员来说将变得显而易见的是,步骤(iii)中的压制可以以本领域已知的任何常用方式进行,例如使用高速旋转压制机或多层压片机,并且上述工艺也可以容易地适用于本发明的不同实施方案,因此还包括添加更多层以生产多层剂型的可能性。
118.在任选的实施方案中,其中每层可以使用多于一种合适的药物或营养赋形剂,每个步骤中所得混合物的筛分和混合可以在添加每种单独的赋形剂或一组赋形剂之后依次进行。
119.根据另一个优选的实施方案,其中提供了根据本发明第一方面的三层药物或营养固体剂型,根据本发明第三方面的方法包括以下步骤:
120.(i)通过筛分至少一种嘧啶衍生物、嘌呤衍生物或其任何盐或溶剂化物提供包含所述至少一种嘧啶衍生物、嘌呤衍生物或其任何盐或溶剂化物以及任选地至少一种合适的药物或营养赋形剂的第一层组合物,然后掺混所得混合物直至均匀;
121.(ii)通过筛分选自b族微生素的至少一种维生素来提供包含选自b族微生素的所述至少一种维生素的第二层组合物,然后使其在水的存在下进行制粒;
122.(iii)提供包含至少一种合适的药物或营养赋形剂的第三层组合物;并且
123.(iii)压制第一或第二层组合物中的一种,然后在前一层的上面或周围压制第三层组合物,接着在第三层组合物的上面或周围压制第一或第二层组合物中的另一种。
124.在第四方面,本发明提供了另一种用于生产根据本发明第一方面的多层药物或营养固体剂型的方法,其中第二层和后续多层通过包衣方法施加到第一层上。
125.根据这第四方面,本发明提供了一种用于生产根据本发明第一方面的多层药物或营养固体剂型的方法,其包括:
126.(i)通过筛分至少一种嘧啶衍生物、嘌呤衍生物或其任何盐或溶剂化物提供包含所述至少一种嘧啶衍生物、嘌呤衍生物或其任何盐或溶剂化物以及任选地至少一种合适的药物或营养赋形剂的第一层组合物,然后掺混所得混合物直至均匀,并且随后压制所得混合物以形成芯层;
127.(ii)提供包含选自b族维生素的至少一种微生物和任选地至少一种合适的药物或营养赋形剂的第二层组合物,其中所述成分分散或溶解在水或有机溶剂中分别形成水性或有机分散体或溶液;并且
128.(iii)使用包衣方式将步骤(ii)的所得分散体或溶液施加到步骤(i)中获得的芯层上。
129.对于技术人员来说将变得显而易见的是,步骤(i)中的压制可以以本领域已知的任何常用方式进行,例如使用旋转压片机。包衣步骤(iii)也可以使用本领域已知的标准包衣方式进行,例如包衣锅。
130.对于本领域技术人员来说还显而易见的是,上述包衣工艺也可以很容易地适用于本发明的不同实施方案,因此还包括添加更多层以生产多层剂型的可能性。
131.具体而言,根据这第四方面,本发明提供了一种用于生产根据本发明第一方面的三层药物或营养固体剂型的方法,其包括:
132.(i)通过筛分至少一种嘧啶衍生物、嘌呤衍生物或其任何盐或溶剂化物提供包含所述至少一种嘧啶衍生物、嘌呤衍生物或其任何盐或溶剂化物以及任选地至少一种合适的药物或营养赋形剂的第一层组合物,然后掺混所得混合物直至均匀,并且随后压制所得混合物以形成芯层;
133.(ii)提供包含至少一种合适的药物或营养赋形剂的第三层组合物;优选地,第三层组合物包含至少一种成膜剂,其更优选地选自羟丙基甲基纤维素、聚乙烯醇和部分水解的聚乙烯醇;其中使用包衣方式将第三层组合物施加到步骤(1)中获得的芯层上;
134.(iii)提供包含选自b族维生素的至少一种微生物和任选地至少一种合适的药物或营养赋形剂的第二层组合物,其中所述成分分散或溶解在水或有机溶剂中分别形成水性或有机分散体或溶液;并且
135.(iv)使用包衣方式将步骤(iii)的所得分散体或溶液施加到步骤(ii)中获得的芯
层上。
136.在本发明的第五方面,根据本发明第一方面的多层药物或营养固体剂型可通过根据本发明第二方面的工艺获得。在特定实施方案中,根据本发明第一方面的双层药物或营养固体剂型可通过根据本发明第二方面的工艺获得。在另一个实施方案中,根据本发明第一方面的三层药物或营养固体剂型可通过根据本发明第二方面的工艺获得。
137.在一个优选的实施方案中,根据本发明第一方面的多层药物或营养固体剂型通过根据本发明第二方面的工艺获得。在特定实施方案中,根据本发明第一方面的双层药物或营养固体剂型通过根据本发明第二方面的工艺获得。在另一个实施方案中,根据本发明第一方面的三层药物或营养固体剂型通过根据本发明第二方面的工艺获得。
138.在本发明的第六方面,根据本发明第一方面的多层药物或营养固体剂型可通过根据本发明第三方面的工艺获得。在特定实施方案中,根据本发明第一方面的双层药物或营养固体剂型可通过根据本发明第三方面的工艺获得。在另一个实施方案中,根据本发明第一方面的三层药物或营养固体剂型可通过根据本发明第三方面的工艺获得。
139.在一个优选的实施方案中,根据本发明第一方面的多层药物或营养固体剂型通过根据本发明第三方面的工艺获得。在特定实施方案中,根据本发明第一方面的双层药物或营养固体剂型通过根据本发明第三方面的工艺获得。在另一个实施方案中,根据本发明第一方面的三层药物或营养固体剂型通过根据本发明第三方面的工艺获得。
140.在本发明的第七方面,根据本发明第一方面的多层药物或营养固体剂型可通过根据本发明第四方面的工艺获得。在特定实施方案中,根据本发明第一方面的双层药物或营养固体剂型可通过根据本发明第四方面的工艺获得。在另一个实施方案中,根据本发明第一方面的三层药物或营养固体剂型可通过根据本发明第四方面的工艺获得。
141.在一个优选的实施方案中,根据本发明第一方面的多层药物或营养固体剂型通过根据本发明第四方面的工艺获得。在特定实施方案中,根据本发明第一方面的双层药物或营养固体剂型通过根据本发明第四方面的工艺获得。在另一个实施方案中,根据本发明第一方面的三层药物或营养固体剂型通过根据本发明第四方面的工艺获得。
142.在本发明的第八方面,提供了根据本发明第一方面的多层药物或营养固体剂型,分别用于制造用于治疗和/或预防周围神经病变的药剂或营养产品。
[0143]“周围神经病变”是指周围神经系统受损的任何病状,诸如多发性周围神经病变、周围神经根病、灼痛和反射交感性营养不良、乳房切除术后神经痛、术后神经痛和疼痛、外阴前庭炎、幻肢痛、丘脑综合征(中枢性中风后疼痛)、颞下颌关节综合征、跖骨痛(莫顿神经痛(morton's neuralgia))和例如由椎间盘脱出或腕骨和跗骨隧道综合征引起的神经压迫造成的神经源性疼痛。
[0144]
在本发明的第九方面,提供了根据本发明第一方面的多层营养固体剂型,用于治疗和/或预防周围神经病变。
[0145]
在本发明的第十方面,提供了根据本发明第一方面的多层营养固体剂型在治疗和/或预防周围神经病变中的用途。
[0146]
在以下条款中描述了本发明的其它方面和实施方案:
[0147]
1.一种用于口服施用的多层药物或营养固体剂型,其包含:
[0148]
‑
第一层,所述第一层包含至少一种嘧啶衍生物、嘌呤衍生物或其任何盐或溶剂化
物;和
[0149]
‑
第二层,所述第二层包含选自b族微生素的至少一种维生素。
[0150]
2.根据条款1所述的多层药物或营养固体剂型,其中:
[0151]
‑
所述第一层包含至少一种嘧啶衍生物或其任何盐或溶剂化物;以及
[0152]
‑
所述第二层包含选自b族微生素的至少一种维生素。
[0153]
3.根据条款1或2所述的多层药物或营养固体剂型,其中所述至少一种嘧啶衍生物选自尿苷、尿苷酯、磷酸尿苷、胞苷、胞苷酯、磷酸胞苷、胸苷、胸苷酯和磷酸胸苷。
[0154]
4.根据任一前述条款所述的多层药物或营养固体剂型,其中所述至少一种嘧啶衍生物选自尿苷、磷酸尿苷、胞苷、磷酸胞苷、胸苷和磷酸胸苷。
[0155]
5.根据任一前述条款所述的多层药物或营养固体剂型,其中所述至少一种嘧啶衍生物选自磷酸尿苷、磷酸胞苷和磷酸胸苷。
[0156]
6.根据任一前述条款所述的多层药物或营养固体剂型,其中所述至少一种嘧啶衍生物是选自单磷酸尿苷、二磷酸尿苷和三磷酸尿苷的磷酸尿苷,或所述至少一种嘧啶衍生物是选自单磷酸胞苷、二磷酸胞苷和三磷酸胞苷的磷酸胞苷,或所述至少一种嘧啶衍生物是选自单磷酸胸苷、二磷酸胸苷和三磷酸胸苷的磷酸胸苷。
[0157]
7.根据任一前述条款所述的多层药物或营养固体剂型,其中所述至少一种嘌呤衍生物选自腺苷、腺苷酯、磷酸腺苷、鸟苷、鸟苷酯、磷酸鸟苷、肌苷、肌苷酯、磷酸肌苷、黄苷、黄苷酯和磷酸黄苷。
[0158]
8.根据任一前述条款所述的多层药物或营养固体剂型,其中所述至少一种嘌呤衍生物选自磷酸腺苷、磷酸鸟苷、磷酸肌苷和磷酸黄苷。
[0159]
9.根据任一前述条款所述的多层药物或营养固体剂型,其中所述至少一种嘌呤衍生物是选自单磷酸腺苷、二磷酸腺苷和三磷酸腺苷的磷酸腺苷,或所述至少一种嘌呤衍生物是选自单磷酸鸟苷、二磷酸鸟苷和三磷酸鸟苷的磷酸鸟苷,或所述至少一种嘌呤衍生物是选自单磷酸肌苷、二磷酸肌苷和三磷酸肌苷的磷酸肌苷,或所述至少一种嘌呤衍生物是选自单磷酸黄苷、二磷酸黄苷和三磷酸黄苷的磷酸黄苷。
[0160]
10.根据条款1所述的多层药物或营养固体剂型,其中所述至少一种嘧啶衍生物、嘌呤衍生物或其任何盐或溶剂化物选自尿苷、尿苷酯、磷酸尿苷、胞苷、胞苷酯、磷酸胞苷、胸苷、胸苷酯、磷酸胸苷、腺苷、腺苷酯、磷酸腺苷、鸟苷、鸟苷酯、磷酸鸟苷、肌苷、肌苷酯、磷酸肌苷、黄苷、黄苷酯、磷酸黄苷及其任何盐或溶剂化物。
[0161]
11.根据条款10所述的多层药物或营养固体剂型,其中所述至少一种嘧啶衍生物、嘌呤衍生物或其任何盐或溶剂化物选自尿苷、磷酸尿苷、胞苷、磷酸胞苷、胸苷、磷酸胸苷、腺苷、磷酸腺苷、鸟苷、磷酸鸟苷、肌苷、磷酸肌苷、黄苷、磷酸黄苷及其任何盐或溶剂化物。
[0162]
12.根据条款10或11所述的多层药物或营养固体剂型,其中所述至少一种嘧啶衍生物、嘌呤衍生物或其任何盐或溶剂化物选自尿苷、磷酸尿苷、胞苷、磷酸胞苷、胸苷、磷酸胸苷、腺苷、磷酸腺苷、鸟苷、磷酸鸟苷及其任何盐或溶剂化物。
[0163]
13.根据条款10
‑
12中任一项所述的多层药物或营养固体剂型,其中所述至少一种嘧啶衍生物、嘌呤衍生物或其任何盐或溶剂化物选自尿苷、磷酸尿苷、胞苷、磷酸胞苷、胸苷、磷酸胸苷、腺苷、磷酸腺苷及其任何盐或溶剂化物。
[0164]
14.根据任一前述条款所述的多层药物或营养固体剂型,其中所述第一层包含至
少一种嘧啶衍生物盐和/或至少一种嘌呤衍生物盐,其选自碱金属盐、碱土金属盐、碱性氨基酸盐、铵盐、链烷醇胺盐或其任何混合物。
[0165]
15.根据任一前述条款所述的多层药物或营养固体剂型,其中所述第一层包含至少一种嘧啶衍生物盐和/或至少一种嘌呤衍生物盐,其选自碱金属盐、碱土金属盐、碱性氨基酸盐、铵盐或其任何混合物。
[0166]
16.根据任一前述条款所述的多层药物或营养固体剂型,其中所述第一层包含至少一种嘧啶衍生物盐和/或至少一种嘌呤衍生物盐,其选自碱金属盐、碱土金属盐或其任何混合物。
[0167]
17.根据任一前述条款所述的多层药物或营养固体剂型,其中所述第一层包含至少一种嘧啶衍生物盐和/或至少一种嘌呤衍生物盐,其是碱金属盐。
[0168]
18.根据任一前述条款所述的多层药物或营养固体剂型,其中所述第一层包含至少一种嘧啶衍生物盐,所述嘧啶衍生物盐是选自下组的碱金属盐:单磷酸胞苷单钠、二磷酸胞苷二钠、三磷酸胞苷三钠、单磷酸尿苷单钠、二磷酸尿苷二钠、三磷酸尿苷三钠、单磷酸胸苷单钠、二磷酸胸苷二钠和三磷酸胸苷三钠。
[0169]
19.根据任一前述条款所述的多层药物或营养固体剂型,其中所述第一层包含至少一种嘌呤衍生物盐,所述嘌呤衍生物盐是选自下组的碱金属盐:单磷酸腺苷单钠、二磷酸腺苷二钠、三磷酸腺苷三钠、单磷酸鸟苷单钠、二磷酸鸟苷二钠、三磷酸鸟苷三钠、单磷酸肌苷单钠、二磷酸肌苷二钠、三磷酸肌苷三钠、单磷酸黄苷单钠、二磷酸黄苷二钠和三磷酸黄苷三钠。
[0170]
20.根据任一前述条款所述的多层药物或营养固体剂型,其中所述第二层的选自b族维生素的所述至少一种维生素是维生素b1、b6或b
12
。
[0171]
21.根据任一前述条款所述的多层药物或营养固体剂型,其中所述第二层的选自b族维生素的所述至少一种维生素是维生素b
12
。
[0172]
22.根据任一前述条款所述的多层药物或营养固体剂型,其中所述第二层的选自b族维生素的所述至少一种维生素是氰钴胺、羟钴胺或甲钴胺形式的维生素b
12
。
[0173]
23.根据任一前述条款所述的多层药物或营养固体剂型,其中所述第二层的选自b族维生素的所述至少一种维生素是氰钴胺或羟钴胺形式的维生素b
12
。
[0174]
24.根据任一前述条款所述的多层药物或营养固体剂型,其中所述第二层的选自b族维生素的所述至少一种维生素是氰钴胺形式的维生素b
12
。
[0175]
25.根据条款21
‑
24中任一项所述的多层药物或营养固体剂型,其中所述第二层还包含维生素b1。
[0176]
26.根据前述条款所述的多层药物或营养固体剂型,其中维生素b1为盐酸硫胺素、硝酸硫胺素、焦磷酸硫胺素或二水合硫胺素单磷酸氯化物的形式。
[0177]
27.根据条款25或26所述的多层药物或营养固体剂型,其中维生素b1是硝酸硫胺素。
[0178]
28.根据条款21
‑
27中任一项所述的多层药物或营养固体剂型,其中所述第二层还包含维生素b6。
[0179]
29.根据前述条款所述的多层药物或营养固体剂型,其中维生素b6为盐酸吡哆醇或磷酸吡哆醛的形式。
[0180]
30.根据条款20所述的多层药物或营养固体剂型,其中所述第二层包含维生素b1、b6和b
12
。
[0181]
31.根据前述条款所述的多层药物或营养固体剂型,其中所述第二层包含氰钴胺形式的维生素b
12
、盐酸吡哆醇形式的维生素b6和盐酸硫胺素或硝酸硫胺素形式的维生素b1。
[0182]
32.根据前述条款所述的多层药物或营养固体剂型,其中所述第二层包含氰钴胺形式的维生素b
12
、盐酸吡哆醇形式的维生素b6和硝酸硫胺素形式的维生素b1。
[0183]
33.根据条款1
‑
3中任一项所述的多层药物或营养固体剂型,其中所述第一层包含第一嘧啶衍生物或其任何盐或溶剂化物,和第二嘧啶衍生物或其任何盐或溶剂化物。
[0184]
34.根据前述条款所述的多层药物或营养固体剂型,其中所述第一和第二嘧啶衍生物独立地选自尿苷、磷酸尿苷、胞苷、磷酸胞苷、胸苷、磷酸胸苷或其任何盐或溶剂化物。
[0185]
35.根据条款33或34所述的多层药物或营养固体剂型,其中所述第一和第二嘧啶衍生物独立地选自尿苷、磷酸尿苷、胞苷、磷酸胞苷或其任何盐或溶剂化物。
[0186]
36.根据条款33
‑
35中任一项所述的多层药物或营养固体剂型,其中所述第一和第二嘧啶衍生物独立地选自磷酸尿苷、磷酸胞苷或其任何盐或溶剂化物。
[0187]
37.根据前述条款33
‑
36中任一项所述的多层药物或营养固体剂型,其中所述第一和第二嘧啶衍生物是磷酸尿苷和磷酸胞苷盐。
[0188]
38.根据前述条款33
‑
36中任一项所述的多层药物或营养固体剂型,其中所述第一和第二嘧啶衍生物是磷酸尿苷盐和磷酸胞苷。
[0189]
39.根据前述条款33
‑
36中任一项所述的多层药物或营养固体剂型,其中所述第一和第二嘧啶衍生物是磷酸尿苷盐和磷酸胞苷盐。
[0190]
40.根据前述条款33
‑
36中任一项所述的多层药物或营养固体剂型,其中所述第一和第二嘧啶衍生物是磷酸尿苷和磷酸胞苷。
[0191]
41.根据前述条款所述的多层药物或营养固体剂型,其中所述第一和第二嘧啶衍生物是单磷酸尿苷和单磷酸胞苷,其中它们中的每一种为盐形式或酸形式。
[0192]
42.根据条款40或41所述的多层药物或营养固体剂型,其中所述第一和第二嘧啶衍生物是单磷酸尿苷二钠和酸形式的单磷酸胞苷。
[0193]
43.根据条款40或41所述的多层药物或营养固体剂型,其中所述第一和第二嘧啶衍生物是单磷酸尿苷二钠和单磷酸胞苷二钠。
[0194]
44.根据条款33
‑
43中任一项所述的多层药物或营养固体剂型,其中所述第二层的选自b族维生素的所述至少一种维生素是维生素b1、b6或b
12
。
[0195]
45.根据条款33
‑
44中任一项所述的多层药物或营养固体剂型,其中所述第二层的选自b族维生素的所述至少一种维生素是维生素b
12
。
[0196]
46.根据条款33
‑
45中任一项所述的多层药物或营养固体剂型,其中所述第二层的选自b族维生素的所述至少一种维生素是氰钴胺、羟钴胺或甲钴胺形式的维生素b
12
。
[0197]
47.根据条款33
‑
46中任一项所述的多层药物或营养固体剂型,其中所述第二层的选自b族维生素的所述至少一种维生素是氰钴胺或羟钴胺形式的维生素b
12
。
[0198]
48.根据条款33
‑
47中任一项所述的多层药物或营养固体剂型,其中所述第二层的选自b族维生素的所述至少一种维生素是氰钴胺形式的维生素b
12
。
[0199]
49.根据条款45
‑
48中任一项所述的多层药物或营养固体剂型,其中所述第二层还包含维生素b1。
[0200]
50.根据前述条款所述的多层药物或营养固体剂型,其中维生素b1为盐酸硫胺素、硝酸硫胺素、焦磷酸硫胺素或二水合硫胺素单磷酸氯化物的形式。
[0201]
51.根据条款49或50所述的多层药物或营养固体剂型,其中维生素b1是硝酸硫胺素。
[0202]
52.根据条款45
‑
51中任一项所述的多层药物或营养固体剂型,其中所述第二层还包含维生素b6。
[0203]
53.根据前述条款所述的多层药物或营养固体剂型,其中维生素b6为盐酸吡哆醇或磷酸吡哆醛的形式。
[0204]
54.根据条款44所述的多层药物或营养固体剂型,其中所述第二层包含维生素b1、b6和b
12
。
[0205]
55.根据前述条款所述的多层药物或营养固体剂型,其中所述第二层包含氰钴胺形式的维生素b
12
、盐酸吡哆醇形式的维生素b6和盐酸硫胺素或硝酸硫胺素形式的维生素b1。
[0206]
56.根据前述条款所述的多层药物或营养固体剂型,其中所述第二层包含氰钴胺形式的维生素b
12
、盐酸吡哆醇形式的维生素b6和硝酸硫胺素形式的维生素b1。
[0207]
57.根据条款1或2所述的多层药物或营养固体剂型,其中所述第一层包含至少一种嘧啶衍生物或其任何盐或溶剂化物,和至少一种嘌呤衍生物或其任何盐或溶剂化物。
[0208]
58.根据条款57所述的多层药物或营养固体剂型,其中所述第一层包含至少一种嘧啶衍生物或其任何盐或溶剂化物,其选自尿苷、尿苷酯、磷酸尿苷、胞苷、胞苷酯、磷酸胞苷、胸苷、胸苷酯、磷酸胸苷及其任何盐或溶剂化物,以及至少一种嘌呤衍生物或其任何盐或溶剂化物,其选自腺苷、腺苷酯、磷酸腺苷、鸟苷、鸟苷酯、磷酸鸟苷、肌苷、肌苷酯、磷酸肌苷、黄苷、黄苷酯、磷酸黄苷及其任何盐或溶剂化物。
[0209]
59.根据条款57或58所述的多层药物或营养固体剂型,其中所述第一层包含至少一种嘧啶衍生物或其任何盐或溶剂化物,其选自尿苷、磷酸尿苷、胞苷、磷酸胞苷、胸苷、磷酸胸苷及其任何盐或溶剂化物,以及至少一种嘌呤衍生物或其任何盐或溶剂化物,其选自腺苷、磷酸腺苷、鸟苷、磷酸鸟苷、肌苷、磷酸肌苷、黄苷、磷酸黄苷及其任何盐或溶剂化物。
[0210]
60.根据条款57
‑
59中任一项所述的多层药物或营养固体剂型,其中所述第一层包含至少一种嘧啶衍生物或其任何盐或溶剂化物,其选自尿苷、磷酸尿苷、胞苷、磷酸胞苷、胸苷、磷酸胸苷及其任何盐或溶剂化物,以及至少一种嘌呤衍生物或其任何盐或溶剂化物,其选自腺苷、磷酸腺苷、鸟苷、磷酸鸟苷及其任何盐或溶剂化物。
[0211]
61.根据条款57
‑
60中任一项所述的多层药物或营养固体剂型,其中所述第一层包含至少一种嘧啶衍生物或其任何盐或溶剂化物,其选自尿苷、磷酸尿苷、胞苷、磷酸胞苷、胸苷、磷酸胸苷及其任何盐或溶剂化物,以及至少一种嘌呤衍生物或其任何盐或溶剂化物,其选自腺苷、磷酸腺苷及其任何盐或溶剂化物。
[0212]
62.根据条款57
‑
61中任一项所述的多层药物或营养固体剂型,其中所述第一层包含至少一种嘧啶衍生物或其任何盐或溶剂化物,其选自尿苷、磷酸尿苷、胞苷、磷酸胞苷及其任何盐或溶剂化物,以及至少一种嘌呤衍生物或其任何盐或溶剂化物,其选自腺苷、磷酸
腺苷及其任何盐或溶剂化物。
[0213]
63.根据条款1所述的多层药物或营养固体剂型,其中所述第一层包含至少一种嘌呤衍生物或其任何盐或溶剂化物。
[0214]
64.根据条款63所述的多层药物或营养固体剂型,其中所述第一层包含至少一种嘌呤衍生物或其任何盐或溶剂化物,其选自腺苷、腺苷酯、磷酸腺苷、鸟苷、鸟苷酯、磷酸鸟苷、肌苷、肌苷酯、磷酸肌苷、黄苷、黄苷酯、磷酸黄苷及其任何盐或溶剂化物。
[0215]
65.根据条款63或64所述的多层药物或营养固体剂型,其中所述第一层包含至少一种嘌呤衍生物或其任何盐或溶剂化物,其选自腺苷、磷酸腺苷、鸟苷、磷酸鸟苷、肌苷、磷酸肌苷、黄苷、磷酸黄苷及其任何盐或溶剂化物。
[0216]
66.根据条款63
‑
65中任一项所述的多层药物或营养固体剂型,其中所述第一层包含至少一种嘌呤衍生物或其任何盐或溶剂化物,其选自腺苷、磷酸腺苷、鸟苷、磷酸鸟苷及其任何盐或溶剂化物。
[0217]
67.根据条款63
‑
66中任一项所述的多层药物或营养固体剂型,其中所述第一层包含至少一种嘌呤衍生物或其任何盐或溶剂化物,其选自腺苷、磷酸腺苷及其任何盐或溶剂化物。
[0218]
68.根据条款57
‑
67中任一项所述的多层药物或营养固体剂型,其中所述第二层的选自b族维生素的所述至少一种维生素是维生素b1、b6和b
12
。
[0219]
69.根据条款57
‑
68中任一项所述的多层药物或营养固体剂型,其中所述第二层的选自b族维生素的所述至少一种维生素是维生素b
12
。
[0220]
70.根据条款57
‑
69中任一项所述的多层药物或营养固体剂型,其中所述第二层的选自b族维生素的所述至少一种维生素是氰钴胺、羟钴胺或甲钴胺形式的维生素b
12
。
[0221]
71.根据条款57
‑
70中任一项所述的多层药物或营养固体剂型,其中所述第二层的选自b族维生素的所述至少一种维生素是氰钴胺或羟钴胺形式的维生素b
12
。
[0222]
72.根据条款59
‑
71中任一项所述的多层药物或营养固体剂型,其中所述第二层的选自b族维生素的所述至少一种维生素是氰钴胺形式的维生素b
12
。
[0223]
73.根据条款69
‑
72中任一项所述的多层药物或营养固体剂型,其中所述第二层还包含维生素b1。
[0224]
74.根据前述条款所述的多层药物或营养固体剂型,其中维生素b1为盐酸硫胺素、硝酸硫胺素、焦磷酸硫胺素或二水合硫胺素单磷酸氯化物的形式。
[0225]
75.根据条款73或74所述的多层药物或营养固体剂型,其中维生素b1是硝酸硫胺素。
[0226]
76.根据条款69
‑
75中任一项所述的多层药物或营养固体剂型,其中所述第二层还包含维生素b6。
[0227]
77.根据前述条款所述的多层药物或营养固体剂型,其中维生素b6为盐酸吡哆醇或磷酸吡哆醛的形式。
[0228]
78.根据条款68
‑
77中任一项所述的多层药物或营养固体剂型,其中所述第二层包含维生素b1、b6和b
12
。
[0229]
79.根据前述条款所述的多层药物或营养固体剂型,其中所述第二层包含氰钴胺形式的维生素b
12
、盐酸吡哆醇形式的维生素b6和盐酸硫胺素或硝酸硫胺素形式的维生素
b1。
[0230]
80.根据前述条款所述的多层药物或营养固体剂型,其中所述第二层包含氰钴胺形式的维生素b
12
、盐酸吡哆醇形式的维生素b6和硝酸硫胺素形式的维生素b1。
[0231]
81.根据任一前述条款所述的多层药物或营养固体剂型,其中所述固体剂型是多层片剂。
[0232]
82.根据任一前述条款所述的多层药物或营养固体剂型,其中所述固体剂型是层压多层片剂或同心多层片剂。
[0233]
83.根据任一前述条款所述的多层药物或营养固体剂型,其中所述固体剂型是同心分层珠粒。
[0234]
84.根据任一前述条款所述的多层药物或营养固体剂型,其还包含第三层,所述第三层包含至少一种合适的药物或营养赋形剂。
[0235]
85.根据前述条款所述的多层药物或营养固体剂型,其中所述第三层放置在与所述第一层或所述第二层相邻的位置,或者与两者相邻放置。
[0236]
86.根据任一前述条款所述的多层药物或营养固体剂型,其中所述第一层包含至少一种合适的药物或营养赋形剂。
[0237]
87.根据任一前述条款所述的多层药物或营养固体剂型,其中所述第二层包含至少一种合适的药物或营养赋形剂。
[0238]
88.根据任一前述条款所述的多层药物或营养固体剂型,其包含总量为至少200mg的所述嘧啶衍生物及其任何盐、溶剂化物和盐溶剂化物,其中所述总量是考虑到所述嘧啶衍生物及其盐或溶剂化物中的每一种的相应等效碱形式来计算的。
[0239]
89.根据任一前述条款所述的多层药物或营养固体剂型,其包含总量在200mg至450mg的范围内,还更优选在250mg至450mg的范围内,还甚至更优选在250mg至430mg的范围内,更优选在300mg至420mg的范围内,以及甚至更优选在350mg至410mg的范围内的所述嘧啶衍生物、嘌呤衍生物及其任何盐或溶剂化物,其中所述总量是考虑到所述嘧啶衍生物及其盐或溶剂化物中的每一种的相应等效碱形式来计算的。
[0240]
90.根据条款1
‑
87中任一项所述的多层药物或营养固体剂型,其包含总量为至少200mg的所述嘧啶衍生物及其任何盐或溶剂化物,其中所述总量是考虑到所述嘧啶衍生物、嘌呤衍生物及其盐或溶剂化物中的每一种的相应等效碱形式来计算的。
[0241]
91.根据前述条款所述的多层药物或营养固体剂型,其包含总量在200mg至450mg的范围内,更优选在250mg至430mg的范围内,还更优选在300mg至420mg的范围内,甚至更优选在350mg至410mg的范围内,以及还甚至更优选为400mg的所述嘧啶衍生物、嘌呤衍生物及其任何盐或溶剂化物,其中所述总量是考虑到所述嘧啶衍生物、嘌呤衍生物及其盐或溶剂化物中的每一种的相应等效碱形式来计算的。
[0242]
92.根据条款1
‑
87中任一项所述的多层药物或营养固体剂型,其包含总量为至少200mg的所述嘧啶衍生物及其任何盐或溶剂化物,其中所述总量是考虑到所述嘌呤衍生物、嘌呤衍生物及其盐或溶剂化物中的每一种的相应等效碱形式来计算的。
[0243]
93.根据前述条款所述的多层药物或营养固体剂型,其包含总量在200mg至450mg的范围内,还更优选在250mg至450mg的范围内,还甚至更优选在250mg至430mg的范围内,更优选在300mg至420mg的范围内,以及甚至更优选在350mg至410mg的范围内的所述嘌呤衍生
物及其任何盐或溶剂化物,其中所述总量是考虑到所述嘌呤衍生物及其盐或溶剂化物中的每一种的相应等效碱形式来计算的。
[0244]
94.根据任一前述条款所述的多层药物或营养固体剂型,其中所述固体剂型在25℃和60%相对湿度下储存至少3个月,优选至少6个月后是稳定的。
[0245]
95.根据任一前述条款所述的多层药物或营养固体剂型,其中所述固体剂型在40℃和75%相对湿度下储存至少3个月,更优选在40℃和75%相对湿度下储存至少6个月后是稳定的。
[0246]
96.根据任一前述条款所述的多层药物或营养固体剂型,其中所述固体剂型在25℃和60%相对湿度下储存至少3个月,优选在25℃和60%相对湿度下储存至少6个月,更优选在40℃和75%相对湿度下储存至少3个月,以及还更优选在40℃和75%相对湿度下储存至少6个月后是稳定的。
[0247]
97.根据任一前述条款所述的多层药物或营养固体剂型,其中所述固体剂型当包装在pvc/pvdc铝箔泡罩中时,在25℃和60%相对湿度下储存至少3个月,优选在25℃和60%相对湿度下储存至少6个月,更优选在25℃和60%相对湿度下,在40℃和75%相对湿度下储存至少3个月,以及还更优选在40℃和75%相对湿度下储存至少6个月后是稳定的。
[0248]
98.一种用于生产根据条款1
‑
97中任一项所述的多层药物或营养固体剂型的方法,其包括:
[0249]
(i)通过筛分至少一种嘧啶衍生物、嘌呤衍生物或其任何盐或溶剂化物提供包含所述至少一种嘧啶衍生物、嘌呤衍生物或其任何盐或溶剂化物以及任选地至少一种合适的药物或营养赋形剂的第一层组合物,然后掺混所得混合物直至均匀;
[0250]
(ii)通过筛分选自b族微生素的至少一种维生素来提供包含选自b族微生素的所述至少一种维生素和任选地至少一种合适的药物或营养赋形剂的第二层组合物,然后掺混所得混合物直至均匀;并且
[0251]
(iii)压制所述第一层或第二层组合物中的一种,然后在前一层的上面或周围压制所述第一层或第二层组合物中的另一种以形成药物或营养固体剂型。
[0252]
99.一种用于生产根据条款1
‑
97中任一项所述的多层药物或营养固体剂型的方法,其包括:
[0253]
(i)通过筛分至少一种嘧啶衍生物或其任何盐或溶剂化物提供包含所述至少一种嘧啶衍生物或其任何盐或溶剂化物以及任选地至少一种合适的药物或营养赋形剂的第一层组合物,然后掺混所得混合物直至均匀;
[0254]
(ii)通过筛分选自b族微生素的至少一种维生素来提供包含选自b族微生素的至少一种维生素和任选地至少一种合适的药物或营养赋形剂的第二层组合物,然后掺混所得混合物直至均匀;并且
[0255]
(iii)压制所述第一层和第二层组合物中的一种,然后在前一层的上面或周围压制所述第一层和第二层组合物中的另一种以形成药物或营养固体剂型。
[0256]
100.一种用于生产根据条款1
‑
97中任一项所述的多层药物或营养固体剂型的方法,其包括:
[0257]
(i)通过筛分至少一种嘧啶衍生物、嘌呤衍生物或其任何盐或溶剂化物提供包含所述至少一种嘧啶衍生物、嘌呤衍生物或其任何盐或溶剂化物以及任选地至少一种合适的
药物或营养赋形剂的第一层组合物,然后掺混所得混合物直至均匀;
[0258]
(ii)通过筛分选自b族微生素的至少一种维生素来提供包含选自b族微生素的至少一种维生素和任选地至少一种合适的药物或营养赋形剂的第二层组合物,然后掺混所得混合物直至均匀;
[0259]
(iii)提供包含至少一种合适的药物或营养赋形剂的第三层组合物,所述赋形剂是惰性成分;并且
[0260]
(iv)压制第一或第二层组合物中的一种,然后在前一层的上面或周围压制第三层组合物,接着在第三层组合物的上面或周围压制第一或第二层组合物中的另一种。
[0261]
101.一种用于生产根据条款1
‑
97中任一项所述的多层药物或营养固体剂型的方法,其包括:
[0262]
(i)通过筛分至少一种嘧啶衍生物、嘌呤衍生物或其任何盐或溶剂化物提供包含所述至少一种嘧啶衍生物、嘌呤衍生物或其任何盐或溶剂化物以及任选地至少一种合适的药物或营养赋形剂的第一层组合物,然后掺混所得混合物直至均匀;
[0263]
(ii)通过筛分选自b族微生素的至少一种维生素来提供包含选自b族微生素的至少一种维生素和任选地至少一种合适的药物或营养赋形剂的第二层组合物,然后掺混所得混合物直至均匀;
[0264]
(iii)提供包含至少一种合适的药物或营养赋形剂的第三层组合物,所述赋形剂是惰性成分;并且
[0265]
(iv)压制第一或第二层组合物中的一种,然后在前一层的上面或周围压制第三层组合物,接着在第三层组合物的上面或周围压制第一或第二层组合物中的另一种。
[0266]
102.一种用于生产根据条款1
‑
97中任一项所述的多层药物或营养固体剂型的方法,其包括:
[0267]
(i)通过筛分至少一种嘧啶衍生物、嘌呤衍生物或其任何盐或溶剂化物提供包含所述至少一种嘧啶衍生物、嘌呤衍生物或其任何盐或溶剂化物以及任选地至少一种合适的药物或营养赋形剂的第一层组合物,然后掺混所得混合物直至均匀,并且随后压制所得混合物以形成芯层;
[0268]
(ii)提供包含选自b族维生素的至少一种微生物和任选地至少一种合适的药物或营养赋形剂的第二层组合物,其中所述成分分散或溶解在水或有机溶剂中分别形成水性或有机分散体或溶液;并且
[0269]
(iii)使用包衣方式将步骤(ii)的所得分散体或溶液施加到步骤(i)中获得的芯层上。
[0270]
103.一种用于生产根据条款1
‑
97中任一项所述的多层药物或营养固体剂型的方法,其包括:
[0271]
(i)通过筛分至少一种嘧啶衍生物、嘌呤衍生物或其任何盐或溶剂化物提供包含所述至少一种嘧啶衍生物、嘌呤衍生物或其任何盐或溶剂化物以及任选地至少一种合适的药物或营养赋形剂的第一层组合物,然后掺混所得混合物直至均匀,并且随后压制所得混合物以形成芯层;
[0272]
(ii)提供包含至少一种合适的药物或营养赋形剂的第三层组合物;优选地,第三层组合物包含至少一种成膜剂,其更优选地选自羟丙基甲基纤维素、聚乙烯醇和部分水解
的聚乙烯醇;其中使用包衣方式将第三层组合物施加到步骤(1)中获得的芯层上;
[0273]
(iii)提供包含选自b族维生素的至少一种微生物和任选地至少一种合适的药物或营养赋形剂的第二层组合物,其中所述成分分散或溶解在水或有机溶剂中分别形成水性或有机分散体或溶液;并且
[0274]
(iv)使用包衣方式将步骤(iii)的所得分散体或溶液施加到步骤(ii)中获得的芯层上。
[0275]
104.根据条款1
‑
97中任一项所述的多层药物或营养固体剂型,其可通过根据条款98
‑
103中任一项的工艺获得。
[0276]
105.根据条款1
‑
97中任一项所述的多层药物或营养固体剂型,其通过根据条款98
‑
103中任一项的工艺获得。
[0277]
106.根据条款1
‑
97中任一项所述的多层药物或营养固体剂型,其分别用于制造用于治疗和/或预防周围神经病变的药剂或营养产品。
[0278]
107.根据条款106使用的多层药物或营养固体剂型,其中所述周围神经病变选自多发性周围神经病变、周围神经根病、灼痛和反射交感性营养不良、乳房切除术后神经痛、术后神经痛和疼痛、外阴前庭炎、幻肢痛、丘脑综合征(中枢性中风后疼痛)、颞下颌关节综合征、跖骨痛(莫顿神经痛)和由神经压迫造成的神经源性疼痛。
[0279]
108.根据条款1
‑
97中任一项所述的多层药物或营养固体剂型在治疗和/或预防周围神经病变中的用途。
[0280]
109.根据条款108所述的用途,其中所述周围神经病变选自多发性周围神经病变、周围神经根病、灼痛和反射交感性营养不良、乳房切除术后神经痛、术后神经痛和疼痛、外阴前庭炎、幻肢痛、丘脑综合征(中枢性中风后疼痛)、颞下颌关节综合征、跖骨痛(莫顿神经痛)和由神经压迫造成的神经源性疼痛。
[0281]
110.根据条款1
‑
97中任一项所述的多层药物或营养固体剂型,其用于治疗和/或预防周围神经病变。
[0282]
111.根据权利要求110所述的多层药物或营养固体剂型,其中所述周围神经病变选自多发性周围神经病变、周围神经根病、灼痛和反射交感性营养不良、乳房切除术后神经痛、术后神经痛和疼痛、外阴前庭炎、幻肢痛、丘脑综合征(中枢性中风后疼痛)、颞下颌关节综合征、跖骨痛(莫顿神经痛)和由神经压迫造成的神经源性疼痛。
[0283]
实施例
[0284]
现在将参考以下实施例更详细地描述本发明,这些实施例不得解释为限制本发明的范围。
[0285]
实施例1
‑
本发明的示例性多层药物或营养固体剂型
[0286]
包含至少一种嘧啶衍生物、嘌呤衍生物或其任何溶剂化物盐和维生素b的以下说明性通用固体剂型可以使用本发明的工艺容易地制备(如实施例2和7中所示例):
[0287][0288][0289][0290]
实施例2
‑
根据本发明第二方面制备本发明的双层药物或营养固体剂型的示例性工艺
[0291]
第1层制造:根据批次配方称取原料(即ump
·
2na、cmp
·
2na或酸形式的cmp、微晶纤维素和胶体二氧化硅),然后通过中型孔筛进行筛分,稍后在掺合器中掺混至均匀。之后,使用小型孔筛筛分硬脂酸镁并与先前的混合物掺混,直至观察到均匀。
[0292]
第2层制造:根据批次配方称取原料(即维生素b1、维生素b6、维生素b
12
、甘露醇、氧化铁、微晶纤维素、胶体二氧化硅),然后通过中型孔筛进行筛分,稍后在掺合器中掺混至均匀。然后通过中型网孔筛分所得掺混物,然后再次掺混。之后,根据批次配方称取硬脂酸镁,使用小型孔筛进行筛分,然后与先前的混合物掺混,直至观察到均匀。
[0293]
压片:根据以下示例性重量,首先在多层压片机中压制第1层,然后将第2层负载到第1层上,随后压制形成双层片剂:
[0294]
‑
第1层:650mg
[0295]
‑
第2层:200mg
[0296]
‑
总重量:850mg
[0297]
实施例3
‑
根据本发明的多层药物或营养固体剂型(ump
·
2na、cmp
·
2na/酸形式的cmp、硝酸硫胺素、盐酸吡哆醇、氰钴胺)
[0298]
示例性的双层片剂(dg186106b1、dg186108b1和18631n1101批次)用以下组合物并根据实施例2中描述的工艺制备:
[0299][0300][0301]1386.487mg实际上相当于考虑到含水量后264.200mg碱形式的ump。
[0302]2127.994mg实际上相当于考虑到含水量后88.000mg碱形式的cmp。
[0303]3103.918mg实际上相当于考虑到含水量后100.000mg碱形式的cmp。
[0304]4379.747mg实际上相当于考虑到含水量后264.200mg碱形式的ump。
[0305]5129.441mg实际上相当于考虑到含水量后88.000mg碱形式的cmp。
[0306]
实施例4
‑
根据本发明的多层药物或营养固体剂型(ump
·
2na、cmp
·
2na、硝酸硫胺素、盐酸吡哆醇、氰钴胺)的稳定性测试
[0307]
进行在pvc/pvdc铝箔泡罩中的,根据实施例2制备的实施例3的两种双层固体剂型(dg186106b1双层片剂批次
‑
ump
·
2na、cmp
·
2na、硝酸硫胺、盐酸吡哆醇和氰钴胺;dg186108b1双层片剂批次
‑
ump
·
2na、酸形式的cmp、硝酸硫胺素、盐酸吡哆醇和氰钴胺)的稳定性测试。结果可总结如下(t=1.5和3.0个月时的测定结果相对于时间t=0时的实际值表示,已经将该实际值认为是100%;%测定通过hplc计算):
[0308][0309][0310]
实施例5
‑
根据本发明第三方面制备本发明的双层药物或营养固体剂型的示例性工艺
[0311]
第1层制造:根据批次配方称取原料(即ump
·
2na、cmp
·
2na或酸形式的cmp、微晶纤维素、羟丙基纤维素和胶体二氧化硅),然后通过中型孔筛进行筛分,稍后在掺合器中掺混至均匀。之后,使用小型孔筛筛分硬脂酸镁并与先前的混合物掺混,直至观察到均匀。
[0312]
第2层制造:根据批次配方称取原料(即维生素b1、维生素b6、维生素b
12
、甘露醇、氧化铁、微晶纤维素和羟丙基纤维素),然后通过中型孔筛进行筛分并且在水的存在下制粒。使用小型孔筛筛分胶体二氧化硅,以及就微晶纤维素的总量而言相当于2.7重量%的微晶纤维素,然后与先前的混合物掺混,直至观察到均匀。之后,还称取硬脂酸镁,使用小型孔筛进行筛分,然后添加到所得掺混物上并掺混直至获得均匀性。
[0313]
压片:根据以下示例性重量,首先在多层压片机中压制第1层,然后将第2层负载到第1层上并压制形成双层片剂:
[0314]
第1层:650mg 第2层:200mg 总重量:850mg
[0315]
实施例6
‑
根据本发明的多层药物或营养固体剂型(ump
·
2na、cmp
·
2na/酸形式的cmp、硝酸硫胺素、氰钴胺)
[0316]
示例性的双层片剂(dg186070a1和dg186072a1批次)用以下组合物并根据实施例5中描述的工艺制备:
[0317][0318]1386.487mg实际上相当于考虑到含水量后264.200mg碱形式的ump。
[0319]2127.994mg实际上相当于考虑到含水量后88.000mg碱形式的cmp。
[0320]3103.386mg实际上相当于考虑到含水量后100.000mg碱形式的cmp。
[0321]
实施例7
‑
根据本发明的多层药物或营养固体剂型(ump
·
2na、cmp
·
2na、硝酸硫胺素、盐酸吡哆醇、氰钴胺)
[0322]
示例性的三层片剂(批次dg186087a1和dg186089a1)用下述组合物并根据本发明第三方面的工艺制备,即:
[0323]
第1层制造:根据批次配方称取原料(即ump
·
2na、cmp
·
2na或酸形式的cmp、微晶纤维素、羟丙基纤维素和胶体二氧化硅),然后通过中型孔筛进行筛分,稍后在掺合器中掺混至均匀。之后,称取硬脂酸镁,使用小型孔筛筛分并与先前的混合物掺混,直至观察到均匀。
[0324]
第2层制造:根据批次配方称取原料(即维生素b1、维生素b6、维生素b12、羟丙基纤维素、红色氧化铁e
‑
172和微晶纤维素),然后通过中型孔筛进行筛分并且在水的存在下制粒。使用小型孔筛筛分胶体二氧化硅,以及就微晶纤维素的总量而言相当于2.7重量%的微晶纤维素,然后与先前的混合物掺混,直至观察到均匀。之后,还称取硬脂酸镁,使用小型孔筛进行筛分,然后添加到所得掺混物上并掺混直至获得均匀性。
[0325]
第3层(惰性层)制造:根据批次配方称取就微晶纤维素的总量而言其量为20重
量%的微晶纤维素与红色氧化铁e
‑
172,然后通过中型孔筛进行筛分并掺混直至均匀。然后,将剩余80重量%的微晶纤维素也以同样的方法进行筛分,然后添加到先前的混合物中,之后将硬脂酸镁也相应地进行筛分,然后添加到先前的掺混物中。掺混所得混合物直至均匀。
[0326]
压片:首先在多层压片机中压制第1层,然后将第3层负载到第1层上并压制形成双层片剂。之后,将第2层负载到第3层上并根据以下示例性重量压制形成相应的三层片剂:
[0327]
‑
第1层:650mg
[0328]
‑
第2层:200mg
[0329]
‑
第3层:200mg
[0330]
‑
总重量:1050mg
[0331]
三层片剂(即dg186087a1和dg186089a1批次)的组成如下:
[0332][0333]
[0334]1386.487mg实际上相当于考虑到含水量后264.200mg碱形式的ump。
[0335]2127.994mg实际上相当于考虑到含水量后88.000mg碱形式的cmp。
[0336]3103.386mg实际上相当于考虑到含水量后100.000mg碱形式的cmp。
[0337]
比较例1
‑
包含ump
·
2na、cmp
·
2na、硝酸硫胺素、盐酸吡哆醇和氰钴胺的单层固体剂型
[0338]
以下列方式制备用于比较目的的单层片剂(dg186075a1批次):
[0339]
根据批次配方称取ump
·
2na、cmp
·
2na、微晶纤维素、羟丙基纤维素和胶体二氧化硅,然后通过中型孔筛进行筛分,稍后在掺合器中掺混至均匀。之后,使用小型孔筛筛分硬脂酸镁并与先前的混合物掺混,直至观察到均匀。
[0340]
并行地,根据批次配方称取维生素b1、维生素b6、维生素b
12
、甘露醇、氧化铁、微晶纤维素和羟丙基纤维素,然后通过中型孔筛进行筛分并且在水的存在下制粒。使用小型孔筛筛分胶体二氧化硅,以及就微晶纤维素的总量而言相当于2.7重量%的微晶纤维素,然后与先前的混合物掺混,直至观察到均匀。之后,还称取硬脂酸镁,使用小型孔筛进行筛分,然后添加到所得掺混物上并掺混直至获得均匀性。然后将该第二掺混物添加到含有ump
·
2na和cmp
·
2na的第一掺混物中,然后将所得掺混物混合直至均匀,然后在压片机中压制成单层片剂。
[0341]
该固体剂型的组成与实施例6的先前固体剂型之一相同,即对应于dg186070a1双层片剂批次的一种,不同之处在于它是单层片剂而不是双层片剂的形式。
[0342][0343]
1.
386.487mg实际上相当于考虑到含水量后264.200mg碱形式的ump。
[0344]
2.
127.994mg实际上相当于考虑到含水量后88.000mg碱形式的cmp。
[0345]
实施例8
‑
实施例6、实施例7和比较例1的多层药物或营养固体剂型的稳定性测试
[0346]
对以下固体剂型进行了稳定性测试:
[0347]
‑
实施例6的双层片剂(dg186070a1和dg186072a1批次);
[0348]
‑
实施例7的三层片剂(dg186087a1和dg186089a1批次);和
[0349]
‑
比较例1的单层片剂(dg186075a1批次)。
[0350]
在下表中总结了获得的结果(t=1.5个月时的测定结果相对于时间t=0时的实际值表示,已经将该实际值认为是100%;%测定通过hplc计算):
[0351]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1