一种放疗计划危及器官剂量体积直方图的预测方法和装置与流程
本发明涉及医学放射治疗技术领域,具体涉及一种放疗计划危及器官剂量体积直方图的预测方法和装置。
背景技术:
放射治疗(radiotherapy,rt)是肿瘤治疗的重要手段,超过50%的肿瘤患者都需要接受姑息性或根治性放疗,其中调强放射治疗(imrt)、固定野调强放疗(fb-imrt)、容积旋转调强放疗(vmat)和螺旋断层调强放疗(tomo))是目前肿瘤放疗的主流技术手段。imrt计划的目的是在确保肿瘤靶区获得足够照射剂量的同时,尽可能减少靶区周边正常组织和危及器官的受照剂量。但是,imrt计划设计复杂并且耗时,依赖设计者的经验和设计时间,考虑到我国人口众多、城乡区域发展不均衡、医疗水平差距大,不同肿瘤中心设计的计划质量存在较大的差异,这种差异可能会导致质量不佳的治疗计划出现,将直接影响患者的预后以及导致放疗副反应的发生。
imrt计划设计耗时、差异大的根本原因在于计划需要设定、调整数个、甚至数十个优化条件。目前这些优化条件的设置都是计划设计者根据临床处方剂量要求,凭借自身知识和经验,反复多次调整来完成的。不同的计划设计者的知识、经验存在较大差异,直接影响最终的计划质量。并且,临床对肿瘤的处方剂量要求和对危及器官的限量要求是基于人群数据、rtog指南和放疗医生临床知识和直觉等因素确定的,其转化成的目标函数只是对某些患者适用,但对于具有不同的靶区和危及器官解剖结构的患者,目标函数要么容易实现而不能设计出最优的治疗计划使危及器官得不到更好的保护,要么无法实现而不能设计出满足靶区处方剂量要求的治疗计划。因此,根据肿瘤患者个体化解剖结构特点预测可以实现的危及器官剂量体积直方图是合理设置优化条件、保证计划质量的关键,也是实现患者个体化计划质控的关键。现有的研究方法大体是从已有计划数据库中提取患者的部分解剖结构信息(例如ovh,dth等)建立危及器官受照剂量与解剖结构之间的参数化模型,预测新患者危及器官剂量指标或dvh。但是在临床实践中,上述方法需要手动提取特征,并且这些特征不能涵盖患者所有解剖结构特点,尤其是对于复杂的肿瘤类型(头颈部肿瘤),降低了临床应用的准确性和适用范围。
技术实现要素:
为了克服上述现有技术中的不足,本发明提供一种放疗计划危及器官剂量体积直方图的预测方法,包括:
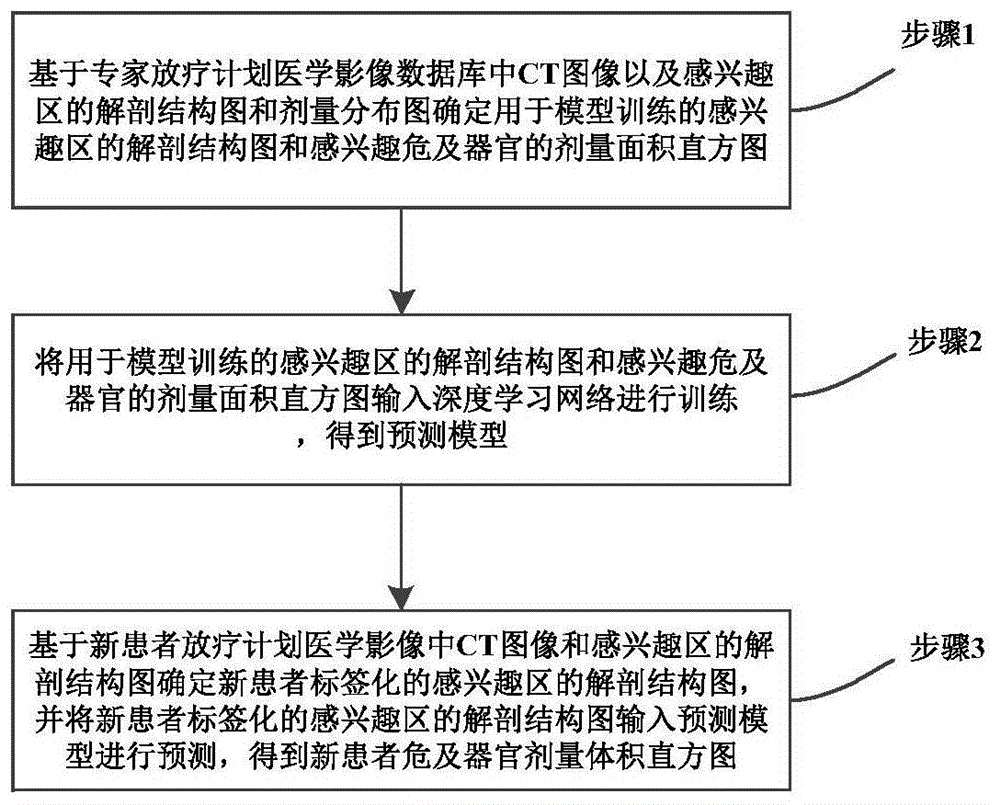
步骤1:基于专家放疗计划医学影像数据库中ct图像以及感兴趣区的解剖结构图和剂量分布图确定用于模型训练的感兴趣区的解剖结构图和感兴趣危及器官的剂量面积直方图;
步骤2:将所述用于模型训练的感兴趣区的解剖结构图和感兴趣危及器官的剂量面积直方图输入深度学习网络进行训练,得到预测模型;
步骤3:基于新患者放疗计划医学影像中ct图像和感兴趣区的解剖结构图确定新患者标签化的感兴趣区的解剖结构图,并将所述新患者标签化的感兴趣区的解剖结构图输入所述预测模型进行预测,得到新患者危及器官剂量体积直方图。
所述步骤1具体包括以下步骤:
步骤1-1:基于专家放疗计划医学影像数据库中ct图像对专家放疗计划医学影像数据库中感兴趣区的解剖结构进行解析,并对解析后的感兴趣区的解剖结构图进行标签化处理,得到标签化的感兴趣区的解剖结构图;
步骤1-2:基于所述标签化的感兴趣区解剖结构,考虑靶区和危及器官的可能空间位置关系,得到用于模型训练的感兴趣区的解剖结构图,所述用于模型训练的感兴趣区的解剖结构图包括靶区与感兴趣危及器官、靶区、感兴趣危及器官;
步骤1-3:基于专家放疗计划医学影像数据库中ct图像对专家放疗计划医学影像数据库中感兴趣区的解剖结构图和剂量分布图进行解析,并对解析后的解剖结构图和剂量分布图进行标签化处理,得到标签化的感兴趣区的解剖结构图和剂量分布图;
步骤1-4:基于所述标签化的感兴趣区的解剖结构图和剂量分布图生成感兴趣危及器官的剂量面积直方图。
步骤2具体包括以下步骤:
步骤2-1:将用于模型训练的感兴趣区的解剖结构图和感兴趣危及器官的剂量面积直方图输入深度学习网络进行训练,得到危及器官剂量面积分布;
步骤2-2:基于所述危及器官剂量面积分布确定所述预测模型。
所述步骤3具体包括以下步骤:
步骤3-1:在所述新患者放疗计划医学影像ct图像中勾画感兴趣区的解剖结构,基于ct图像和感兴趣区的解剖结构图对感兴趣区解剖结构进行解析,得到三维矩阵形式的感兴趣区解剖结构,并对所述三维矩阵形式的感兴趣区解剖结构进行标签化处理,得到标签化的感兴趣区解剖结构;
步骤3-2:基于所述标签化的感兴趣区解剖结构获取新患者标签化的感兴趣区的解剖结构图,所述新患者标签化的感兴趣区的解剖结构图包括靶区与感兴趣危及器官、靶区、感兴趣危及器官;
步骤3-3:将所述新患者标签化的感兴趣区的解剖结构图输入所述预测模型,生成新患者危及器官剂量面积分布,并对所述新患者危及器官剂量面积分布进行取整处理;
步骤3-4:将所述新患者危及器官剂量面积分布进行逐层累加得到剂量体积分布,并基于所述剂量体积分布确定新患者危及器官剂量体积直方图。
所述步骤1-1具体包括以下步骤:
步骤1-1-1:读取所述专家放疗计划医学影像数据库中ct图像,将所述专家放疗计划医学影像数据库中ct图像按照正确的层数序列进行排序,确定并调整层内和层间的图像分辨率;
步骤1-1-2:读取所述专家放疗计划医学影像数据库中感兴趣区的解剖结构图,按照专家放疗计划医学影像数据库中ct图像的层面顺序对感兴趣区的解剖结构图进行解析,得到解析后的感兴趣区的解剖结构图;
步骤1-1-3:将解析后的感兴趣区的解剖结构图与放疗计划系统中的感兴趣区的解剖结构图进行比对,若解析后的感兴趣区的解剖结构图与放疗计划系统中的感兴趣区的解剖结构图不匹配,返回步骤1-1-2重新执行,直至解析后的感兴趣区的解剖结构图与放疗计划系统中的感兴趣区的解剖结构图匹配;
步骤1-1-4:基于感兴趣区的解剖结构图的分辨率与ct图像保持一致原则对解析后的感兴趣区的解剖结构图进行标签化处理,如果出现重叠区域,按照体轮廓、靶区和危及器官的顺序对感兴趣解剖结构依次进行累加标签化,得到标签化的感兴趣区的解剖结构图。
所述步骤1-3具体包括以下步骤:
步骤1-3-1:读取所述专家放疗计划医学影像数据库中ct图像,将所述专家放疗计划医学影像数据库中ct图像按照正确的层数序列进行排序,确定并调整层内和层间的图像分辨率;
步骤1-3-2:读取所述专家放疗计划医学影像数据库中感兴趣区的解剖结构图,按照专家放疗计划医学影像数据库中ct图像的层面顺序对感兴趣区的解剖结构图进行解析,得到解析后的感兴趣区的解剖结构图;
步骤1-3-3:读取所述专家放疗计划医学影像数据库中的剂量分布图,按照专家放疗计划医学影像数据库中ct图像的层面顺序对读取的剂量分布图进行解析,得到解析后的剂量分布图;
步骤1-3-4:将解析后的感兴趣区的解剖结构图与专家放疗计划医学影像数据库中的感兴趣区的解剖结构图进行比对,若解析后的感兴趣区的解剖结构图与专家放疗计划医学影像数据库的感兴趣区的解剖结构图不匹配,返回步骤1-3-2重新执行,直至解析后的感兴趣区的解剖结构图与专家放疗计划医学影像数据库中的感兴趣区的解剖结构图匹配;
步骤1-3-5:将解析后的剂量分布图与专家放疗计划医学影像数据库中的剂量分布图进行比对,若解析后的剂量分布图与专家放疗计划医学影像数据库中的剂量分布图不匹配,返回步骤1-3-3重新执行,直至解析后的剂量分布图与专家放疗计划医学影像数据库中的剂量分布图一致;
步骤1-3-6:按照感兴趣区的解剖结构图的分辨率与ct图像保持一致原则调整解析后的感兴趣区的解剖结构图的分辨率,并对调整后的解剖结构图进行标签化处理,得到标签化的感兴趣区的解剖结构图;
步骤1-3-7:按照解析后的剂量分布图与ct图像保持一致原则调整解析后的剂量分布图的分辨率,得到调整后的剂量分布图。
所述步骤1-4具体包括以下步骤:
步骤1-4-1:对于感兴趣危及器官,按照从头到脚的方向逐层遍历,在每层内按照层内的分辨率逐像素统计危及器官内的剂量数值;
步骤1-4-2:基于统计的危及器官内的剂量数值,按下式确定剂量面积直方图曲线:
式中,dah(d)为剂量面积直方图曲线,d表示剂量,a表示危及器官在层面内的面积,dmax表示危及器官在层面内的最大剂量,da(d)/dd是微分剂量面积直方图;
步骤1-4-3:对所述剂量面积直方图曲线进行验证,若所述剂量面积直方图曲线验证通过,执行步骤1-4-4,否则返回步骤1-4-1重新执行,直至所述剂量面积直方图曲线验证通过;具体验证过程包括:
1)将所述剂量面积直方图曲线逐层累加,得到初步的感兴趣危及器官的剂量体积曲线;
2)将所述初步的感兴趣危及器官的剂量体积曲线与专家放疗计划医学影像数据库中的剂量体积曲线进行对比,若初步的感兴趣危及器官的剂量体积曲线与专家放疗计划医学影像数据库中的剂量体积曲线匹配,确定初步的感兴趣危及器官的剂量体积曲线即为最终的感兴趣危及器官的剂量体积曲线;若初步的感兴趣危及器官的剂量体积曲线与专家放疗计划医学影像数据库中的剂量体积曲线不匹配,则调整所述剂量面积直方图曲线,直至得到与专家放疗计划医学影像数据库中的剂量体积曲线匹配的感兴趣危及器官的剂量体积曲线;
步骤1-4-4:将所述感兴趣危及器官的剂量面积曲线的横轴剂量按照输入数据的横轴分辨率进行分割,并将所述感兴趣危及器官的剂量面积曲线的纵轴面积按照输入数据的纵轴分辨率进行分割,之后将所述剂量面积曲线下的区域填充为数值1,将所述剂量面积曲线上的区域填充为数值0,得到感兴趣危及器官的剂量面积直方图。
所述步骤2-2具体包括以下步骤:
步骤2-2-1:对危及器官剂量面积分布进行取整后处理,对所述危及器官剂量面积分布进行逐层累加,得到剂量体积分布,并将0或1填充的剂量体积分布转换为横轴是剂量、纵轴是体积的危及器官剂量体积曲线;
步骤2-2-2:基于临床剂量体积曲线对所述危及器官剂量体积曲线进行测试,得到最终的预测模型。
所述步骤2-2-2中,基于临床剂量体积曲线,通过平均绝对误差或相似性指数对所述危及器官剂量体积曲线进行测试;
其中,通过平均绝对误差对所述危及器官剂量体积曲线进行测试,包括:
(1)从所述危及器官剂量体积曲线上提取危及器官的剂量或剂量-体积的指标;
(2)基于提取的危及器官的剂量或剂量-体积的指标,按下式计算平均绝对误差:
式中,mae表示平均绝对误差,n表示测试数据集样本数,
(3)将所述平均绝对误差与预设的误差阈值比较,若所述平均绝对误差小于等于预设的误差阈值,确定所述危及器官剂量体积曲线通过测试,得到最终的预测模型,否则,返回步骤1,直至重新得到的所述危及器官剂量体积曲线通过测试;
其中,通过相似性指数对所述危及器官剂量体积曲线进行测试,包括:
(1)分别获取测试患者的临床危及器官剂量体积曲线下包围的面积和测试患者的预测危及器官剂量体积曲线的下包围面积;
(2)基于获取的面积,按下式计算相似性指数:
式中,
(3)将所述相似性指数与预设的指数阈值比较,若所述相似性指数大于等于预设的指数阈值,确定所述危及器官剂量体积曲线通过测试,得到最终的预测模型,否则,返回步骤1,直至重新得到的所述危及器官剂量体积曲线通过测试。
基于同一发明构思,本发明还提供一种放疗计划危及器官剂量体积直方图的预测装置,包括:
确定模块,用于基于专家放疗计划医学影像数据库中ct图像以及感兴趣区的解剖结构图和剂量分布图确定用于模型训练的感兴趣区的解剖结构图和感兴趣危及器官的剂量面积直方图;
建模模块,用于将所述用于模型训练的感兴趣区的解剖结构图和感兴趣危及器官的剂量面积直方图输入深度学习网络进行训练,得到预测模型;
预测模块,用于基于新患者放疗计划医学影像中ct图像和感兴趣区的解剖结构图确定新患者标签化的感兴趣区的解剖结构图,并将所述新患者标签化的感兴趣区的解剖结构图输入所述预测模型进行预测,得到新患者危及器官剂量体积直方图。
与最接近的现有技术相比,本发明提供的技术方案具有以下有益效果:
本发明提供的放疗计划危及器官剂量体积直方图的预测方法中,基于专家放疗计划医学影像数据库中ct图像以及感兴趣区的解剖结构图和剂量分布图确定用于模型训练的感兴趣区的解剖结构图和感兴趣危及器官的剂量面积直方图;将所述用于模型训练的感兴趣区的解剖结构图和感兴趣危及器官的剂量面积直方图输入深度学习网络进行训练,得到预测模型;基于新患者放疗计划医学影像中ct图像和感兴趣区的解剖结构图确定新患者标签化的感兴趣区的解剖结构图,并将所述新患者标签化的感兴趣区的解剖结构图输入所述预测模型进行预测,得到新患者危及器官剂量体积直方图,预测耗时短,准确度高;
通过本发明技术方案得到的新患者危及器官剂量体积直方图是从优质的放疗计划数据库中获得,确保了放疗计划质量,避免了不同水平设计者带来的计划质量差异大的问题,根据建立的预测模型实现放疗计划危及器官剂量体积直方图的预测,为放疗计划质量控制提供坚实的基础;
本发明提供的技术方案能够适用于具有多种处方剂量的靶区和多种不同的危及器官解剖结构的患者;
本发明提供的技术方案不局限于肿瘤类型,能够对不同肿瘤类型进行预测,临床应用范围较广;
本发明提供的技术方案能够实现个体化逆向计划初始目标函数自动化设置以及计划质量检查,提高放疗计划设计质量并缩短设计时间,解决精准放疗计划设计耗时和计划质量差异大的问题。
附图说明
图1是本发明实施例中放疗计划危及器官剂量体积直方图的预测方法流程图;
图2是本发明实施例中放疗计划危及器官剂量体积直方图的预测装置结构图;
图3是本发明实施例中测试患者的左侧腮腺临床和预测dvh曲线比较结果图;
图4是本发明实施例中测试患者的右侧腮腺临床和预测dvh曲线比较结果图;
图5是本发明实施例中测试数据集上临床和预测dvh曲线下面积的相似性指数示意图。
具体实施方式
下面结合附图对本发明作进一步详细说明。
实施例1
本发明实施例1提供了一种放疗计划危及器官剂量体积直方图(dosevolumehistogram,dvh)的预测方法,具体流程图如图1所示,具体过程如下:
步骤1:基于专家放疗计划医学影像数据库中ct图像以及感兴趣区(体轮廓-靶区-危及器官)的解剖结构图和剂量分布图确定用于模型训练的感兴趣区的解剖结构图和感兴趣危及器官的剂量面积直方图(doseareahistogram,dah);
步骤1中,建立专家放疗计划医学影像数据库,选择依据为放疗计划数据完整,感兴趣区的解剖结构勾画清晰,勾画原则严格按照临床指导规范并由高年资放疗医生确认,选取的放疗计划经过高年资物理师和放疗医生共同确认,以确保选取优质的放疗计划。通过放疗计划系统中的脚本程序,实现统一感兴趣区[体轮廓-靶区-危及器官]解剖结构的命名,并确定靶区的处方剂量。利用批量恢复放疗计划数据的技术,获取放疗计划数据文件(rtdicom),其中rtdicom包括ct图像、感兴趣区的解剖结构图、剂量分布图和放疗计划文件,并对rtdicom进行匿名化处理,建立[ct图像]-[感兴趣区的解剖结构图]-[剂量分布图]-[放疗计划文件]的数据库。步骤1具体包括以下步骤:
步骤1-1:基于专家放疗计划医学影像数据库中ct图像对专家放疗计划医学影像数据库中感兴趣区的解剖结构进行解析,并对解析后的感兴趣区的解剖结构图进行标签化处理,得到标签化的感兴趣区的解剖结构图;
步骤1-1中,将ct图像和感兴趣区的解剖结构图导入图像提取算法,解析感兴趣区解剖结构为三维矩阵形式并进行标签化处理,其中感兴趣区的解剖结构在标签化过程中,如果有重叠区域的出现,按照体轮廓、靶区和危及器官的顺利依次进行累加标签化;其中图像提取算法是基于matlab开发的,可以成功从rtdicom格式数据中提取出感兴趣区的解剖结构图,如果存在多个不同处方剂量的靶区,图像提取算法可以自动识别并记录放疗计划的处方剂量和靶区数目,并归入同一放疗计划数据库;步骤1-1具体包括以下步骤:
步骤1-1-1:读取专家放疗计划医学影像数据库中ct图像,将专家放疗计划医学影像数据库中ct图像按照正确的层数序列进行排序,确定并调整层内和层间的图像分辨率;
步骤1-1-2:读取专家放疗计划医学影像数据库中感兴趣区的解剖结构图,按照专家放疗计划医学影像数据库中ct图像的层面顺序对感兴趣区的解剖结构图进行解析,得到解析后的感兴趣区的解剖结构图;
步骤1-1-3:将解析后的感兴趣区的解剖结构图与放疗计划系统中的感兴趣区的解剖结构图进行比对,若解析后的感兴趣区的解剖结构图与放疗计划系统中的感兴趣区的解剖结构图不匹配,返回步骤1-1-2重新执行,直至解析后的感兴趣区的解剖结构图与放疗计划系统中的感兴趣区的解剖结构图匹配;
步骤1-1-4:基于感兴趣区的解剖结构图的分辨率与ct图像保持一致原则对解析后的感兴趣区的解剖结构图进行标签化处理,如果出现重叠区域,按照体轮廓、靶区和危及器官的顺序对感兴趣解剖结构依次进行累加标签化,得到标签化的感兴趣区的解剖结构图。
步骤1-2:基于标签化的感兴趣区解剖结构,考虑靶区和危及器官的可能空间位置关系,得到用于模型训练的感兴趣区的解剖结构图,用于模型训练的感兴趣区的解剖结构图包括靶区与感兴趣危及器官、靶区、感兴趣危及器官,还包括感兴趣危及器官和其他危及器官;
步骤1-3:基于专家放疗计划医学影像数据库中ct图像对专家放疗计划医学影像数据库中感兴趣区的解剖结构图和剂量分布图进行解析,并对解析后的解剖结构图和剂量分布图进行标签化处理,得到标签化的感兴趣区的解剖结构图和剂量分布图;步骤1-3具体包括以下步骤:
步骤1-3-1:读取专家放疗计划医学影像数据库中ct图像,将专家放疗计划医学影像数据库中ct图像按照正确的层数序列进行排序,确定并调整层内和层间的图像分辨率;
步骤1-3-2:读取专家放疗计划医学影像数据库中感兴趣区的解剖结构图,按照专家放疗计划医学影像数据库中ct图像的层面顺序对感兴趣区的解剖结构图进行解析,得到解析后的感兴趣区的解剖结构图;
步骤1-3-3:读取专家放疗计划医学影像数据库中的剂量分布图,按照专家放疗计划医学影像数据库中ct图像的层面顺序对读取的剂量分布图进行解析,得到解析后的剂量分布图;
步骤1-3-4:将解析后的感兴趣区的解剖结构图与专家放疗计划医学影像数据库中的感兴趣区的解剖结构图进行比对,若解析后的感兴趣区的解剖结构图与专家放疗计划医学影像数据库的感兴趣区的解剖结构图不匹配,返回步骤1-3-2重新执行,直至解析后的感兴趣区的解剖结构图与专家放疗计划医学影像数据库中的感兴趣区的解剖结构图匹配;
步骤1-3-5:将解析后的剂量分布图与专家放疗计划医学影像数据库中的剂量分布图进行比对,若解析后的剂量分布图与专家放疗计划医学影像数据库中的剂量分布图不匹配,返回步骤1-3-3重新执行,直至解析后的剂量分布图与专家放疗计划医学影像数据库中的剂量分布图一致;
步骤1-3-6:按照感兴趣区的解剖结构图的分辨率与ct图像保持一致原则调整解析后的感兴趣区的解剖结构图的分辨率,并对调整后的解剖结构图进行标签化处理,得到标签化的感兴趣区的解剖结构图;
步骤1-3-7:按照解析后的剂量分布图与ct图像保持一致原则调整解析后的剂量分布图的分辨率,得到调整后的剂量分布图。
步骤1-4:基于标签化的感兴趣区的解剖结构图和剂量分布图生成感兴趣危及器官的剂量面积直方图,危及器官解剖结构图和剂量分布图为三维矩阵形式,步骤1-4具体包括以下步骤:
步骤1-4-1:对于感兴趣危及器官,按照从头到脚的方向逐层遍历,在每层内按照层内的分辨率逐像素统计危及器官内的剂量数值;
步骤1-4-2:基于统计的危及器官内的剂量数值,按下式确定剂量面积直方图曲线:
式中,dah(d)为剂量面积直方图曲线,d表示剂量,a表示危及器官在层面内的面积,dmax表示危及器官在层面内的最大剂量,da(d)/dd是微分剂量面积直方图;
步骤1-4-3:对剂量面积直方图曲线进行验证,若剂量面积直方图曲线验证通过,执行步骤1-4-4,否则返回步骤1-4-1重新执行,直至剂量面积直方图曲线验证通过;具体验证过程包括:
1)将剂量面积直方图曲线逐层累加,得到初步的感兴趣危及器官的剂量体积曲线;
2)将初步的感兴趣危及器官的剂量体积曲线与专家放疗计划医学影像数据库中的剂量体积曲线进行对比,若初步的感兴趣危及器官的剂量体积曲线与专家放疗计划医学影像数据库中的剂量体积曲线匹配,确定初步的感兴趣危及器官的剂量体积曲线即为最终的感兴趣危及器官的剂量体积曲线;若初步的感兴趣危及器官的剂量体积曲线与专家放疗计划医学影像数据库中的剂量体积曲线不匹配,则调整剂量面积直方图曲线,直至得到与专家放疗计划医学影像数据库中的剂量体积曲线匹配的感兴趣危及器官的剂量体积曲线;
步骤1-4-4:将上述解析的感兴趣危及器官dah曲线输入dah转化算法,得到用于模型训练的输出端感兴趣危及器官dah分布,其中的dah转化算法是基于matlab开发的,可以成功将dah曲线转化为dah分布,转化方法是将横轴剂量和纵轴面积分别按照输入数据的横轴分辨率和纵轴分辨率进行分割,并将曲线下的区域填充为数值1,曲线上的区域填充为数值0。具体是将感兴趣危及器官的剂量面积曲线的横轴剂量按照输入数据的横轴分辨率进行分割,并将感兴趣危及器官的剂量面积曲线的纵轴面积按照输入数据的纵轴分辨率进行分割,之后将剂量面积曲线下的区域填充为数值1,将剂量面积曲线上的区域填充为数值0,得到感兴趣危及器官的剂量面积直方图。
步骤2:将用于模型训练的感兴趣区的解剖结构图和感兴趣危及器官的剂量面积直方图输入深度学习网络进行训练,得到预测模型;
步骤2中,运用keras框架构建深度学习网络,keras是一个包含了诸多神经网络算法的函数库,被广泛应用在深度学习的相关研究中,利用keras中的深度学习算法,搭建深度学习网络预测放疗计划危及器官dvh。将上述已经解析的多通道感兴趣危及器官的解剖结构和dah分布逐层输入到深度学习网络模型中进行训练,实现对输入解剖结构特征的抽象、提取和传递,建立逐层解剖结构特征与dah分布的关联,整合危及器官所有层面的dah便可以得到dvh。深度学习网络需要经过训练、验证、测试和评估等过程确定预测模型,其中数据集中随机选取一部分样本用于训练模型,一部分样本用于验证模型,一部分样本用于测试模型,利用定性和定量的方法评价测试结果,通过不断调整模型参数、改变网络结构以及输入输出数据结构等方式反复调整训练模型,直到最终确认预测模型。模型训练过程中,利用有限的数据量反复训练深度学习网络,网络可能会因为自身强大的学习能力而将所学习到的信息强行记忆,这样训练而成的网络往往不具有普适性,而且容易出现过拟合的现象。因此,网络模型训练过程中对数据进行了随机平移、旋转和翻转等,保证网络每次训练迭代过程中的输入数据都是不一致的,相当于构建了大样本的训练数据集。
步骤2具体包括以下步骤:
步骤2-1:将用于模型训练的感兴趣区的解剖结构图和感兴趣危及器官的剂量面积直方图输入深度学习网络进行训练,得到危及器官剂量面积分布;本发明实施例1利用keras框架中的神经网络函数库,基于残差网络resnet50(residualneuralnetwork,50layers)和反卷积网络deconvolutionlayer构建预测模型,但网络模型不限于此。
训练过程包括选取模型训练的损失函数、优化算法和超参数等,本实施例采用均方误差(meansquareerror,mse)函数作为损失函数,通过随机梯度下降优化算法adam反复迭代,使梯度不断下降更新权值进行训练,并且在训练过程中选取合适的学习率(learningrate,lr)和批量大小(batchsize)等超参数。模型通过验证和测试保证模型的可靠性和准确性,本实施例中放疗计划数据库将被随机分成三部分,70%的样本用于模型训练,20%的样本用于模型验证,10%的样本用于模型测试,模型训练过程中损失函数在训练数据集和验证数据集上均需要收敛,并且监测验证数据集上的损失函数值(validationloss),使用earlystopping技术避免过拟合,选取在验证数据集上损失函数值最小的模型作为预测模型。
步骤2-2:基于危及器官剂量面积分布确定预测模型,步骤2-2具体包括以下步骤:
步骤2-2-1:对危及器官剂量面积分布进行取整后处理,对危及器官剂量面积分布进行逐层累加,得到剂量体积分布,并将0或1填充的剂量体积分布转换为横轴是剂量、纵轴是体积的危及器官剂量体积曲线;
步骤2-2-2:基于临床剂量体积曲线对危及器官剂量体积曲线进行测试,得到最终的预测模型。
步骤2-2-2中,基于临床剂量体积曲线,通过平均绝对误差或相似性指数对危及器官剂量体积曲线进行测试;
其中,通过平均绝对误差对危及器官剂量体积曲线进行测试,包括:
(1)从危及器官剂量体积曲线上提取危及器官的剂量或剂量-体积的指标(dosevolumeindex,dvi);
(2)基于提取的危及器官的剂量或剂量-体积的指标,按下式计算平均绝对误差(meanabsoluteerrors,mae):
式中,mae表示平均绝对误差,n表示测试数据集样本数,
(3)将平均绝对误差与预设的误差阈值比较,若平均绝对误差小于等于预设的误差阈值,确定危及器官剂量体积曲线通过测试,得到最终的预测模型,否则,返回步骤1,直至重新得到的危及器官剂量体积曲线通过测试;
其中,通过相似性指数对危及器官剂量体积曲线进行测试,包括:
(1)分别获取测试患者的临床危及器官剂量体积曲线下包围的面积和测试患者的预测危及器官剂量体积曲线的下包围面积;
(2)基于获取的面积,按下式计算相似性指数:
式中,
(3)将相似性指数与预设的指数阈值比较,若相似性指数大于等于预设的指数阈值,确定危及器官剂量体积曲线通过测试,得到最终的预测模型,否则,返回步骤1,直至重新得到的危及器官剂量体积曲线通过测试。
步骤3:基于新患者放疗计划医学影像中ct图像和感兴趣区的解剖结构图确定新患者标签化的感兴趣区的解剖结构图,并将新患者标签化的感兴趣区的解剖结构图输入预测模型进行预测,得到新患者危及器官剂量体积直方图。
步骤3具体包括以下步骤:
步骤3-1:在新患者放疗计划医学影像ct图像中勾画感兴趣区的解剖结构,基于ct图像和感兴趣区的解剖结构图对感兴趣区解剖结构进行解析,得到三维矩阵形式的感兴趣区解剖结构,并对三维矩阵形式的感兴趣区解剖结构进行标签化处理,得到标签化的感兴趣区解剖结构;
步骤3-2:基于标签化的感兴趣区解剖结构获取新患者标签化的感兴趣区的解剖结构图,新患者标签化的感兴趣区的解剖结构图包括靶区与感兴趣危及器官、靶区、感兴趣危及器官,还包括感兴趣危及器官和其他危及器官;
步骤3-3:将新患者标签化的感兴趣区的解剖结构图输入预测模型,生成新患者危及器官剂量面积分布,并对新患者危及器官剂量面积分布进行取整处理;
步骤3-4:将新患者危及器官剂量面积分布进行逐层累加得到剂量体积分布,并基于剂量体积分布确定新患者危及器官剂量体积直方图。
本发明实施例1中,可以根据步骤3得到的新患者危及器官剂量体积直方图进而得到新患者危及器官剂量或剂量-体积参数,自动设置新患者的逆向计划的初始目标函数;之后将预测的新患者的危及器官dvh曲线与临床常规计划设计得到的dvh曲线进行自动比较,实现自动计划质量检查,如果不满足判断标准修改常规计划设计得到新的dvh曲线,继续进行比较直到满足判断标准,得到新患者可执行的计划。
实施例2
基于同一发明构思,本发明实施例2还提供一种放疗计划危及器官剂量体积直方图的预测装置,如图2所示,下面对各个组成部分的功能进行详细说明:
确定模块,用于基于专家放疗计划医学影像数据库中ct图像以及感兴趣区的解剖结构图和剂量分布图确定用于模型训练的感兴趣区的解剖结构图和感兴趣危及器官的剂量面积直方图;
建模模块,用于将用于模型训练的感兴趣区的解剖结构图和感兴趣危及器官的剂量面积直方图输入深度学习网络进行训练,得到预测模型;
预测模块,用于基于新患者放疗计划医学影像中ct图像和感兴趣区的解剖结构图确定新患者标签化的感兴趣区的解剖结构图,并将新患者标签化的感兴趣区的解剖结构图输入预测模型进行预测,得到新患者危及器官剂量体积直方图。
确定模块具体用于:
(1)基于专家放疗计划医学影像数据库中ct图像对专家放疗计划医学影像数据库中感兴趣区的解剖结构进行解析,并对解析后的感兴趣区的解剖结构图进行标签化处理,得到标签化的感兴趣区的解剖结构图;具体过程如下:
读取专家放疗计划医学影像数据库中ct图像,将专家放疗计划医学影像数据库中ct图像按照正确的层数序列进行排序,确定并调整层内和层间的图像分辨率;
读取专家放疗计划医学影像数据库中感兴趣区的解剖结构图,按照专家放疗计划医学影像数据库中ct图像的层面顺序对感兴趣区的解剖结构图进行解析,得到解析后的感兴趣区的解剖结构图;
将解析后的感兴趣区的解剖结构图与放疗计划系统中的感兴趣区的解剖结构图进行比对,若解析后的感兴趣区的解剖结构图与放疗计划系统中的感兴趣区的解剖结构图不匹配,返回步骤1-1-2重新执行,直至解析后的感兴趣区的解剖结构图与放疗计划系统中的感兴趣区的解剖结构图匹配;
基于感兴趣区的解剖结构图的分辨率与ct图像保持一致原则对解析后的感兴趣区的解剖结构图进行标签化处理,如果出现重叠区域,按照体轮廓、靶区和危及器官的顺序对感兴趣解剖结构依次进行累加标签化,得到标签化的感兴趣区的解剖结构图;
(2)基于标签化的感兴趣区解剖结构,考虑靶区和危及器官的可能空间位置关系,得到用于模型训练的感兴趣区的解剖结构图,用于模型训练的感兴趣区的解剖结构图包括靶区与感兴趣危及器官、靶区、感兴趣危及器官,还包括感兴趣危及器官和其他危及器官;
(3)基于专家放疗计划医学影像数据库中ct图像对专家放疗计划医学影像数据库中感兴趣区的解剖结构图和剂量分布图进行解析,并对解析后的解剖结构图和剂量分布图进行标签化处理,得到标签化的感兴趣区的解剖结构图和剂量分布图;具体包括:
读取专家放疗计划医学影像数据库中ct图像,将专家放疗计划医学影像数据库中ct图像按照正确的层数序列进行排序,确定并调整层内和层间的图像分辨率;
读取专家放疗计划医学影像数据库中感兴趣区的解剖结构图,按照专家放疗计划医学影像数据库中ct图像的层面顺序对感兴趣区的解剖结构图进行解析,得到解析后的感兴趣区的解剖结构图;
读取专家放疗计划医学影像数据库中的剂量分布图,按照专家放疗计划医学影像数据库中ct图像的层面顺序对读取的剂量分布图进行解析,得到解析后的剂量分布图;
将解析后的感兴趣区的解剖结构图与专家放疗计划医学影像数据库中的感兴趣区的解剖结构图进行比对,若解析后的感兴趣区的解剖结构图与专家放疗计划医学影像数据库的感兴趣区的解剖结构图不匹配,返回重新读取专家放疗计划医学影像数据库中感兴趣区的解剖结构图,并执行后续操作,直至解析后的感兴趣区的解剖结构图与专家放疗计划医学影像数据库中的感兴趣区的解剖结构图匹配;
将解析后的剂量分布图与专家放疗计划医学影像数据库中的剂量分布图进行比对,若解析后的剂量分布图与专家放疗计划医学影像数据库中的剂量分布图不匹配,返回重新读取专家放疗计划医学影像数据库中的剂量分布图,并执行后续操作,直至解析后的剂量分布图与专家放疗计划医学影像数据库中的剂量分布图一致;
按照感兴趣区的解剖结构图的分辨率与ct图像保持一致原则调整解析后的感兴趣区的解剖结构图的分辨率,并对调整后的解剖结构图进行标签化处理,得到标签化的感兴趣区的解剖结构图;
按照解析后的剂量分布图与ct图像保持一致原则调整解析后的剂量分布图的分辨率,得到调整后的剂量分布图。
(4)基于标签化的感兴趣区的解剖结构图和剂量分布图生成感兴趣危及器官的剂量面积直方图,具体过程如下:
a)对于感兴趣危及器官,按照从头到脚的方向逐层遍历,在每层内按照层内的分辨率逐像素统计危及器官内的剂量数值;
b)基于统计的危及器官内的剂量数值,按下式确定剂量面积直方图曲线:
式中,dah(d)为剂量面积直方图曲线,d表示剂量,a表示危及器官在层面内的面积,dmax表示危及器官在层面内的最大剂量,da(d)/dd是微分剂量面积直方图;
c)对剂量面积直方图曲线进行验证,若剂量面积直方图曲线验证通过,执行d),否则返回a)重新执行,直至剂量面积直方图曲线验证通过;具体验证过程包括:
1)将剂量面积直方图曲线逐层累加,得到初步的感兴趣危及器官的剂量体积曲线;
2)将初步的感兴趣危及器官的剂量体积曲线与专家放疗计划医学影像数据库中的剂量体积曲线进行对比,若初步的感兴趣危及器官的剂量体积曲线与专家放疗计划医学影像数据库中的剂量体积曲线匹配,确定初步的感兴趣危及器官的剂量体积曲线即为最终的感兴趣危及器官的剂量体积曲线;若初步的感兴趣危及器官的剂量体积曲线与专家放疗计划医学影像数据库中的剂量体积曲线不匹配,则调整剂量面积直方图曲线,并执行后续操作,直至得到与专家放疗计划医学影像数据库中的剂量体积曲线匹配的感兴趣危及器官的剂量体积曲线;
d)将感兴趣危及器官的剂量面积曲线的横轴剂量按照输入数据的横轴分辨率进行分割,并将感兴趣危及器官的剂量面积曲线的纵轴面积按照输入数据的纵轴分辨率进行分割,之后将剂量面积曲线下的区域填充为数值1,将剂量面积曲线上的区域填充为数值0,得到感兴趣危及器官的剂量面积直方图。
建模模块具体用于:
1、将用于模型训练的感兴趣区的解剖结构图和感兴趣危及器官的剂量面积直方图输入深度学习网络进行训练,得到危及器官剂量面积分布;
2、基于危及器官剂量面积分布确定预测模型,具体如下:
对危及器官剂量面积分布进行取整后处理,对危及器官剂量面积分布进行逐层累加,得到剂量体积分布,并将0或1填充的剂量体积分布转换为横轴是剂量、纵轴是体积的危及器官剂量体积曲线;
基于临床剂量体积曲线对危及器官剂量体积曲线进行测试,得到最终的预测模型,具体是基于临床剂量体积曲线,通过平均绝对误差或相似性指数对危及器官剂量体积曲线进行测试;
其中,通过平均绝对误差对危及器官剂量体积曲线进行测试,包括:
(1)从危及器官剂量体积曲线上提取危及器官的剂量或剂量-体积的指标;
(2)基于提取的危及器官的剂量或剂量-体积的指标,按下式计算平均绝对误差:
式中,mae表示平均绝对误差,n表示测试数据集样本数,
(3)将平均绝对误差与预设的误差阈值比较,若平均绝对误差小于等于预设的误差阈值,确定危及器官剂量体积曲线通过测试,得到最终的预测模型,否则,返回步骤1,直至重新得到的危及器官剂量体积曲线通过测试;
其中,通过相似性指数对危及器官剂量体积曲线进行测试,包括:
(1)分别获取测试患者的临床危及器官剂量体积曲线下包围的面积和测试患者的预测危及器官剂量体积曲线的下包围面积;
(2)基于获取的面积,按下式计算相似性指数:
式中,
(3)将相似性指数与预设的指数阈值比较,若相似性指数大于等于预设的指数阈值,确定危及器官剂量体积曲线通过测试,得到最终的预测模型,否则,返回步骤1,直至重新得到的危及器官剂量体积曲线通过测试。
预测模块具体用于:
在新患者放疗计划医学影像ct图像中勾画感兴趣区的解剖结构,基于ct图像和感兴趣区的解剖结构图对感兴趣区解剖结构进行解析,得到三维矩阵形式的感兴趣区解剖结构,并对三维矩阵形式的感兴趣区解剖结构进行标签化处理,得到标签化的感兴趣区解剖结构;
基于标签化的感兴趣区解剖结构获取新患者标签化的感兴趣区的解剖结构图,新患者标签化的感兴趣区的解剖结构图包括靶区与感兴趣危及器官、靶区、感兴趣危及器官;
将新患者标签化的感兴趣区的解剖结构图输入预测模型,生成新患者危及器官剂量面积分布,并对新患者危及器官剂量面积分布进行取整处理;
将新患者危及器官剂量面积分布进行逐层累加得到剂量体积分布,并基于剂量体积分布确定新患者危及器官剂量体积直方图。
实施例3
本发明实施例3以鼻咽癌为例介绍明预测放疗计划危及器官剂量体积直方图的方法,并完成新患者dvh预测实现自动设置逆向计划初始目标函数和计划质量检查的流程,具体包括以下步骤:
(t1)建立鼻咽癌放疗计划专家数据库,具体包括如下:
(t1.1)收集中国医学科学院肿瘤医院2014-2017年收治的190例tomo鼻咽癌患者的放疗计划数据,其中随机选取136例作为训练数据集,34例作为验证数据集,20例作为测试数据集;
(t1.2)对于每一个放疗计划,其包括ct图像,感兴趣区[体轮廓、3个梯度的靶区以及21个危及器官]的解剖结构图和剂量分布图,具体地说明如下:
(t1.2.1)ct图像层内256×256像素,层厚3mm;
(t1.2.2)靶区的处方剂量从高到低依次为73.92gy、69.96gy和60.06gy,分别记为ptv74、ptv70和ptv60,有两种处方模式[ptv74,ptv70,ptv60]和[ptv74,ptv60];
(t1.2.3)危及器官包括脑干prv、脑干、脊髓prv、脊髓、左腮腺、右腮腺、甲状腺、左晶体、右晶体、左视神经、右视神经、视交叉、喉、气管、左下颌骨、右下颌骨、左啮合关节、右啮合关节、左颞叶、右颞叶和垂体。
(t2)对专家数据库中鼻咽癌放疗计划进行解析和预处理,得到多通道感兴趣区的解剖结构作为模型训练的输入数据,以及感兴趣危及器官的dah分布作为模型训练的输出数据,具体包括如下:
(t2.1)ct图像和感兴趣区的解剖结构图输入图像提取算法进行解析,并保持解剖结构与ct图像保持一样的空间分辨率;
(t2.2)已经解析的鼻咽癌解剖结构实现了体轮廓、3个靶区和21个危及器官解剖结构的标签化处理,其中体轮廓标记为10,[ptv74,ptv70,ptv60]分别标记为[74,70,60],21个危及器官按照(t1.2.3)中的顺序分别标记为[90,190]间隔5,当体轮廓、靶区和危及器官有重叠区域时,按照体轮廓、ptv60、ptv70、ptv74和危及器官的顺序依次填充;
(t2.3)以左腮腺为例,说明模型输入端包括的四通道数据:通道1是靶区与左腮腺,通道2是靶区,通道3是左腮腺,通道4是左腮腺和其他危及器官,为加速训练过程,将输入数据层内调整为128×128像素,输入数据的数据结构为128×128×4;
(t2.4)ct图像、感兴趣危及器官的解剖结构图和剂量分布图输入图像提取算法进行解析,并保持解剖结构和剂量分布与ct图像保持一样的空间分辨率;
(t2.5)利用已解析的鼻咽癌感兴趣危及器官的解剖结构和剂量分布,结合剂量面积直方图曲线计算公式按感兴趣危及器官的层面,依次生成逐层感兴趣危及器官dah曲线,其中剂量轴范围是[0,90]gy,面积轴选用相对面积范围是[0,1],将dah曲线导入dah转化算法,得到用于模型输出端的dah分布,其中曲线下的区域填充为数值1,曲线上的区域填充为数值0,层内维度是128×128;
(t3)将前述鼻咽癌四通道感兴趣区的解剖结构和感兴趣危及器官dah分布输入到深度学习网络模型进行训练,经过模型验证和后处理,以及在测试数据集上定性和定量的评价,确定最终的深度学习网络模型预测危及器官dvh,具体内容如下:
(t3.1)对于每一个感兴趣的危及器官,模型输入数据是四通道的感兴趣区的解剖结构,模型输出数据是感兴趣危及器官的dah分布;
(t3.2)搭建前后连通的残差反卷积网络,模型包括收缩路径和扩张路径,其中收缩路径利用resnet50网络结构实现对解剖结构特征的抽象和提取,扩张路径通过结合部分resnet50网络和反卷积网络实现对解剖结构特征的抽象和提取;
(t3.3)模型的训练过程是逐层进行的,输入和输出数据进行归一化处理,并且使用数据增大方法避免过拟合,本发明实施例3选用随机旋转和平移数据的方式增大1倍的训练数据,由于内存限制,批量大小(batchsize)选取4,采用均方误差(meansquareerror,mse)函数作为损失函数,通过使用随机梯度下降adam优化算法对损失函数进行优化,使梯度不断下降更新权重值,学习速率(learningrate,lr)设置为0.001,验证集损失值(validationloss)作为监测目标,利用early-stopping技术停止优化过程,即validationloss值迭代15次后都不继续减小便停止优化,选取validationloss值最小所对应的模型作为预测模型。
(t3.4)利用预测模型可以直接预测鼻咽癌危及器官dah分布,后处理过程是将预测出的危及器官dah分布进行取整处理,同时逐层累加得到dvh分布,并将其输入到dvh生成算法,得到鼻咽癌危及器官dvh曲线;
(t3.5)在测试数据集上,利用定性定量评价预测模型的准确性,具体包括:
(t3.5.1)根据定性评价预测模型准确性,图3和图4分别给出了一例测试患者的左侧腮腺和右侧腮腺临床和预测dvh曲线比较结果,其中实线代表临床dvh曲线,虚线代表预测dvh曲线,从定性角度看整体趋势符合度高;
(t3.5.2)根据相似性指数定量评价预测模型准确性,图5给出了测试数据集上临床和预测dvh曲线下面积的相似性指数,对于全部危及器官,dsc值从0.915到0.985;
(t3.5.3)满足准确性要求,确定其为最终的预测模型。
(t4)对一个新的鼻咽癌患者,实现自动设置逆向计划初始目标函数和计划质量检查流程,具体内容如下:
(t4.1)在新鼻咽癌患者ct图像上勾画体轮廓、靶区和危及器官,传输至图像提取算法进行解析和预处理,得到模型需要的输入数据,即四通道的感兴趣区的解剖结构图;
(t4.2)将四通道的感兴趣区的解剖结构图输入已经训练的预测危及器官dvh的深度学习网络模型,可以得到新鼻咽癌患者危及器官dah分布,并对dah分布进行取整的后处理;
(t4.3)将新鼻咽癌患者危及器官dah分布进行逐层累加得到dvh分布,并将其输入到dvh生成算法,得到危及器官dvh曲线;
(t4.4)根据预测的危及器官dvh曲线,进而得到新鼻咽癌患者危及器官剂量或剂量-体积参数,自动设置逆向计划初始目标函数,进而得到可执行的计划;
(t4.5)通过将预测的新鼻咽癌危及器官dvh曲线与临床常规计划设计得到的dvh曲线进行自动比较,实现自动计划质量检查,如果常规计划鼻咽癌危及器官受量高于预测的dvh曲线,继续优化常规临床计划直到与预测值接近,得到可执行的计划。
综上,本发明实施例将医疗大数据以及深度学习技术与放射治疗的精准计划预测进行结合,建立并优化了放疗计划危及器官dvh预测模型,将预测结果自动转化为逆向计划初始目标函数,实现了个体化逆向计划目标函数自动化设置以及计划质量检查的目标,解决了目前放射治疗中计划设计耗时和缺乏质量控制的问题,使计划水平较低的肿瘤放疗中心可以根据该技术进行学习改进,提高其放疗计划的整体质量,确保各肿瘤放疗中心的计划质量处于相似的水平,提高了放疗计划的设计效率,缩短了计划设计的等待时间,达到放疗计划设计的效率和质量双赢,并且本实施例以头颈部鼻咽癌这一复杂部位做了详细说明,特别地,本实例涉及到的方法不局限于任何治疗技术和任何肿瘤类型,最终将此技术可延伸到各部位肿瘤实现放疗技术在效率和精准上的突破。
为了描述的方便,以上所述装置的各部分以功能分为各种模块或单元分别描述。当然,在实施本申请时可以把各模块或单元的功能在同一个或多个软件或硬件中实现。
本领域内的技术人员应明白,本申请的实施例可提供为方法、系统、或计算机程序产品。因此,本申请可采用完全硬件实施例、完全软件实施例、或结合软件和硬件方面的实施例的形式。而且,本申请可采用在一个或多个其中包含有计算机可用程序代码的计算机可用存储介质(包括但不限于磁盘存储器、cd-rom、光学存储器等)上实施的计算机程序产品的形式。
本申请是参照根据本申请实施例的方法、设备(系统)、和计算机程序产品的流程图和/或方框图来描述的。应理解可由计算机程序指令实现流程图和/或方框图中的每一流程和/或方框、以及流程图和/或方框图中的流程和/或方框的结合。可提供这些计算机程序指令到通用计算机、专用计算机、嵌入式处理机或其他可编程数据处理设备的处理器以产生一个机器,使得通过计算机或其他可编程数据处理设备的处理器执行的指令产生用于实现在流程图一个流程或多个流程和/或方框图一个方框或多个方框中指定的功能的装置。
这些计算机程序指令也可存储在能引导计算机或其他可编程数据处理设备以特定方式工作的计算机可读存储器中,使得存储在该计算机可读存储器中的指令产生包括指令装置的制造品,该指令装置实现在流程图一个流程或多个流程和/或方框图一个方框或多个方框中指定的功能。
这些计算机程序指令也可装载到计算机或其他可编程数据处理设备上,使得在计算机或其他可编程设备上执行一系列操作步骤以产生计算机实现的处理,从而在计算机或其他可编程设备上执行的指令提供用于实现在流程图一个流程或多个流程和/或方框图一个方框或多个方框中指定的功能的步骤。
最后应当说明的是:以上实施例仅用以说明本发明的技术方案而非对其限制,所属领域的普通技术人员参照上述实施例依然可以对本发明的具体实施方式进行修改或者等同替换,这些未脱离本发明精神和范围的任何修改或者等同替换,均在申请待批的本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!