治疗前列腺癌的方法与流程
治疗前列腺癌的方法
1.相关申请的交叉引用
2.本技术要求于2020年5月29日提交的美国申请第63/032,453号、于2020年5月22日提交的美国申请第63/028,843号、于2019年12月9日提交的美国申请第62/945,418号和于2019年10月22日提交的美国申请第62/924,655号的优先权和权益,所述美国申请中每一个的全部内容通过引用并入本文。
技术领域
3.本技术涉及治疗前列腺癌,包含转移性和/或去势抵抗性前列腺癌,包括向需要治疗的受试者施用式(i)化合物。
背景技术:
4.雄激素受体(ar)属于核激素受体家族,其被如睾酮和二氢睾酮等雄激素活化(《药理学评论(pharmacol.rev.)》2006,58(4),782-97;《维生素和激素(vitam.horm.)》1999,55:309-52.)。缺乏雄激素时,ar被细胞溶质中的热休克蛋白90(hsp90)结合。当雄激素结合ar时,其构形发生变化,从hsp90释放ar并且暴露核定位信号(nls)。后者使得ar能够易位到细胞核中,其中ar充当转录因子以促进负责雄性性特征的基因表达(《内分泌学评论(endocr.rev.)》1987,8(1):1-28;《分子内分泌学(mol.endocrinol.)》2002,16(10),2181-7)。ar缺乏导致雄激素不敏感综合征,以前称为睾丸女性化症。
5.虽然ar负责雄性性特征的发育,但它也是某些形式的癌症(包含前列腺癌)中有充分记录的致癌基因(《内分泌学评论》2004,25(2),276-308)。具ar活性的常测靶基因是分泌型前列腺特异性抗原(psa)蛋白质。前列腺癌的当前治疗方案涉及利用两种方法抑制雄激素-ar轴。第一种方法依赖于雄激素的减少,而第二种策略旨在抑制ar功能(《自然评论:药物发现(nat.rev.drug discovery)》,2013,12,823-824)。尽管开发了有效的靶向疗法,但大多数患者产生耐药性并且疾病进展。治疗前列腺癌的替代方法涉及消除ar蛋白质。由于ar是多种形式的前列腺癌中肿瘤发生的关键驱动因素,因此消除它应该会产生治疗上有益的响应。本领域存在对疾病,尤其是癌症、前列腺癌和肯尼迪病(kennedy's disease)的有效治疗的持续需求。然而,非特异性效果以及不能完全靶向和调节某些类别的蛋白质(如转录因子)仍然是开发有效抗癌药剂的障碍。因此,利用或增强小脑蛋白的底物特异性并同时“可调”使得可以特异性地靶向并调节广泛的蛋白质类别的小分子治疗剂作为治疗剂时将是非常有用的。
技术实现要素:
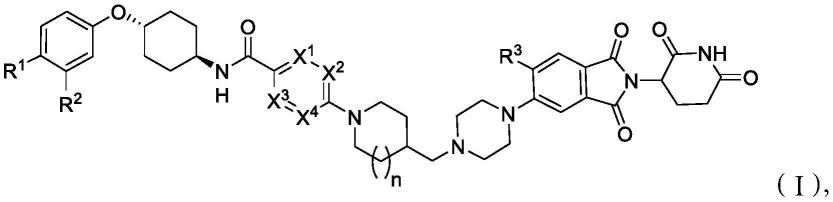
6.在一方面,本技术涉及一种在有需要的受试者中治疗前列腺癌的方法,所述方法包括向所述受试者施用治疗有效量的式(i)化合物,
[0007][0008]
或其药学上可接受的盐、对映异构体、立体异构体、溶剂化物、多晶型物、同位素衍生物或前药,其中:
[0009]
r1是氢、cn或c
1-c6烷基;
[0010]
r2是氢、卤基或c
1-c6烷基;
[0011]
r3是氢或卤基;
[0012]
x1是ch或n;
[0013]
x2是ch或n;
[0014]
x3是ch或n;
[0015]
x4是ch或n;并且
[0016]
n是0或1;
[0017]
条件是x1、x2、x3和x4中的至少两个是ch。
[0018]
在一个实施例中,所述前列腺癌是去势抵抗性前列腺癌。
[0019]
在一个实施例中,所述前列腺癌是转移性前列腺癌。
[0020]
在一个实施例中,r1是cn并且r2是氯。
[0021]
在一个实施例中,r3是氢。
[0022]
在一个实施例中,r3是氟。
[0023]
在一个实施例中,n是0。
[0024]
在一个实施例中,n是1。
[0025]
在一个实施例中,x1、x2、x3和x4中的每一个是ch。
[0026]
在一个实施例中,x1、x2、x3和x4中的三个是ch,并且另一个是n。
[0027]
在一个实施例中,x1、x2、x3和x4中的两个是ch,并且另外两个是n。
[0028]
在一个实施例中,所述式(i)化合物选自由以下组成的组:
[0029]
[0030][0031]
或其药学上可接受的盐、对映异构体、立体异构体、溶剂化物、多晶型物、同位素衍生物或前药。
[0032]
在一个实施例中,将所述式(i)化合物口服施用于所述受试者。
[0033]
在一个实施例中,将治疗有效量的所述式(i)化合物每天一次、每天两次、每天三次或每天四次施用于所述受试者。在一个实施例中,将治疗有效量的所述式(i)化合物每天一次施用于所述受试者。在一个实施例中,将治疗有效量的所述式(i)化合物一次性全部施用于所述受试者,或者分两部分、三部分或四部分施用。
[0034]
在一个实施例中,所述式(i)化合物的治疗有效量为约70mg到约1000mg。
[0035]
在一个实施例中,所述式(i)化合物的治疗有效量为约100mg到约280mg。
[0036]
在一个实施例中,所述式(i)化合物的治疗有效量导致大于约4,500纳克*小时/毫升、约4,600纳克*小时/毫升、约4,700纳克*小时/毫升、约4,800纳克*小时/毫升、约4,900纳克*小时/毫升、约5,000纳克*小时/毫升、约5,100纳克*小时/毫升、约5,200纳克*小时/毫升、约5,300纳克*小时/毫升、5,400纳克*小时/毫升、约5,500纳克*小时/毫升、约5,600纳克*小时/毫升、约5,700纳克*小时/毫升、约5,800纳克*小时/毫升、约5,900纳克*小时/毫升或约6,000纳克*小时/毫升的平均第15天auc
0-24
。
[0037]
在一个实施例中,所述式(i)化合物的治疗有效量导致大于约4,500纳克*小时/毫升且小于约5,500纳克*小时/毫升的平均第15天auc
0-24
。
[0038]
在一个实施例中,所述式(i)化合物的治疗有效量导致大于约300ng/ml且小于约400ng/ml的平均第15天c
max
。
[0039]
在一个实施例中,所述式(i)化合物的治疗有效量导致大于约330ng/ml、约335ng/ml、约340ng/ml、约345ng/ml、约350ng/ml、约355ng/ml、约360ng/ml、约365ng/ml、约370ng/ml、约375ng/ml或约380ng/ml的平均第15天c
max
。
[0040]
在一个实施例中,所述式(i)化合物被配制成片剂。在一个实施例中,所述片剂包括式(i)化合物和任选的以下一项或多项:乳化剂;表面活性剂;粘合剂;崩解剂;助流剂;和润滑剂。
[0041]
在一个实施例中,需要治疗的受试者处于进食状态。
[0042]
在一个实施例中,需要治疗的受试者处于禁食状态。
[0043]
在一方面,本技术涉及一种在有需要的受试者中治疗前列腺癌的方法,所述方法包括每天一次口服施用治疗有效量的式(i)化合物或其药学上可接受的盐、对映异构体、立体异构体、溶剂化物、多晶型物、同位素衍生物或前药,其中所述式(i)化合物选自由以下组成的组:
[0044]
[0045][0046]
或其药学上可接受的盐、对映异构体、立体异构体、溶剂化物、多晶型物、同位素衍生物或前药。
[0047]
在一个实施例中,将治疗有效量的所述式(i)化合物一次性全部施用于所述受试者,或者分两部分、三部分或四部分施用。
[0048]
在一个实施例中,所述式(i)化合物的治疗有效量为约70mg到约1000mg。
[0049]
在一个实施例中,所述式(i)化合物被配制成片剂。
附图说明
[0050]
图1是比较化合物(i-g)与恩杂鲁胺对vcap增殖的体外抑制作用的剂量响应曲线。
[0051]
图2是显示vcap肿瘤细胞中的ar响应于在0.03nm、0.1nm、0.3nm、1nm、3nm、10nm、30nm、100nm和300nm的浓度下的化合物(i-g)处理而减少的蛋白质印迹实验。
[0052]
图3是总结在去势vcap异种移植模型中进行的动物实验的系列线形图。化合物(i-g)以0.1mg/kg(mpk)、0.3mg/kg、1mg/kg和3mg/kg的剂量每天一次口服施用。恩杂鲁胺(20mg/kg)和媒剂也用作对照组。
[0053]
图4是总结在完整(非去势)vcap异种移植模型中进行的动物实验的系列线形图。化合物(i-g)以1mg/kg、3mg/kg和10mg/kg的剂量每天一次口服施用。恩杂鲁胺(20mg/kg)和媒剂也用作对照组。
[0054]
图5是总结在恩杂鲁胺抵抗性vcap异种移植模型中进行的动物实验的系列线形图。化合物(i-g)以3mg/kg和10mg/kg的剂量每天一次口服施用。恩杂鲁胺(20mg/kg)和媒剂也用作对照组。
[0055]
图6是显示恩杂鲁胺抵抗性vcap肿瘤中的ar响应于以10mg/kg和3mg/kg(口服,每天一次)给药化合物(i-g)而减少的蛋白质印迹实验。
[0056]
图7是一系列线形图,其提供了在第15天给药后24小时内针对所有三种测试剂量(35mg/天、70mg/天和140mg/天,口服施用)的化合物(i-g)的平均浓度的表示。
[0057]
图8是条形图(又名瀑布图),其显示在接受化合物(i-g)的20名转移性去势抵抗性前列腺癌(mcrpc)患者中前列腺特异性抗原(psa)测试结果的最佳变化百分比。每个条形代表与单个患者的治疗前水平相比血浆psa的最佳变化百分比。如图例所示,患者接受35mg/天、70mg/天、140mg/天或280mg/天的化合物(i-g)。
[0058]
图9是条形图(又名瀑布图),其显示在接受≥140mg每日剂量的化合物(i-g)的12名mcrpc患者中前列腺特异性抗原(psa)测试结果的最佳变化百分比,以及分别存在于从每名患者中分离出的循环肿瘤dna或循环肿瘤细胞中的ar基因或蛋白质的分子状态。每个条形代表与单个患者的治疗前水平相比血浆psa的最佳变化百分比。ar-v7是ar的剪接变体。amplif.是指ar基因的扩增。
[0059]
图10总结了接受140mg/天剂量的化合物(i-g)的一名患者(“患者19”)的主要特征。该患者对应于图8和图9中右起第二个条。
[0060]
图11a总结了接受140mg/天剂量的化合物(i-g)的一名患者(“患者20”)的主要特征。该患者对应于图8和图9中最右边的条。图11b示出了治疗前患者20的肿瘤的ct扫描。图11c示出了4个周期后患者20的肿瘤的ct扫描,其显示了recist响应。
[0061]
图12是在第15天给药后24小时内针对所有四种测试剂量(35mg/天、70mg/天、140mg/天和280mg/天,口服施用)的化合物(i-g)的平均第15天auc
0-24
(纳克*小时/毫升)的表示。
[0062]
图13是一系列线形图,其提供了在第15天给药后24小时内针对所有四种测试剂量(y轴上从最低到最高的顺序-35mg/天、70mg/天、140mg/天和280mg/天,口服施用)的化合物(i-g)的平均浓度的表示。
具体实施方式
[0063]
定义
[0064]“卤素”或“卤基”是指氟(f)、氯(cl)、溴(br)或碘(i)。
[0065]“c
1-c6烷基”是指含有1-6个碳原子的直链或支链饱和烃。(c
1-c6)烷基基团的实例包含但不限于甲基、乙基、丙基、丁基、戊基、己基、异丙基、异丁基、仲丁基、叔丁基、异戊基、新戊基和异己基。
[0066]
如本文所使用的,关于式(i)化合物的“药学上可接受的盐”是指式(i)化合物的盐形式以及存在一个或多个水分子的盐形式的水合物。此类盐和水合形式保留了式(i)化合物的生物活性并且在生物学或其它方面不是不期望的,即,如果有的话,则表现出最小的毒理学作用。代表性的“药学上可接受的盐”包含例如,水溶性和水不溶性盐,例如乙酸盐、氨芪磺酸盐(amsonate)(4,4-二氨基芪-2,2-二磺酸盐)、苯磺酸盐、苯甲酸盐、碳酸氢盐、硫酸氢盐、酒石酸氢盐、硼酸盐、溴化物、丁酸盐、钙、依地酸钙、樟脑磺酸盐、碳酸盐、氯化物、柠檬酸盐、克拉维酸盐(clavulariate)、二盐酸盐、乙二胺四乙酸盐、乙二磺酸盐、丙酸酯十二烷基硫酸盐、乙磺酸盐、富马酸盐、葡庚糖酸盐、葡糖酸盐、谷氨酸盐、乙醇酰基对氨基苯胂酸盐、六氟磷酸盐、己基间苯二酚盐、海巴明(hydrabamine)、氢溴酸盐、盐酸盐、羟基萘甲酸盐、碘化物、异硫代硫酸盐、乳酸盐、乳糖醛酸盐、月桂酸盐、镁、苹果酸盐、马来酸盐、扁桃酸盐、甲磺酸盐、甲基溴、甲基硝酸盐、甲基硫酸盐、粘酸盐、萘磺酸盐、硝酸盐、n-甲基葡糖胺铵盐、3-羟基-2-萘甲酸盐、油酸盐、草酸盐、棕榈酸盐、双羟萘酸盐(1,1-亚甲基-双-2-羟基-3-萘甲酸盐,einbonate)、泛酸盐、磷酸盐/二磷酸盐、苦味酸盐、多聚半乳糖醛酸盐、丙酸盐、对甲苯磺酸盐、水杨酸盐、硬脂酸盐、碱式醋酸盐、琥珀酸盐、硫酸盐、磺基水杨酸盐、suramate、丹宁酸盐、酒石酸盐、茶氯酸盐、甲苯磺酸盐、三乙基碘以及戊酸盐。
[0067]
术语“异构体”是指具有相同组合物和分子量但在物理性质和/或化学性质上不同的盐和/或化合物。结构差异可以在于组成(几何异构体)或使偏振光的平面旋转的能力(立体异构体)。关于立体异构体,式(i)化合物的盐可以具有一个或多个不对称碳原子,并且可以作为外消旋物、外消旋混合物和作为单独的对映异构体或非对映异构体出现。
[0068]
式(i)化合物可以以未溶剂化的形式以及溶剂化的形式,如例如水合物存在。
[0069]“溶剂化物”意指含有化学计量或非化学计量的量的溶剂的溶剂添加形式。一些化合物具有在结晶固态中捕获固定摩尔比的溶剂分子,从而形成溶剂化物的趋势。如果溶剂是水,则所形成的溶剂化物是水合物,当溶剂是醇时,所形成的溶剂化物是醇化物(alcoholate)。水合物通过一种或多种水分子与其中水保留其分子状态为h2o的物质之一的组合而形成,此类组合能够形成一种或多种水合物。在水合物中,水分子通过分子间力,特别是氢桥,通过副价连接。固体水合物包含水作为化学计量比率的所谓的结晶水,其中水分子不必与其结合状态等同。水合物的实例是倍半水合物、一水合物、二水合物或三水合物。同样合适的是本发明的化合物的盐的水合物。
[0070]
当化合物从溶液或浆料结晶时,它可以在空间的不同排列晶格中结晶(这种性质
被称为“多态性”),以形成具有不同结晶形式的晶体,每种结晶形式被称为“多晶型”。如本文所使用的,“多晶型物”是指分子定位在三维晶格位点的式(i)化合物的晶体形式。式(i)化合物的不同多晶型物可以在一种或多种物理性质上彼此不同,如溶解度和溶解速率、真实比重、晶体形式、累积模式、可流动性和/或固态稳定性等。
[0071]
如本文所提到的,“同位素衍生物”涉及用一个或多个稳定同位素被同位素富集或标记(关于化合物的一种或多种原子)的式(i)化合物。因此,在本技术中,式(i)化合物包含例如用一种或多种原子(如氘)同位素富集或标记的化合物。
[0072]
如本文所使用的,术语“药学上可接受的前药”是指式(i)化合物的那些前药,它们在合理的医学判断范围内,适合用于与人和低等动物的组织接触,具有过度的毒性、刺激、过敏响应等,与合理的益处/风险比相称,并且对它们的预期用途有效,以及本发明化合物的两性离子形式,如果可能的话。
[0073]
如本文所使用的,“前药”是指可通过代谢手段(例如,通过水解)在体内转化以提供由本发明的化学式描述的任何化合物的化合物。各种形式的前药是本领域已知的,例如如在bundgaard,(编者),《前药设计(design of prodrugs)》,爱思唯尔出版公司(elsevier),(1985);widder等人(编者),《酶学方法(methods in enzymology)》,第4卷,学术出版社(academic press),(1985);krogsgaard-larsen等人,(编者),“前药的设计和应用(design and application of prodrugs)”,《药物设计和开发教科书(textbook of drug design and development)》,第5章,1 13-191(1991);bundgaard等人,《药物递送评论杂志(journal of drug deliver reviews)》,8:1-38(1992);bundgaard,《药物科学杂志(j.of pharmaceutical sciences)》,77:285及其后(1988);higuchi和stella(编者)《作为新颖药物递送系统的前药(prodrugs as novel drug delivery systems)》,美国化学学会(american chemical society),(1975);以及bernard testa和joachim mayer,“药物和前药代谢中的水解:化学、生物化学和酶学(hydrolysis in drug and prodrug metabolism:chemistry,biochemistry and enzymology)”,约翰威利父子出版公司(john wiley and sons,ltd)(2002)中所讨论的。
[0074]
本发明还涵盖含有本发明的化合物的药学上可接受的前药的药物组合物,以及通过施用本发明的化合物的药学上可接受的前药来治疗病症的方法。例如,具有游离氨基、酰氨基、羟基或羧基基团的本发明的化合物可以转化为前药。前药包含这样的化合物:其中氨基酸残基或两个或更多个(例如,两个、三个或四个)氨基酸残基的多肽链通过酰胺或酯键被共价连接到本发明的化合物的游离氨基、羟基或羧酸基团。氨基酸残基包含但不限于通常由三个字母符号表示的20种天然存在的氨基酸,并且还包含4-羟基脯氨酸、羟基赖氨酸、锁链素(demosine)、异锁链素(isodemosine)、3-甲基组氨酸、正缬氨酸、β-丙氨酸、γ-氨基丁酸、瓜氨酸、同型半胱氨酸、高丝氨酸、鸟氨酸和甲硫氨酸砜。还涵盖另一种类型的前药。例如,游离羧基基团可以被衍生为酰胺或烷基酯。如在《先进的药物递送评论(advanced drug delivery reviews)》,1996,19,1 15中所概述的,游离羟基基团可以使用包含但不限于琥珀酸半酯、磷酸酯、二甲基氨基乙酸酯和磷酰氧基甲基氧基羰基的基团进行衍生化。还包含羟基和氨基基团的氨基甲酸酯前药,以及羟基基团的碳酸酯前药、磺酸酯和硫酸酯。还涵盖将羟基基团衍生为(酰氧基)甲基醚和(酰氧基)乙基醚,其中酰基基团可以是任选地被包含但不限于醚、胺和羧酸官能团的基团取代的烷基酯,或其中酰基基团是如上所述的氨
基酸酯。这种类型的前药描述于《药物化学杂志(j.med.chem.)》1996,39,10中。游离胺还可以衍生为酰胺、磺酰胺或磷酰胺。所有这些前药部分都可以并入包含但不限于醚、胺和羧酸官能团的基团。由本发明设想的取代基和变量的组合仅是导致形成稳定化合物的那些。
[0075]
转移性前列腺癌或转移瘤是指已经扩散到前列腺以外到身体其它部位(例如,骨骼、淋巴结、肝、肺、脑)的前列腺癌。
[0076]
去势抵抗性前列腺癌(castrate-resistant prostate cancer或castration-resistant prostate cancer)(或对去势具有抵抗性的前列腺癌)是一种前列腺癌,即使体内睾酮的含量降低到非常低的水平,它也会继续增长。
[0077]
转移性去势抵抗性前列腺癌是一种已经转移并且即使体内的睾酮含量降低到非常低的水平仍继续生长的前列腺癌。
[0078]
如本文所使用的,“治疗”描述了用于对抗疾病、病状或病症的目的的受试者的管理和护理,并且包含减少或减轻症状或并发症,或消除疾病、病状或病症。
[0079]
如本文所使用的,“预防”描述了停止疾病、病状或病症的症状或并发症的发作。
[0080]“施用”是指将药剂,如式(i)化合物引入到受试者中。相关术语“施用(administering)”和
“…
的施用(administration of)”(和语法等同物)均指直接施用,其可以由医学专业人员施用于受试者或由受试者自行施用;和/或间接施用,其可以为开处方药物的行为。例如,指导患者自行施用药物和/或为患者提供药物的处方的医生将药物施用于患者。
[0081]
如本文所使用的,“治疗有效量”是指足以治疗、改善或预防特定疾病(例如,前列腺癌)、疾病症状、病症或病状或表现出可检测的治疗或抑制作用的式(i)化合物的游离碱的量。所述作用可以通过本领域已知的任何测定方法来检测。特定受试者的有效量可能取决于受试者的体重、体型和健康状况;病状的性质和程度;以及是否要向受试者施用额外的治疗剂。对于给定情况的治疗有效量可以通过在临床医生的技能和判断内的常规实验来确定。
[0082]
如本文所使用的,“c
max”是指在向受试者施用一剂特定化合物后观察到的受试者中特定化合物的最大(峰值)血浆浓度。
[0083]
如本文所使用的,“auc”是指血浆浓度-时间曲线下的总面积,其是目标化合物的暴露的量度,并且是单剂量后或稳态下的浓度-时间曲线的积分。auc以纳克*小时/毫升(纳克x小时/毫升)为单位表示。
[0084]
如本文所使用的,“auc
tau”是指从0小时到给药间隔结束的auc。
[0085]“auc
0-24”意指施用单个剂量后0小时到24小时的auc。
[0086]
如本文所使用的,关于本公开的口服剂型的“受控释放”或“cr”意指式(i)化合物根据预定的曲线从剂型释放,所述预定的曲线可以包含口服施用后在何时和何处发生释放和/或在特定时间段内的特定释放速率。
[0087]
如本文所使用的,关于本公开的口服剂型的“受控释放药剂”是指调节式(i)化合物从剂型释放的一种或多种物质或材料。受控释放药剂可以是有机或无机、天然存在的或合成的材料,如聚合物材料、甘油三酯、甘油三酯的衍生物、脂肪酸和脂肪酸的盐、滑石、硼酸和胶体二氧化硅。
[0088]
如本文所使用的,关于本公开的剂型的“肠溶包衣”是指围绕包括式(i)化合物的
核心并且在胃的酸性环境中保持基本完整但溶解在肠道的ph值环境中的ph依赖性材料。
[0089]
如应用于本文所述的cr口服剂型的“胃抵抗性”或“gr”是指式(i)化合物在受试者胃中的释放不应超过剂型中的式(i)化合物总量的5%、2.5%、1%或0.5%。
[0090]
如本文所使用的,“口服剂型”是指含有特定量(剂量)的式(i)化合物或其药学上可接受的盐和/或溶剂化物作为活性成分,和非活性组分(赋形剂)的药物产品,所述药物产品被配制成适于口服施用的特定构型,如片剂或胶囊。在一个实施例中,组合物呈可以被评分的片剂的形式。
[0091]
如本公开所使用的,术语“载体”涵盖载体、赋形剂和稀释剂并且是指材料、组合物或媒剂,如液体或固体填充剂、稀释剂、赋形剂、溶剂或包封材料,其涉及将药剂从一个器官或身体的一部分携带或运输到受试者的另一个器官或身体的另一部分。
[0092]
醋酸阿比特龙是由杨森(janssen)开发并以品牌销售的用于治疗转移性去势抵抗性前列腺癌的市售药物。
[0093]
术语“约”作为如“约x”的定量表达的一部分,包含高于或低于x的10%的任何值,并且还包含落在x-10%与x+10%之间的任何数值。因此,例如,约40g的重量包含36至44g的重量。
[0094]
如应用于本文所述或要求保护的特定剂型、组合物、用途、方法或工艺的“包括(comprising或comprises)”意指所述剂型、组合物、用途、方法或工艺包含具体描述或权利要求中所述的所有要素,但不排除其它要素。“基本上由...组成(consists essentially of和consisting essentially of)”意指所述或要求保护的组合物、剂型、方法、用途或工艺不排除对所述组合物、剂型、方法、用途或工艺的物理、药理学、药代动力学性质或治疗效果不产生实质影响的其它材料或步骤。“由...组成(consists of和consisting of)”意指排除超过微量元素的其它成分和实质性方法或工艺步骤。
[0095]
如用于描述受试者的“禁食状况(fasted condition)”或“禁食状态(fasted state)”意指受试者在目标时间点(如施用式(i)化合物的时间)之前至少4小时没有进食。在一个实施例中,处于禁食状态的受试者在施用式(i)化合物之前至少6小时、8小时、10小时或12小时中的任何一个时间段没有进食。
[0096]
如本文用于描述受试者的“进食状况(fed condition)”或“进食状态(fed state)”意指受试者已经在目标时间点(如施用式(i)化合物的时间)之前少于4小时内进食。在一个实施例中,处于进食状态的受试者在施用式(i)化合物之前至少3小时、2小时、1小时或0.5小时中的任何一个时间段没有进食。
[0097]
在本公开中使用冠词“一个/种(a/an)”来指代一个或多于一个(即,至少一个)的所述冠词的语法对象。例如,“要素”意指一个要素或多于一个要素。
[0098]
除非另有说明,否则在本公开中,术语“和/或”用于意指“和”或“或”。
[0099]
术语“患者”和“受试者”在本文中可互换使用,并且指哺乳动物,例如人、小鼠、大鼠、豚鼠、犬、猫、马、牛、猪,或非人灵长类动物,如猴、黑猩猩、狒狒或恒河猴。
[0100]
在一个实施例中,受试者是人。
[0101]
在一个实施例中,受试者是已被诊断为患有前列腺癌的人。
[0102]
在一个实施例中,受试者是已被诊断为患有转移性前列腺癌的人。
[0103]
在一个实施例中,受试者是已被诊断为患有去势抵抗性前列腺癌的人。
[0104]
在一个实施例中,受试者是已被诊断为患有转移性去势抵抗性前列腺癌的人。
[0105]
式(i)化合物
[0106]
在一方面,本技术涉及治疗和/或预防癌症的方法,所述方法包括向有需要的受试者施用式(i)化合物。在一方面,本技术涉及式(i)化合物在治疗和/或预防前列腺癌中的用途。在一方面,本技术涉及式(i)化合物在制备用于治疗和/或预防前列腺癌的药物中的用途。
[0107]
如本文所述,式(i)化合物是指具有以下结构的化合物:
[0108][0109]
或其药学上可接受的盐、对映异构体、立体异构体、溶剂化物、多晶型物、同位素衍生物或前药,其中:
[0110]
r1是氢、cn或c
1-c6烷基;
[0111]
r2是氢、卤基或c
1-c6烷基;
[0112]
r3是氢或卤基;
[0113]
x1是ch或n;
[0114]
x2是ch或n;
[0115]
x3是ch或n;
[0116]
x4是ch或n;并且
[0117]
n是0或1。
[0118]
在一个实施例中,r1是氢。
[0119]
在一个实施例中,r1是cn。
[0120]
在一个实施例中,r1是c
1-c6烷基。
[0121]
在一个实施例中,r2是氢。
[0122]
在一个实施例中,r2是卤基。在一个实施例中,r2是f。在一个实施例中,r2是cl。在一个实施例中,r2是br。在一个实施例中,r2是i。
[0123]
在一个实施例中,r2是c
1-c6烷基。
[0124]
在一个实施例中,r3是氢。
[0125]
在一个实施例中,r3是卤基。在一个实施例中,r3是f。在一个实施例中,r3是cl。在一个实施例中,r3是br。在一个实施例中,r3是i。
[0126]
在一个实施例中,x1、x2、x3和x4中的至少一个是ch。
[0127]
在一个实施例中,x1、x2、x3和x4中的至少两个是ch。
[0128]
在一个实施例中,x1、x2、x3和x4中的至少三个是ch。
[0129]
在一个实施例中,x1、x2、x3和x4中的每一个是ch。
[0130]
在一个实施例中,x1、x2和x3各自是ch,并且x4是n。
[0131]
在一个实施例中,x1、x2和x4各自是ch,并且x3是n。
[0132]
在一个实施例中,x1、x3和x4各自是ch,并且x2是n。
[0133]
在一个实施例中,x2、x3和x4各自是ch,并且x1是n。
[0134]
在一个实施例中,x1和x2各自是ch,并且x3和x4各自是n。
[0135]
在一个实施例中,x1和x3各自是ch,并且x2和x4各自是n。
[0136]
在一个实施例中,x1和x4各自是ch,并且x2和x3各自是n。
[0137]
在一个实施例中,x2和x3各自是ch,并且x1和x4各自是n。
[0138]
在一个实施例中,x2和x4各自是ch,并且x1和x3各自是n。
[0139]
在一个实施例中,x3和x4各自是ch,并且x1和x2各自是n。
[0140]
在一个实施例中,n是0。
[0141]
在一个实施例中,n是1。
[0142]
在一个实施例中,所述式(i)化合物是
[0143]
[0144]
[0145][0146]
或其药学上可接受的盐、对映异构体、立体异构体、溶剂化物、多晶型物、同位素衍生物或前药。
[0147]
在一个实施例中,式(i)化合物是式(i-a)化合物:
[0148][0149]
或其药学上可接受的盐、对映异构体、立体异构体、溶剂化物、多晶型物、同位素衍生物或前药。
[0150]
在一个实施例中,式(i)化合物是式(i-b)化合物:
[0151][0152]
或其药学上可接受的盐、对映异构体、立体异构体、溶剂化物、多晶型物、同位素衍生物或前药。
[0153]
在一个实施例中,式(i)化合物是式(i-c)化合物:
[0154][0155]
或其药学上可接受的盐、对映异构体、立体异构体、溶剂化物、多晶型物、同位素衍生物或前药。
[0156]
在一个实施例中,式(i)化合物是式(i-d)化合物:
[0157][0158]
或其药学上可接受的盐、对映异构体、立体异构体、溶剂化物、多晶型物、同位素衍生物或前药。
[0159]
在一个实施例中,式(i)化合物是式(i-e)化合物:
[0160][0161]
或其药学上可接受的盐、对映异构体、立体异构体、溶剂化物、多晶型物、同位素衍生物或前药。
[0162]
在一个实施例中,式(i)化合物是式(i-f)化合物:
[0163][0164]
或其药学上可接受的盐、对映异构体、立体异构体、溶剂化物、多晶型物、同位素衍生物或前药。
[0165]
在一个实施例中,式(i)化合物是式(i-g)化合物:
[0166][0167]
或其药学上可接受的盐、对映异构体、立体异构体、溶剂化物、多晶型物、同位素衍生物或前药。
[0168]
在一个实施例中,式(i)化合物是式(i-h)化合物:
[0169][0170]
或其药学上可接受的盐、对映异构体、立体异构体、溶剂化物、多晶型物、同位素衍生物或前药。
[0171]
在一个实施例中,式(i)化合物是式(i-i)化合物:
[0172][0173]
或其药学上可接受的盐、对映异构体、立体异构体、溶剂化物、多晶型物、同位素衍生物或前药。
[0174]
式(i)化合物可以使用用于有机分子制备以及官能团转化和操控的标准合成方法和程序(包含保护基团的使用)合成,所述标准合成方法和程序可以从相关科学文献或从本领域中的标准参考教科书中获得。尽管不局限于任何一种或多种来源,但公认的有机合成参考教科书包含:smith,m.b.;march,j.《玛奇高等有机化学:反应、机理和结构(march’s advanced organic chemistry:reactions,mechanisms,and structure)》,第5版;约翰威利父子出版公司(john wiley&sons):纽约,2001;以及greene,t.w.;wuts,p.g.m.《有机合成中的保护基团(protective groups in organic synthesis)》,第3版;约翰威利父子出版公司(john wiley&sons):纽约,1999。用于制备式(i)化合物的方法描述于美国专利申请公开号2018/0099940,现为美国专利第10,584,101号,其内容整体并入本文。
[0175]
在细胞中泛素化/降解靶蛋白的方法
[0176]
本发明提供了一种在细胞中泛素化/降解靶蛋白的方法。所述方法包括施用双功能组合物,所述双功能组合物包括e3泛素连接酶结合部分和蛋白质靶向部分,优选地通过接头部分连接,如本文另外描述的,其中e3泛素连接酶结合部分与蛋白质靶向部分偶联,并且其中e3泛素连接酶结合部分识别泛素途径蛋白(例如,泛素连接酶,优选地,e3泛素连接酶)并且蛋白质靶向部分识别靶蛋白,使得当靶蛋白位于泛素连接酶附近时,靶蛋白将发生降解,从而导致降解/抑制靶蛋白的作用和控制蛋白质水平。对本发明提供的蛋白质水平的控制提供了疾病状态或病状的治疗,所述疾病状态或病状通过降低患者细胞中所述蛋白质的水平而通过靶蛋白进行调节。
[0177]
在一个实施例中,本发明涉及一种治疗有需要患者的通过蛋白质调节的疾病状态或病状的方法,其中所述蛋白质的降解将对所述患者产生治疗效果,所述方法包括向有需要的患者施用有效量的根据本发明的化合物,所述化合物任选地与另一种生物活性剂(例如,阿比特龙)组合。疾病状态或病状可以是由微生物剂或其它外源性药剂(如病毒、细菌、真菌、原生动物或其它微生物)引起的疾病,或者可以是由导致疾病状态和/或病状的蛋白质的过表达引起的疾病状态。
[0178]
治疗方法
[0179]
在一方面,本技术涉及一种治疗和/或预防癌症的方法,所述方法包括向有需要的受试者施用治疗有效量的式(i)化合物,或其药学上可接受的盐、对映异构体、立体异构体、溶剂化物、多晶型物、同位素衍生物或前药。
[0180]
本文所述的治疗癌症的方法包含肿瘤大小的减小。可替代地或另外地,癌症是转移性癌症,并且该治疗方法包含抑制转移性癌细胞侵入。
[0181]
在一个实施例中,癌症是前列腺癌。
[0182]
在一个实施例中,癌症是转移性前列腺癌。
[0183]
在一个实施例中,癌症是去势抵抗性前列腺癌。
[0184]
在一个实施例中,癌症是转移性去势抵抗性前列腺癌(mcrpc)。
[0185]
在一个实施例中,患有mcrpc的受试者将对用式(i)化合物或其药学上可接受的盐、对映异构体、立体异构体、溶剂化物、多晶型物、同位素衍生物或前药进行的治疗具有不同的响应,这取决于受试者的ar生物标志物状态。
[0186]
在一方面,本技术涉及用式(i)化合物治疗前列腺癌,其中所述式(i)化合物是指具有以下结构的化合物:
[0187][0188]
或其药学上可接受的盐、对映异构体、立体异构体、溶剂化物、多晶型物、同位素衍生物或前药,其中r1、r2、r3、x1、x2、x3和x4以及n如本文所定义。在一个实施例中,癌症是转移性前列腺癌。在一个实施例中,癌症是去势抵抗性前列腺癌。在一个实施例中,癌症是转移性去势抵抗性前列腺癌。
[0189]
在一方面,本技术涉及用式(i)化合物治疗前列腺癌,其中所述式(i)化合物选自由以下组成的组:
[0190]
[0191][0192]
或其药学上可接受的盐、对映异构体、立体异构体、溶剂化物、多晶型物、同位素衍生物或前药。在一个实施例中,癌症是转移性前列腺癌。在一个实施例中,前列腺癌是去势抵抗性前列腺癌。在一个实施例中,前列腺癌是转移性去势抵抗性前列腺癌。
[0193]
在一方面,本技术涉及用式(i)化合物与另一种生物活性剂的组合治疗前列腺癌,其中所述式(i)化合物是指具有以下结构的化合物:
[0194][0195]
或其药学上可接受的盐、对映异构体、立体异构体、溶剂化物、多晶型物、同位素衍生物或前药,其中r1、r2、r3、x1、x2、x3和x4以及n如本文所定义。在一个实施例中,式(i)化合物是式(i-g)化合物。
[0196]
在一个实施例中,用式(i)化合物与另一种生物活性剂的组合治疗的前列腺癌是转移性前列腺癌。在一个实施例中,用式(i)化合物与另一种生物活性剂的组合治疗的前列腺癌是去势抵抗性前列腺癌。在一个实施例中,用式(i)化合物与另一种生物活性剂的组合治疗的前列腺癌是转移性去势抵抗性前列腺癌。在一个实施例中,另一种生物活性剂是阿比特龙或其药学上可接受的盐。在一个实施例中,另一种生物活性剂是醋酸阿比特龙。
[0197]
在一个方面,治疗癌症导致肿瘤大小的减小。肿瘤大小的减小也可以被称为“肿瘤消退”。优选地,治疗后,肿瘤大小相对于其治疗前的大小减小5%或更多;更优选地,肿瘤大小减小10%或更多;更优选地,减小20%或更多;更优选地,减小30%或更多;更优选地,减小40%或更多;甚至更优选地,减小50%或更多;并且最优选地,减小多于75%或更多。肿瘤大小可以通过任何可重现的测量手段来测量。在一个优选的方面中,肿瘤大小可以被测量
为肿瘤的直径。
[0198]
在另一个方面中,治疗癌症导致肿瘤体积的减小。优选地,治疗后,肿瘤体积相对于其治疗前的大小减小5%或更多;更优选地,肿瘤体积减小10%或更多;更优选地,减小20%或更多;更优选地,减小30%或更多;更优选地,减小40%或更多;甚至更优选地,减小50%或更多;并且最优选地,减小多于75%或更多。肿瘤体积可以通过任何可重现的测量手段来测量。
[0199]
在另一个方面中,治疗癌症导致肿瘤数量的减少。优选地,治疗后,肿瘤数量相对于治疗前的数量减少5%或更多;更优选地,肿瘤数量减少10%或更多;更优选地,减少20%或更多;更优选地,减少30%或更多;更优选地,减少40%或更多;甚至更优选地,减少50%或更多;并且最优选地,减少多于75%。肿瘤数量可以通过任何可重现的测量手段来测量。在一个优选的方面中,可以通过对裸眼可见的或在指定的放大率下可见的肿瘤进行计数来测量肿瘤数量。在一个优选的方面中,指定的放大率为2x、3x、4x、5x、10x或50x。
[0200]
在另一个方面中,治疗癌症导致远离原发性肿瘤部位的其它组织或器官中的转移性病灶的数量减少。优选地,治疗后,转移性病灶的数量相对于治疗前的数量减少5%或更多;更优选地,转移性病灶数量减少10%或更多;更优选地,减少20%或更多;更优选地,减少30%或更多;更优选地,减少40%或更多;甚至更优选地,减少50%或更多;并且最优选地,减少多于75%。转移性病灶数量可以通过任何可重现的测量手段来测量。在一个优选的方面中,可以通过对裸眼可见的或在指定的放大率下可见的转移性病灶进行计数来测量转移性病灶的数量。在一个优选的方面中,指定的放大率为2x、3x、4x、5x、10x或50x。
[0201]
在另一个方面中,与仅接受载体的群体相比,治疗癌症导致经治疗的受试者群体的平均存活时间增加。优选地,平均存活时间增加超过30天;更优选地,超过60天;更优选地,超过90天;并且最优选地,超过120天。群体的平均存活时间的增加可以通过任何可重现的手段来测量。在一个优选的方面中,可以例如通过计算群体在用活性药剂或化合物开始治疗后的平均存活长度来测量群体的平均存活时间的增加。在另一个优选的方面中,也可以例如通过计算群体在用活性药剂或化合物完成第一轮治疗后的平均存活长度来测量群体的平均存活时间的增加。
[0202]
在另一个方面中,与未经治疗的受试者的群体相比,治疗癌症导致经治疗的受试者群体的平均存活时间增加。优选地,平均存活时间增加超过30天;更优选地,超过60天;更优选地,超过90天;并且最优选地,超过120天。群体的平均存活时间的增加可以通过任何可重现的手段来测量。在一个优选的方面中,可以例如通过计算群体在用活性药剂或化合物开始治疗后的平均存活长度来测量群体的平均存活时间的增加。在另一个优选的方面中,也可以例如通过计算群体在用式(i)化合物完成第一轮治疗后的平均存活长度来测量群体的平均存活时间的增加。
[0203]
在另一个方面中,治疗癌症导致肿瘤生长速率的降低。优选地,治疗后,肿瘤生长速率相对于治疗前的数量减少至少5%;更优选地,肿瘤生长速率减少至少10%;更优选地,减少至少20%;更优选地,减少至少30%;更优选地,减少至少40%;更优选地,减少至少50%;甚至更优选地,减少至少50%;并且最优选地,减少至少75%。肿瘤生长速率可以通过任何可重现的测量手段来测量。在一个优选的方面中,根据每单位时间的肿瘤直径的变化来测量肿瘤生长速率。
[0204]
在另一个方面中,治疗癌症导致肿瘤再生长的减少。优选地,治疗后,肿瘤再生长少于5%;更优选地,肿瘤再生长少于10%;更优选地,少于20%;更优选地,少于30%;更优选地,少于40%;更优选地,少于50%;甚至更优选地,少于50%;并且最优选地,少于75%。肿瘤再生长可以通过任何可重现的测量手段来测量。在一个优选的方面中,例如通过测量在治疗后的先前肿瘤缩小之后肿瘤的直径的增加来测量肿瘤再生长。在另一个优选的方面中,肿瘤再生长的减少由治疗停止后肿瘤再发生的失败来指示。
[0205]
用于本文所述的任何方法和用途的式(i)化合物的剂量根据药剂、受体受试者的年龄、体重和临床状况,以及施用疗法的临床医生或执业者的经验和判断,以及影响所选剂量的其它因素而改变。
[0206]
治疗有效量的式(i)化合物可以在一天内施用一次或多次,持续至多30天或更长时间,随后1天或更长时间不施用式(i)化合物。该类型的治疗时间表,即,连续数日施用式(i)化合物随后连续数日不施用式(i)化合物,可以被称为一个治疗周期。治疗周期可以根据需要重复多次以达到预期效果。
[0207]
在一个实施例中,式(i)化合物的治疗有效量是0.01、0.05、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、1.5、2、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、105、110、115、120、125、130、135、140、145、150、155、160、165、170、175、180、185、190、195、200、205、210、215、220、225、230、235、240、245、250、255、260、265、270、275、280、285、290、295、300、305、310、315、320、325、330、335、340、345、350、355、360、365、370、375、380、385、390、395、400、405、410、415、420、425、430、435、440、445、450、455、460、465、470、475、480、485、490、495、500、505、510、515、520、525、530、535、540、545、550、555、560、565、570、575、580、585、590、595、600、605、610、615、620、625、630、635、640、645、650、655、660、665、670、675、680、685、690、695、700、705、710、715、720、725、730、735、740、745、750、755、760、765、770、775、780、785、790、795、800、805、810、815、820、825、830、835、840、845、850、855、860、865、870、875、880、885、890、895、900、905、910、915、920、925、930、935、940、945、950、955、960、965、970、975、980、985、990、995或1,000mg,连续一天、两天、三天、四天、五天、六天、七天、八天、九天、十天、十一天、十二天、十三天、十四天、十五天、三十天每天施用一次、两次、三次、四次或更多次,或以单次或分次剂量的形式每天施用一次、两次、三次、四次或更多次,持续2个月、3个月、4个月、5个月、6个月或更长时间。
[0208]
在一个实施例中,式(i)化合物的治疗有效量为约10到约40mg、约20到约50mg、约30到约60mg、约40到约70mg、约50到约80mg、约60到约90mg、约70到约100mg、约80到约110mg、约90到约120mg、约100到约130mg、约110到约140mg、约120到约150mg、约130到约160mg、约140到约170mg、约150到约180mg、约160到约190mg、约170到约200mg、约180到约210mg、约190到约220mg、约200到约230mg、约210到约240mg、约220到约250mg、约230到约260mg、约240到约270mg、约250到约280mg、约260到约290mg、约270到约300mg、约280到约310mg、约290到约320mg、约300到约330mg、约310到约340mg、约320到约350mg、约330到约
360mg、约340到约370mg、约350到约380mg、约360到约390mg、约370到约400mg、约380到约410mg、约390到约420mg、约400到约430mg、约410到约440mg、约420到约450mg、约430到约460mg、约440到约470mg、约450到约480mg、约460到约490mg、约470到约500mg、约480到约510mg、约490到约520mg、约500到约530mg、约510到约540mg、约520到约550mg、约530到约560mg、约540到约570mg、约550到约580mg、约560到约590mg、约570到约600mg、约580到约610mg、约590到约620mg、约600到约630mg、约610到约640mg、约620到约650mg、约630到约660mg、约640到约670mg、约650到约680mg、约660到约690mg、约670到约700mg、约680到约710mg、约690到约720mg、约700到约730mg、约710到约740mg、约720到约750mg、约730到约760mg、约740到约770mg、约750到约780mg、约760到约790mg、约770到约800mg、约780到约810mg、约790到约820mg、约800到约830mg、约810到约840mg、约820到约850mg、约830到约860mg、约840到约870mg、约850到约880mg、约860到约890mg、约870到约900mg、约880到约910mg、约890到约920mg、约900到约930mg、约910到约940mg、约920到约950mg、约930到约960mg、约940到约970mg、约950到约980mg、约960到约990mg或约970到约1,000mg,以单次或分次剂量的形式每天施用一次、两次、三次、四次或更多次(该剂量可以根据患者的体重(kg)、体表面积(m2)和年龄(岁)进行调整)。
[0209]
在一个实施例中,式(i)化合物的治疗有效量为约35mg到约1000mg,以单次或分次剂量的形式每天施用一次、两次、三次、四次或更多次(该剂量可以根据患者的体重(kg)、体表面积(m2)和年龄(岁)进行调整)。
[0210]
在一个实施例中,式(i)化合物的治疗有效量为约70mg到约1000mg,以单次或分次剂量的形式每天施用一次、两次、三次、四次或更多次(该剂量可以根据患者的体重(kg)、体表面积(m2)和年龄(岁)进行调整)。
[0211]
在一个实施例中,式(i)化合物的治疗有效量为约35mg、70mg、105mg、140mg、175mg、210mg、245mg、280mg、315mg、350mg、385mg、420mg、455mg、490mg、525mg、560mg、595mg、630mg、665mg或700mg,以单次或分次剂量的形式每天施用一次、两次、三次、四次或更多次(该剂量可以根据患者的体重(kg)、体表面积(m2)和年龄(岁)进行调整)。
[0212]
式(i)化合物的治疗有效量还可以在约0.01mg/kg/天到约100mg/kg/天的范围内。在一方面,式(i)化合物的治疗有效量可以在约0.05mg/kg/天到约10mg/kg/天的范围内。在一方面,式(i)化合物的治疗有效量可以在约0.075mg/kg/天到约5mg/kg/天的范围内。在一方面,式(i)化合物的治疗有效量可以在约0.10mg/kg/天到约1mg/kg/天的范围内。在一方面,式(i)化合物的治疗有效量可以在约0.20mg/kg/天到约0.70mg/kg/天的范围内。
[0213]
在一个实施例中,式(i)化合物的治疗有效量为约0.10mg/kg/天、约0.15mg/kg/天、约0.20mg/kg/天、约0.25mg/kg/天、约0.30mg/kg/天、约0.35mg/kg/天、约0.40mg/kg/天、约0.45mg/kg/天、约0.50mg/kg/天、约0.55mg/kg/天、约0.60mg/kg/天、约0.65mg/kg/天、约0.70mg/kg/天、约0.75mg/kg/天、约0.80mg/kg/天、约0.85mg/kg/天、约0.90mg/kg/天、约0.95mg/kg/天或约1.00mg/kg/天。
[0214]
在一个实施例中,式(i)化合物的治疗有效量为约1.05mg/kg/天、约1.10mg/kg/天、约1.15mg/kg/天、约1.20mg/kg/天、约1.25mg/kg/天、约1.30mg/kg/天、约1.35mg/kg/天、约1.40mg/kg/天、约1.45mg/kg/天、约1.50mg/kg/天、约1.55mg/kg/天、约1.60mg/kg/天、约1.65mg/kg/天、约1.70mg/kg/天、约1.75mg/kg/天、约1.80mg/kg/天、约1.85mg/kg/
天、约1.90mg/kg/天、约1.95mg/kg/天或约2.00mg/kg/天。
[0215]
在一个实施例中,式(i)化合物的治疗有效量为约2mg/kg/天、约2.5mg/kg/天、约3mg/kg/天、约3.5mg/kg/天、约4mg/kg/天、约4.5mg/kg/天、约5mg/kg/天、约5.5mg/kg/天、约6mg/kg/天、约6.5mg/kg/天、约7mg/kg/天、约7.5mg/kg/天、约8.0mg/kg/天、约8.5mg/kg/天、约9.0mg/kg/天、约9.5mg/kg/天或约10mg/kg/天。
[0216]
在一个实施例中,将治疗有效量的式(i)化合物每天一次施用于受试者。在一个实施例中,将式(i)化合物的每日剂量一次性全部施用于受试者。在一个实施例中,将式(i)化合物的每日剂量以两部分施用于受试者。在一个实施例中,将式(i)化合物的每日剂量以三部分施用于受试者。在一个实施例中,将式(i)化合物的每日剂量以四部分施用于受试者。在一个实施例中,将式(i)化合物的每日剂量以五部分或更多部分施用于受试者。在一个实施例中,这些部分在全天中以规则间隔施用于受试者,例如每12小时、每8小时、每6小时、每5小时、每4小时等。
[0217]
在一个实施例中,式(i)化合物的治疗有效量导致大于约3,500纳克*小时/毫升、约3,550纳克*小时/毫升、约3,600纳克*小时/毫升、约3,650纳克*小时/毫升、约3,700纳克*小时/毫升、约3,750纳克*小时/毫升、约3,800纳克*小时/毫升、约3,850纳克*小时/毫升、约3,900纳克*小时/毫升、约3,950纳克*小时/毫升、约4,000纳克*小时/毫升、4,050纳克*小时/毫升、约4,100纳克*小时/毫升、约4,150纳克*小时/毫升、约4,200纳克*小时/毫升、4,250纳克*小时/毫升、约4,300纳克*小时/毫升、约4,350纳克*小时/毫升、约4,400纳克*小时/毫升、约4,450纳克*小时/毫升、约4,500纳克*小时/毫升、约4,550纳克*小时/毫升、约4,600纳克*小时/毫升、约4,650纳克*小时/毫升、约4,700纳克*小时/毫升、约4,750纳克*小时/毫升、约4,800纳克*小时/毫升、约4,850纳克*小时/毫升、约4,900纳克*小时/毫升、约4,950纳克*小时/毫升、约5,000纳克*小时/毫升、5,050纳克*小时/毫升、约5,100纳克*小时/毫升、约5,150纳克*小时/毫升、约5,200纳克*小时/毫升、约5,250纳克*小时/毫升、约5,300纳克*小时/毫升、约5,350纳克*小时/毫升、约5,400纳克*小时/毫升、约5,450纳克*小时/毫升、约5,500纳克*小时/毫升、约5,550纳克*小时/毫升、约5,600纳克*小时/毫升、约5,650纳克*小时/毫升、约5,700纳克*小时/毫升、约5,750纳克*小时/毫升、约5,800纳克*小时/毫升、约5,850纳克*小时/毫升、约5,900纳克*小时/毫升、5,950纳克*小时/毫升、或约6,000纳克*小时/毫升、6,050纳克*小时/毫升、约6,100纳克*小时/毫升、约6,150纳克*小时/毫升、约6,200纳克*小时/毫升、约6,250纳克*小时/毫升、约6,300纳克*小时/毫升、约6,350纳克*小时/毫升、约6,400纳克*小时/毫升、约6,450纳克*小时/毫升、约6,500纳克*小时/毫升、约6,550纳克*小时/毫升、约6,600纳克*小时/毫升、约6,650纳克*小时/毫升、约6,700纳克*小时/毫升、约6,750纳克*小时/毫升、约6,800纳克*小时/毫升、约6,850纳克*小时/毫升、约6,900纳克*小时/毫升、6,950纳克*小时/毫升、或约7,000纳克*小时/毫升、7,050纳克*小时/毫升、约7,100纳克*小时/毫升、约7,150纳克*小时/毫升、约7,200纳克*小时/毫升、约7,250纳克*小时/毫升、约7,300纳克*小时/毫升、约7,350纳克*小时/毫升、约7,400纳克*小时/毫升、约7,450纳克*小时/毫升、约7,500纳克*小时/毫升、约7,550纳克*小时/毫升、约7,600纳克*小时/毫升、约7,650纳克*小时/毫升、约7,700纳克*小时/毫升、约7,750纳克*小时/毫升、约7,800纳克*小时/毫升、约7,850纳克*小时/毫升、约7,900纳克*小时/毫升、7,950纳克*小时/毫升、或约8,000纳克*小时/毫升、8,
050纳克*小时/毫升、约8,100纳克*小时/毫升、约8,150纳克*小时/毫升、约8,200纳克*小时/毫升、约8,250纳克*小时/毫升、约8,300纳克*小时/毫升、约8,350纳克*小时/毫升、约8,400纳克*小时/毫升、约8,450纳克*小时/毫升、约8,500纳克*小时/毫升、约8,550纳克*小时/毫升、约8,600纳克*小时/毫升、约8,650纳克*小时/毫升、约8,700纳克*小时/毫升、约8,750纳克*小时/毫升、约8,800纳克*小时/毫升、约8,850纳克*小时/毫升、约8,900纳克*小时/毫升、8,950纳克*小时/毫升或约9,000纳克*小时/毫升的平均第15天auc
0-24
。
[0218]
在一个实施例中,式(i)化合物的治疗有效量导致大于约250ng/ml、约255ng/ml、约260ng/ml、约265ng/ml、约270ng/ml、约275ng/ml、约280ng/ml、约285ng/ml、约290ng/ml、约295ng/ml、约300ng/ml、约305ng/ml、约310ng/ml、约315ng/ml、约320ng/ml、约325ng/ml、约330ng/ml、约335ng/ml、约340ng/ml、约345ng/ml、约350ng/ml、约355ng/ml、约360ng/ml、约365ng/ml、约370ng/ml、约375ng/ml、约380ng/ml、约385ng/ml、约390ng/ml、约395ng/ml、约400ng/ml、约405ng/ml、约410ng/ml、约415ng/ml、约420ng/ml、约425ng/ml、约430ng/ml、约435ng/ml、约440ng/ml、约445ng/ml、约450ng/ml、约455ng/ml、约460ng/ml、约465ng/ml、约470ng/ml、约475ng/ml、约480ng/ml、约485ng/ml、约490ng/ml、约495ng/ml或约500ng/ml的平均第15天c
max
。
[0219]
式(i)化合物的治疗有效量可以最初在细胞培养测定中或在动物模型(通常是大鼠、小鼠、兔、犬或猪)中估计。动物模型还可以用于确定适当的浓度范围和施用途径。然后,此类信息可以用于确定对于在人体中施用有用的剂量和途径。治疗/预防功效和毒性可以通过细胞培养物或实验动物中的标准制药程序来确定,例如,ed
50
(在50%的群体中治疗有效的剂量)和ld
50
(对50%的群体致死的剂量)。在毒性作用和治疗效果之间的剂量比是治疗指数,并且其可以表示为比ld
50
/ed
50
。展现出大的治疗指数的药物组合物是优选的。剂量可以在此范围内变化,这取决于所采用的剂型、患者的敏感性和施用途径。
[0220]
调整剂量和施用以提供式(i)化合物的足够水平或维持期望的效果。可以考虑的因素包含疾病状态的严重程度、受试者的一般健康状况、受试者的年龄、体重和性别、饮食、施用的时间和频率、药物组合、反应敏感性,以及对疗法的耐受性/响应。长效药物组合物可以每3至4天、每周、或每两周一次给予,这取决于特定配制品的半衰期和清除率。
[0221]
在一个实施例中,对于用式(i)化合物与另一种生物活性剂的组合治疗前列腺癌的方法,本文描述了式(i)化合物的治疗有效量,并且所述其它生物活性剂的治疗有效量是0.01、0.05、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、1.5、2、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、105、110、115、120、125、130、135、140、145、150、155、160、165、170、175、180、185、190、195、200、205、210、215、220、225、230、235、240、245、250、255、260、265、270、275、280、285、290、295、300、305、310、315、320、325、330、335、340、345、350、355、360、365、370、375、380、385、390、395、400、405、410、415、420、425、430、435、440、445、450、455、460、465、470、475、480、485、490、495、500、505、510、515、520、525、530、535、540、545、550、555、560、565、570、575、580、585、590、595、600、605、610、615、620、625、630、635、640、645、650、655、660、665、670、675、
680、685、690、695、700、705、710、715、720、725、730、735、740、745、750、755、760、765、770、775、780、785、790、795、800、805、810、815、820、825、830、835、840、845、850、855、860、865、870、875、880、885、890、895、900、905、910、915、920、925、930、935、940、945、950、955、960、965、970、975、980、985、990、995或1,000mg,连续一天、两天、三天、四天、五天、六天、七天、八天、九天、十天、十一天、十二天、十三天、十四天、十五天、三十天每天施用一次、两次、三次、四次或更多次,或以单次或分次剂量的形式每天施用一次、两次、三次、四次或更多次,持续2个月、3个月、4个月、5个月、6个月或更长时间。在一个实施例中,另一种生物活性剂是阿比特龙或其药学上可接受的盐。在一个实施例中,另一种生物活性剂是醋酸阿比特龙。
[0222]
在一个实施例中,对于用式(i)化合物与阿比特龙或其药学上可接受的盐的组合治疗前列腺癌的方法,本文描述了式(i)化合物的治疗有效量,并且阿比特龙或其药学上可接受的盐的治疗有效量是0.01、0.05、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、1.5、2、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、105、110、115、120、125、130、135、140、145、150、155、160、165、170、175、180、185、190、195、200、205、210、215、220、225、230、235、240、245、250、255、260、265、270、275、280、285、290、295、300、305、310、315、320、325、330、335、340、345、350、355、360、365、370、375、380、385、390、395、400、405、410、415、420、425、430、435、440、445、450、455、460、465、470、475、480、485、490、495、500、505、510、515、520、525、530、535、540、545、550、555、560、565、570、575、580、585、590、595、600、605、610、615、620、625、630、635、640、645、650、655、660、665、670、675、680、685、690、695、700、705、710、715、720、725、730、735、740、745、750、755、760、765、770、775、780、785、790、795、800、805、810、815、820、825、830、835、840、845、850、855、860、865、870、875、880、885、890、895、900、905、910、915、920、925、930、935、940、945、950、955、960、965、970、975、980、985、990、995或1,000mg,连续一天、两天、三天、四天、五天、六天、七天、八天、九天、十天、十一天、十二天、十三天、十四天、十五天、三十天每天施用一次、两次、三次、四次或更多次,或以单次或分次剂量的形式每天施用一次、两次、三次、四次或更多次,持续2个月、3个月、4个月、5个月、6个月或更长时间。在一个实施例中,所述阿比特龙是醋酸阿比特龙。
[0223]
在一个实施例中,对于用式(i)化合物与醋酸阿比特龙的组合治疗前列腺癌的方法,本文描述了式(i)化合物的治疗有效量,并且醋酸阿比特龙的治疗有效量是1,000mg,以单次或分次剂量的形式连续一天、两天、三天、四天、五天、六天、七天、八天、九天、十天、十一天、十二天、十三天、十四天、十五天、三十天或更长时间每天口服施用一次。在一个实施例中,醋酸阿比特龙与口服施用的5mg泼尼松组合施用,每天两次。在一个实施例中,将式(i)化合物和醋酸阿比特龙的组合施用于处于禁食状态的有需要的受试者。在一个实施例中,受试者在施用式(i)化合物和醋酸阿比特龙的组合之前至少两小时和之后至少一小时不进食。
[0224]
在一个实施例中,将式(i)化合物和醋酸阿比特龙同时施用于受试者。在一个实施例中,将式(i)化合物和醋酸阿比特龙依次施用于受试者。
[0225]
在一个实施例中,将式(i)化合物和醋酸阿比特龙在时间上接近地施用于受试者。
[0226]
在一些实施例中,“时间接近”意指式(i)化合物的施用发生在施用醋酸阿比特龙之前或之后的时间段内,使得式(i)化合物的治疗效果与醋酸阿比特龙的治疗效果重叠。在一些实施例中,式(i)化合物的治疗效果与醋酸阿比特龙的治疗效果完全重叠。在一些实施例中,“时间接近”意指式(i)化合物的施用发生在施用醋酸阿比特龙之前或之后的时间段内,使得式(i)化合物与醋酸阿比特龙之间存在协同效应。
[0227]“时间接近”可根据各种因素而变化,包含但不限于治疗剂将施用于的受试者的年龄、性别、体重、遗传背景、医疗状况、疾病史和治疗史;待治疗或改善的疾病或病状;要达到的治疗结果;治疗剂的剂量、给药频率和给药持续时间;治疗剂的药代动力学和药效学;以及施用治疗剂的途径。在一些实施例中,“时间接近”意指在15分钟内、在30分钟内、在一小时内、在两小时内、在四小时内、在六小时内、在八小时内、在12小时内、在18小时内、在24小时内、在36小时内、在2天内、在3天内、在4天内、在5天内、在6天内、在一周内、在2周内、在3周内、在4周内、在6周内或在8周内。在一些实施例中,一种治疗剂的多次施用可以与另一种治疗剂的单次施用在时间接近的情况下发生。在一些实施例中,时间接近可以在治疗周期期间或在给药方案内改变。
[0228]
药物组合物
[0229]
在一个实施例中,式(i)化合物被配制用于口服施用。例如,在一个实施例中,式(i)化合物被配制成片剂,所述片剂包括以下各项中的0个、1个、2个或更多个:乳化剂;表面活性剂、粘合剂;崩解剂、助流剂;和润滑剂。
[0230]
在一个实施例中,乳化剂是羟丙甲纤维素。
[0231]
在一个实施例中,表面活性剂是维生素e聚乙二醇琥珀酸酯。
[0232]
在一个实施例中,粘合剂(在本文中也被称为填充剂)选自由微晶纤维素、乳糖一水合物、蔗糖、葡萄糖和山梨糖醇组成的组。
[0233]
在一个实施例中,崩解剂是交联羧甲基纤维素钠。
[0234]
在一个实施例中,助流剂是指用于通过减少颗粒间粘合来促进粉末流动的物质。在一个实施例中,在本公开的剂型中,助流剂选自由二氧化硅、无水胶体二氧化硅、淀粉和滑石粉组成的组。
[0235]
在一个实施例中,润滑剂是指防止成分在用于制备本公开的剂型的机器中粘附和/或聚集在一起的物质。在一个实施例中,在本公开的剂型中,润滑剂选自由硬脂酸镁、硬脂酰富马酸钠、硬脂酸和植物硬脂精组成的组。
[0236]
含有式(i)化合物的药物组合物可以以通常已知的方式制备,例如借助常规混合、溶解、制粒、制糖衣、磨粉、乳化、胶囊化、包埋或冻干工艺的方式。药物组合物可以使用一种或多种药学上可接受的载体以常规方式配制,所述一种或多种药学上可接受的载体包括赋形剂和/或辅助剂,其促进将式(i)化合物加工成可以在药学上使用的制剂。当然,适当的调配物取决于所选择的施用途径。
[0237]
适合于可注射用途的药物组合物包含无菌水溶液(在水溶性的情况下)或分散体以及用于临时制备无菌可注射溶液或分散液的无菌粉末。对于静脉内施用,合适的载体包含生理盐水、抑菌水、cremophor el
tm
(新泽西州帕西帕尼市的巴斯夫公司(basf,parsippany,n.j.))或磷酸酯缓冲盐水(pbs)。在所有情况下,组合物必须是无菌的,并且应
该是流体,以达到易于注射的程度。它必须在制造和储存的条件下稳定,并且必须保存以抵抗如细菌和真菌等微生物的污染作用。载体可以是含有例如水、乙醇、多元醇(例如,甘油、丙二醇和液体聚乙二醇等)及其合适的混合物的溶剂或分散介质。可以例如通过使用如卵磷脂等包衣、通过在分散体的情况下维持所需粒度以及通过使用表面活性剂来维持恰当的流动性。可以通过各种抗细菌剂和抗真菌剂(例如,对羟苯甲酸酯、三氯叔丁醇、苯酚、抗坏血酸、硫柳汞等)来实现对微生物的作用的预防。在许多情况下,将优选的是在组合物中包含等渗剂,例如糖、多元醇(如甘露醇、山梨醇)、氯化钠。通过在组合物中包含延迟吸收的药剂,例如单硬脂酸铝和明胶,可以实现可注射组合物的延长吸收。
[0238]
可以通过以下方式制备无菌可注射溶液:根据需要,将所需量的式(i)化合物与以上列举的成分中的一种或其组合一起掺入适当溶剂中,随后进行过滤灭菌。通常,通过将活性药剂或化合物掺入无菌媒剂中来制备分散液,所述无菌媒剂含有碱性分散介质和来自以上列举的那些的所需其它成分。在用于制备无菌可注射溶液的无菌粉末的情况下,制备的方法是真空干燥和冷冻干燥,其产生活性成分的粉末加上来自其先前经无菌过滤的溶液的任何另外的所需成分。
[0239]
口服组合物通常包含惰性稀释剂或可食用的药学上可接受的载体。它们可以被包封在明胶胶囊中或被压制成片剂。出于口服治疗性施用的目的,式(i)化合物中可以掺入赋形剂并且以片剂、锭剂、或胶囊的形式使用。还可以使用流体载体制备作为漱口水使用的口服组合物,其中口服施用流体载体中的药剂或化合物,并含漱和吐出或吞食。可以包含药学上相容的粘结剂和/或佐剂材料作为组合物的一部分。片剂、丸剂、胶囊、锭剂等可以含有以下任何成分或类似性质的化合物:粘合剂,如微晶纤维素、黄蓍胶或明胶;赋形剂,如淀粉或乳糖;崩解剂,如海藻酸、羟基乙酸淀粉钠或玉米淀粉;润滑剂,如硬脂酸镁;助流剂,如胶体二氧化硅;甜味剂,如蔗糖或糖精;或调味剂,如薄荷、水杨酸甲酯或橙味调味剂。
[0240]
对于通过吸入施用,将药剂或化合物以气溶胶喷雾的形式从含有合适的推进剂(例如,如二氧化碳等气体,或喷雾剂)的加压容器或分配器中递送。
[0241]
也可以通过透粘膜或透皮的方式进行全身施用。对于透粘膜或透皮施用,在调配物中使用适合于待渗透的屏障的渗透剂。此类渗透剂通常是本领域中已知的并且包含例如用于透粘膜施用的洗涤剂、胆盐和夫西地酸衍生物。透粘膜施用可以通过使用鼻喷雾剂或栓剂来实现。对于透皮施用,将活性药剂或化合物配制成如本领域中通常已知的软膏、膏剂、凝胶或乳膏。
[0242]
在一方面,将式(i)化合物与药学上可接受的载体一起制备,所述载体将保护药剂或化合物免于从体内快速消除,如控释调配物,包含植入物和微囊化递送系统。可以使用可生物可降解的、生物相容的聚合物,如乙烯乙酸乙烯酯、聚酐、聚乙醇酸、胶原、聚原酸酯和聚乳酸。用于制备此类调配物的方法对本领域技术人员而言是显而易见的。
[0243]
脂质体悬浮液(包含靶向受感染细胞的脂质体,其中单克隆抗体针对病毒抗原)也可以用作药学上可接受的载体。这些可以根据本领域技术人员已知的方法来制备,例如,如在美国专利第4,522,811中所描述的。
[0244]
尤其有利的是以剂量单位形式配制口服或肠胃外组合物以便于施用和剂量统一。如本文所使用的,剂量单位形式是指适合作为待治疗受试者的单位剂量的物理上离散单
位;每单位含有经计算与所需的药物载体联合产生所期望的治疗效果的预定量的活性剂或化合物。本技术的剂量单位形式的规格由式(i)化合物的独特特性和待实现的特定治疗效果指示并且直接取决于所述特性和待实现的特定治疗效果。
[0245]
药物组合物可以与施用说明书一起包含在容器、包装或分配器中。
[0246]
式(i)化合物的示例性施用模式包含全身施用或局部施用,如口服、鼻腔、肠胃外、透皮、皮下、阴道、口腔、直肠或局部施用模式。在一个实施例中,式(i)化合物或其药学上可接受的盐或水合物被口服施用。在一个实施例中,式(i)化合物作为片剂、胶囊、小胶囊、溶液、悬浮液、糖浆、颗粒、珠、粉末或球团施用。
[0247]
示例性药物组合物是片剂和明胶胶囊,其包括式(i)化合物的盐和药学上可接受的载体,如a)稀释剂,例如,纯净水、甘油三酯油,如氢化或部分氢化的植物油,或其混合物,玉米油、橄榄油、葵花油、红花油、鱼油,如epa或dha,或其酯或甘油三酯或其混合物,ω-3脂肪酸或其衍生物、乳糖、葡萄糖、蔗糖、甘露醇、山梨糖醇、纤维素、钠、糖精、葡萄糖和/或甘氨酸;b)润滑剂,例如,二氧化硅、滑石、硬脂酸、其镁盐或钙盐、油酸钠、硬脂酸钠、硬脂酸镁、苯甲酸钠、乙酸钠、氯化钠和/或聚乙二醇;也适用于片剂;c)粘合剂,例如,硅酸铝镁、淀粉糊、明胶、黄蓍胶、甲基纤维素、羧甲基纤维素钠、碳酸镁、天然糖如葡萄糖或β-乳糖、玉米甜味剂、天然和合成树胶如阿拉伯胶、黄蓍胶或海藻酸钠、蜡和/或聚乙烯吡咯烷酮,如果需要的话;d)崩解剂,例如,淀粉、琼脂、甲基纤维素、膨润土、黄原胶、海藻酸或其钠盐,或泡腾混合物;e)吸收剂、着色剂、调味剂和甜味剂;f)乳化剂或分散剂,如tween 80、labrasol、hpmc、doss、caproyl909、labrafac、labrafil、peceol、transcutol、capmul mcm、capmul pg-12、captex 355、gelucire、维生素e tgps或其它可接受的乳化剂;和/或g)增强盐吸收的试剂,如环糊精、羟丙基-环糊精、peg400和/或peg200。
[0248]
为了从式(i)化合物或其盐或水合物制备药物组合物,惰性的药学上可接受的载体可以是固体或液体。固体形式制剂包含粉末、片剂、可分散颗粒剂、胶囊、扁囊剂和栓剂。粉末和片剂可以包括约5到约95%的活性成分。合适的固体载体是本领域已知的,例如,碳酸镁、硬脂酸镁、滑石、糖或乳糖。片剂、粉剂、扁囊剂和胶囊可以用作适合于口服施用的固体剂型。用于各种组合物的药学上可接受的载体和制造方法的实例可以在以下文献中找到:a.gennaro(编者),《雷明顿制药科学(remington's pharmaceutical sciences)》,第18版,(1990),宾夕法尼亚州伊斯顿市的麦克出版公司(mack publishing co.,easton,pa)。
[0249]
固体形式制剂包含溶液、悬浮液和乳液。例如,用于肠胃外注射或向口服溶液、悬浮液和乳液中添加甜味剂和遮光剂的水或水-丙二醇溶液。液体形式制剂还可以包含用于鼻内施用的溶液。
[0250]
液体(具体地说,可注射的)组合物可以例如通过溶解、分散等来制备。例如,将所公开的盐溶解在药学上可接受的溶剂(如例如水、盐水、右旋糖水溶液、甘油、乙醇等)中或与所述药学上可接受的溶剂混合,从而形成可注射的等渗溶液或悬浮液。蛋白质(如白蛋白、冰冻微粒或血清蛋白质)可以用于溶解所公开的化合物。
[0251]
肠胃外可注射施用通常用于皮下、肌肉内或静脉内注射和输注。注射剂可以以常规形式作为液体溶液或悬浮液或适合用于在注射之前溶解在液体中的固体形式制备。
[0252]
适用于吸入的气溶胶制剂可以包含粉末形式的溶液和固体,它们可以与药学上可接受的载体组合,如惰性压缩气体,例如氮气。
[0253]
还包含的是固体形式制剂,所述固体形式制剂旨在使用之前不久被转化为液体形式制剂以用于口服或肠胃外施用。此类液体形式包含溶液剂、悬浮液和乳液。
[0254]
取决于预期的施用模式,所公开的组合物可以是固体、半固体或液体剂型,如例如注射剂、片剂、栓剂、丸剂、缓释胶囊、酏剂、酊剂、乳液、糖浆、粉末、液体、悬浮液等,有时呈单位剂量形式,并且与常规制药实践一致。同样,它们也可以以静脉内(团注和输注)、腹膜内、皮下或肌肉内的形式施用,所有这些形式均使用制药领域技术人员熟知的形式。
[0255]
药物组合物可以分别根据常规的混合、制粒或包衣方法制备,并且按重量或体积计,本发明的药物组合物可以含有约0.1%到约99%、约5%到约90%、或约1%到约20%的所公开的盐。
[0256]
除非另外指示,否则基于%w/w指示的本文所述的口服剂型(例如片剂)的任何组分的所有量是指口服剂型的总重量。
[0257]
实例
[0258]
通过以下实例进一步说明本公开,所述实例不应被解释为将本公开的范围或精神限制为本文所述的特定程序。应当理解,提供实例以说明某些实施例,并且不意图由此限制本公开的范围。应当进一步理解,在不脱离本公开的精神和/或所附权利要求书的范围的情况下,可以诉诸本领域的技术人员可以想到的各种其它实施例、修改及其等同物。
[0259]
实例1
–
化合物(i-g)的体外研究
[0260]
据显示,化合物(i-g)在通常用于前列腺癌研究的多种细胞系(包含例如vcap细胞)中降解95%到98%的雄激素受体(ar)。(化合物(i-g)在vcap中的dc
50
为1nm)。在化合物(i-g)施用的4小时内观察到接近最大的降解。化合物(i-g)抑制vcap增殖的效力比恩杂鲁胺强约60倍。(图1.)
[0261]
图2显示vcap肿瘤细胞中的ar响应于在0.03nm、0.1nm、0.3nm、1nm、3nm、10nm、30nm、100nm和300nm的浓度下的化合物(i-g)处理而减少。
[0262]
实例2
–
用动物进行的体内研究和化合物(i-g)的临床前有效暴露范围的评估
[0263]
在vcap异种移植动物模型中用化合物(i-g)进行临床前动物研究。vcap来源于前列腺癌的椎体转移性生长。它是体内研究的理想细胞系,因为它具有临床前列腺癌的许多特性。vcap也是研究ar耐药性的有用模型,因为它表达的ar剪接变体已被证明可驱动对ar拮抗剂的耐药性。(《欧洲泌尿外科(european urology.)》2018年4月;73(4):572-582)。
[0264]
在去势的vcap异种移植模型中以0.1mg/kg(mpk)、0.3mg/kg、1mg/kg和3mg/kg的剂量每日一次口服施用化合物(i-g)(图3)。恩杂鲁胺(20mg/kg)和媒剂也用作对照组。
[0265]
在完整的(非去势的)vcap异种移植模型中以1mg/kg、3mg/kg、10mg/kg的剂量每日一次口服施用化合物(i-g)(图4)。恩杂鲁胺(20mg/kg)和媒剂也用作对照组。
[0266]
在恩杂鲁胺抵抗性vcap异种移植模型中以3mg/kg和10mg/kg的剂量每日一次口服施用化合物(i-g)(图5)。恩杂鲁胺(20mg/kg)和媒剂也用作对照组。
[0267]
以1mg/kg和3mg/kg的剂量每日一次口服施用化合物(i-g)的药代动力学结果如下表1所示。化合物(i-g)的1mg/kg剂量是在vcap异种移植物中优于恩杂鲁胺的最低剂量。化合物(i-g)的3mg/kg剂量是恩杂鲁胺抵抗性vcap模型中的最低有效剂量(与对照组相比70%的肿瘤生长抑制)。
[0268]
图6显示恩杂鲁胺抵抗性vcap肿瘤中的ar响应于以10mg/kg和3mg/kg(口服,每天
一次)给药化合物(i-g)而减少。
[0269]
表1.
[0270][0271]
值表示总药物浓度
[0272]
auc或曲线下面积是总暴露的测量结果
[0273]cmax
是给药期间峰值浓度的测量结果
[0274]
实例3
–
化合物(i-g)和阿比特龙的体内动物研究
[0275]
在去势的vcap异种移植物中,化合物(i-g)和阿比特龙的组合比任一种单独的药剂更显著地减弱肿瘤生长。
[0276]
实例4
–
毒理学研究
[0277]
每天一次向动物口服施用化合物(i-g),持续28天,然后对于高剂量动物进行14天的恢复。
[0278]
在狗中,每天一次施用口服剂量为3mg/kg、10mg/kg或30mg/kg的化合物(i-g)。确定30mg/kg剂量超过最大耐受剂量。在所有剂量水平下都观察到胃肠道改变(包含单独的媒剂)。在一些中剂量和高剂量动物中观察到可逆的肝功能酶升高,这被认为是非不利的。雄性动物表现出前列腺重量降低,这可能归因于化合物(i-g)的药理学。
[0279]
在大鼠中,以20mg/kg、60mg/kg或120mg/kg的剂量每天一次向雄性施用化合物(i-g)的口服剂量。以20mg/kg、40mg/kg或120mg/kg的剂量每天一次向雌性大鼠施用化合物(i-g)的口服剂量。
[0280]
总体而言,化合物(i-g)在所有剂量下均被良好耐受,80mg/kg雌性组除外。这些老鼠体重减轻,食物消耗减少。在雄性高剂量大鼠中的所有发现都是完全可逆的(肝脏肥大、股骨骺板增厚)。雄性大鼠还表现出前列腺重量降低,这可能归因于化合物(i-g)的药理学。
[0281]
实例5
–
用化合物(i-g)进行的i期临床试验研究设计
[0282]
进行了化合物(i-g)的i期临床试验。实施传统的3+3剂量递增设计。化合物(i-g)的起始剂量是每天一次与食物一起口服施用35mg。剂量增加取决于毒性。
[0283]
该试验的关键标准是:患有转移性去势抵抗性前列腺癌(mcrpc)的男性;至少两种先前的全身疗法,其中至少一种是阿比特龙或恩杂鲁胺;以及最近疗法的疾病进展(例如,psa升高或骨扫描时出现两个或更多新病变)。
[0284]
该试验的主要目标是获得化合物(i-g)的最大耐受剂量和推荐的ii期试验剂量。另外的目标包含评估化合物(i-g)的总体安全性、药代动力学、抗肿瘤活性(例如,psa、recist)和生物标志物,包含例如ctc中的ar降解和治疗前与治疗后活检(当可用时);ar(和其它)基因突变、ctdna扩增;以及ctc中的ar-v7。
[0285]
实例6
–
i期药代动力学数据
–
化合物(i-g)的口服施用
[0286]
在i期临床试验中,以35mg/天、70mg/天和140mg/天的剂量口服施用化合物(i-g)。观察到用140mg/天剂量的化合物(i-g)治疗进入与肿瘤生长抑制相关的临床前有效范围。
[0287]
初始药代动力学结果显示在下表2以及图7中,其提供了在第15天给药后24小时内
针对所有三种测试剂量(35mg/天、70mg/天和140mg/天)的化合物(i-g)的平均浓度的表示。
[0288]
表2.
[0289][0290]a使用估算的24小时值计算的第15天auc。
[0291]
实例7
–
用化合物(i-g)进行的i期剂量递增研究
[0292]
以35mg/天、70mg/天、140mg/天和280mg/天的剂量向人类受试者(n=22)口服施用化合物(i-g)。
[0293]
在35mg/天队列(n=3)中,未观察到剂量限制性毒性,也未观察到2级、3级或4级的不良事件。
[0294]
在70mg/天队列(n=4)中,未观察到剂量限制性毒性。一名患者经历了2级不良事件(腹泻、疲劳、呕吐)。一名患者经历了与化合物(i-g)的施用无关的3级不良事件(贫血)。
[0295]
在140mg/天队列(n=8)中,未观察到剂量限制性毒性。50%的患者经历了2级不良事件,并且1名患者经历了3级不良事件(淋巴细胞计数减少)。这些结果不包含该队列组中被确定为不可评估且在第1天停止治疗的一名患者。
[0296]
在280mg/天队列(n=7)中,一名患者经历了剂量限制性毒性和肾衰竭,并且5名患者经历了2级或更少的不良事件。
[0297]
实例8
–
mcrpc患者中血浆psa相对于治疗前水平的最佳变化百分比的评估以及口服施用化合物(i-g)后生物标志物状态的后续评估
[0298]
以35mg/天、70mg/天、140mg/天或280mg/天的剂量向二十名患者口服施用化合物(i-g)。图8中提供了二十名患者中每名患者的血浆psa相对于治疗前水平的最佳变化百分比。在用化合物(i-g)治疗后,患者19(右数第二个条)和患者20(最右边的条)的psa减少了至少50%。
[0299]
评估了以大于或等于140mg/天的剂量口服施用化合物(i-g)的十二名患者的ar生物标志物状态。图9示出了这12名患者的ar生物标志物状态以及他们的血浆psa水平的最佳变化百分比。具有不同ar生物标志物状态的患者对化合物(i-g)的治疗有不同的响应。例如,同时具有t878a和h875y ar突变的患者19(右数第二个条)和患者20(最右边的条)是本研究中唯一治疗后psa减少至少50%的患者。
[0300]
患者19和20的主要特征分别总结在图10和图11a中。图11b示出了在用化合物(i-g)治疗前患者20的肿瘤的ct扫描。图11c示出了4个周期后患者20的肿瘤的ct扫描,其显示了recist响应。
[0301]
实例9
–
另外的药代动力学数据
–
化合物(i-g)的口服施用
[0302]
以35mg/天、70mg/天、140mg/天和280mg/天的剂量口服施用化合物(i-g)。观察到用140mg/天和280mg/天剂量的化合物(i-g)治疗进入与肿瘤生长抑制相关的临床前有效范围。(图12.)图13中提供了在第15天给药后24小时内针对所有四种测试剂量(35mg/天、70mg/天、140mg/天和280mg/天)的化合物(i-g)的平均血浆浓度。
[0303]
等同物
[0304]
本领域技术人员将认识到,或者能够仅使用常规实验来确定,本文具体描述的具体实施例的许多等同物。此类等同物旨在被涵盖在以下权利要求书的范围内。
[0305]
本文已通过参考某些优选的实施例来描述本公开的方法。然而,由于基于本文所述的公开内容,对本领域技术人员而言,对其的特定变化将变得显而易见,因此不应将本公开视为限于此。
[0306]
除非另外定义,否则本文所使用的所有技术及科学术语均具有与本公开所属领域的普通技术人员通常所理解的含义相同的含义。在说明书和权利要求书中,单数形式也包含复数,除非上下文另外明确地说明。
[0307]
应当理解,本公开的至少一些描述已被简化以集中于与对本公开的清晰理解相关的要素,同时为了清楚起见,消除本领域普通技术人员将理解的其它要素还可以包括本公开的一部分。然而,由于此类要素是本领域众所周知的,并且因为它们不一定促进对本公开的更好的理解,所以本文不提供对此类要素的描述。
[0308]
此外,在方法不依赖于本文阐述的特定步骤顺序的情况下,权利要求书中陈述的步骤的特定顺序不应被解释为对该权利要求的限制。
[0309]
本文引用的所有专利、专利申请、参考文献和出版物都通过引用全部且完全并入本文,如同以其整体阐述的那样。此类文件不被承认为本公开的现有技术。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1