去氧穿心莲内酯在制备过氧化物酶体增殖物激活受体拮抗剂中的应用
1.本发明涉及一种核激素受体家族中的配体激活受体抑制剂的应用,特别涉及一种过氧化物酶体增殖物激活受体转录活性抑制剂的应用。
背景技术:
2.过氧化物酶体增殖物激活受体(peroxisome proliferators
‑
activated receptors,ppars)是核激素受体家族中的配体激活受体,在不同的物种中已经发现了它的3种亚型(pparα,pparβ/δ,pparγ),控制许多细胞内的代谢过程,属于配体诱导核受体(ligand
‑
inducible nuclear receptors)。
3.胰腺癌是恶性程度极高的消化道肿瘤之一,其总体5年生存率不足8%,它的特点是容易早期转移,快速浸润,并且对标准治疗容易产生耐药性。头颈部副神经节瘤主要包括颈静脉球体瘤和颈动脉体瘤,临床上少见,占全身肿瘤的0.03%,若任其生长可压迫邻近组织、累及脑神经及侵蚀颅底骨质而出现多种临床症状,甚至危及生命。胶质母细胞瘤是成人常见的恶性程度最高的脑肿瘤,预后差,且大部分患者常表现出对化疗药的原发性与继发性耐药。而慢性淋巴细胞白血病(chronic lymphocytic leukemia,cll)也是一种进展缓慢的以成熟b淋巴细胞在外周血、骨髓、脾脏和淋巴结聚集为特征的恶性淋巴系统克隆增殖性疾病,骨髓的正常造血功能受到抑制,最终骨髓衰竭,病人出现贫血、出血、感染以及淋巴器官浸润肿大。以上疾病均对人类健康产生较大危害,对家庭经济产生沉重的负担。
4.有研究显示,ppar
‑
α拮抗剂可能对上述肿瘤有治疗作用。如对头颈部副神经节瘤,可通过抑制pi3k/gsk3β/β
‑
catenin通路降低hnpgls细胞的活力和增殖。减弱mmps表达,增强ampk磷酸化,抑制nf
‑
κb及其dna结合活性。对于胰腺癌,可损害胰腺癌细胞的活力。对胶质母细胞瘤,可降低胆固醇酯和脂滴,重新编程脂质代谢,调节mva通路;抑制5
‑
lo表达,阻断erks磷酸化和bcl
‑
2/bax信号的激活;克服trail抗性以增强胶质瘤细胞的凋亡。对慢性淋巴细胞白血病,ppar
‑
α拮抗剂nxt629(pubchem cid号:71721539;分子量:609.8)可使增殖的cll细胞进入免疫原性死亡途径,直接诱导循环cll细胞凋亡;即使存在保护性微环境,也能诱导cll细胞死亡。ppar
‑
α拮抗剂mk886(pubchem cid号:3651377;分子量为472.1)可阻断完整活化白细胞中白三烯的合成,具有减轻炎症反应性疾病如哮喘、关节炎和银屑病的作用;可抑制5
‑
脂氧合酶向膜组分易位从而抑制骨肉瘤细胞中白三烯的合成,抑制骨肉瘤的进展;拮抗剂gw6471(pubchem cid号:446738;分子量为619.7)可通过加强核受体与共阻遏蛋白(如smrt和n
‑
cor)的结合,具有抑制急性早幼粒细胞白血病和甲状腺激素抵抗综合征的作用;可抑制以pparα依赖性方式激活pi3k/akt/nf
‑
κb通路导致的卵巢癌和头颈部副神经节瘤的进展;可降低癌症干细胞的活力、增殖和球体形成,导致三阴性乳腺癌癌细胞凋亡和代谢障碍。
5.ppar
‑
α激动剂对代谢异常疾病如高甘油三脂血症、胰岛素抵抗症;心血管疾病如动脉粥样硬化;炎症性疾病如非酒精性脂肪性肝炎均具有保护改善的有益作用,且目前对
ppar
‑
α激动剂有大量研究报道,贝特类降血脂药也广泛应用于临床且有较好的疗效。
6.去氧穿心莲内酯(deoxyandrographolide,dag)是从天然植物药穿心莲中提取的成分,它可通过葡萄糖转运蛋白4易位至l6肌管质膜,促进葡萄糖摄取并在体内发挥抗高血糖作用。对raw 264.7巨噬细胞中lps诱导的no产生抑制作用,减轻氧化应激所带来的各种机体损伤。
7.已知穿心莲也具有抗病原微生物及抗炎、增强免疫、保肝利胆、抗肿瘤等功效,穿心莲主要成分之一的穿心莲内酯具有ppar
‑
α激动作用。而我们发现穿心莲成分去氧穿心莲内酯对ppar
‑
α转录活性具有抑制作用,这种对ppar
‑
α的双重调节机制为研发不良反应较少的抗肿瘤、抗白血病穿心莲新药制剂提供了一种可能。我们认为有很大的研究意义和发展空间。
技术实现要素:
8.本发明的目的是提供去氧穿心莲内酯在制备过氧化物酶体增殖物激活受体ppars的拮抗剂中的应用。
9.其中,所述去氧穿心莲内酯(deoxyandrographolide)的分子式为:c
20
h
30
o4;分子量为:334.4;cas号为4176
‑
97
‑
0;化学结构式如下:
[0010][0011]
去氧穿心莲内酯是一种已知化合物,可购自市售产品,也可从药材穿心莲中提取分离得到,具体的获取手段为现有技术,本发明对此不作特别限定。
[0012]
去氧穿心莲内酯为白色粉末,可溶于甲醇、乙醇、丙酮、吡啶和氯仿,可溶于苯和乙醚的无色针状结晶(乙醚
‑
轻石油醚),无色片状结晶(丙酮、乙醇或氯仿),属于萜类物质,旋光度为
‑
40(c=1,无水乙醇)。
[0013]
去氧穿心莲内酯是穿心莲的生物活性成分,具有抗菌和钩端螺旋体作用。临床适用治疗钩端螺旋体、急性细菌性痢疾、上呼吸道感染、流行性感冒及原因不明的发热等病症均有一定疗效;毒性小,未见明显副作用;能减少二甲苯或h+刺激所致伊文思兰自毛细血管壁的渗出,有抑制巴豆油所致大鼠炎性渗出作用,对大鼠蛋清性足肿有显著抑制作用,对肾上腺皮质功能有不同程度的兴奋作用;具有保护肝脏的作用,其通过诱导tnfrsf1a的释放,逐渐使肝细胞对tnf
‑
α介导的凋亡脱敏。
[0014]
为实现本发明的目的,本发明一方面提供一种去氧穿心莲内酯在制备过氧化物酶体增殖物激活受体ppars的拮抗剂中的应用;去氧穿心莲内酯对过氧化物酶体增殖物激活受体ppars具有抑制作用,去氧穿心莲内酯抑制过氧化物酶体增殖物激活受体ppars转录活
性的用途。
[0015]
其中,所述过氧化物酶体增殖物激活受体选择ppar
‑
α亚型受体。
[0016]
特别是,所述ppars拮抗剂为ppars转录活性抑制剂。
[0017]
尤其是,所述去氧穿心莲内酯抑制ppars转录活性,优选为抑制ppar
‑
α亚型受体的转录活性。
[0018]
本发明另一方面提供一种去氧穿心莲内酯在制备治疗过氧化物酶体增殖物激活受体ppars失调疾病的药物中的应用。
[0019]
其中,所述过氧化物酶体增殖物激活受体失调疾病为ppar
‑
α亚型受体失调疾病。
[0020]
特别是,所述治疗过氧化物酶体增殖物激活受体ppars失调疾病的药物以去氧穿心莲内酯为活性成分制备而成,具体为本领域技术人员所掌握。
[0021]
尤其是,本发明提供的去氧穿心莲内酯主要针对由ppar
‑
α亚型受体失调所引起的疾病,包括头颈部副神经节瘤、胰腺癌、胶质母细胞瘤等恶性消耗性疾病、白血病或糖尿病等。
[0022]
特别是,所述ppar
‑
α亚型受体失调是指ppar
‑
α的转录活性过度增强。
[0023]
我们的实验可直接证明去氧穿心莲内酯抑制ppar
‑
α的转录活性,可能通过增强ppar
‑
α与共阻遏蛋白(如smrt和n
‑
cor)的结合,防止ppar
‑
α的羧基末端激活螺旋(af
‑
2)呈现活性构象,达到抑制ppar
‑
α的转录活性。
[0024]
与现有技术相比,本发明具有如下优点和好处:
[0025]
中草药具有悠久的应用历史,是药物开发的重要来源,很多高活性药物都是从中草药中发现的,例如青蒿素、紫杉醇等。而穿心莲作为一味重要的中草药,在中医药领域中广泛使用,本发明在研究过程中,筛选得到穿心莲提取物中的单体化合物去氧穿心莲内酯可以高效抑制过氧化物酶体增殖物激活受体的转录活性,可以抗高血糖,抑制raw 264.7巨噬细胞中lps诱导的no产生,抑制cox
‑
2活性,减轻氧化应激与炎症损伤,是新型的ppar
‑
α亚型受体转录活性抑制剂,即ppar
‑
α亚型受体拮抗剂。
附图说明
[0026]
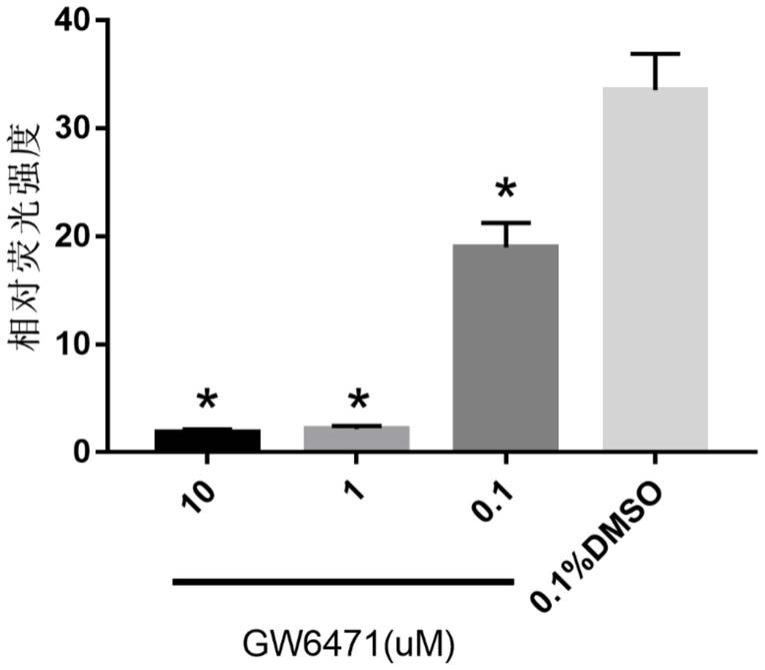
图1为不同浓度gw6471对ppar
‑
α转录活性的影响结果图。
[0027]
图2为不同浓度非诺贝特对ppar
‑
α转录活性的影响结果图。
[0028]
图3为不同浓度去氧穿心莲内酯(dag)对ppar
‑
α转录活性的影响结果图。
[0029]
图4为去氧穿心莲内酯(dag)对非诺贝特激动ppar
‑
α转录活性的影响结果图。
具体实施方式
[0030]
下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但这些实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
[0031]
以下通过试验例来进一步阐述本发明所述穿心莲成分去氧穿心莲内酯的有益效果,这些试验例包括了本发明药物的药效学试验。
[0032]
试验例1
[0033]
1材料与方法
[0034]
1.1细胞与质粒
[0035]
hek293细胞系从北京协和医学院细胞资源中心(其为细胞系资源的国家基础设施,nsti的总部)购得。通过pcr和培养检查细胞系没有支原体污染,用pcr鉴定其种源,用str谱(fbi,codis)鉴定细胞系。
[0036]
质粒:pzdonor
‑
cmv
‑
pparα、pgl4.23
‑
ppre
‑
luc及prl
‑
cmv由北京北因健康科技有限公司提供。
[0037]
1.2药品及主要试剂
[0038]
去氧穿心莲内酯(deoxyandrographolide),上海源叶生物科技有限公司,货号:b21031
‑
5mg;ppar
‑
α特异性激动剂非诺贝特,上海源叶生物科技有限公司,货号49562
‑
28
‑
9;ppar
‑
α特异性抑制剂gw6471,mce公司,美国,货号hy
‑
15372;lipofectamine3000 transfection kit(lipo3000转染试剂盒,试剂盒包含试剂lipo 3000、p3000),赛默飞公司,美国,货号l3000015;双荧光素酶报告基因检测试剂盒,promega,美国,货号e1960;
[0039]
1.3仪器
[0040]
synergyii酶标仪,bio
‑
tek公司,美国。
[0041]
1.4试验方法
[0042]
1.4.1分组与给药
[0043]
实验分别设空白对照组,ppar
‑
α特异性抑制剂组,ppar
‑
α特异性激动剂组,去氧穿心莲内酯实验组,去氧穿心莲内酯+非诺贝特试验组,其中,空白对照组为0.1%dmso;ppar
‑
α特异性抑制剂组中抑制剂gw6471的浓度为0.1、1、10um;ppar
‑
α特异性激动剂组中激动剂非诺贝特的浓度为10、20、30、40um;去氧穿心莲内酯实验组中去氧穿心莲内酯的浓度分别为12.5、25、50、100um;去氧穿心莲内酯+非诺贝特试验组中去氧穿心莲内酯浓度为100um,非诺贝特浓度为30um。激动剂、抑制剂、去氧穿心莲内酯用0.1%dmso溶解,制成上述相应的浓度。
[0044]
1.4.2质粒转染hek293细胞、药物干预
[0045]
1)将hek293细胞培养在含10%fbs的dmem培养基中,放入37℃,5%co2培养箱内培养。取生长旺盛的hek293细胞,配制成5
×
105个/ml的hek293细胞悬液,在转染前24h按照每孔1ml接种于24孔板中,即每孔内接种细胞密度为5
×
105个/孔;
[0046]
2)接种24小时后弃去原有培养基,换上新配置的含10%fbs的dmem培养基,置于37℃,5%co2细胞培养箱中培养30min
‑
60min;
[0047]
3)制备脂质体
‑
dna复合物,按每孔转染样品量描述:
[0048]3‑
1)将脂质体lipo3000加入到无血清无抗生素的dmem培养基中,充分混匀,其中lipo3000与无血清无抗生素的dmem培养基的体积之比为0.75:25,通常是按照lipo3000(0.75ul)加入至25ul无血清无抗生素的dmem培养基中的比例,充分混匀,得到a液;
[0049]3‑
2)将质粒pzdonor
‑
cmv
‑
pparα、pgl4.23
‑
ppre
‑
luc、prl
‑
cmv和试剂p3000按每孔分别为0.2μg、0.2μg、0.03μg、1ul的比例加入至25ul无血清无抗生素的dmem培养基中,充分混匀,得到b液;
[0050]3‑
3)将b液加入a液中,室温静置15min,得到脂质体
‑
dna复合物;
[0051]
ppar
‑
α为目的基因,ppre是能与pparα特异性结合的元件,ppre质粒上携带萤火虫
荧光(f),prl质粒上携带海肾荧光(r)。双荧光素检测这两种荧光,其中萤火虫荧光值代表目的基因pparα的绝对值,海肾荧光值代表内在的变化因素(如:培养细胞的数目和活力的差别,细胞转染和裂解的效率等)对实验准确性的影响,提供转录活力的内对照。
[0052]
4)转染
[0053]
按每孔转染量将上述步骤3)中制备的脂质体
‑
dna复合物加入到上述步骤2)中的24孔板培养体系中,轻摇培养板使其混匀,37℃培养24h使目的基因ppar
‑
α充分转染入细胞,然后给药,进行药物干预。
[0054]
5)加药干预
[0055]5‑
1)ppar
‑
α特异性抑制剂干预
[0056]
ppar
‑
α抑制剂gw6471溶于dmso中,分别配制成浓度为0.1um、1um、10um的抑制剂gw6471溶液,备用;
[0057]
经上述步骤4)转染24h后,吸弃培养基,然后向24孔板培养体系的每孔内加入不同浓度的ppar
‑
α抑制剂gw6471溶液,浓度设置为0um(即向其中加入0.1%dmso),0.1um、1um、10um;每个浓度3个复孔,重复3次。
[0058]5‑
2)ppar
‑
α特异性激动剂干预
[0059]
ppar
‑
α激动剂非诺贝特溶于dmso中,分别配制成浓度为10um、20um、30um、40um的激动剂非诺贝特溶液,备用;
[0060]
经上述步骤4)转染24h后,吸弃培养基,然后向24孔板培养体系的每孔内加入不同浓度的ppar
‑
α激动剂非诺贝特,设置浓度为0um(即向其中加入0.1%dmso),10um、20um、30um、40um;每个浓度3个复孔,重复3次。
[0061]5‑
3)去氧穿心莲内酯干预
[0062]
将去氧穿心莲内酯溶于dmso中,分别配制成浓度为12.5um、25um、50um、100um的去氧穿心莲内酯溶液,备用;
[0063]
经上述步骤4)转染24h后,吸弃培养基,然后向24孔板每孔内加入不同浓度的去氧穿心莲内酯,设置浓度为0um(即向其中加入0.1%dmso),12.5um、25um、50um、100um;每个浓度3个复孔,重复3次。
[0064]5‑
4)去氧穿心莲内酯与ppar
‑
α特异性激动剂同时干预
[0065]
经上述步骤4)转染24h后,吸弃培养基,然后向24孔板每孔内加入用dmso溶解的去氧穿心莲内酯和非诺贝特的混合液,混合液中去氧穿心莲内酯的浓度为100um,非诺贝特的浓度为30um;以及0.1%的dmso;3个复孔,重复3次。
[0066]
加入药物后,置于37℃,5%co2细胞培养箱中进行培养,即进行药物干预。
[0067]
1.4.3荧光素酶报告基因检测:
[0068]
加药干预48h后,除去培养基,用预冷(温度4℃)的1
×
pbs清洗2遍,不要接触贴壁细胞,尽可能多地将漂洗用pbs吸出,每孔加入100μl的1
×
被动裂解液,室温下震摇15min,将裂解液转移至96孔板中,每孔100ul。
[0069]
应用双荧光素酶报告基因测定试剂盒测定荧光素酶活性,预先将100ul荧光素酶测定试剂(larii)加入96孔板中,再使用酶标仪测定萤火虫荧光素活性(f),然后再加入100ul终止液,接着再测定海肾荧光素活性(r),萤火虫荧光素与海肾荧光素光强的比值(f/r)即为ppar
‑
α转录表达强度。
[0070]
2试验结果
[0071]
2.1gw6471与非诺贝特对ppar
‑
α转录活性的影响
[0072]
药物干预48h后,gw6471以浓度依赖的方式降低hek293细胞ppar
‑
α的转录活性,gw6471 1um时荧光素酶活性达到最低效应值(如图1);其中与空白对照组(即gw6471 0um)比较,*p<0.05;非诺贝特以浓度依赖的方式增加hek293细胞ppar
‑
α的转录活性,非诺贝特30um时荧光素酶活性达到峰值(如图2);其中与空白对照组(即非诺贝特0um)比较,*p<0.05。
[0073]
2.2去氧穿心莲内酯对ppar
‑
α活性的影响
[0074]
药物干预48h后,去氧穿心莲内酯以浓度依赖的方式降低hek293细胞ppar
‑
α的转录活性(如图3),去氧穿心莲内酯100um时荧光素酶活性达到最低效应值(图3),其中与空白对照组(即去氧穿心莲内酯0um)比较,*p<0.05;100um去氧穿心莲内酯与非诺贝特共同孵育后可显著抑制荧光素酶活性(如图4),与30um非诺贝特比较,*p<0.05。
[0075]
该实验利用双萤光素酶报告基因分析方法,建立ppar
‑
α抑制剂体外筛选体系,采用不同浓度的ppar
‑
α抑制剂gw6471干预,ppar
‑
α的转录活性随浓度增加而降低。特异性激动剂非诺贝特与100um去氧穿心莲内酯共同孵育后,转录活性降低,表明去氧穿心莲内酯以浓度依赖的方式降低ppar
‑
α的转录活性,并可抑制特异性激动剂非诺贝特的作用。以上结果表明,去氧穿心莲内酯具有抑制ppar
‑
α转录活性的作用。
[0076]
本发明上述实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1