通过阻断半乳凝素-3治疗炎性疾病的方法与流程
本公开的方面大体上涉及结合半乳凝素-3(gal3)的抗体或其结合片段。一些方面结合gal-3并阻断其与病毒蛋白(诸如sars-cov-2病毒或其他冠状病毒的蛋白,或病毒相关宿主蛋白)的相互作用。本公开的方面大体上涉及减少炎症(例如,通过由gal3降低免疫细胞活化)的抗体或其结合片段。
背景技术:
1、半乳凝素-3(gal3,gal3)是凝集素或碳水化合物结合蛋白,对β-半乳糖苷具有特异性。在人细胞中,gal3在细胞核、细胞质、细胞表面中以及在细胞外空间中表达并且可以找到。
技术实现思路
1、半乳凝素-3(gal3)已被表明具有免疫调节活性。这一点的实例是gal3和t细胞免疫球蛋白与粘蛋白结构域分子-3(t-cell immunoglobulin and mucin-domaincontaining-3(tim-3))(tim-3)之间的相互作用,其引起免疫响应诸如t细胞活化的抑制并且可以使癌细胞逃避免疫清除。抑制其的这种现象和方法在wo 2019/023247和wo 2020/160156中进行了举例说明,每个文献通过引用以其整体明确地并入本文。
2、由sars-cov-2冠状病毒引起的covid-19流行病导致对人类死亡率、全球经济和全世界公共卫生基础设施的负担的极大影响。病毒如何与宿主免疫系统相互作用很大程度上目前仍是未知的。然而,响应sars-cov-2冠状病毒的不受控制的炎症可大大有助于增加长期后遗症和死亡的风险。此外,用于人类的冠状病毒免疫疗法或疫苗仅开始批准。因此,一般而言,对于针对sars-cov-2和其他冠状病毒以及针对炎性疾病的新的和有效的治疗和预防存在持续的需求。
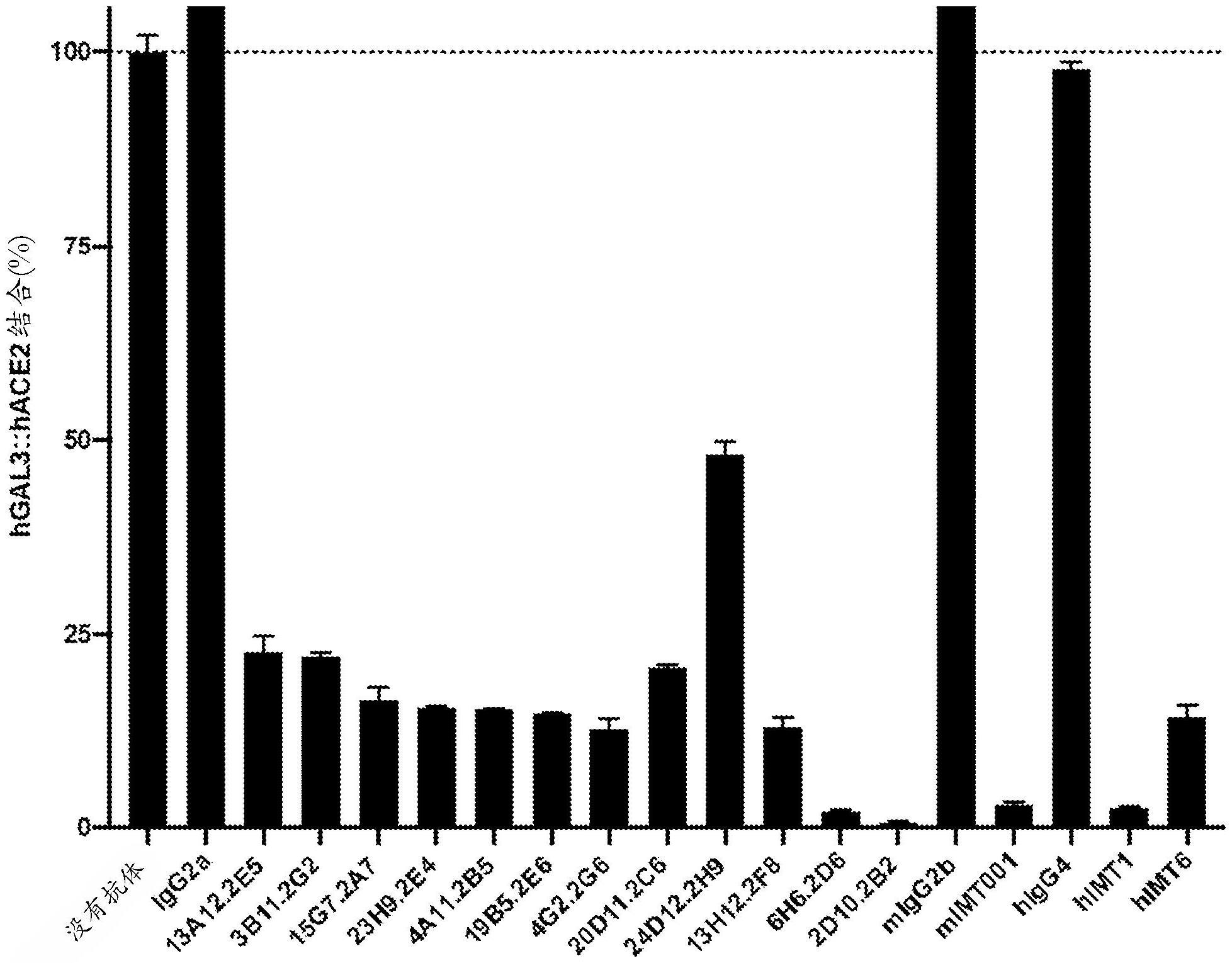
3、本文公开了用于破坏半乳凝素-3(gal3)和病毒蛋白(诸如sars-cov-2病毒或其他冠状病毒的蛋白,如冠状病毒棘突蛋白)或病毒相关宿主蛋白(包括ace2或cd147)之间的相互作用的方法、抗体和组合物。
4、本文还公开了治疗病毒感染的方法。该病毒感染可与炎性症状相关。在一些实施方式中,方法涉及预防和/或减少病毒扩散或减少病毒可侵入细胞(例如体外或体内二者其一)的风险。
5、本文进一步公开了涉及抗gal3抗体或其结合片段用于治疗受试者中的疾病或病症的方法、药物和组合物,诸如治疗病毒感染或治疗纤维化诸如肺纤维化,其可例如发展为病毒感染的后遗症,或炎性疾病诸如慢性阻塞性肺病(copd)。
6、本文还公开了抗gal3抗体或其结合片段用于治疗例如由细菌、病毒、真菌或原生动物感染引起的细胞因子释放综合征(crs,细胞因子风暴)或败血症的方法和用途。在一些实施方式中,crs可以是败血症的结果。在一些实施方式中,crs是冠状病毒感染诸如sars-cov-2感染的结果。
7、本文还公开了涉及抗gal3抗体或其结合片段用于治疗炎性疾病或用于降低或抑制受试者中炎症的方法、药物和组合物。在一些实施方式中,该炎症可与免疫细胞诸如嗜中性粒细胞的活化和/或迁移相关。在一些实施方式中,抗gal3抗体或其结合片段的施用降低或抑制受试者中的嗜中性粒细胞活化和/或迁移。在一些实施方式中,抗gal3抗体或其结合片段的施用降低或抑制受试者中由嗜中性粒细胞表达的cd62l的切割和/或降低或抑制il-8产生。在一些实施方式中,抗gal3抗体或其结合片段的施用降低受试者中嗜中性粒细胞的数量。在一些实施方式中,抗gal3抗体或其结合片段的施用调节受试者中gal3、髓过氧物酶(mpo)、生长有关的致癌基因α(groα)/角质细胞-衍生的趋化因子(kc)、ly6c1、inos、il-6、tnfα、il-1b、col1a1、asma、tgfβ、vegfa、vegfb或其任意组合的表达。在一些实施方式中,抗gal3抗体或其结合片段的施用降低受试者中自身抗体诸如抗核酸自身抗体的产生。炎症可以是肺部炎症和可与疾病相关,所述疾病包括但不限于copd、肺炎、哮喘、结节病、肺纤维化、组织细胞增生症、闭塞性细支气管炎或其任意组合。在一些实施方式中,炎症可与自身免疫病相关,所述自身免疫病包括但不限于系统性红斑狼疮(sle)、格雷夫斯病、类风湿性关节炎、多发性硬化、舍格伦综合征、乳糜泻或其任意组合。
8、本文还公开了通过细胞降低或抑制cd62l的切割,降低il-8产生,和/或调节gal3、mpo、groα/kc、ly6c1、inos、il-6、tnfα、il-1b、col1a1、asma、tgfβ、vegfa、vegfb或其任意组合的表达的方法。在一些实施方式中,方法包括将细胞与抗gal3抗体或其结合片段接触。
9、本文还公开了药物抗体制剂。在一些实施方式中,药物抗体制剂包括治疗上有效量的本文公开的一种或多种抗体。在一些实施方式中,药物抗体制剂进一步包括组氨酸、甲硫氨酸、nacl和聚山梨醇酯。在一些实施方式中,药物抗体制剂处于5.3和6.3之间的ph。
10、本文还公开了包括本文公开的任一种药物抗体制剂的无菌瓶。在一些实施方式中,无菌瓶包括浓缩形式的本文公开的任一种药物抗体制剂,使得浓缩形式旨在施用药物抗体制剂之前被稀释。
11、本文公开的药物抗体制剂和无菌瓶实施方式可用于治疗需要其的受试者的方法。在一些实施方式中,本文公开的药物抗体制剂和无菌瓶实施方式用于治疗需要其的受试者冠状病毒感染的方法。在一些实施方式中,冠状病毒感染是sars相关冠状病毒感染。在一些实施方式中,冠状病毒感染是sars-cov-2感染。在一些实施方式,本文公开的药物抗体制剂和无菌瓶实施方式用于降低或抑制需要其的受试者炎症的方法。在一些实施方式中,炎症可与炎性疾病相关,所述炎性疾病包括但不限于肺部炎症诸如copd、肺炎、哮喘、结节病、肺纤维化、组织细胞增生症、闭塞性细支气管炎或其任意组合;或自身免疫病诸如系统性红斑狼疮(sle)、格雷夫斯病、类风湿性关节炎、多发性硬化、舍格伦综合征、乳糜泻或其任意组合。
技术特征:
1.一种抗gal3抗体或其结合片段,其包括(1)包含vl-cdr1、vl-cdr2和vl-cdr3的轻链可变区;和(2)包含vh-cdr1、vh-cdr2和vh-cdr3的重链可变区,其中
2.根据权利要求1所述的抗gal3抗体或其结合片段,其中抗gal3抗体或结合片段包括图14中阐释的vl-cdr1、vl-cdr2、vl-cdr3、vh-cdr1、vh-cdr2和vh-cdr3的组合。
3.根据权利要求1或2所述的抗gal3抗体或其结合片段,其中轻链可变区包括与选自seq id no:374-447、823-825的序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列。
4.根据权利要求1-3的任一项所述的抗gal3抗体或其结合片段,其中轻链可变区包括选自seq id no:374-447、823-825的序列。
5.根据权利要求1-4的任一项所述的抗gal3抗体或其结合片段,其中重链可变区包括与选自seq id no:297-373、822、828的序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列。
6.根据权利要求1-5的任一项所述的抗gal3抗体或其结合片段,其中重链可变区包括选自seq id no:297-373、822、828的序列。
7.根据权利要求1-6的任一项所述的抗gal3抗体或其结合片段,其中抗gal3抗体或其结合片段包括轻链,其中轻链包括与选自seq id no:495-538、830的序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列。
8.根据权利要求7所述的抗gal3抗体或其结合片段,其中轻链包括选自seq id no:495-538、830的序列。
9.根据权利要求1-8的任一项所述的抗gal3抗体或其结合片段,其中抗gal3抗体或其结合片段包括重链,其中重链包括与选自seq id no:448-494、829的序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列。
10.根据权利要求9所述的抗gal3抗体或其结合片段,其中重链包括选自seq id no:448-494、829的序列。
11.根据权利要求1-10的任一项所述的抗gal3抗体或其结合片段,其中抗gal3抗体或结合片段选自由下述组成的组:tb001、tb006、12g5.d7、13a12.2e5、14h10.2c9、15f10.2d6、19b5.2e6、20d11.2c6、20h5.a3、23h9.2e4、2d10.2b2、3b11.2g2、7d8.2d8、mimt001、4a11.2b5、4a11.h1l1、4a11.h4l2、4g2.2g6、6b3.2d3、6h6.2d6、9h2.2h10、13g4.2f8、13h12.2f8、15g7.2a7、19d9.2e5、23b10.2b12、24d12.2h9、f846c.1b2、f846c.1f5、f846c.1h12、f846c.1h5、f846c.2h3、f846tc.14a2、f846tc.14e4、f846tc.16b5、f846tc.7f10、f847c.10b9、f847c.11b1、f847c.12f12、f847c.26f5、f847c.4b10、f849c.8d10、f849c.8h3、846.2b11、846.4d5、846t.1h2、847.14h4、846.2d4、846.2f11、846t.10b1、846t.2e3、846t.4c9、846t.4e11、846t.4f5、846t.8d1、847.10c9、847.11d6、847.15d12、847.15f9、847.15h11、847.20h7、847.21b11、847.27b9、847.28d1、847.2b8、847.3b3、849.1d2、849.2d7、849.2f12、849.4b2、849.4f12、849.4f2、849.5c2、849.8d12、f847c.21h6、849.5h1、847.23f11、847.16d10、847.13e2-mh0ml1、847.13e2-mh0ml2、847.12c4、847.4d3、2d10-vh0-vl0或其结合片段。
12.一种治疗需要其的受试者的肺纤维化的方法,其包括:
13.根据权利要求12所述的方法,其中病毒感染是冠状病毒感染。
14.根据权利要求12或13所述的方法,其中病毒感染是sars相关冠状病毒感染。
15.根据权利要求12-14的任一项所述的方法,其中病毒感染是sars-cov-2冠状病毒感染。
16.一种破坏gal3和sars-cov-2相关宿主细胞受体之间的相互作用的方法,其包括:
17.一种破坏gal3和sars-cov-2s蛋白之间的相互作用的方法,其包括:
18.一种治疗需要其的受试者的sars-cov-2感染的方法,其包括:
19.一种治疗需要其的受试者的病毒感染的方法,其包括:
20.根据权利要求19所述的方法,其中病毒感染是冠状病毒感染并且病毒蛋白是冠状病毒蛋白。
21.根据权利要求19或20所述的方法,其中病毒感染是sars相关冠状病毒感染并且病毒蛋白是sars相关冠状病毒蛋白。
22.根据权利要求19-21的任一项所述的方法,其中病毒感染是sars-cov-2病毒感染并且病毒蛋白是sars-cov-2s蛋白。
23.一种治疗sars-cov-2感染的方法,其包括:
24.根据权利要求23所述的方法,其中与细胞相关的gal3是由细胞表达的gal3。
25.根据权利要求24所述的方法,其中与细胞相关的gal3是结合至细胞表面的gal3。
26.一种预防和/或减少病毒扩散的方法,所述方法包括:
27.一种减少病毒可侵入细胞的风险的方法,所述方法包括:
28.一种降低或抑制经历细胞因子释放综合征(crs)或易受crs的受试者中的毒性的方法,所述方法包括:
29.根据权利要求28所述的方法,其中crs是以下的结果:细菌感染、病毒感染、真菌感染、原生动物感染、移植物抗宿主病、巨细胞病毒、eb病毒、噬血细胞淋巴组织细胞增生症(hlh)、eb病毒-相关hlh、偶发hlh、巨噬细胞活化综合征(mas)、慢性关节炎、全身型幼年特发性关节炎(sjia)、斯提耳氏病、cryopyrin-相关周期性综合征(caps)、家族性冷自身炎症综合征(fcas)、家族性寒冷性荨麻疹(fcu)、muckle-well综合征(mws)、慢性小儿神经皮肤和关节(cinca)综合征、包括nlrp3基因功能突变的遗传或重新获得的冷炎素病、遗传性自身炎症紊乱、急性胰腺炎、重度烧伤、创伤、急性呼吸窘迫综合征(ards)、链球菌、假单胞菌、流感、禽流感、h5n1、h1n1、天花病毒、冠状病毒、严重急性呼吸综合征(sars)、sars-cov-1、sars-cov-2、败血症、革兰氏阴性败血症、革兰氏阳性毒素、疟疾、埃博拉病毒、天花病毒、全身革兰氏阴性细菌感染、菌血症、梅毒吉海综合征、糖基磷脂酰肌醇(gpi)或脂多糖,或以包括利妥昔单抗、奥妥珠单抗、阿来组单抗、本妥昔单抗、达西组单抗、纳武利尤单抗、西拉利珠单抗、奥沙利铂、来那度胺、t-细胞衔接子分子、双特异性t-细胞衔接子(bite)分子或cart疗法的免疫疗法的治疗。
30.根据权利要求29所述的方法,其中crs是败血症的结果。
31.根据权利要求29或30所述的方法,其中败血症是细菌败血症、病毒败血症、真菌败血症或原生动物败血症。
32.根据权利要求28-31的任一项所述的方法,其中crs是病毒感染的结果。
33.根据权利要求28-32的任一项所述的方法,其中crs是冠状病毒感染的结果。
34.根据权利要求28-33的任一项所述的方法,其中crs是sars相关冠状病毒感染的结果。
35.根据权利要求28-34的任一项所述的方法,其中crs是sars-cov-2冠状病毒感染的结果。
36.一种降低或抑制需要其的受试者中的炎症的方法,所述方法包括:
37.根据权利要求36所述的方法,其中受试者中的炎症与嗜中性粒细胞活化和/或迁移相关。
38.根据权利要求36或37所述的方法,其中有效量的抗gal3抗体或其结合片段的施用降低或抑制受试者中的嗜中性粒细胞活化和/或迁移。
39.根据权利要求36-38的任一项所述的方法,其中有效量的抗gal3抗体或其结合片段的施用降低或抑制受试者中的由嗜中性粒细胞表达的cd62l的切割和/或降低或抑制受试者中的il-8产生。
40.根据权利要求36-39的任一项所述的方法,进一步包括在施用步骤之后检测受试者中嗜中性粒细胞cd62l切割的降低和/或il-8产生的降低。
41.根据权利要求36-40的任一项所述的方法,其中有效量的抗gal3抗体或其结合片段的施用降低受试者中嗜中性粒细胞的数量。
42.根据权利要求36-41的任一项所述的方法,进一步包括在施用步骤之后检测受试者中嗜中性粒细胞数量的降低。
43.根据权利要求36-42的任一项所述的方法,其中有效量的抗gal3抗体或其结合片段的施用调节受试者中gal3、髓过氧物酶(mpo)、生长有关的致癌基因α(groα)/角质细胞-衍生的趋化因子(kc)、ly6c1、inos、il-6、tnfα、il-1b、col1a1、asma、tgfβ、vegfa、vegfb或其任意组合的表达。
44.根据权利要求36-43的任一项所述的方法,进一步包括在施用步骤之后检测受试者中gal3、mpo、groα/kc、ly6c1、inos、il-6、tnfα、il-1b、col1a1、asma、tgfβ、vegfa、vegfb或其任意组合的表达的变化。
45.根据权利要求36-44的任一项所述的方法,其中有效量的抗gal3抗体或其结合片段的施用降低受试者中自身抗体的产生。
46.根据权利要求45所述的方法,其中自身抗体是抗核酸自身抗体。
47.根据权利要求36-46的任一项所述的方法,其中炎症包括肺部炎症。
48.根据权利要求36-47的任一项所述的方法,其中炎症包括copd、肺炎、哮喘、结节病、肺纤维化、组织细胞增生症、闭塞性细支气管炎或其任意组合。
49.根据权利要求36-48的任一项所述的方法,其中炎症包括自身免疫病。
50.根据权利要求49所述的方法,其中自身免疫病包括系统性红斑狼疮(sle)、格雷夫斯病、类风湿性关节炎、多发性硬化、舍格伦综合征、乳糜泻或其任意组合。
51.根据权利要求36-50的任一项所述的方法,进一步包括在施用步骤之后检测受试者中炎症的改善。
52.一种降低或抑制通过细胞的cd62l的切割、降低通过细胞的il-8产生和/或调节通过细胞的gal3、mpo、groα/kc、ly6c1、inos、il-6、tnfα、il-1b、col1a1、asma、tgfβ、vegfa、vegfb或其任意组合的表达的方法,包括将细胞与抗gal3抗体或其结合片段接触,因此降低或抑制通过细胞的cd62l的切割,降低通过细胞的il-8产生和/或调节通过细胞的gal3、mpo、groα/kc、ly6c1、inos、il-6、tnfα、il-1b、col1a1、asma、tgfβ、vegfa、vegfb或其任意组合的表达。
53.根据权利要求52所述的方法,其中细胞是免疫细胞。
54.根据权利要求53所述的方法,其中免疫细胞是嗜中性粒细胞。
55.根据权利要求52-54的任一项所述的方法,其中cd62l的切割被降低至少60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%,il-8产生被降低至少1%、2%、3%、4%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%,tnfα表达被降低至少10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%,和/或il-6表达被降低至少10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%。
56.根据权利要求52-55的任一项所述的方法,其中通过elisa确定cd62l的切割的降低或抑制,il-8产生的降低,和/或gal3、mpo、groα/kc、ly6c1、inos、il-6、tnfα、il-1b、col1a1、asma、tgfβ、vegfa、vegfb或其任意组合的表达的变化。
57.根据权利要求12-35的任一项所述的方法,其中抗gal3抗体或其结合片段对gal3的n末端、gal3的n末端结构域或gal3的串联重复结构域(trd)是特异的。
58.根据权利要求12-57的任一项所述的方法,其中抗gal3抗体或其结合片段结合至gal3的n末端。
59.根据权利要求12-58的任一项所述的方法,其中抗gal3抗体或其结合片段结合至gal3的n末端结构域。
60.根据权利要求12-59的任一项所述的方法,其中抗gal3抗体或其结合片段结合至gal3的串联重复结构域。
61.根据权利要求12-60的任一项所述的方法,其中抗gal3抗体或其结合片段结合至肽1(adnfslhdalsgsgnpnpqg;seq id no:3)。
62.根据权利要求12-61的任一项所述的方法,其中抗gal3抗体或其结合片段结合至肽6(gaypgqappgaypgapgayp;seq id no:8)。
63.根据权利要求12-62的任一项所述的方法,其中抗gal3抗体或其结合片段结合至肽7(aypgapgaypgapapgvypg;seq id no:9)。
64.根据权利要求12-63的任一项所述的方法,其中抗gal3抗体或其结合片段包括(1)包含vl-cdr1、vl-cdr2和vl-cdr3的轻链可变区;和(2)包含vh-cdr1、vh-cdr2和vh-cdr3的重链可变区,其中
65.根据权利要求12-64的任一项所述的方法,其中抗gal3抗体或结合片段包括图14中阐释的vl-cdr1、vl-cdr2、vl-cdr3、vh-cdr1、vh-cdr2和vh-cdr3的组合。
66.根据权利要求64或65所述的方法,其中轻链可变区包括与选自seq id no:374-449的序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列。
67.根据权利要求64-66的任一项所述的方法,其中轻链可变区包括选自seq id no:374-449的序列。
68.根据权利要求64-67的任一项所述的方法,其中重链可变区包括与选自seq id no:297-373、822、828的序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列。
69.根据权利要求64-68的任一项所述的方法,其中重链可变区包括选自seq id no:297-373、822、828的序列。
70.根据权利要求64-69的任一项所述的方法,其中抗gal3抗体或其结合片段包括轻链,其中轻链包括与选自seq id no:495-538、830的序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列。
71.根据权利要求70所述的方法,其中轻链包括选自seq id no:495-538、830的序列。
72.根据权利要求64-71的任一项所述的方法,其中抗gal3抗体或其结合片段包括重链,其中重链包括与选自seq id no:448-494、829的序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列。
73.根据权利要求72所述的方法,其中重链包括选自seq id no:448-494、829的序列。
74.根据权利要求12-73的任一项所述的方法,其中抗gal3抗体或其结合片段选自由下述组成的组:tb001、tb006、12g5.d7、13a12.2e5、14h10.2c9、15f10.2d6、19b5.2e6、20d11.2c6、20h5.a3、23h9.2e4、2d10.2b2、3b11.2g2、7d8.2d8、mimt001、4a11.2b5、4a11.h1l1、4a11.h4l2、4g2.2g6、6b3.2d3、6h6.2d6、9h2.2h10、13g4.2f8、13h12.2f8、15g7.2a7、19d9.2e5、23b10.2b12、24d12.2h9、f846c.1b2、f846c.1f5、f846c.1h12、f846c.1h5、f846c.2h3、f846tc.14a2、f846tc.14e4、f846tc.16b5、f846tc.7f10、f847c.10b9、f847c.11b1、f847c.12f12、f847c.26f5、f847c.4b10、f849c.8d10、f849c.8h3、846.2b11、846.4d5、846t.1h2、847.14h4、846.2d4、846.2f11、846t.10b1、846t.2e3、846t.4c9、846t.4e11、846t.4f5、846t.8d1、847.10c9、847.11d6、847.15d12、847.15f9、847.15h11、847.20h7、847.21b11、847.27b9、847.28d1、847.2b8、847.3b3、849.1d2、849.2d7、849.2f12、849.4b2、849.4f12、849.4f2、849.5c2、849.8d12、f847c.21h6、849.5h1、847.23f11、847.16d10、847.13e2-mh0ml1、847.13e2-mh0ml2、847.12c4、847.4d3、2d10-vh0-vl0或其结合片段。
75.根据权利要求12-74的任一项所述的方法,进一步包括施用选自由下述组成的组的一种或多种抗病毒或抗炎疗法:氯喹、羟化氯喹、法匹拉韦、法维拉韦、瑞德西韦、托珠单抗、巴瑞替尼、阿卡替尼、加利司韦、沙利鲁单抗、洛匹那韦、利托那韦、达芦那韦、利巴韦林、地塞米松、环索奈德、恢复期血浆、干扰素-α、聚乙二醇化干扰素-α和干扰素α-2b或其任意组合。
76.抗gal3抗体或其结合片段用于治疗crs的用途。
77.根据权利要求76所述的用途,其中crs是下述的结果:细菌感染、病毒感染、真菌感染、原生动物感染、移植物抗宿主病、巨细胞病毒、eb病毒、噬血细胞淋巴组织细胞增生症(hlh)、eb病毒-相关hlh、偶发hlh、巨噬细胞活化综合征(mas)、慢性关节炎、全身型幼年特发性关节炎(sjia)、斯提耳氏病、cryopyrin-相关周期性综合征(caps)、家族性冷自身炎症综合征(fcas)、家族性寒冷性荨麻疹(fcu)、muckle-well综合征(mws)、慢性小儿神经皮肤和关节(cinca)综合征、包括nlrp3基因功能突变的遗传或重新获得的冷炎素病、遗传性自身炎症紊乱、急性胰腺炎、重度烧伤、创伤、急性呼吸窘迫综合征(ards)、链球菌、假单胞菌、流感、禽流感、h5n1、h1n1、天花病毒、冠状病毒、严重急性呼吸综合征(sars)、sars-cov-1、sars-cov-2、败血症、革兰氏阴性败血症、革兰氏阳性毒素、疟疾、埃博拉病毒、天花病毒、全身革兰氏阴性细菌感染、菌血症、梅毒吉海综合征、糖基磷脂酰肌醇(gpi)或脂多糖,或以包括利妥昔单抗、奥妥珠单抗、阿来组单抗、本妥昔单抗、达西组单抗、纳武利尤单抗、西拉利珠单抗、奥沙利铂、来那度胺、t-细胞衔接子分子、双特异性t-细胞衔接子(bite)分子或cart疗法的免疫疗法的治疗。
78.根据权利要求76或77所述的用途,其中crs是败血症的结果。
79.根据权利要求76-78的任一项所述的用途,其中败血症是细菌败血症、病毒败血症、真菌败血症或原生动物败血症。
80.抗gal3抗体或其结合片段用于治疗肺纤维化的用途,其中肺纤维化是病毒感染的后遗症。
81.抗gal3抗体或其结合片段用于治疗病毒感染的用途。
82.根据权利要求76-81的任一项所述的用途,其中病毒感染是冠状病毒感染。
83.根据权利要求76-82的任一项所述的用途,其中病毒感染是sars相关冠状病毒感染。
84.根据权利要求76-83的任一项所述的用途,其中病毒感染是sars-cov-2冠状病毒感染。
85.根据权利要求76-84的任一项所述的用途,其中抗gal3抗体或其结合片段结合至gal3的n末端。
86.根据权利要求76-85的任一项所述的用途,其中抗gal3抗体或其结合片段结合至gal3的n末端结构域。
87.根据权利要求76-86的任一项所述的用途,其中抗gal3抗体或其结合片段结合至gal3的串联重复结构域。
88.根据权利要求76-87的任一项所述的用途,其中抗gal3抗体或其结合片段结合至肽1(adnfslhdalsgsgnpnpqg;seq id no:3)。
89.根据权利要求76-87的任一项所述的用途,其中抗gal3抗体或其结合片段结合至肽6(gaypgqappgaypgapgayp;seq id no:8)。
90.根据权利要求76-87的任一项所述的用途,其中抗gal3抗体或其结合片段结合至肽7(aypgapgaypgapapgvypg;seq id no:9)。
91.根据权利要求76-90的任一项所述的用途,其中抗gal3抗体或其结合片段包括(1)包含vl-cdr1、vl-cdr2和vl-cdr3的轻链可变区;和(2)包含vh-cdr1、vh-cdr2和vh-cdr3的重链可变区,其中
92.根据权利要求76-91的任一项所述的用途,其中抗gal3抗体或结合片段包括图14中阐释的vl-cdr1、vl-cdr2、vl-cdr3、vh-cdr1、vh-cdr2和vh-cdr3的组合。
93.根据权利要求91或92所述的用途,其中轻链可变区包括与选自seq id no:374-447、823-825的序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列。
94.根据权利要求91-93的任一项所述的用途,其中轻链可变区包括选自seq id no:374-447、823-825的序列。
95.根据权利要求91-94的任一项所述的用途,其中重链可变区包括与选自seq id no:297-373、822、828的序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列。
96.根据权利要求91-95的任一项所述的用途,其中重链可变区包括选自seq id no:297-373、822、828的序列。
97.根据权利要求91-96的任一项所述的用途,其中抗gal3抗体或其结合片段包括轻链,其中轻链包括与选自seq id no:495-538、830的序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列。
98.根据权利要求97所述的用途,其中轻链包括选自seq id no:495-538、830的序列。
99.根据权利要求91-98的任一项所述的用途,其中抗gal3抗体或其结合片段包括重链,其中重链包括与选自seq id no:448-494、829的序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列。
100.根据权利要求99所述的用途,其中重链包括选自seq id no:448-494、829的序列。
101.根据权利要求76-100的任一项所述的用途,其中抗gal3抗体或其结合片段选自由下述组成的组:tb001、tb006、12g5.d7、13a12.2e5、14h10.2c9、15f10.2d6、19b5.2e6、20d11.2c6、20h5.a3、23h9.2e4、2d10.2b2、3b11.2g2、7d8.2d8、mimt001、4a11.2b5、4a11.h1l1、4a11.h4l2、4g2.2g6、6b3.2d3、6h6.2d6、9h2.2h10、13g4.2f8、13h12.2f8、15g7.2a7、19d9.2e5、23b10.2b12、24d12.2h9、f846c.1b2、f846c.1f5、f846c.1h12、f846c.1h5、f846c.2h3、f846tc.14a2、f846tc.14e4、f846tc.16b5、f846tc.7f10、f847c.10b9、f847c.11b1、f847c.12f12、f847c.26f5、f847c.4b10、f849c.8d10、f849c.8h3、846.2b11、846.4d5、846t.1h2、847.14h4、846.2d4、846.2f11、846t.10b1、846t.2e3、846t.4c9、846t.4e11、846t.4f5、846t.8d1、847.10c9、847.11d6、847.15d12、847.15f9、847.15h11、847.20h7、847.21b11、847.27b9、847.28d1、847.2b8、847.3b3、849.1d2、849.2d7、849.2f12、849.4b2、849.4f12、849.4f2、849.5c2、849.8d12、f847c.21h6、849.5h1、847.23f11、847.16d10、847.13e2-mh0ml1、847.13e2-mh0ml2、847.12c4、847.4d3、2d10-vh0-vl0或其结合片段。
102.一种治疗病症的方法,所述方法包括:
103.一种药物抗体制剂,其包含:
104.根据权利要求103所述的药物抗体制剂,其中抗体包括具有序列seq id no:31的vh-cdr1、具有序列seq id no:72的vh-cdr2、具有序列seq id no:113的vh-cdr3、具有序列seq id no:171的vl-cdr1、具有序列seq id no:222的vl-cdr2和具有序列seq id no:249的vl-cdr3。
105.根据权利要求103或104所述的药物抗体制剂,其中组氨酸是l-组氨酸。
106.根据权利要求105所述的药物抗体制剂,其中l-组氨酸以10至50mm存在。
107.根据权利要求105或106所述的药物抗体制剂,其中l-组氨酸以约20mm存在。
108.根据权利要求103-107的任一项所述的药物抗体制剂,其中甲硫氨酸以2至10mm存在。
109.根据权利要求103-108的任一项所述的药物抗体制剂,其中甲硫氨酸以5mm存在。
110.根据权利要求103-109的任一项所述的药物抗体制剂,其中nacl以50至150mm存在。
111.根据权利要求103-110的任一项所述的药物抗体制剂,其中nacl以100mm存在。
112.根据权利要求103-111的任一项所述的药物抗体制剂,其中聚山梨醇酯包括聚山梨醇酯-20、聚山梨醇酯-40、聚山梨醇酯-60、聚山梨醇酯-80或其任意组合。
113.根据权利要求103-112的任一项所述的药物抗体制剂,其中聚山梨醇酯包括聚山梨醇酯-80。
114.根据权利要求113所述的药物抗体制剂,其中聚山梨醇酯80以0.01至0.04%或约0.01%至约0.04%存在。
115.根据权利要求114所述的药物抗体制剂,其中聚山梨醇酯80以0.02%或约0.02%存在。
116.根据权利要求103-115的任一项所述的药物抗体制剂,其中ph为约5.8。
117.根据权利要求103-116的任一项所述的药物抗体制剂,其中ph为5.8。
118.根据权利要求103-117的任一项所述的药物抗体制剂,进一步包括蔗糖、甘露醇或二者。
119.根据权利要求118所述的药物抗体制剂,其中蔗糖以2%至5%或约2%至约5%存在。
120.根据权利要求118或119所述的药物抗体制剂,其中甘露醇以2%至5%或约2%至约5%存在。
121.根据权利要求103-120的任一项所述的药物抗体制剂,其中抗体以作为单位剂量的1至50mg的量存在。
122.根据权利要求103-121的任一项所述的药物抗体制剂,其中抗体以作为单位剂量的1mg、5mg、10mg、20mg、40mg或50mg之一的量或由任意两个前述量定义的范围内的任意量存在。
123.根据权利要求103-122的任一项所述的药物抗体制剂,其中抗体以1mg/ml、5mg/ml、10mg/ml、20mg/ml、40mg/ml或50mg/ml之一的浓度或由任意两个前述浓度定义的范围内的任意浓度存在。
124.根据权利要求103-123的任一项所述的药物抗体制剂,其中l-组氨酸以约20mm存在,甲硫氨酸以约5mm存在,nacl以约100mm存在,聚山梨醇酯80以约0.02%存在,蔗糖以2-5%存在,甘露醇以2-5%存在,ph为约5.8,并且其中治疗上有效量的抗体是作为单位剂量的1mg、5mg、10mg、20mg、40mg或50mg之一,或是由任意两个前述量定义的范围内的任意量。
125.一种药物抗体制剂,其包括:
126.根据权利要求103-125的任一项所述的药物抗体制剂,其中蔗糖以2-5%存在并且甘露醇以2-5%存在。
127.根据权利要求103-126的任一项所述的药物抗体制剂,其中制剂被配制用于肠胃外施用。
128.根据权利要求103-127的任一项所述的药物抗体制剂,其中制剂被配制用于皮下施用。
129.根据权利要求128所述的药物抗体制剂,其中被配制用于皮下施用的制剂包括蔗糖或甘露醇或二者。
130.根据权利要求103-127的任一项所述的药物抗体制剂,其中制剂被配制用于静脉内施用。
131.根据权利要求130所述的药物抗体制剂,其中被配制用于静脉内施用的制剂不包括蔗糖或甘露醇或二者。
132.根据权利要求103-131的任一项所述的药物抗体制剂,其中药物抗体制剂以20mg/ml或50mg/ml的抗体浓度制备。
133.根据权利要求103-132的任一项所述的药物抗体制剂,其中药物抗体制剂在5℃或25℃/60%相对湿度(rh)保持60%稳定超过3个月。
134.一种无菌瓶,其包括药物抗体制剂,其中药物抗体制剂包括治疗上有效量的抗体,其中抗体包括具有序列seq id no:31的vh-cdr1、具有序列seq id no:72的vh-cdr2、具有序列seq id no:113的vh-cdr3、具有序列seq id no:171的vl-cdr1、具有序列seq id no:222的vl-cdr2和具有序列seq id no:249的vl-cdr3。
135.根据权利要求134所述的无菌瓶,其中药物抗体制剂进一步包括组氨酸、甲硫氨酸、nacl和聚山梨醇酯,并且其中制剂处于5.3和6.3之间的ph。
136.根据权利要求134或135所述的无菌瓶,其中无菌瓶是5ml或10ml无菌瓶。
137.根据权利要求134-136的任一项所述的无菌瓶,其中无菌瓶包含2、3、4、5、6、7、8、9或10ml的药物抗体制剂。
138.根据权利要求134-137的任一项所述的无菌瓶,其中无菌瓶包含2ml或至少2ml的药物抗体制剂。
139.根据权利要求134-137的任一项所述的无菌瓶,其中无菌瓶包含8ml或至少8ml的药物抗体制剂。
140.根据权利要求134-139的任一项所述的无菌瓶,其中药物抗体制剂是浓缩形式的根据权利要求103-133的任一项所述的药物抗体制剂。
141.根据权利要求140所述的无菌瓶,其中浓缩形式的药物抗体制剂的浓度是20、30、40、50、60、70、80、90或100mg/ml的抗体,或由任意两个前述浓度定义的范围内的任意浓度。
142.根据权利要求140或141所述的无菌瓶,其中浓缩形式的药物抗体制剂的浓度是20mg/ml或至少20mg/ml的抗体。
143.根据权利要求140-142的任一项所述的无菌瓶,其中浓缩形式的药物抗体制剂的浓度是50mg/ml或至少50mg/ml的抗体。
144.根据权利要求140-143的任一项所述的无菌瓶,其中浓缩形式的药物抗体制剂旨在被稀释1x、2x、3x、4x、5x、6x、7x、8x、9x、10x、11x、12x、13x、14x、15x、16x、17x、18x、19x、20x、30x、40x、50x、60x、70x、80x、90x或100x倍或由任意两个前述倍数定义的范围内的任意倍数。
145.根据权利要求140-144的任一项所述的无菌瓶,其中浓缩形式的药物抗体制剂旨在被稀释至0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20mg/ml或由任意两个前述浓度定义的范围内的任意浓度。
146.根据权利要求140-145的任一项所述的无菌瓶,其中浓缩形式的药物抗体制剂旨在被稀释至200、210、220、230、240、250、260、270、280、290、300、310、320、330、340、350、360、370、380、390、400、410、420、430、440、450、460、470、480、490、500、510、520、530、540、550、560、570、580、590或600ml的终体积。
147.根据权利要求140-146的任一项所述的无菌瓶,其中浓缩形式的药物抗体制剂旨在用生理盐水稀释。
148.根据权利要求140-147的任一项所述的无菌瓶,其中药物抗体制剂被配制用于肠胃外施用。
149.根据权利要求140-148的任一项所述的无菌瓶,其中药物抗体制剂被配制用于皮下施用。
150.根据权利要求149所述的无菌瓶,其中被配制用于皮下施用的药物抗体制剂包括蔗糖或甘露醇或二者。
151.根据权利要求140-148的任一项所述的无菌瓶,其中药物抗体制剂被配制用于静脉内施用。
152.根据权利要求151所述的无菌瓶,其中被配制用于静脉内施用的药物抗体制剂不包括蔗糖或甘露醇或二者。
153.根据权利要求134-152的任一项所述的无菌瓶,其中药物抗体制剂在5℃或25℃/60%相对湿度(rh)保持60%稳定超过3个月。
154.根据前述药物抗体制剂权利要求或无菌瓶权利要求的任一项所述的药物抗体制剂,其中抗体包括与序列seq id no:298具有至少80%、85%、90%、95%、99%或100%同一性的序列的重链可变结构域(vh)区。
155.根据前述药物抗体制剂权利要求或无菌瓶权利要求的任一项的药物抗体制剂,其中抗体包括与序列seq id no:375具有至少80%、85%、90%、95%、99%或100%同一性的序列的轻链可变结构域(vl)区。
156.根据前述药物抗体制剂权利要求或无菌瓶权利要求的任一项的药物抗体制剂,其中抗体包括与序列seq id no:298具有至少80%、85%、90%、95%、99%或100%同一性的序列的vh区,并且其中抗体包括与序列seq id no:375具有至少80%、85%、90%、95%、99%或100%同一性的序列的vl区。
157.根据前述药物抗体制剂权利要求或无菌瓶权利要求的任一项的药物抗体制剂,其中抗体包括具有序列seq id no:298的vh区。
158.根据前述药物抗体制剂权利要求或无菌瓶权利要求的任一项的药物抗体制剂,其中抗体包括具有序列seq id no:375的vl区。
159.根据前述药物抗体制剂权利要求或无菌瓶权利要求的任一项的药物抗体制剂,其中抗体包括具有序列seq id no:298的vh区,并且其中抗体包括具有序列seq id no:375的vl区。
160.根据前述药物抗体制剂权利要求或无菌瓶权利要求的任一项的药物抗体制剂,其中抗体包括与序列seq id no:449具有至少80%、85%、90%、95%、99%或100%同一性的序列的重链(hc)。
161.根据前述药物抗体制剂权利要求或无菌瓶权利要求的任一项的药物抗体制剂,其中抗体包括与序列seq id no:496具有至少80%、85%、90%、95%、99%或100%同一性的序列的轻链(lc)。
162.根据前述药物抗体制剂权利要求或无菌瓶权利要求的任一项的药物抗体制剂,其中抗体包括具有序列seq id no:449的hc。
163.根据前述药物抗体制剂权利要求或无菌瓶权利要求的任一项的药物抗体制剂,其中抗体包括具有序列seq id no:496的lc。
164.根据前述药物抗体制剂权利要求或无菌瓶权利要求的任一项的药物抗体制剂,其中抗体包括由与序列seq id no:540具有至少80%、85%、90%、95%、99%或100%同一性的核酸序列编码的vh。
165.根据前述药物抗体制剂权利要求或无菌瓶权利要求的任一项的药物抗体制剂,其中抗体包括由与序列seq id no:622具有至少80%、85%、90%、95%、99%或100%同一性的核酸序列编码的vl。
166.根据前述药物抗体制剂权利要求或无菌瓶权利要求的任一项的药物抗体制剂,其中抗体包括由核酸序列seq id no:540编码的vh。
167.根据前述药物抗体制剂权利要求或无菌瓶权利要求的任一项的药物抗体制剂,其中抗体包括由核酸序列seq id no:622编码的vl。
168.根据前述药物抗体制剂权利要求或无菌瓶权利要求的任一项的药物抗体制剂,其中抗体包括由与序列seq id no:704具有至少80%、85%、90%、95%、99%或100%同一性的核酸序列编码的hc。
169.根据前述药物抗体制剂权利要求或无菌瓶权利要求的任一项的药物抗体制剂,其中抗体包括由与序列seq id no:751具有至少80%、85%、90%、95%、99%或100%同一性的核酸序列编码的lc。
170.根据前述药物抗体制剂权利要求或无菌瓶权利要求的任一项的药物抗体制剂,其中抗体包括由核酸序列seq id no:704编码的hc。
171.根据前述药物抗体制剂权利要求或无菌瓶权利要求的任一项的药物抗体制剂,其中抗体包括由核酸序列seq id no:751编码的lc。
172.一种治疗冠状病毒感染的方法,所述方法包括:
173.根据权利要求172所述的方法,其中药物抗体制剂每天、每周、每两周或每10天施用。
174.根据权利要求172或173所述的方法,其中受试者被施用作为单位剂量的1mg、5mg、10mg、20mg、40mg或50mg的抗体或作为单位剂量的由任意两个前述量定义的范围内的任意量的抗体。
175.根据权利要求172-174的任一项所述的方法,其中受试者被施用药物抗体制剂,其包括:
176.根据权利要求172-175的任一项所述的方法,其中单位剂量在10、20、30、40、50、60、70、80、90、100、120、130、140、150、160、170、180、190或200分钟的进程内被施用。
177.根据权利要求172-176的任一项所述的方法,其中单位剂量在60分钟的进程内被施用。
178.根据权利要求172-177的一项所述的方法,进一步包括鉴定需要治疗冠状病毒感染的受试者的步骤。
179.根据权利要求178所述的方法,其中鉴定需要治疗冠状病毒感染的受试者的步骤包括下述的一个或多个:通过pcr测试或等同测试鉴定阳性冠状病毒感染,鉴定受试者为具有发烧、咳嗽、喉咙痛、萎靡、头痛、肌肉痛、胃肠症状、远足呼吸短促、每分钟呼吸频率≥20次、在海平面的房间空气上的氧饱和度(spo2)>93%、每分钟心率≥90下、糖尿病、高血压、癌症、慢性肾病、身体质量指数(bmi)≥35、≥65岁、心血管疾病诸如高血压、慢性阻塞性肺病或其他慢性呼吸道疾病的症状。
180.根据权利要求172-179的一项所述的方法,其中治疗步骤是给予已经具有冠状病毒感染症状的患者。
181.根据权利要求172-180的一项所述的方法,其中治疗步骤是预防性的。
182.根据权利要求172-181的任一项所述的方法,其中冠状病毒感染是sars-cov、mers-cov或sars-cov-2感染。
183.根据权利要求172-182的任一项所述的方法,其中药物抗体制剂被施用10-18个月。
184.根据权利要求172-183的任一项所述的方法,其中药物抗体制剂经静脉内施用。
185.根据权利要求172-184的任一项所述的方法,其中药物抗体制剂经皮下施用。
186.一种药物抗体制剂,其包括:
187.根据权利要求186所述的药物抗体制剂,进一步包括蔗糖或甘露醇或二者。
188.根据权利要求186或187所述的药物抗体制剂,其中抗体以作为单位剂量的1mg、5mg、10mg、20mg、40mg或50mg的量存在。
189.一种治疗冠状病毒感染的方法,所述方法包括:
190.一种降低或抑制需要其的受试者中炎症的方法,所述方法包括:
技术总结
本文公开了用于破坏半乳凝素‑3(Gal3)和病毒蛋白(诸如SARS‑CoV‑2病毒或其他冠状病毒的蛋白)或病毒‑相关宿主蛋白之间的相互作用的方法、抗体和组合物。本文进一步公开了用于治疗受试者中的疾病或病症,诸如治疗病毒感染或治疗纤维化(如肺纤维化)的方法、药物和组合物,所述纤维化发展为病毒感染的后遗症或细胞因子释放综合征。本文进一步公开了用于治疗可与受试者中嗜中性粒细胞活性相关的炎性疾病或病症(诸如肺的炎症或系统性红斑狼疮)的方法、药物和组合物。本文还公开了用于治疗疾病(诸如冠状病毒感染)的药物抗体制剂。
技术研发人员:孙东旭,C·A·戈登,K·希克斯,王岩,T-H·蔡,Y·A·梁
受保护的技术使用者:真和制药有限公司
技术研发日:
技术公布日:2024/1/12
- 还没有人留言评论。精彩留言会获得点赞!