减少人类受试者中的Tau的方法与流程
本发明属于医学治疗领域。具体地,本发明涉及抗tau抗体及其在减少人类受试者中的tau中的用途。
背景技术:
1、阿尔茨海默病是以认知缺陷和记忆丧失以及包括焦虑、抑郁和激动的行为和精神病症状为特征的神经退化性疾病。这种疾病与衰老有关,并被认为是美国第四大最常见的医学死因。
2、阿尔茨海默病的标志性病理特征是淀粉样蛋白斑和神经原纤维缠结。淀粉样蛋白斑主要由β-淀粉样蛋白(aβ)组成。目前开发的旨在改变或减缓阿尔茨海默病进展的许多疗法是靶向aβ。此类疗法包括eli lilly的索拉奈珠单抗(solanezumab)、biogen的阿杜卡努单抗(aducanumab)和roche的克雷珠单抗(crenezumab),它们都是针对aβ的人源化单克隆抗体。
3、神经原纤维缠结由过度磷酸化的tau蛋白的聚集体组成,并且通常发现于患有阿尔茨海默病的患者的人脑中对记忆和认知功能重要的几个区域。tau的主要生理功能为微管聚合和稳定。tau与微管的结合通过tau的微管结合区的正电荷与微管网架上的负电荷之间的离子相互作用发生(butner和kirschner 1991)。tau蛋白含有85个可能的磷酸化位点,并且这些位点中的许多位点处的磷酸化干扰tau的主要功能。与轴突微管晶格结合的tau处于低磷酸化状态,而阿尔茨海默病中聚集的tau是过度磷酸化的。
4、目前正在开发预防或清除tau聚集的几种候选药物(brunden等人,2009)。在转基因小鼠模型中的研究已经表明,主动和被动tau免疫都可以具有有益的治疗效果(asuni等人,2007;boutajangout等人,2011)。此外,已经报告了磷酸定向抗体和非磷酸定向抗体两者的活性(schroeder等人,2016)。然而,对各种方法的功效和安全性的机理理解还没有很好地建立(sigurdsson 2016)。
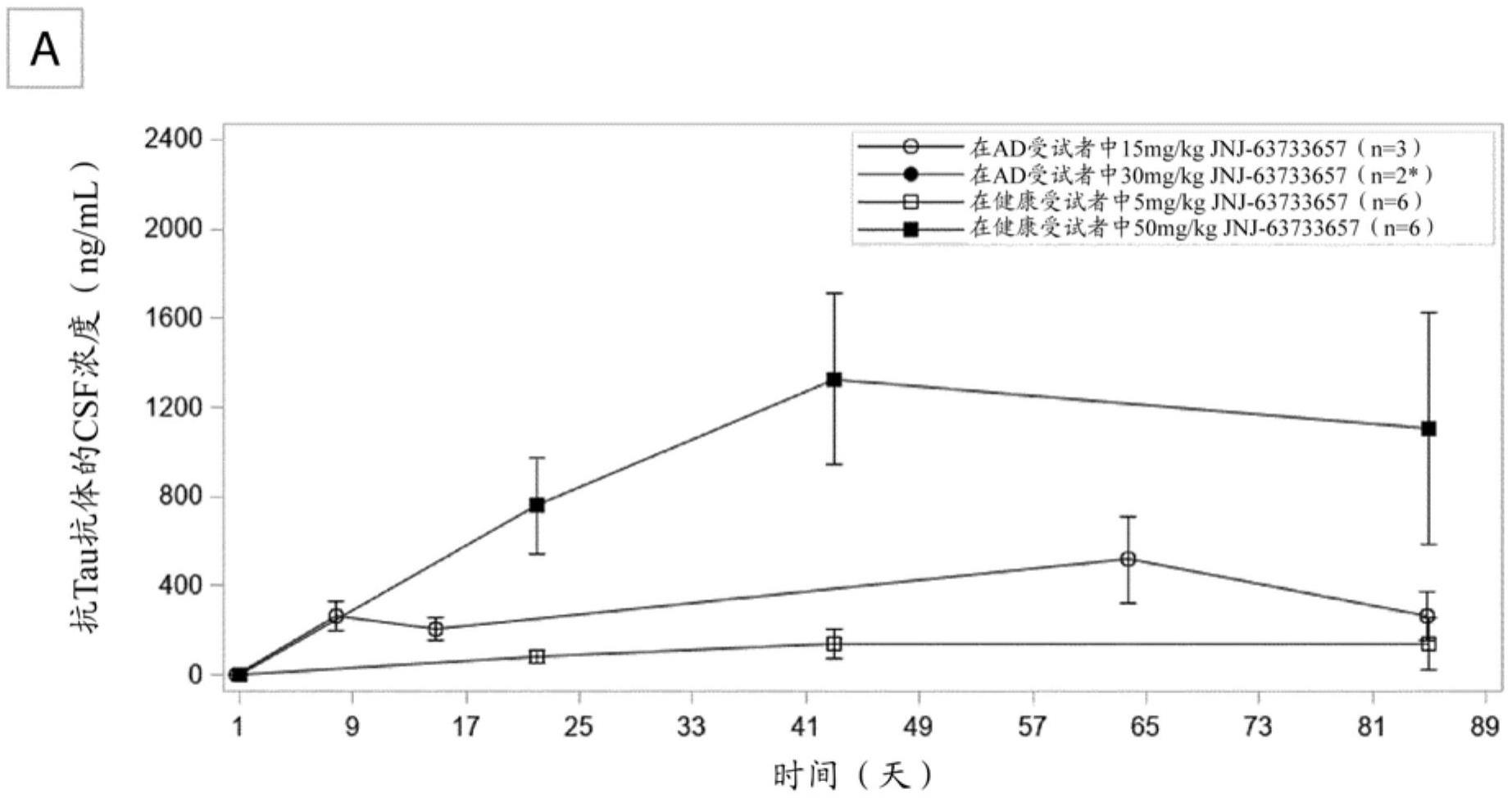
5、仍然需要预防tau聚集和tau蛋白病发展以治疗tau蛋白病诸如阿尔茨海默病的有效治疗剂。
技术实现思路
1、本发明的一些主要方面总结如下。在本发明的具体实施方式、实施例和本公开的权利要求书部分中描述了另外的方面。本公开的每个部分中的描述旨在结合其他部分来阅读。此外,在本公开的每个部分中描述的各种实施方案可以以各种方式组合,并且所有这样的组合旨在落入本发明的范围内。
2、因此,本公开提供了减少受试者中的tau,优选磷酸化tau的方法。
3、本发明的一个方面涉及一种减少对其有需要的受试者中的总脑脊液p217+tau的方法,所述方法包括向所述受试者施用组合物,所述组合物包含药学上可接受的载体和每剂量约1mg/kg至约60mg/kg的单克隆抗体。
4、一个方面涉及一种减少对其有需要的受试者中的游离脑脊液p217+tau的方法,所述方法包括向所述受试者施用组合物,所述组合物包含药学上可接受的载体和每剂量约1mg/kg至约60mg/kg的单克隆抗体。
5、另一个方面涉及一种减少对其有需要的受试者中的总脑脊液tau的方法,所述方法包括向所述受试者施用组合物,所述组合物包含药学上可接受的载体和每剂量约1mg/kg至约60mg/kg的单克隆抗体。
6、另一方面涉及一种减少对其有需要的受试者中的脑脊液p181tau的方法,所述方法包括向所述受试者施用组合物,所述组合物包含药学上可接受的载体和每剂量约1mg/kg至约60mg/kg的单克隆抗体。
7、用于本发明方法的单克隆抗体可包含:包含seq id no:1的氨基酸序列的重链可变互补决定区(cdr)1、包含seq id no:2的氨基酸序列的重链可变cdr2、包含seq id no:3的氨基酸序列的重链可变cdr3、包含seq id no:13的氨基酸序列的轻链可变cdr1、包含seqid no:14的氨基酸序列的轻链可变cdr2和包含seq id no:15的氨基酸序列的轻链可变cdr3。在一些实施方案中,单克隆抗体包含:具有seq id no:1的氨基酸序列的重链可变cdr1、具有seq id no:2的氨基酸序列的重链可变cdr2、具有seq id no:3的氨基酸序列的重链可变cdr3、具有seq id no:13的氨基酸序列的轻链可变cdr1、具有seq id no:14的氨基酸序列的轻链可变cdr2和具有seq id no:15的氨基酸序列的轻链可变cdr3。
8、单克隆抗体可包含含有seq id no:25的氨基酸序列的重链可变区和含有seq idno:26的氨基酸序列的轻链可变区。在某些实施方案中,单克隆抗体包含具有seq id no:25的氨基酸序列的重链可变区和具有seq id no:26的氨基酸序列的轻链可变区。
9、此外,单克隆抗体可包含含有seq id no:27的氨基酸序列的重链和含有seq idno:28的氨基酸序列的轻链。在某些实施方案中,单克隆抗体包含具有seq id no:27的氨基酸序列的重链和具有seq id no:28的氨基酸序列的轻链。
10、除了单克隆抗体之外,所述组合物还可含有组氨酸、蔗糖、聚山梨醇酯20和乙二胺四乙酸。所述组合物可具有约5-6的ph。
11、在一些实施方案中,本发明的方法可包括向所述受试者施用包含每剂量约10mg/kg至约40mg/kg、或约20mg/kg至约60mg/kg、或约40mg/kg至约60mg/kg的单克隆抗体的组合物。在某些实施方案中,所述方法可包括向所述受试者施用包含每剂量约1mg/kg、3mg/kg、5mg/kg、10mg/kg、15mg/kg、20mg/kg、25mg/kg、30mg/kg、35mg/kg、40mg/kg、45mg/kg、50mg/kg、55mg/kg、60mg/kg或其间的任何值的所述单克隆抗体的所述组合物。
12、所述组合物可以皮下或通过静脉内输注施用。此外,所述组合物可以以多于一个剂量施用,例如,以多于一个剂量,其中每个剂量间隔约4周的时段。
13、所述单克隆抗体的施用可导致施用后约0.05天至约0.25天的所述单克隆抗体的中值血清tmax。此外,或另选地,所述单克隆抗体的施用可导致施用后约18天至约27天的所述单克隆抗体的中值血清t1/2。
14、在本发明的方法中,所述受试者可能需要治疗阿尔茨海默病。在具体实施方案中,所述受试者可能需要治疗早期阿尔茨海默病、前驱阿尔茨海默病或轻度阿尔茨海默病。
技术特征:
1.一种减少对其有需要的受试者中的总脑脊液p217+tau的方法,所述方法包括向所述受试者施用组合物,所述组合物包含药学上可接受的载体和每剂量约1mg/kg至约60mg/kg的单克隆抗体,
2.一种减少对其有需要的受试者中的游离脑脊液p217+tau的方法,所述方法包括向所述受试者施用组合物,所述组合物包含药学上可接受的载体和每剂量约1mg/kg至约60mg/kg的单克隆抗体,
3.一种减少对其有需要的受试者中的总脑脊液tau的方法,所述方法包括向所述受试者施用组合物,所述组合物包含药学上可接受的载体和每剂量约1mg/kg至约60mg/kg的单克隆抗体,
4.一种减少对其有需要的受试者中的脑脊液p181tau的方法,所述方法包括向所述受试者施用组合物,所述组合物包含药学上可接受的载体和每剂量约1mg/kg至约60mg/kg的单克隆抗体,
5.根据权利要求1至4中任一项所述的方法,其中所述单克隆抗体包含具有seq id no:1的氨基酸序列的重链可变cdr1、具有seq id no:2的氨基酸序列的重链可变cdr2、具有seqid no:3的氨基酸序列的重链可变cdr3、具有seq id no:13的氨基酸序列的轻链可变cdr1、具有seq id no:14的氨基酸序列的轻链可变cdr2和具有seq id no:15的氨基酸序列的轻链可变cdr3。
6.根据权利要求1至5中任一项所述的方法,其中所述单克隆抗体包含含有seq id no:25的氨基酸序列的重链可变区和含有seq id no:26的氨基酸序列的轻链可变区。
7.根据权利要求1至6中任一项所述的方法,其中所述单克隆抗体包含具有seq id no:25的氨基酸序列的重链可变区和具有seq id no:26的氨基酸序列的轻链可变区。
8.根据权利要求1至7中任一项所述的方法,其中所述单克隆抗体包含含有seq id no:27的氨基酸序列的重链和含有seq id no:28的氨基酸序列的轻链。
9.根据权利要求1至8中任一项所述的方法,其中所述单克隆抗体包含具有seq id no:27的氨基酸序列的重链和具有seq id no:28的氨基酸序列的轻链。
10.根据权利要求1至9中任一项所述的方法,其中所述组合物还包含组氨酸、蔗糖、聚山梨醇酯20和乙二胺四乙酸。
11.根据权利要求1至10中任一项所述的方法,其中所述组合物具有约5-6的ph。
12.根据权利要求1至11中任一项所述的方法,所述方法包括向所述受试者施用包含每剂量约10mg/kg至约40mg/kg的所述单克隆抗体的所述组合物。
13.根据权利要求1至11中任一项所述的方法,所述方法包括向所述受试者施用包含每剂量约20mg/kg至约60mg/kg的所述单克隆抗体的所述组合物。
14.根据权利要求1至11中任一项所述的方法,所述方法包括向所述受试者施用包含每剂量约40mg/kg至约60mg/kg的所述单克隆抗体的所述组合物。
15.根据权利要求1至11中任一项所述的方法,所述方法包括向所述受试者施用包含每剂量约1mg/kg、3mg/kg、5mg/kg、10mg/kg、15mg/kg、20mg/kg、25mg/kg、30mg/kg、35mg/kg、40mg/kg、45mg/kg、50mg/kg、55mg/kg、60mg/kg或其间的任何值的所述单克隆抗体的所述组合物。
16.根据权利要求1至15中任一项所述的方法,其中所述组合物通过静脉内输注施用。
17.根据权利要求1至16中任一项所述的方法,其中所述组合物以多于一个剂量施用。
18.根据权利要求17所述的方法,其中每个剂量的所述施用间隔约4周的时段。
19.根据权利要求1至18中任一项所述的方法,其中所述单克隆抗体的所述施用导致施用后约0.05天至约0.25天的所述单克隆抗体的中值血清tmax。
20.根据权利要求1至19中任一项所述的方法,其中所述单克隆抗体的所述施用导致施用后约18天至约27天的所述单克隆抗体的中值血清t1/2。
21.根据权利要求1至20中任一项所述的方法,其中所述受试者需要治疗阿尔茨海默病。
22.根据权利要求21所述的方法,其中所述受试者需要治疗早期阿尔茨海默病、由于阿尔茨海默病引起的轻度认知损害(mci)或轻度至中度阿尔茨海默病。
技术总结
本发明描述了用于减少受试者中的tau的方法。该方法涉及向受试者施用结合tau,特别是结合tau上的磷酸化表位的抗tau抗体。该方法可用于减少CSF中的p217+tau,包括总p217+tau和游离p217+tau。
技术研发人员:W·R·加尔彭,M·蒂默斯,T·L·K·雅各布斯,P·南迪,L·李
受保护的技术使用者:詹森药业有限公司
技术研发日:
技术公布日:2024/1/15
- 还没有人留言评论。精彩留言会获得点赞!