特女贞苷在制备治疗糖尿病视网膜病变损伤药物中的应用的制作方法
:
1.本发明属于医药领域,具体涉及特女贞苷在制备治疗糖尿病视网膜病变损伤药物中的应用。
背景技术:
2.糖尿病视网膜病变(diabetic retinopathy,dr)是糖尿病最常见微血管并发症之一,也是成年人致盲的主要原因。研究表明,dr的发病机制与持续性高血糖引起的血管内皮细胞损伤密切相关。血管内皮细胞损伤包括过度氧化应激、炎症反应及细胞凋亡等,通过抑制高血糖引起的血管内皮细胞损伤可起到治疗dr的作用。特女贞苷(spencnuezhenide),其cas号:449733-84-0,是从木犀科植物女贞子的干燥成熟果实中分离得到的环烯醚萜苷类物质,具有抗炎、免疫调节等多种药理活性。
技术实现要素:
3.本发明的第一个目的是提供特女贞苷在制备治疗糖尿病视网膜病变损伤药物中的应用。
4.本发明的第二个目的是提供一种治疗糖尿病视网膜病变损伤药物,其含有特女贞苷作为活性成分。
5.优选,是特女贞苷在制备治疗人视网膜微血管内皮细胞损伤药物中的应用。
6.进一步优选,是特女贞苷在制备治疗高糖诱导的人视网膜微血管内皮细胞损伤药物中的应用。
7.本发明发现,特女贞苷可有效抑制高糖诱导的hrmecs凋亡、氧化应激及炎症反应,其作用机制与抑制细胞中foxo4表达有关,推测特女贞苷可能通过抑制foxo4信号通路发挥改善dr微血管的损伤。本研究结果为特女贞苷对糖尿病诱导dr微血管损伤相关疾病的治疗提供了新的实验基础和新的研究方向,具有治疗糖尿病视网膜病变的潜在价值。
附图说明:
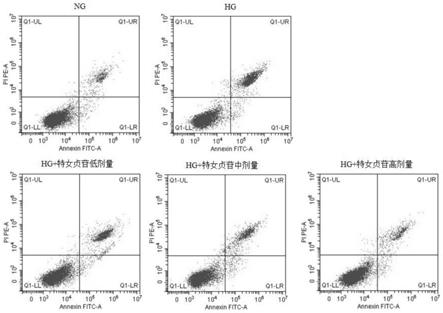
8.图1是各组hrmecs细胞凋亡率,nc:正常对照组;hg:高糖模型组;hg+特女贞苷低剂量:高糖+特女贞苷低剂量组;hg+特女苷中剂量:高糖+特女苷中剂量组;hg+特女贞苷高剂量:高糖+特女贞苷高剂量组。
9.图2是各组hrmecs中foxo4蛋白的表达电泳图,nc:正常对照组,hg:高糖模型组组,hg+特女贞苷低剂量:高糖特女贞苷低剂量组,hg+特女贞苷中剂量:高糖特女贞苷中剂量组,hg+特女贞苷高剂量:高糖特女贞苷高剂量组。
具体实施方式:
10.以下实施例是对本发明的进一步说明,而不是对本发明的限制。
11.实施例1:
12.1材料与方法
13.1.1材料
14.1.1.1细胞及来源人视网膜微血管内皮细胞hrmecs购自北京伊塔生物科技有限公司。
15.1.1.2主要试剂及仪器特女贞苷(购自成都仪睿生物科技有限公司);dmem培养液、annexinv-fitc/pi试剂盒、二喹啉甲酸(bca)蛋白浓度测定试剂盒(均购自北京索莱宝科技有限公司);胎牛血清(浙江天杭生物科技有限公司);lipofectamine
tm
2000试剂盒(美国invitrogen公司);foxo4小干扰rna(si-fox4)和过表达载体(pcdna-foxo4)、小干扰rna阴性序列(si rnanegative control,si-nc)和空载体(pcdna)(均购自上海生工生物工程有限公司);sod、mda、il-1β和tnf-α试剂盒(购自南京建成科技有限公司);foxo4抗体(货号ab154520)(购自abcam公司)。流式细胞仪(型号facscalibur,美国bd公司),凝胶扫描系统(型号wd-9413c,北京六一生物科技有限公司),酶标仪(型号fax-2100,美国awareness公司)和荧光定量pcr仪(型号t100,美国bio-rad公司)。
16.1.2方法
17.1.2.1hrmecs高糖模型建立及特女贞苷最佳剂量筛选:10%fbs dmem培养液培养hrmecs细胞置于co2培养箱中培养。当细胞融合至90%时,0.25%胰酶消化并传代。将2.5ml对数期hrmecs(2.5
×
104个/ml)接种至6孔板中,培养4h后弃培养上清。将hrmecs分为正常对照(ng)组、高糖模型组(hg)组、特女贞苷低剂量组、特女贞苷中剂量组和特女贞苷高剂量组。正常对照组细胞在dmem培养液培养24h,高糖模型组细胞用含30nmol/l葡萄糖的dmem培养液培养24h,特女贞苷低、中、高剂量组分别在dmem培养液中加入含25μmol/l、50μmol/l、100μmol/l特女贞苷和30nmol/l葡萄糖共同培养24h。24h后收集各组细胞和细胞培养液,进行相关指标检测。
18.1.2.2流式细胞术检测细hhrmecs细胞凋亡率
19.将收集的各组hhrmecs用pbs清洗2次,并调整密度为1.0
×
106个/ml。取1.0ml细胞悬液,1000r/min离心5min后,弃上清,加500μl结合缓冲液重悬细胞。加10μlannexin v-fitc,避光孵育10min。再加5μlpi,避光孵育5min后,上流式细胞仪检测细胞凋亡。
20.1.2.3黄嘌呤氧化酶法检测hrmecs细胞中sod活性(sod试剂盒)
21.将收集的各组hrmecs细胞用pbs清洗2次,加细胞裂解液充分裂解细胞,3500r/min离心10min,收集上清液。设置测定管和对照管,测定管依次加1.0ml试剂一应用液,0.05ml离心后的上清液,0.1ml试剂二、0.1ml试剂三及0.1ml试剂四应用液;对照管依次加加1.0ml试剂一应用液,0.05ml蒸馏水,0.1ml试剂二、0.1ml试剂三及0.1ml试剂四应用液。将两管中的液体涡旋混合均匀,37℃水浴40min。然后向两管中均加入2ml显色液,混合均匀,室温放置10min,使用酶标仪(波长550nm)测定两管的光密度(od)值。sod(u
·
l-1
)=(od
对照管-od
测定管
)/od
对照管
/50%
×
反应体系稀释倍数
×
样品测试前稀释倍数
×
1000。
22.1.2.4硫代巴比妥酸法检测hrmecs细胞中mda质量浓度(mda试剂盒)
23.将收集的各组细胞hrmecs细胞用pbs清洗2次,加细胞裂解液充分裂解细胞,3500r/min离心10min,收集上清液。设置标准管、标准空白管、测定管和测定空白管,标准管加0.1ml10 nmol
·
ml-1
标准品和0.1ml试剂一,标准空白管加0.1ml无水乙醇和0.1ml试剂一,测定管加0.1ml离心后的上清液和0.1ml试剂一,测定空白管加0.1ml离心后的上清液和
0.1ml试剂一。混合均匀,向标准管、标准空白管、测定管中均加3.0ml试剂二和1.0ml试剂三,向测定空白管中加3.0ml试剂二和1.0m50%冰醋酸。涡旋混合均匀,95℃水浴40min。流水冷却,3500r/min离心10min,取上清液,使用酶标仪(波长532nm)测定各管光密度(od)值。mda(nmol
·
ml-1
)=(od
测定管-od
测定空白管
)/(od
标准管-od
标准空白管
)
×
标准品浓度(10nmol
·
ml-1
)
×
样品测试前稀释倍数。
24.1.2.5elisa检测细胞培养上清液中il-1β和tnf-α表达量(il-1β和tnf-α试剂盒)
25.将收集的各组细胞培养上清3500r/min离心10min,收集上清液。先将试剂盒在室温下平衡半小时。设置空白孔、标准品孔、零孔和样品孔,空白孔不加样,标准品孔每孔加50μl稀释好的标准品和50μl生物素抗原工作液,零孔加50μl标准品/样品稀释液和50μl生物素抗原工作液,样品孔加50μl样品和50μl生物素抗原工作液。轻轻摇晃,盖上封板膜,37℃孵育30min。小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30秒后弃去,如此重复5次,拍干。向标准品孔、零孔和样品孔中加50μl亲和素-hrp,轻轻摇晃,盖上封板膜,37℃培养箱中孵育30min。小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30秒后弃去,如此重复5次,拍干。向每孔先加入50μl显色剂a,再加入μl显色剂b,轻轻震荡混匀,37℃避光显色10分钟。向每孔加50μl终止液,终止反应(此时蓝色立转黄色)。以空白孔调零,使用酶标仪(450nm)测定各孔od值,根据浓度和od值算出标准曲线的回归方程,并计算il-1β和tnf-α表达量。
26.1.2.6蛋白质印迹法检测hhmecs细胞种foxo4蛋白相对表达量
27.收集各组hhmecs细胞pbs清洗2次,用ripa试剂裂解细胞,4℃、12000r/min离心10min。取上清液,bca法检测蛋白浓度后,行10%sds-page电泳。将分离蛋白转至pvdf膜,5%脱脂奶粉封闭1h。于4℃冰箱中分别用foxo4(1:500)、gapdh(1:1000)一抗孵育过夜,加入山羊抗兔二抗(1:2000)中37℃孵育1h。加显影液,避光显影,曝光拍照,imagej软件分析foxo4相对gapdh的表达量。
28.1.2.7细胞转染和处理
29.取2.5ml对数期浓度为2.5
×
104个/ml的hrmecs细胞悬液接种至6孔板中,培养24h后,弃培养液,加不含fbs的dmem培养液。用lipofectamine
tm
2000脂质体法分别转染si-foxo4、si-nc、pcdna-foxo4、pcdna至hrmecs细胞,转染12h后,更换为完全培养液。再培养12h后,弃培养液。转染si-foxo4、si-nc的hrmecs均用含30nmol/l葡萄糖的培养液培养24h,分别记为hg+si-foxo4组、hg+si-nc组。转染pcdna-foxo4、pcdna的hrmecs均用含100μmol/l特女贞苷与30nmol/l葡萄糖的培养液共同培养24h,分别记为hg+特女贞苷+pcdna-foxo4组、hg+特女贞苷+pcdna组。培养结束后,收集各组细胞,分别按照上述1.2.2、1.2.3、1.2.4和1.2.5检测细胞细胞凋亡率、细胞中mda含量和sod活性及培养上清液中细胞中il-1β和tnf-α表达量。
30.1.3统计学分析
31.spss.22.0软件(美国,ibm spss公司)分析实验数据。本研究中计量资料经s-w检验符合正态分布,计量资料以均数
±
标准差(mean
±
sd)表示,经正态性检验和方差齐性检验后,两组间比较行独立样本t检验;多组间比较用单因素方差分析,组间两两比较用lsd-t检验。以p《0.05表示差异有统计学意义。
32.2结果
33.2.1不同剂量特女贞苷处理组细胞的凋亡率和凋亡相关蛋白表达变化
34.正常对照组、高糖模型组及高糖+特女贞苷低、中、高剂量组hhrmecs细胞凋亡率分别为(7.32
±
0.72)%、(23.96
±
1.32)%、(19.84
±
1.09)%、(14.13
±
0.85)%和(9.84
±
0.70)%,五组间细胞凋亡率比较差异有统计学意义(f=458.723,p《0.05)。高糖+特女贞苷低、中、高剂量组细胞凋亡率均明显低于高糖模型组,且随着特女贞苷剂量增加而细胞凋亡率逐渐减少,差异均有统计学意义(均p《0.05)(图1)。
35.2.2不同剂量特女贞苷组细胞中mda浓度和sod活性变化
36.正常对照组、高糖模型组及高糖+特女贞苷低、中、高剂量组细胞中mda浓度分别为(82.96
±
6.42)nmol
·
ml-1
、(546.04
±
20.41)nmol
·
ml-1
、(471.09
±
20.71)nmol
·
ml-1
、(344.85
±
22.88)nmol
·
ml-1
和(172.24
±
19.02)nmol
·
ml-1
,sod活性分别为(273.11
±
16.80)u
·
l-1
、(35.41
±
2.32)u
·
l-1
、(61.78
±
5.57)u
·
l-1
、(130.54
±
15.74)u
·
l-1
和(224.69
±
14.84)u
·
l-1
,五组间mda浓度和sod活性总体比较差异均有统计学意义(f
mda
=968.228,p《0.05;f
sod
=599.344,p《0.05)。与正常对照组组比较,高糖模型组hrmecs细胞中sod活性明显降低(p《0.05),mda含量明显升高(p《0.05);与高糖模型组比较,高糖+特女贞苷低、中、高组hrmecs中sod活性值均升高(p《0.05),mda含量均降低(p《0.05),且呈剂量依赖性,(p《0.05)。
37.2.3不同剂量特女贞苷组炎症因子表达量变化
38.正常对照组、高糖模型组及特女贞苷低、中、高剂量组细胞培养上清液中炎症因子il-1β的表达量分别为(144.15
±
13.52)pg
·
ml-1
、(639.26
±
21.24)pg
·
ml-1
、(552.95
±
35.15)pg
·
ml-1
、(403.09
±
19.70)pg
·
ml-1
和(247.42
±
21.53)pg
·
ml-1
,tnf-α的表达量分别为(214.84
±
15.29)pg
·
ml-1
、(717.12
±
28.10)pg
·
ml-1
、(609.67
±
31.71)pg
·
ml-1
、(497.67
±
26.49)pg
·
ml-1
、(332.04
±
22.81)pg
·
ml-1
,五组间il-1β和tnf-α的表达量总体比较差异均有统计学意义(f
il-1β
=700.175,p《0.05;f
tnf-α
=572.340,p《0.05)。与正常对照组比较,高糖模型组细胞中il-1β和tnf-α表达量显著升高,差异均有统计学意义(p《0.05);与高糖模型组比较,高糖+特女贞苷低、中、高剂量组il-1β和tnf-α的表达量均显著降低,且呈剂量依赖性,差异均具有统计学意义(p《0.05)。
39.2.4不同剂量特女贞苷组细胞foxo4蛋白表达量变化
40.正常对照组、高糖模型组及高糖+特女贞苷低、中、高剂量组细胞中foxo4蛋白相对表达量分别为0.18
±
0.02、0.83
±
0.06、0.66
±
0.05、0.42
±
0.03和0.22
±
0.02,五组间foxo4蛋白相对表达量总体比较差异具有统计学意义(f=453.577,p《0.05)。与正常对照组比较,高糖模型组细胞中foxo4蛋白表达量明显升高,差异具有统计学意义(p《0.05)。与高糖模型组比较,特女贞苷低、中、高剂量组foxo4蛋白表达量均明显降低,且呈现剂量依赖性,差异均具有统计学意义(p《0.05)(图2)。
41.3讨论
42.近年来,随着居民生活水平的提高及生活方式的改变,糖尿病发病率逐年升高。dr作为糖尿病的常见并发症,其发病率也呈增长趋势。研究认为,高血糖是诱发dr的重要因素,其可引起hrmecs过度氧化应激、炎症反应及细胞凋亡,促进糖dr的发生发展。因此探索dr中保护hrmecs的药物对于控制dr疾病的发生与发展具有重要意义。
43.mda是脂质过氧化的产物之一,其表达量可间接反映细胞氧化应激水平。sod是机
体内重要的抗氧化酶,可清除氧自由基,减轻自由基对机体组织的氧化损伤。il-1β和tnf-α是诱导微血管病变的主要炎性因子。il-1β引起血清蛋白和红细胞向玻璃体内渗和弥散,导致局部水肿和炎症,引起血管内皮细胞损伤,导致血管间隙增加,视网膜屏障破坏。tnf-α作用于内皮细胞受体,激活nf-κb途径,诱导hrmecs凋亡,促使血管通透性增加,刺激血管外机制和血管细胞增殖,促进眼内新生血管生成。本研究结果显示,人视网膜微血管内皮细胞(hrmecs)经高糖干预后,细胞凋亡率、细胞中mda含量及培养上清液中il-1β和tnf-α表达量均明显升高,而细胞中sod活性降低。
44.本研究结果发现,特女贞苷降低了高糖诱导的hrmecs细胞凋亡率,抑制细胞中mda含量及培养上清液中il-1β和tnf-α表达量,同时增强了细胞sod活性,且呈剂量依赖性。本研究结果提示,特女贞苷通过增强高糖诱导下hrmecs的抗氧化能力,抑制hrmecs的凋亡及氧化应激作用。
45.foxo4是叉头框转录因子家族成员,在机体组织生理或病理过程中发挥重要调控作用,与多种疾病的发生发展密切相关。敲减foxo4可减少缺血/再灌注(i/r)引起的肝细胞凋亡,减轻肝i/r损伤
16.;敲低foxo4可减少i/r大鼠心肌梗死面积,改善心脏功能,并抑制大鼠心肌组织氧化应激及心肌细胞凋亡,保护心肌组织免受i/r损伤。foxo4的dna结合区域含有5个氨基酸构成的片段,受到胰岛素调控,且其在胰岛素外周靶器官中广泛表达,参与糖尿病并发症的发生,foxo4表达的上调可加重糖尿病视网膜病变。本研究结果显示,高糖促进了hrmecs中foxo4的表达,而敲减foxo4抑制了高糖诱导的hrmecs凋亡、氧化应激及炎症反应,这与陆骏等报道结果一致,提示foxo4有可能成为减轻糖尿病视网膜病变的分子靶点。此外,本研究结果进一步提示,特女贞苷可呈剂量依赖性抑制高糖诱导的hrmecs中foxo4蛋白表达,而过表达foxo4逆转了特女贞苷对高糖诱导的hrmecs凋亡、氧化应激及炎症反应的抑制作用,结果提示特女贞苷可能通过下调foxo4表达来抑制高糖诱导的hrmecs凋亡、氧化应激及炎症反应。但特女贞苷是否可通过调控其他信号通路表达而达到治疗dr的目的尚需进一步探究。本研究为特女贞苷治疗dr等相关疾病的提供了一定的实验基础,后续可在疾病动物模型内进一步验证其安全性和有效性。
46.综上所述,特女贞苷可有效抑制高糖诱导的hrmecs凋亡、氧化应激及炎症反应,其作用机制与抑制细胞中foxo4表达有关,推测特女贞苷可能通过抑制foxo4信号通路发挥改善dr微血管的损伤。本研究结果为特女贞苷对糖尿病诱导dr微血管损伤相关疾病的治疗提供了新的实验基础和新的研究方向,具有治疗糖尿病视网膜病变的潜在价值。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1