神经节苷脂GM1在用于听力损伤的药物中的用途
神经节苷脂gm1在用于听力损伤的药物中的用途
技术领域
1.本发明属于药物用途技术领域。具体涉及一种神经节苷脂gm1在制备用于预防、缓解或治疗听力损伤的药物中的用途。所述听力损伤包含由化疗药物引起的毛细胞损伤,还包含噪音性耳聋、老年性耳聋、和由于药物副作用导致的毛细胞损伤。
背景技术:
2.以铂类为基础的化疗药物被认为是听力损伤的主要原因,其中包括了顺铂、奥沙利铂、以及紫杉醇及其联合铂类药物(顺铂或奥沙利铂)的化疗。基础的化疗药物及头颈部的放射性治疗,是最容易引起听力损伤的癌症治疗方法。听觉系统对化疗药物敏感,主要在于铂类药物如顺铂、奥沙利铂、紫杉醇及其联合铂类化疗不可避免的造成毛细胞损伤。
3.临床治疗中,对于肿瘤化疗患者的听力损伤缺乏关注,主要关注点在于化疗效果。因此,化疗造成肿瘤患者听功能损伤的治疗并未得到重视,造成大量化疗病人听功能损伤得不到治疗。如果必须要接受化疗或放疗,并且患者已经出现了或者可能会出现听力损失,那么就需要考虑一些预防或治疗的方法。
4.目前而言,临床上对于听力损伤的治疗主要是通过助听器来帮助改善患者的听功能,然而,这种方式并非从根本上修复或治疗患者的听觉系统,更非事先预防这种听力损伤的发生。目前对于化疗患者而言,其听力损伤仍无可用的预防、缓解或治疗药物。因此,临床上亟需一种能够预防、缓解或治疗由化疗药物引起的听力损伤的药物,以提升癌症患者化疗后的生存质量。
技术实现要素:
5.本发明的目的在于,一方面,提供一种神经节苷脂gm1在制备用于预防、缓解或治疗由化疗药物引起的听力损伤的药物中的用途。
6.在一些优选的实施方式中,本发明中所述化疗药物选自铂类药物、紫杉醇、或其任意组合;优选地,所述化疗药物选自顺铂、奥沙利铂、紫杉醇、顺铂与紫杉醇的组合、奥沙利铂与紫杉醇的组合;更优选地,其中所述紫杉醇为白蛋白结合型紫杉醇。
7.本发明的所述用途,在一些优选的实施方式中,所述听力损伤包含患者不同程度的毛细胞损伤。
8.在另一些优选的实施方式中,所述毛细胞损伤包含:正常细胞的消失/减少、畸形细胞的增加、细胞位置或细胞相对位置的异常、细胞中特征指标分子(如myosin7a等)的异常。
9.本发明的所述用途,在一些优选的实施方式中,所述患者包含肿瘤患者,选自患有多发性骨髓瘤、消化道肿瘤、呼吸道肿瘤、头颈部肿瘤、乳腺癌、生殖系统肿瘤等患者,以及其他适用于铂类、紫杉醇及其组合化疗的患者,和其他应用各种放化疗的实体瘤和血液肿瘤患者。
10.本发明一个优选的实施方式中,所述神经节苷脂gm1为单唾液酸四己糖神经节苷
脂钠。
11.本发明中,所述神经节苷脂gm1的制剂形式选自注射制剂、口服制剂、局部给药制剂或外用制剂;优选地,所述神经节苷脂gm1的制剂形式为注射制剂。
12.在一些优选的实施方式中,本发明所述神经节苷脂gm1在所述化疗药物给药之前、期间或之后给药。
13.本发明的目的还在于,另一方面,提供一种神经节苷脂gm1在制备用于与化疗药物联用预防肿瘤患者听力损伤的药物中的用途,其中,所述化疗药物选自顺铂、奥沙利铂、紫杉醇、顺铂与紫杉醇的组合、或奥沙利铂与紫杉醇的组合,所述听力损伤包含不同程度的毛细胞损伤,包含:正常细胞的消失/减少、畸形细胞的增加、细胞位置或细胞相对位置的异常、细胞中特征指标分子(如myosin7a等)的异常。
14.本发明第三方面的目的在于,提供一种神经节苷脂gm1在制备用于预防、缓解或治疗患者听力损伤的药物中的用途,其中所述患者选自噪音性耳聋患者、老年性耳聋患者、和由于药物副作用导致的听力损伤患者,所述听力损伤包含患者不同程度的毛细胞损伤。
15.本发明具有以下有益效果:
16.1、本发明的神经节苷脂gm1,能够对由铂类药物,或紫杉醇、或紫杉醇联合铂类药物化疗引起的听力损伤(尤其是由毛细胞损伤导致的听力损伤)有显著改善作用,能够预防、缓解或治疗患者由于使用化疗药物而导致的听力损伤,从而有效提高癌症患者化疗之后的生活质量。
17.2、实验数据显示,与空白对照组比较,本发明的神经节苷脂gm1未发现动物明显的不良反应,安全性良好。
18.3、本发明的神经节苷脂gm,对噪音性耳聋患者、老年性耳聋患者、以及由于药物副作用导致的听力损伤患者中,尤其是由毛细胞的损伤导致的听力损伤,具有预防、缓解或治疗作用,从而提高患者的生活质量。
附图说明
19.本发明文本中的hpf(hour post fertilization)是指受精后几小时(斑马鱼);关于组间差异显著性:ns(no significant)是指gm1处理组与对照组相比无显著性差异,*p<0.05;**p<0.01;***p<0.001;****p<0.0001。
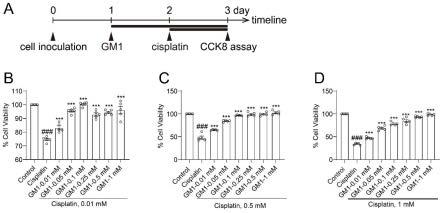
20.图1是单唾液酸四己糖神经节苷脂钠(gm1)改善顺铂对耳蜗毛细胞系house ear institute-organ of corti 1(hei-oc1)细胞的损伤;其中,图1a为药物对hei-oc1细胞的处理程序;图1b~图1d为0.01mm~1mm gm1分别对0.01mm~1mm顺铂损伤hei-oc1细胞的预保护作用;图中,###顺铂损伤组与对照组相比p《0.001,***gm1处理组与顺铂损伤组相比p《0.001。
21.图2是单唾液酸四己糖神经节苷脂钠(gm1)改善顺铂对斑马鱼毛细胞的损伤;其中,图2a为药物对转基因斑马鱼的处理程序;图2b、图2c为0.1mg/ml~2mg/ml gm1在24hpf处理分别对0.01mg/ml~0.5mg/ml顺铂损伤斑马鱼毛细胞的预保护作用;图中,ns gm1处理组与对照组相比无显著性差异,***gm1处理组与顺铂处理组相比p《0.001。
22.图3是单唾液酸四己糖神经节苷脂钠(gm1)改善顺铂对斑马鱼毛细胞的损伤;其中,图3a是gm1和顺铂对转基因斑马鱼的处理程序;图3b、图3c是0.1mg/ml~2mg/ml gm1在
8hpf处理分别对0.01mg/ml~0.5mg/ml顺铂损伤斑马鱼毛细胞的预保护作用;图中,ns gm1处理组与对照组相比无显著性差异,***gm1处理组与顺铂处理组相比p《0.001。
23.图4是单唾液酸四己糖神经节苷脂钠(gm1)改善奥沙利铂对耳蜗毛细胞系house ear institute-organ of corti 1(hei-oc1)细胞的损伤;其中,图4a是药物对hei-oc1细胞的处理程序;图4b~图4d是0.01mm~1mm gm1分别对0.1mm~1.5mm奥沙利铂损伤hei-oc1细胞的预保护作用;图中,###奥沙利铂损伤组与对照组相比p《0.001,ns gm1处理组与奥沙利铂损伤组相比无显著性差异,***gm1处理组与奥沙利铂损伤组相比p《0.001。
24.图5是单唾液酸四己糖神经节苷脂钠(gm1)改善奥沙利铂对斑马鱼毛细胞的损伤;其中,图5a是药物对转基因斑马鱼的处理程序,gm1在24hpf对斑马鱼胚胎预保护;图5b、图5c为0.1mg/ml~2mg/ml gm1在24hpf处理分别对0.1mg/ml~1mg/ml奥沙利铂损伤斑马鱼毛细胞的预保护作用;图中,ns gm1处理组与对照组相比无显著性差异,***gm1处理组与奥沙利铂处理组相比p《0.001;
25.图6是单唾液酸四己糖神经节苷脂钠(gm1)改善奥沙利铂对斑马鱼毛细胞的损伤;其中,图6a是药物对转基因斑马鱼的处理程序,gm1在8hpf对斑马鱼胚胎预保护;图6b、图6c是0.1mg/ml~2mg/ml gm1在8hpf处理分别对0.1mg/ml~1mg/ml奥沙利铂损伤斑马鱼毛细胞的预保护作用;图中,ns gm1处理组与对照组相比无显著性差异,***gm1处理组与奥沙利铂处理组相比p《0.001;
26.图7是单唾液酸四己糖神经节苷脂钠(gm1)改善白蛋白结合型紫杉醇对斑马鱼毛细胞的损伤;其中,图7a是药物对转基因斑马鱼的处理程序,gm1在24hpf对斑马鱼胚胎预保护;图7b、图7c为0.1mg/ml~2mg/ml gm1分别对0.01mg/ml~1mg/ml白蛋白结合型紫杉醇损伤斑马鱼毛细胞的预保护作用;图中,ns gm1处理组与对照组相比无显著性差异,***gm1处理组与白蛋白结合型紫杉醇处理组相比p《0.001;
27.图8是单唾液酸四己糖神经节苷脂钠(gm1)改善白蛋白结合型紫杉醇对斑马鱼毛细胞的损伤;图8a是药物对转基因斑马鱼的处理程序,gm1在8hpf对斑马鱼胚胎预保护;图8b、图8c是0.1mg/ml~2mg/ml gm1分别对0.01mg/ml~1mg/ml白蛋白结合型紫杉醇损伤斑马鱼毛细胞的预保护作用;图中,ns gm1处理组与对照组相比无显著性差异,***gm1处理组与白蛋白结合型紫杉醇处理组相比p《0.001;
28.图9是单唾液酸四己糖神经节苷脂钠(gm1)改善白蛋白结合型紫杉醇联合顺铂对斑马鱼毛细胞的损伤;图9a是药物对转基因斑马鱼的处理程序,gm1在8hpf对斑马鱼胚胎预保护;图9b、图9c是0.1mg/ml~2mg/ml gm1分别对0.01mg/ml~1mg/ml白蛋白结合型紫杉醇联合0.01mg/ml~0.5mg/ml顺铂损伤斑马鱼毛细胞的预保护作用;图中,ns gm1处理组与对照组相比无显著性差异,***gm1处理组与白蛋白结合型紫杉醇联合顺铂处理组相比p《0.001;
29.图10是单唾液酸四己糖神经节苷脂钠(gm1)改善白蛋白结合型紫杉醇联合奥沙利铂对斑马鱼毛细胞的损伤;其中,图10a是药物对转基因斑马鱼的处理程序,gm1在8hpf对斑马鱼胚胎预保护;图10b、图10c是0.1mg/ml~2mg/ml gm1分别对0.01mg/ml~1mg/ml白蛋白结合型紫杉醇联合0.1mg/ml~1mg/ml奥沙利铂损伤斑马鱼毛细胞的预保护作用;图中,ns gm1处理组与对照组相比无显著性差异,***gm1处理组与白蛋白结合型紫杉醇联合奥沙利铂处理组相比p《0.001。
30.图11是单唾液酸四己糖神经节苷脂钠(gm1)改善顺铂引起的小鼠耳蜗毛细胞损伤;其中,图11a是荧光显微镜下观察小鼠耳蜗毛细胞形态;图11b是毛细胞表型计数,显示顺铂具有显著的小鼠耳蜗毛细胞毒性,gm1预处理后具有明显的保护效果,降低了毛细胞的损失和畸形数量。
31.图12是单唾液酸四己糖神经节苷脂钠(gm1)改善奥沙利铂联合紫杉醇引起的小鼠耳蜗毛细胞损伤;其中,图12a是荧光显微镜下观察小鼠耳蜗毛细胞形态;图12b是毛细胞表型计数,显示奥沙利铂联合紫杉醇具有显著的小鼠耳蜗毛细胞毒性,gm1预处理后具有明显的保护效果,降低了毛细胞的损失和畸形数量。
32.图13是单唾液酸四己糖神经节苷脂钠(gm1)的干预处理可以保护顺铂引起的听力损伤。图13a是小鼠耳蜗corti免疫荧光图,其中myo7a(绿色)标记毛细胞,dapi(蓝色)标记细胞核,腹腔注射顺铂(cisplatin)3mg/kg引起毛细胞减少,腹腔注射gm1 20mg/kg能预防顺铂导致的毛细胞减少(scale bar:50μm)。图13b是统计不同组别小鼠耳蜗200μm区域(白色虚线区域)具有myo7a阳性信号毛细胞数量图,其中***p《0.001,****p《0.0001。图13c-f表示不同组别之间小鼠在24khz刺激下的abr波形图。图13g分别统计不同组别之间的abr反应阈值,其中****p《0.0001。图13h分别统计不同组别在80db刺激下的abr潜伏期,其中****p《0.0001。
33.图14是单唾液酸四己糖神经节苷脂钠(gm1)干预处理可以保护奥沙利铂引起的听力损伤。图14a是小鼠耳蜗corti免疫荧光图,其中myo7a(绿色)标记毛细胞,dapi(蓝色)标记细胞核,腹腔注射奥沙利铂(oxa)5mg/kg引起毛细胞减少,腹腔注射gm1 20mg/kg能预防oxa导致的毛细胞减少。图14b统计不同组别小鼠耳蜗200μm区域(白色虚线区域)的myo7a阳性信号毛细胞数量,其中****p《0.0001。图14c-f表示不同组别之间小鼠在24khz刺激下的abr波形图。图14g分别统计不同组别之间的abr反应阈值,其中****p《0.0001。图14h分别统计不同组别在80db刺激下的abr潜伏期,其中****p《0.0001。
具体实施方式
34.下面参照具体的实施例对本发明做进一步说明。应当理解为,此处所描述的具体实施例仅用于解释本发明,并不用于限定本发明的范围。
35.实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道购买得到的常规产品。
36.下面实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的实验材料,如无特殊说明,均为市售产品。
37.实施例1gm1在预防/改善顺铂引起的小鼠耳蜗毛细胞及斑马鱼毛细胞损伤/听力损伤方面的作用
38.一、gm1预保护顺铂对小鼠耳蜗毛细胞(hei-oc1)的损伤
39.hei-oc1细胞实验过程,如图1a所示,包括以下步骤:
40.1、10%完全培养基配置比例:dmem(45ml)+fbs(5ml)
41.细胞复苏:将冻存细胞放在33℃水浴锅,快速使其溶解,溶解后加入到预热好的培养基中,放入培养箱,10h后进行全量换液。
42.细胞传代:在镜下观察,当细胞密度铺满皿底面积的80%时,即可进行细胞传代。培养基、pbs(细胞培养级别)、0.25%trypsin-edta(gibco)预热15min。
43.(1)从培养箱中取出细胞,弃上清,用pbs清洗一遍,注意:加液体的时候沿皿壁加入,防止细胞被吹起;
44.(2)去掉pbs,加1~2ml 0.25%trypsin-edta(胰酶的量取决于皿的底面积,覆盖皿底就可以了),37℃消化90s,可看到细胞在皿底形成一整片膜;
45.(3)加入新鲜培养基终止消化,将细胞冲下,转移到加入到离心管中,1500rpm/5min;
46.(4)弃上清,加1ml培养基重悬细胞。细胞计数,按密度1
×
104个/ml传代。
47.2、细胞种板:种板前期消化、重悬、计数与传代相同
48.(1)种板有两种不同的细胞密度,高密度3
×
104个/ml、低密度1
×
104个/ml;
49.(2)96孔板每孔加入100μl细胞悬液,四周的孔用无菌水封边;
50.(3)种好细胞的96孔板放回培养箱中培养。
51.3、化合物顺铂ic
50
测定
52.(1)细胞种板后,放到培养箱中培养24h,弃去旧的培养基,加入含有不同浓度顺铂的新鲜培养基,继续培养24h或者48h;
53.(2)培养结束后,每孔加入10μl cck8,继续培养4h,酶标仪测定吸光度od值;
54.(3)依据od值,使用graphpad计算化合物ic
50
值,根据ic
50
浓度选择出对应的高损伤组、中损伤组和低损伤组的浓度,获得顺铂引起的低损伤、中损伤、高损伤hei-oc1细胞模型用于后续实验研究。
55.4、gm1对hel-oc1细胞的预保护
56.(1)细胞种板,放在培养箱中培养24h;
57.(2)撤去旧培养基,加入gm1(0.01~1mm,水溶液)处理24h或者48h;
58.(3)gm1处理24或者48h后,吸取含有gm1的培养基,用来配置顺铂;
59.(4)将含有gm1和顺铂的培养液放到培养箱中;
60.(5)再继续在培养箱中处理24h或者48h,然后每孔加入10μl cck8,培养4h后,测定od值,计算细胞存活率。
61.研究结果如图1中图b、图c、图d所示,结果表明,gm1在0.01~1mm浓度范围内均有预保护作用。
62.二、gm1在24hpf处理预保护顺铂对斑马鱼毛细胞的损伤
63.收集荧光蛋白标记毛细胞的tg(brn3c:egfp)转基因斑马鱼胚胎于28.5℃培养箱中孵育,6hpf选取状态良好的胚胎置于96孔板,胚胎随机分组:control组、gm1处理组、顺铂(cisplatin)处理组、gm1+顺铂处理组,如图2a所示。
64.在8hpf至24hpf阶段开始用含有一定浓度(0.1mg/ml~2mg/ml)gm1的胚胎培养液孵育胚胎,gm1处理6h后可根据分组进行一定浓度顺铂(0.01mg/ml~0.5mg/ml)的处理,如图2a所示。
65.药物处理过程均在28.5℃培养箱中进行,待胚胎发育至72hpf后,根据需要选择时间段对斑马鱼幼鱼进行活体成像。经将荧光标记毛细胞的转基因斑马鱼幼鱼固定在含有0.03%tricaine麻醉剂的0.8%lmp琼脂糖凝胶中,置于激光共聚焦显微镜下活体三维成
像,分析毛细胞的形态、数量指标。
66.结果如图2b、图2c所示,顺铂处理后,毛细胞排列紊乱,毛细胞胞体损伤、纤毛缩短或消失,毛细胞数量显著减少。gm1预处理后再加顺铂处理,与只用顺铂处理相比,毛细胞数量显著增加,毛细胞呈更紧密簇状排列,纤毛结构有所改善。
67.三、gm1在8hpf处理预保护顺铂对斑马鱼毛细胞的损伤
68.收集荧光蛋白标记毛细胞的tg(brn3c:egfp)转基因斑马鱼胚胎于28.5℃培养箱中孵育,6hpf选取状态良好的胚胎置于96孔板,胚胎随机分组:control组、gm1处理组、顺铂(cisplatin)处理组、gm1+顺铂处理组,如图3a所示。
69.在8hpf至24hpf阶段开始用含有一定浓度(0.1mg/ml~2mg/ml)gm1的胚胎培养液孵育胚胎,gm1处理6h后可根据分组进行一定浓度顺铂(0.01mg/ml~0.5mg/ml)的处理,如图3a所示。
70.药物处理过程均在28.5℃培养箱中进行,待胚胎发育至72hpf后,根据需要选择时间段对斑马鱼幼鱼进行活体成像。经将荧光标记毛细胞的转基因斑马鱼幼鱼固定在含有0.03%tricaine麻醉剂的0.8%lmp琼脂糖凝胶中,置于激光共聚焦显微镜下活体三维成像,分析毛细胞的形态、数量指标。
71.结果如图3b、图3c所示,顺铂处理后,毛细胞排列紊乱,毛细胞胞体损伤、纤毛缩短或消失,毛细胞数量显著减少。gm1预处理后再加顺铂处理,与只用顺铂处理相比,毛细胞数量显著增加,毛细胞呈更紧密簇状排列,纤毛结构有所改善。
72.实施例2 gm1在预防/改善奥沙利铂引起的小鼠耳蜗毛细胞及斑马鱼毛细胞损伤/听力损伤方面的作用
73.一、gm1预保护奥沙利铂对小鼠耳蜗毛细胞(hei-oc1)的损伤
74.hei-oc1细胞实验过程,如图4中图a所示,包括以下步骤:
75.1、10%完全培养基配置比例:dmem(45ml)+fbs(5ml)
76.细胞复苏:将冻存细胞放在33℃水浴锅,快速使其溶解,溶解后加入到预热好的培养基中,放入培养箱,10h后进行全量换液。
77.细胞传代:在镜下观察,当细胞密度铺满皿底面积的80%时,即可进行细胞传代。培养基、pbs(细胞培养级别)、0.25%trypsin-edta(gibco)预热15min。
78.(1)从培养箱中取出细胞,弃上清,用pbs清洗一遍,注意:加液体的时候沿皿壁加入,防止细胞被吹起;
79.(2)去掉pbs,加1~2ml 0.25%trypsin-edta(胰酶的量取决于皿的底面积,覆盖皿底就可以了),37℃消化90s,可看到细胞在皿底形成一整片膜;
80.(3)加入新鲜培养基终止消化,将细胞冲下,转移到加入到离心管中,1500rpm/5min;
81.(4)弃上清,加1ml培养基重悬细胞。细胞计数,按密度1
×
104个/ml传代。
82.2、细胞种板:种板前期消化、重悬、计数与传代相同
83.(1)种板有两种不同的细胞密度,高密度3
×
104个/ml、低密度1
×
104个/ml;
84.(2)96孔板每孔加入100μl细胞悬液,四周的孔用无菌水封边;
85.(3)种好细胞的96孔板放回培养箱中培养。
86.3、化合物奥沙利铂ic
50
测定
87.(1)细胞种板后,放到培养箱中培养24h,弃去旧的培养基,加入含有不同浓度奥沙利铂的新鲜培养基,继续培养24h或者48h;
88.(2)培养结束后,每孔加入10μl cck8,继续培养4h,酶标仪测定吸光度od值;
89.(3)依据od值,使用graphpad计算化合物ic
50
值,根据ic
50
浓度选择出对应的高损伤组、中损伤组和低损伤组的浓度,获得奥沙利铂引起的低损伤、中损伤、高损伤hei-oc1细胞模型用于后续实验研究。
90.4、gm1对hel-oc1细胞的预保护
91.(1)细胞种板,放在培养箱中培养24h;
92.(2)撤去旧培养基,加入不同浓度gm1(0.01~1mm,水溶液)处理24h或者48h;
93.(3)gm1处理24或者48h后,吸取含有gm1的培养基,用来配置奥沙利铂;
94.(4)将含有gm1和奥沙利铂的培养液放到培养箱中;
95.(5)再继续在培养箱中处理24h或者48h,然后每孔加入10μl cck8,培养4h后,测定od值,计算细胞存活率。
96.研究结果如图4中图b、图c、图d所示,结果表明,gm1在0.01~1mm浓度范围内均有预保护作用。
97.二、gm1在24hpf处理预保护奥沙利铂对斑马鱼毛细胞的损伤
98.收集荧光蛋白标记毛细胞的tg(brn3c:egfp)转基因斑马鱼胚胎于28.5℃培养箱中孵育,6hpf选取状态良好的胚胎置于96孔板,胚胎随机分组:control组、gm1处理组、奥沙利铂(oxaliplatin)处理组、gm1+奥沙利铂处理组,如图5a所示。
99.在24hpf开始用含有一定浓度(0.1mg/ml~2mg/ml)gm1的胚胎培养液孵育胚胎,gm1处理6h后可根据分组进行一定浓度奥沙利铂(0.1mg/ml~1mg/ml)的处理,如图5a所示。
100.药物处理过程均在28.5℃培养箱中进行,待胚胎发育至72hpf后,根据需要选择时间段对斑马鱼幼鱼进行活体成像。经将荧光标记毛细胞的转基因斑马鱼幼鱼固定在含有0.03%tricaine麻醉剂的0.8%lmp琼脂糖凝胶中,置于激光共聚焦显微镜下活体三维成像,分析毛细胞的形态、数量指标。
101.结果如图5b、图5c所示,奥沙利铂处理后,毛细胞排列紊乱,毛细胞胞体损伤、纤毛缩短或消失,毛细胞数量显著减少。gm1预处理后再加奥沙利铂处理,与只用奥沙利铂处理相比,毛细胞数量显著增加,毛细胞呈更紧密簇状排列,纤毛结构有所改善。
102.三、gm1在8hpf处理预保护奥沙利铂对斑马鱼毛细胞的损伤
103.收集荧光蛋白标记毛细胞的tg(brn3c:egfp)转基因斑马鱼胚胎于28.5℃培养箱中孵育,6hpf选取状态良好的胚胎置于96孔板,胚胎随机分组:control组、gm1处理组、奥沙利铂(oxaliplatin)处理组、gm1+奥沙利铂处理组,如图6a所示。
104.在8hpf开始用含有一定浓度(0.1mg/ml~2mg/ml)gm1的胚胎培养液孵育胚胎,gm1处理6h后可根据分组进行一定浓度奥沙利铂(0.1mg/ml~1mg/ml)的处理,如图6a所示。
105.药物处理过程均在28.5℃培养箱中进行,待胚胎发育至72hpf后,根据需要选择时间段对斑马鱼幼鱼进行活体成像。经将荧光标记毛细胞的转基因斑马鱼幼鱼固定在含有0.03%tricaine麻醉剂的0.8%lmp琼脂糖凝胶中,置于激光共聚焦显微镜下活体三维成像,分析毛细胞的形态、数量指标。
106.结果如图6b、图6c所示,奥沙利铂处理后,毛细胞排列紊乱,毛细胞胞体损伤、纤毛
缩短或消失,毛细胞数量显著减少。gm1预处理后再加奥沙利铂处理,与只用奥沙利铂处理相比,毛细胞数量显著增加,毛细胞呈更紧密簇状排列,纤毛结构有所改善。
107.实施例3 gm1在预防/改善紫杉醇或其联合铂类药物引起的斑马鱼毛细胞损伤/听力损伤方面的作用
108.一、gm1在24hpf处理预保护紫杉醇对斑马鱼毛细胞的损伤
109.收集荧光蛋白标记毛细胞的tg(brn3c:egfp)转基因斑马鱼胚胎于28.5℃培养箱中孵育,6hpf选取状态良好的胚胎置于96孔板,胚胎随机分组:control组、gm1处理组、紫杉醇(白蛋白结合型,组成为100mg紫杉醇和900mg人血白蛋白)处理组、gm1+紫杉醇(白蛋白结合型)处理组。如图7a所示,紫杉醇(白蛋白结合型)(0.01mg/ml~1mg/ml,胚胎培养液)处理组在48hpf开始处理。在24hpf开始用含有一定浓度(0.1mg/ml~2mg/ml)gm1的胚胎培养液孵育胚胎,gm1处理6h后可根据分组进行一定浓度紫杉醇(白蛋白结合型)(0.01mg/ml~1mg/ml,胚胎培养液)处理。
110.药物处理过程均在28.5℃培养箱中进行。待胚胎发育至72hpf后,根据需要选择时间段对斑马鱼幼鱼进行活体成像。经将荧光标记毛细胞的转基因斑马鱼幼鱼固定在含有0.03%tricaine麻醉剂的0.8%lmp琼脂糖凝胶中,置于激光共聚焦显微镜下活体三维成像,结果如图7b所示;分析毛细胞的形态、数量、分布等参数指标,结果如图7c所示。
111.紫杉醇(白蛋白结合型)处理后,毛细胞排列紊乱,毛细胞胞体损伤、纤毛缩短或消失,毛细胞数量显著减少。gm1预处理后再加紫杉醇(白蛋白结合型)处理,与只用紫杉醇(白蛋白结合型)处理相比,毛细胞数量显著增加,毛细胞呈更紧密簇状排列,纤毛结构有所改善。
112.二、gm1在8hpf处理预保护紫杉醇对斑马鱼毛细胞的损伤
113.收集荧光蛋白标记毛细胞的tg(brn3c:egfp)转基因斑马鱼胚胎于28.5℃培养箱中孵育,6hpf选取状态良好的胚胎置于96孔板,胚胎随机分组:control组、gm1处理组、紫杉醇(白蛋白结合型,组成为100mg紫杉醇和900mg人血白蛋白)处理组、gm1+紫杉醇(白蛋白结合型)处理组。如图8a所示,紫杉醇(白蛋白结合型)(0.01mg/ml~1mg/ml,胚胎培养液)处理组在48hpf开始处理。在8hpf开始用含有一定浓度(0.1mg/ml~2mg/ml)gm1的胚胎培养液孵育胚胎,gm1处理6h后可根据分组进行一定浓度紫杉醇(白蛋白结合型)(0.01mg/ml~1mg/ml,胚胎培养液)处理。
114.药物处理过程均在28.5℃培养箱中进行。待胚胎发育至72hpf后,根据需要选择时间段对斑马鱼幼鱼进行活体成像。经将荧光标记毛细胞的转基因斑马鱼幼鱼固定在含有0.03%tricaine麻醉剂的0.8%lmp琼脂糖凝胶中,置于激光共聚焦显微镜下活体三维成像,结果如图8b所示;分析毛细胞的形态、数量、分布等参数指标,结果如图8c所示。
115.紫杉醇(白蛋白结合型)处理后,毛细胞排列紊乱,毛细胞胞体损伤、纤毛缩短或消失,毛细胞数量显著减少。gm1预处理后再加紫杉醇(白蛋白结合型)处理,与只用紫杉醇(白蛋白结合型)处理相比,毛细胞数量显著增加,毛细胞呈更紧密簇状排列,纤毛结构有所改善。
116.三、gm1在8hpf处理预保护紫杉醇联合顺铂对斑马鱼毛细胞的损伤
117.收集荧光蛋白标记毛细胞的tg(brn3c:egfp)转基因斑马鱼胚胎于28.5℃培养箱中孵育,6hpf选取状态良好的胚胎置于96孔板,胚胎随机分组:control组、gm1处理组、紫杉
醇(白蛋白结合型,组成为100mg紫杉醇和900mg人血白蛋白)联合顺铂处理组、gm1+紫杉醇(白蛋白结合型)联合顺铂处理组。如图9a所示,紫杉醇(白蛋白结合型)(0.01mg/ml~1mg/ml,胚胎培养液)联合顺铂(0.01mg/ml~0.5mg/ml,胚胎培养液)处理组在48hpf开始处理。在8hpf开始用含有一定浓度(0.1mg/ml~2mg/ml)gm1的胚胎培养液孵育胚胎,gm1处理6h后可根据分组进行一定浓度紫杉醇(白蛋白结合型)(0.01mg/ml~1mg/ml,胚胎培养液)与顺铂(0.01mg/ml~0.5mg/ml,胚胎培养液)联合处理。
118.药物处理过程均在28.5℃培养箱中进行。待胚胎发育至72hpf后,根据需要选择时间段对斑马鱼幼鱼进行活体成像。经将荧光标记毛细胞的转基因斑马鱼幼鱼固定在含有0.03%tricaine麻醉剂的0.8%lmp琼脂糖凝胶中,置于激光共聚焦显微镜下活体三维成像,结果如图9b所示;分析毛细胞的形态、数量、分布等参数指标,结果如图9c所示。
119.紫杉醇(白蛋白结合型)联合顺铂处理后,毛细胞排列紊乱,毛细胞胞体损伤、纤毛缩短或消失,毛细胞数量显著减少。gm1预处理后再加紫杉醇(白蛋白结合型)联合顺铂处理,与只用紫杉醇(白蛋白结合型)联合顺铂处理相比,毛细胞数量显著增加,毛细胞呈更紧密簇状排列,纤毛结构有所改善。
120.四、gm1在8hpf处理预保护紫杉醇联合奥沙利铂对斑马鱼毛细胞的损伤
121.收集荧光蛋白标记毛细胞的tg(brn3c:egfp)转基因斑马鱼胚胎于28.5℃培养箱中孵育,6hpf选取状态良好的胚胎置于96孔板,胚胎随机分组:control组、gm1处理组、紫杉醇(白蛋白结合型,组成为100mg紫杉醇和900mg人血白蛋白)联合奥沙利铂处理组、gm1+紫杉醇(白蛋白结合型)联合奥沙利铂处理组。如图10a所示,紫杉醇(白蛋白结合型)(0.01mg/ml~1mg/ml,胚胎培养液)联合奥沙利铂(0.1mg/ml~1mg/ml,胚胎培养液)处理组在48hpf开始处理。在8hpf开始用含有一定浓度(0.1mg/ml~2mg/ml)gm1的胚胎培养液孵育胚胎,gm1处理6h后可根据分组进行一定浓度紫杉醇(白蛋白结合型)(0.01mg/ml~1mg/ml,胚胎培养液)与奥沙利铂(0.1mg/ml~1mg/ml,胚胎培养液)联合处理。
122.药物处理过程均在28.5℃培养箱中进行。待胚胎发育至72hpf后,根据需要选择时间段对斑马鱼幼鱼进行活体成像。经将荧光标记毛细胞的转基因斑马鱼幼鱼固定在含有0.03%tricaine麻醉剂的0.8%lmp琼脂糖凝胶中,置于激光共聚焦显微镜下活体三维成像,结果如图10b所示;分析毛细胞的形态、数量、分布等参数指标,结果如图10c所示。
123.紫杉醇(白蛋白结合型)联合奥沙利铂处理后,毛细胞排列紊乱,毛细胞胞体损伤、纤毛缩短或消失,毛细胞数量显著减少。gm1预处理后再加紫杉醇(白蛋白结合型)联合奥沙利铂处理,与只用紫杉醇(白蛋白结合型)联合奥沙利铂处理相比,毛细胞数量显著增加,毛细胞呈更紧密簇状排列,纤毛结构有所改善。
124.实施例4 gm1在预防/改善顺铂、奥沙利铂及紫杉醇引起的小鼠毛细胞损伤/听力损伤方面的作用
125.一、gm1预防/改善顺铂引起的小鼠耳蜗毛细胞损伤
126.取新生小鼠按照实验分组给予药物处理,gm1剂量为200mg/kg,顺铂剂量为5mg/kg。药物处理完成后,取出小鼠temperal bone置于冰盒上,快速解剖耳蜗。用分装好的cell-tak涂10mm的盖玻片,每个玻片涂0.5μl,涂成直径5mm的圆,晾干(新鲜涂制)。涂好的盖玻片放入有耳蜗的培养皿中,把耳蜗正面朝上粘附在玻片上,粘附好的玻片放入4孔培养皿中(之前已加入3ml的pbs,置于冰上),待所有的玻片都粘附好后,在四孔培养皿中加入
16%的pfa,使溶液最终成为4%的pfa。固定1h,用pbst洗3次,blocking medium封闭1-2h(每个孔100μl),在加有一抗的pbt-1中4℃过夜,pbst洗3次后加入二抗,室温1h(每孔100μl)。pbst洗3次,每个sample加6μl dako,盖上盖玻片,用指甲油封片。荧光显微镜下观察小鼠耳蜗毛细胞形态,结果如图11a所示。毛细胞表型计数显示,顺铂具有显著的小鼠耳蜗毛细胞毒性,gm1预处理后具有明显的保护效果,降低了毛细胞的损失和畸形数量(图11b)。
127.二、gm1预防/改善奥沙利铂联合紫杉醇引起的小鼠耳蜗毛细胞损伤
128.取新生小鼠按照实验分组给予药物处理,gm1剂量为200mg/kg,奥沙利铂和紫杉醇剂量为5mg/kg。药物处理完成后,取出小鼠temperal bone置于冰盒上,快速解剖耳蜗。用分装好的cell-tak涂10mm的盖玻片,每个玻片涂0.5μl,涂成直径5mm的圆,晾干(新鲜涂制)。涂好的盖玻片放入有耳蜗的培养皿中,把耳蜗正面朝上粘附在玻片上,粘附好的玻片放入4孔培养皿中(之前已加入3ml的pbs,置于冰上),待所有的玻片都粘附好后,在四孔培养皿中加入16%的pfa,使溶液最终成为4%的pfa。固定1h,用pbst洗3次,blocking medium封闭1-2h(每个孔100μl),在加有一抗的pbt-1中4℃过夜,pbst洗3次后加入二抗,室温1h(每孔100μl)。pbst洗3次,每个sample加6μl dako,盖上盖玻片,用指甲油封片。荧光显微镜下观察小鼠耳蜗毛细胞形态,结果如图12a所示。毛细胞表型计数显示,顺铂具有显著的小鼠耳蜗毛细胞毒性,gm1预处理后具有明显的保护效果,降低了毛细胞的损失和畸形数量(图12b)。
129.三、gm1预防/改善顺铂、奥沙利铂引起的小鼠耳蜗毛细胞损伤/听力损伤的研究
130.实验材料
131.1、实验动物:8周龄c57bl/6雄鼠,由南通大学实验动物中心提供。
132.2、实验试剂:
[0133][0134]
3、实验器材:
[0135][0136]
实验方法
[0137]
1、实验动物分组和给药
[0138]
1)顺铂分组和给药
[0139]
使用前瞻性随机对照实验,随机数字表法将实验小鼠分为以下四组,每组各10只小鼠:对照组(vehicle)、顺铂组(cisplatin)、gm1+顺铂组(gm1&cisplatin)、gm1组(gm1)。顺铂组小鼠给予腹腔注射顺铂3mg/kg,连续7d;gm1组小鼠给予腹腔注射gm1 20mg/kg,连续7d;gm1+顺铂组小鼠提前7d处理,腹腔注射gm1 20mg/kg,在第8天时腹腔注射顺铂3mg/kg,连续7d;对照组仅给予腹腔注射等量生理盐水。四组停药一天后复查听性脑干反应(auditory brainstem response,abr),完成abr检查后处死小鼠取耳蜗用于后续形态学、分子生物学实验。
[0140]
2)奥沙利铂分组和给药
[0141]
使用前瞻性随机对照实验,随机数字表法将动物小鼠分为以下四组,每组各8只小鼠:对照组(vehicle)、奥沙利铂组(oxa)、gm1+奥沙利铂组(gm1&oxa)、gm1组(gm1)。奥沙利铂组小鼠给予腹腔注射奥沙利铂5mg/kg,连续7d;gm1组小鼠给予腹腔注射gm1 20mg/kg,连续7d;gm1+奥沙利铂组小鼠提前7d处理,腹腔注射gm1 20mg/kg,在第8天时腹腔注射奥沙利铂5mg/kg,连续7d;对照组仅给予腹腔注射等量生理盐水。四组停药一天后复查abr,完成abr检查后处死小鼠取耳蜗用于后续形态学、分子生物学实验。
[0142]
2、abr测试
[0143]
abr是一种声音诱发的神经反应,通常用于评估人类和实验动物的听觉功能。在小鼠中,abr检测会出现5个波形图,分别命名为波ⅰ、波ⅱ、波ⅲ、波ⅳ、波
ⅴ
,其中波ⅰ接受来自听神经的神经信号,波ⅱ接受来自耳蜗的神经信号,波ⅲ接受来自上橄榄核的神经信号,波ⅳ接受橄榄周核和外侧丘状核的神经信号,波
ⅴ
接受下丘核的神经信号。
[0144]
abr测试在隔音室进行,在进行abr测试前,称好小鼠重量,腹腔注射4%水合氯醛麻醉动物,用皮下针电极分别插入到小鼠颅顶顶正中皮(+电极)、乳突(-极)和后腿(接地),通过扬声器单声道分别施click刺激和不同频率4khz、8khz、16khz、24khz、32khz的短纯音刺激,从90db声压级开始,以10db的减量重复刺激,记录abr波形图。实验结束后,统计记录波ⅱ的反应阈值和潜伏期变化。
[0145]
3、小鼠耳蜗corti免疫荧光染色
[0146]
abr实验结束后,从各组中随机选择5只小鼠用于免疫荧光染色。小鼠内耳经4%pfa固定和edta脱钙处理后,在显微镜下小心剥取小鼠耳蜗。在预冷的pbs中解剖出小鼠基底膜;用cell-tak涂10mm的盖玻片,涂成直径5mm的圆圈,晾干(新鲜涂制);涂好的盖玻片放
入有小鼠耳蜗基底膜的培养皿中,把耳蜗粘附在玻片上,粘附时耳蜗正面朝上(正面有突起);粘附好的玻片放入4孔培养皿中(提前加入3ml的pbs,置于冰上),用pbs清洗三次;室温封闭一小时后,加入毛细胞标记物myosin7a(myo7a)一抗置于4℃下孵育过夜;用pbs漂洗3次,每次5分钟内,将对应的二抗按比例室温孵育2小时;pbs漂洗3次,每次5分钟,在每个玻片上加10μl含dapi(4',6-二脒基-2-苯基吲哚,一种能够与dna强力结合的荧光染料)的封片剂,盖上10mm盖玻片,用指甲油封片;利用共聚焦显微镜采集图片。
[0147]
4、数据处理
[0148]
激光共聚焦拍摄的图像均用imaris
×
64 9.0.a软件分析处理。实验获得的数据均用graphpad prism8处理,one-way anova用于单因素多组间差异性比较,two-way anova用于两组间多因素比较,p《0.05表明差异具有统计学意义。
[0149]
实验结果及结论
[0150]
1、gm1预防顺铂引起的corti毛细胞损伤和abr反应阈异常
[0151]
corti器是位于耳蜗膜蜗管基底膜上的螺旋器,由内、外毛细胞,支持细胞和盖膜(tectorial membrane)组成,是听觉感受器的主要成分。靠蜗轴侧有单排内毛细胞(inner hair cells,ihcs),其外侧有3排或更多的外毛细胞(outer hair cells,ohcs)。基底膜不同部位毛细胞的高度不一,从蜗底至蜗顶其毛细胞逐渐变高。在蜗底毛细胞的静纤毛短,靠近蜗顶静纤毛逐渐变长,所敏感的波长也逐渐变长。这些耳蜗毛细胞的高度以及静纤毛长度的梯度变化,是产生耳蜗波长排列和调波功能的形态学基础。为了探究gm1对顺铂引起的毛细胞损伤是否有预防保护作用,经腹腔注射顺铂后,通过免疫荧光染色检测小鼠耳蜗corti毛细胞。实验结果如图13(a-b)和表1所示,分别统计小鼠左、右耳蜗顶部(apex)、中部(middle)、基底部(base)的有myo7a阳性信号毛细胞数量,结果表明,与对照组相比腹腔注射顺铂3mg/kg引起小鼠耳蜗毛细胞数目减少,而gm1可以预防顺铂导致的毛细胞减少。
[0152]
由于abr测试的波ⅱ接受耳蜗核的神经信号,所以实验统计记录不同组别之间的波ⅱ的反应阈值和潜伏期变化,实验结果如图13(c-h)和表2、3所示,顺铂可以引起小鼠的abr反应阈值和abr反应潜伏期的异常,表现为反应阈值变大和潜伏期延长,而gm1可以预防小鼠听力行为异常。实验结果提示用gm1预处理可以预防顺铂听力损伤。
[0153]
表1-3说明:表1-3均为每组10只小鼠的相关数据,无先后顺序。
[0154]
表1 gm1预防顺铂引起听力损伤-corti器myo7a阳性毛细胞数目
[0155]
[0156]
表2 gm1预防顺铂引起听力损伤-abr行为实验潜伏期(ms)
[0157][0158][0159]
表3 gm1预防顺铂引起听力损伤-abr行为实验听力阈值(db)
[0160][0161][0162]
四、gm1预防奥沙利铂引起的听力损伤-corti毛细胞损伤和abr反应阈异常
[0163]
经腹腔注射奥沙利铂5mg/kg后,通过免疫荧光染色检测小鼠耳蜗corti毛细胞,实验结果如图14(a-b)和表4所示,奥沙利铂引起小鼠耳蜗毛细胞数目减少,而gm1可以预防奥沙利铂导致的毛细胞减少。经abr检测也发现,实验结果如图14(c-h)和表5、6所示,奥沙利铂可以引起小鼠的abr反应阈值和abr反应潜伏期的异常,表现为反应阈值变大和潜伏期延长,而gm1可以预防小鼠听力行为异常。实验结果提示用gm1预处理可以预防奥沙利铂听力损伤。
[0164]
表4-6说明:表4为每组10只小鼠的相关数据,无先后顺序。表5、6为每组8只小鼠的相关数据,无先后顺序。
[0165]
表4 gm1预防奥沙利铂引起听力损伤-corti器myo7a阳性毛细胞数目
[0166][0167]
表5 gm1预防奥沙利铂引起听力损伤-abr行为实验潜伏期(ms)
[0168][0169][0170]
表6 gm1预防奥沙利铂引起听力损伤-abr行为实验听力阈值(db)
[0171][0172][0173]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1