曲安奈德注射液的制备方法与流程
本申请涉及药物制备,特别涉及一种曲安奈德注射液的制备方法。
背景技术:
1、曲安奈德注射液为注射剂(混悬剂),法定药品标准中列有无菌检查项目,严格意义上应完全不含有任何活的微生物,但由于目前检验手段的局限性,绝对无菌的概念不能适用于对整批产品的无菌性评价,因此目前所使用的“无菌”概念,是概率意义上的“无菌”。一批药品的无菌特性只能通过该批药品中活微生物存在的概率低至某个可接受的水平,即无菌保证水平(sterility assurance level,sal)来表征。
2、通常的灭菌方式按工艺的不同分为最终灭菌工艺(sterilizing process)和无菌生产工艺(aseptic processing)。其中最终灭菌工艺是指将完成最终密封的产品进行适当灭菌的工艺,由此生产的无菌制剂称为最终灭菌无菌药品。无菌生产工艺系指在无菌环境条件下,通过无菌操作来生产无菌药品的方法,除菌过滤和无菌生产均属于无菌生产工艺。部分或全部工序采用无菌生产工艺的药品称为非最终灭菌无菌药品。最终灭菌无菌产品的无菌保证水平为残存微生物污染概率≤10-6,非最终灭菌无菌产品的无菌保证水平至少应达到95%置信限下的污染概率<0.1%。由此可见,非最终灭菌无菌产品存在微生物污染的概率远远高于最终灭菌无菌产品。
3、此外,曲安奈德注射液为混悬液,非专利文献1中指出混悬剂不能采用最终灭菌方式,采用静态灭菌可能导致混悬剂结块、挂壁等问题,应采用无菌原料药和无菌工艺进行生产。鉴于上述情况,目前采用无菌工艺是制备曲安奈德注射液的主流方法。例如,专利文献1公开了一种采用灭菌工艺制备醋酸曲安奈德注射液的方法,该方法将混悬液灭菌后再分装到无菌的包装瓶中。专利文献2也公开了一种制备曲安奈德注射液的方法,该方法在搅拌等能使用药物均匀分散的条件下进行灭菌,再无菌分装到无菌的包装瓶中。上述两种方法虽然能够提高无菌保证水平,但均没有采用最终灭菌工艺,达不到最终灭菌无菌产品的无菌保证水平,仍然会给消费者带来较大的风险。
4、现有技术文献:
5、非专利技术文献
6、非专利文献1:pharmaceutical dosage forms and drug delivery(thirdedition:revised and expanded)第389页
7、专利文献
8、专利文献1:cn114206348a
9、专利文献2:us20190269616a1
技术实现思路
1、有鉴于此,本申请的主要目的在于提供一种曲安奈德注射液的制备方法,通过该制备方法能够制得无菌保证水平更高的曲安奈德注射液。
2、为此,本申请提供一种曲安奈德注射液的制备方法,包括以下步骤:
3、(1)将辅料与曲安奈德原料药混合,配制成曲安奈德注射液中间产品,所述曲安奈德注射液中间产品中曲安奈德原料药的体积模式粒度分布满足如下条件:d(0.9)=13.5~24.0μm,d(0.5)=6.0~8.0μm,d(0.1)=1.1~1.4μm,并且所述曲安奈德注射液中间产品的黏度为30.0~50.0mpa·s;
4、(2)将所述曲安奈德注射液中间产品灌装进行密封,得到曲安奈德注射液灭菌前中间产品;以及
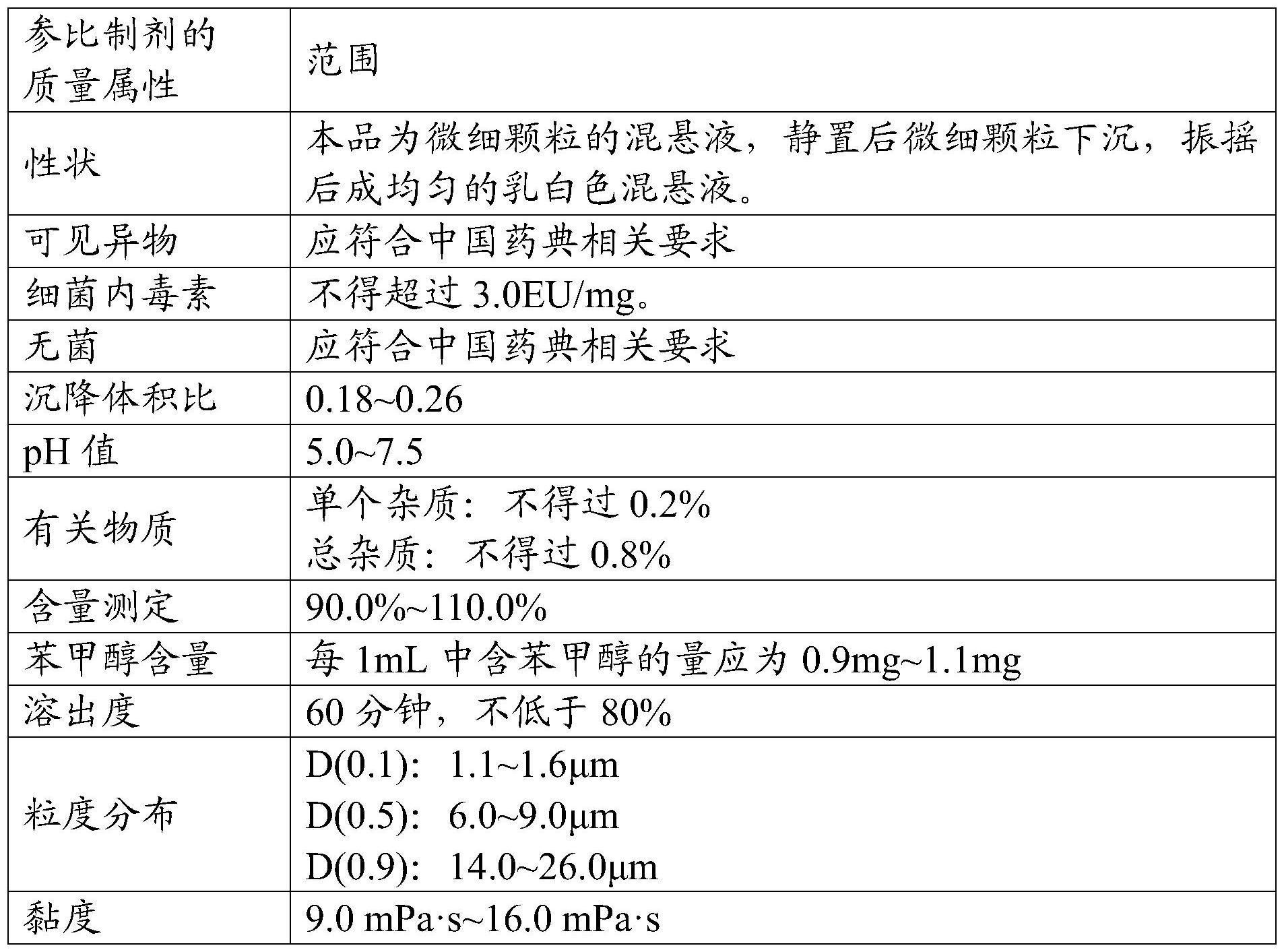
5、(3)将所述曲安奈德注射液灭菌前中间产品进行最终灭菌,最终灭菌后的曲安奈德注射液满足如下条件:体积模式粒度分布为:d(0.9)=14.0~26.0μm,d(0.5)=6.0~9.0μm,d(0.1)=1.1~1.6μm;黏度为9.0~16.0mpa·s。
6、在一些实施方式中,在所述步骤(1)中,所述辅料含有0.60%~0.66%羧甲基纤维素钠、0.038%~0.042%聚山梨酯80、0.94%~1.04%苯甲醇以及0.63%~0.69%氯化钠。
7、在一些实施方式中,所述辅料含有的0.60%~0.66%羧甲基纤维素钠由不同比例高、中、低黏度的羧甲基纤维素钠组成。
8、在一些实施方式中,在所述步骤(1)中,所述曲安奈德原料药采用气流粉碎机进行预处理。
9、在一些实施方式中,在曲安奈德注射液中间产品进行灌装之前,所述制备方法还包括:将所述曲安奈德注射液中间产品进行混悬得到曲安奈德注射液的混悬液。
10、在一些实施方式中,所述混悬时间为60分钟~80分钟。
11、在一些实施方式中,在所述步骤(3)中,所述最终灭菌以静态方式进行。
12、在一些实施方式中,在所述步骤(3)中,所述最终灭菌采用蒸汽灭菌柜或水浴灭菌柜进行。
13、在一些实施方式中,所述最终灭菌条件为121℃、12分钟~30分钟;或者115℃、30分钟~60分钟。
14、本申请提供的曲安奈德注射液的制备方法通过控制曲安奈德原料药及注射液中间产品的粒度分布和黏度范围,对产品进行最终灭菌,由此得到的曲安奈德注射液符合参比制剂的质量属性,并且提高了无菌保证水平。
技术特征:
1.一种曲安奈德注射液的制备方法,其中,包括以下步骤:
2.根据权利要求1所述的制备方法,其中,在所述步骤(1)中,所述辅料含有0.60%~0.66%羧甲基纤维素钠、0.038%~0.042%聚山梨酯80、0.94%~1.04%苯甲醇以及0.63%~0.69%氯化钠。
3.根据权利要求2所述的制备方法,其中,所述辅料含有的0.60%~0.66%羧甲基纤维素钠由不同比例高、中、低黏度的羧甲基纤维素钠组成。
4.根据权利要求1所述的制备方法,其中,在所述步骤(1)中,所述曲安奈德原料药采用气流粉碎机进行预处理。
5.根据权利要求1所述的制备方法,在曲安奈德注射液中间产品进行灌装之前,所述制备方法还包括:将所述曲安奈德注射液中间产品进行混悬得到曲安奈德注射液的混悬液。
6.根据权利要求5所述的制备方法,其中,所述混悬时间为60~80分钟。
7.根据权利要求1所述的制备方法,其中,在所述步骤(3)中,所述最终灭菌以静态方式进行。
8.根据权利要求7所述的制备方法,其中,在所述步骤(3)中,所述最终灭菌采用蒸汽灭菌柜或水浴灭菌柜进行。
9.根据权利要求7所述的制备方法,其中,所述最终灭菌条件为121℃、12分钟~30分钟;或者115℃、30分钟~60分钟。
技术总结
本申请涉及一种曲安奈德注射液最终灭菌工艺的制备方法,其中,包括以下步骤:(1)将辅料与曲安奈德原料药混合,配制成曲安奈德注射液中间产品,所述曲安奈德注射液中间产品中曲安奈德原料药的体积模式粒度分布满足如下条件:D(0.9)=13.5~24.0μm,D(0.5)=6.0~8.0μm,D(0.1)=1.1~1.4μm,并且所述曲安奈德注射液中间产品的黏度为30.0~50.0mPa·s;(2)将所述曲安奈德注射液中间产品灌装进行密封,得到曲安奈德注射液灭菌前中间产品;以及(3)将所述曲安奈德注射液灭菌前中间产品进行最终灭菌,最终灭菌后的曲安奈德注射液满足如下条件:体积模式粒度分布为:D(0.9)=14.0~26.0μm,D(0.5)=6.0~9.0μm,D(0.1)=1.1~1.6μm;黏度为9.0~16.0mPa·s。根据本申请得到的曲安奈德注射液符合参比制剂的质量属性,并且提高了无菌保证水平。
技术研发人员:曹天海,陈昊,郭红梅,陈锡书,李艳娇,丁丽娜,和振伟,文雪莲
受保护的技术使用者:昆明积大制药股份有限公司
技术研发日:
技术公布日:2024/1/11
- 还没有人留言评论。精彩留言会获得点赞!