用于治疗乙型肝炎病毒感染的组合物和方法与流程
背景技术:
1、hbv由以下组成:(i)包含三种相关表面蛋白(乙型肝炎表面抗原,hbsag)和脂质的包膜;以及(ii)包裹病毒dna基因组和dna聚合酶的二十面体核衣壳。hbv衣壳在包装rna前基因组复制复合物期间在受感染细胞的胞质溶胶中形成,并且在通过颗粒内腔中的前基因组的逆转录合成病毒dna基因组期间获得出芽能力。三种hbv包膜蛋白s-hbsag、m-hbsag和l-hbsag在内质网处形成复杂的跨膜折叠,并且形成二硫键连接的同源二聚体和异源二聚体。在细胞内膜处出芽期间,胞质溶胶前s区中的短线性结构域与衣壳表面上的结合位点相互作用。病毒粒子随后分泌到血液中。另外,表面蛋白可以在不存在衣壳的情况下出芽,并且形成相较于病毒粒子还以3-4对数过量分泌的亚病毒颗粒(svp)。高水平hbsag可能耗尽hbsag特异性t细胞反应,并且被提出作为患有慢性乙型肝炎(chb)的患者的病毒免疫耐受性的重要因子(chisari fv、isogawa m、wieland sf,《病理生物学(pathologiebiologie)》,2010;58:258-66)。
2、乙型肝炎病毒导致潜在危及生命的急性和慢性肝脏感染。急性乙型肝炎的特征是有或没有症状、有发生暴发性肝炎的风险的病毒血症(liang tj、block tm、mcmahon bj、ghany mg、guo jt、locarnini s、zoulim f、chang km、lok as,乙型肝炎目前和未来疗法:从发现到治愈(present and future therapies of hepatitis b:from discovery tocure),《肝病学(hepatology)》2015年8月3日.doi:10.1002/hep.28025.[电子版先于印刷版])。尽管自1982年以来就有可用的针对乙型肝炎的有效疫苗,但who报告,仍有2.4亿人慢性感染乙型肝炎,并且每年有超过780 000人死于乙型肝炎并发症。大约三分之一的慢性乙型肝炎(chb)患者患有肝硬化、肝功能衰竭和肝细胞癌,每年导致600,000人死亡(liangtj、block tm、mcmahon bj、ghany mg、urban s、guo jt、locarnini s、zoulim f、chang km、lok as,乙型肝炎目前和未来疗法:从发现到治愈,《肝病学》2015年8月3日.doi:10.1002/hep.28025.[电子版先于印刷版])。
3、对于感染hbv的患者,可能由于共同感染或重复感染hdv而出现严重并发症。根据who,丁型肝炎感染全世界约1500万人。hdv被视为亚病毒卫星,因为其仅可在存在hbv的情况下传播。hdv为已知的最小动物病毒(40nm)之一,由此其基因组仅为1.6kb并且编码s和lhdag。hdv基因组复制所需的所有其它蛋白质(包括rna聚合酶)由宿主细胞提供,并且hdv包膜由hbv提供。当引入到受纳细胞中时,hdv rna基因组复制并且与hdv编码的蛋白质的多个拷贝缔合,以组装核糖核蛋白(rnp)复合物。rnp由hbv包膜蛋白从细胞中导出,所述hbv包膜蛋白能够组装脂蛋白囊泡,所述脂蛋白囊泡在分泌之前出芽到前高尔基体隔室的内腔中。此外,hbv包膜蛋白还提供将hdv靶向到未感染细胞的机制,由此确保hdv传播。
4、由hdv引起的并发症包括在急性感染中发生肝衰竭的可能性更大并迅速发展为肝硬化,在慢性感染中患肝癌的机会增加。结合乙型肝炎病毒,丁型肝炎在所有肝炎感染中的死亡率最高,为20%(fattovich g、giustina g、christensen e、pantalena m、zagni i、realdi g、schalm sw,丁型肝炎病毒感染对代偿期乙型肝硬化发病率和死亡率的影响(influence of hepatitis delta virus infection on morbidity and mortality incompensated cirrhosis type b)《肠道(gut)》.2000年3月;46(3):420-6)。慢性hdv感染的唯一批准疗法为干扰素-α。然而,用干扰素-α治疗hdv相对低效且耐受不良。用干扰素-α治疗导致四分之一的患者在治疗后六个月产生持续的病毒学反应。此外,核苷(酸)类似物(na)已在丁型肝炎中进行广泛测试,但其似乎无效。na与干扰素的组合治疗也被证明是令人失望的(zaigham abbas、minaam abbas,丁型肝炎管理:需要新型治疗选项(managementof hepatitis delta:need for novel therapeutic options)《世界胃肠病学杂志(worldj gastroenterol.)》2015年8月28日;21(32):9461-9465)。因此,需要新治疗选项。
技术实现思路
技术特征:
1.一种治疗受试者的乙型肝炎病毒(hbv)感染的方法,所述方法包括向所述受试者施用单剂量的包含抗体的药物组合物,其中所述抗体包含seq id no:91的重链氨基酸序列和seq id no:93的轻链氨基酸序列,并且
2.一种治疗受试者的乙型肝炎病毒(hbv)感染的方法,所述方法包括向所述受试者施用单剂量的包含抗体的药物组合物,其中所述抗体包含seq id no:91的重链氨基酸序列和seq id no:93的轻链氨基酸序列,并且
3.一种治疗受试者的乙型肝炎病毒(hbv)感染的方法,所述方法包括向所述受试者施用治疗有效量的包含抗体的药物组合物,其中:
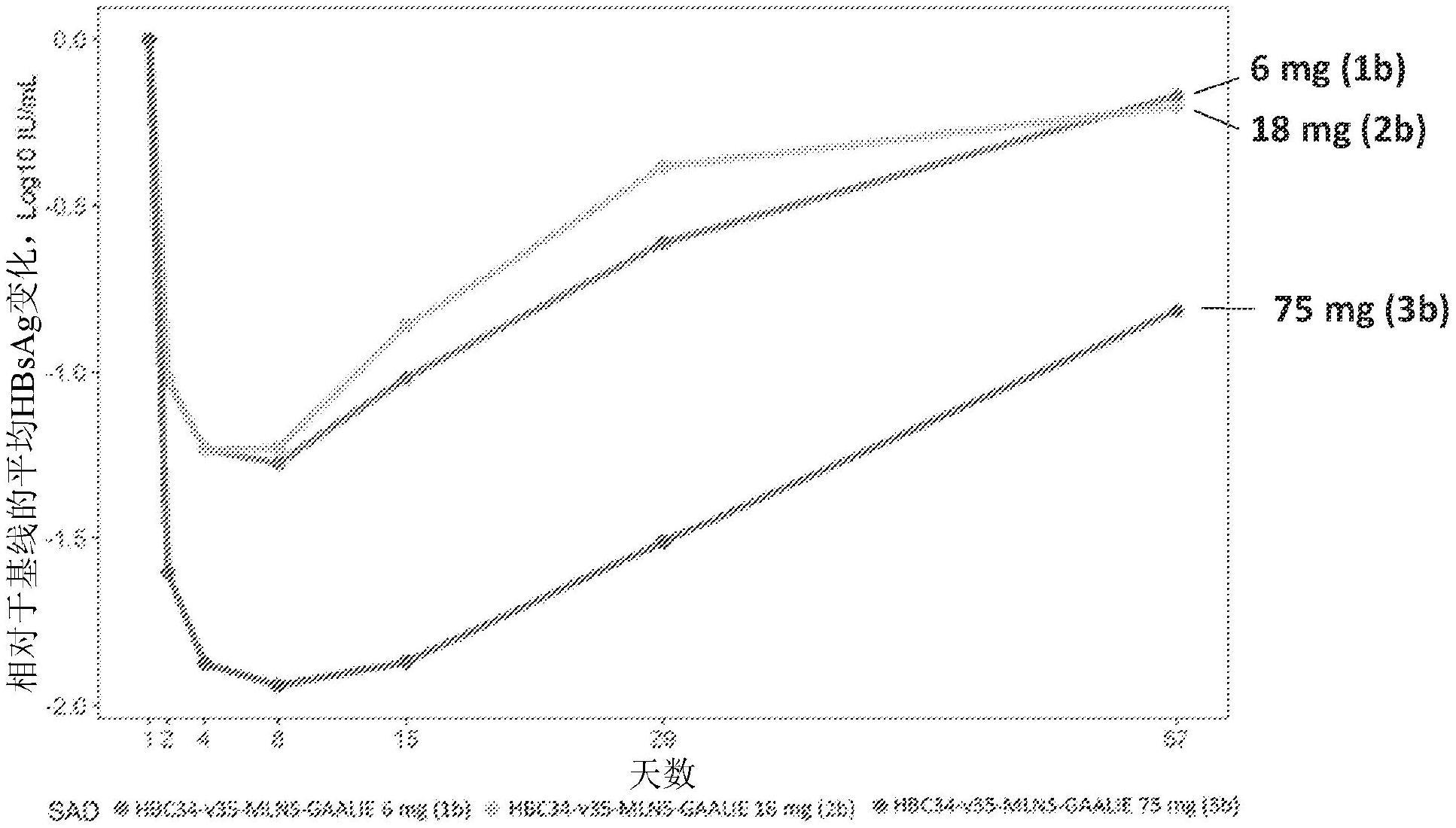
4.根据权利要求1至3中任一项所述的方法,其中在施用单剂量8天内,所述受试者的所述血清hbsag相较于基线减少至少1.0log10 iu/ml。
5.根据权利要求1至4中任一项所述的方法,其中所述药物组合物的所述单剂量包含至少75mg的所述抗体,并且在施用所述单剂量8天内,所述受试者的血清hbsag相较于基线减少至少1.5log10 iu/ml。
6.根据权利要求1至5中任一项所述的方法,其中在施用所述单剂量之后56天,所述受试者的所述血清hbsag相较于基线减少至少0.5log10 iu/ml。
7.根据权利要求1至6中任一项所述的方法,其中所述受试者具有介于300ng/ml与6,000ng/ml之间的所述抗体的cmax。
8.根据权利要求7所述的方法,其中所述受试者具有的所述抗体的所述cmax为至少300ng/ml、400ng/ml、500ng/ml、600ng/ml、700ng/ml、800ng/ml、900ng/ml、1000ng/ml、1100ng/ml、1200ng/ml、1300ng/ml、1400ng/ml、1500ng/ml、1600ng/ml、1700ng/ml、1800ng/ml、1900ng/ml、2000ng/ml、2100ng/ml、2200ng/ml、2300ng/ml、2400ng/ml、2500ng/ml、2600ng/ml、2700ng/ml、2800ng/ml、2900ng/ml、3000ng/ml、3100ng/ml、3200ng/ml、3300ng/ml、3400ng/ml、3500ng/ml、3600ng/ml、3700ng/ml、3800ng/ml、3900ng/ml、4000ng/ml、4100ng/ml、4200ng/ml、4300ng/ml、4400ng/ml、4500ng/ml、4600ng/ml、4700ng/ml、4800ng/ml、4900ng/ml、5000ng/ml、5100ng/ml、5200ng/ml、5300ng/ml、5400ng/ml、5500ng/ml、5600ng/ml、5700ng/ml、5800ng/ml或5900ng/ml。
9.根据权利要求1至8中任一项所述的方法,其中所述药物组合物的所述单剂量包含至多10mg、至多15mg、至多18mg、至多25mg、至多30mg、至多35mg、至多40mg、至多45mg、至多50mg、至多55mg、至多60mg、至多75mg、至多90mg、至多300mg、至多900mg或至多3000mg的所述抗体,
10.根据权利要求1至9中任一项所述的方法,其中所述药物组合物的所述单剂量包含浓度在100mg/ml至200mg/ml的范围内,如100mg/ml、110mg/ml、120mg/ml、130mg/ml、140mg/ml、150mg/ml、160mg/ml、170mg/ml、180mg/ml、190mg/ml或200mg/ml,优选地150mg/ml的所述抗体。
11.根据权利要求1至10中任一项所述的方法,其中所述药物组合物的所述单剂量包含约75mg的所述抗体。
12.根据权利要求1至10中任一项所述的方法,其中所述药物组合物的所述单剂量包含约90mg的所述抗体。
13.根据权利要求1至10中任一项所述的方法,其中所述药物组合物的所述单剂量包含至多300mg的所述抗体。
14.根据权利要求1至10中任一项所述的方法,其中所述药物组合物的所述单剂量包含至多900mg的所述抗体。
15.根据权利要求1至10中任一项所述的方法,其中所述药物组合物的所述单剂量包含至多3,000mg的所述抗体。
16.根据权利要求1至15中任一项所述的方法,其中所述方法包括通过皮下注射施用所述单剂量,任选地其中所述单剂量包含6mg的所述抗体、18mg的所述抗体或75mg的所述抗体,或所述单剂量由6mg的所述抗体、18mg的所述抗体或75mg的所述抗体组成。
17.根据权利要求1至16中任一项所述的方法,其中所述方法包括通过静脉内注射施用所述单剂量。
18.根据权利要求1至17中任一项所述的方法,其中所述药物组合物进一步包含水,任选地usp水。
19.根据权利要求1至18中任一项所述的方法,其中所述药物组合物进一步包含组氨酸,任选地在所述药物组合物中组氨酸浓度范围为10mm至40mm,如20mm。
20.根据权利要求1至19中任一项所述的方法,其中所述药物组合物进一步包含二糖,如蔗糖,任选地5%、6%、7%、8%或9%,优选地约7%(w/v)。
21.根据权利要求1至20中任一项所述的方法,其中所述药物组合物进一步包含表面活性剂或三嵌段共聚物,任选地聚山梨醇酯或泊洛沙姆-188,优选地聚山梨醇酯80(ps80),其中任选地所述聚山梨醇酯或泊洛沙姆-188存在范围为0.01%至0.05%(w/v),优选地0.02%(w/v)。
22.根据权利要求1至21中任一项所述的方法,其中所述药物组合物的ph在5.8至6.2的范围内、在5.9至6.1的范围内,或为5.8、为5.9、为6.0、为6.1或为6.2。
23.根据权利要求22所述的方法,其中所述药物组合物包含:
24.根据权利要求1至23中任一项所述的方法,其中所述受试者是成人。
25.根据权利要求24所述的方法,其中所述受试者的年龄范围为18岁至65岁。
26.根据权利要求1至25中任一项所述的方法,其中所述受试者的体重为40kg至125kg,和/或所述受试者的身体质量指数(bmi)为18至35kg/m2。
27.根据权利要求1至26中任一项所述的方法,其中所述受试者患有慢性hbv感染;所述hbv感染例如由2次血清hbsag、hbv dna和/或hbeag阳性定义,其中所述2次相隔至少6个月。
28.根据权利要求1至27中任一项所述的方法,其中所述受试者未患肝硬化。
29.根据权利要求28所述的方法,其中未患肝硬化由以下确定:
30.根据权利要求1至29中任一项所述的方法,其中在施用所述单剂量之前,所述受试者已经任选地在120天内,进一步任选地在60天内接受核苷(酸)逆转录酶抑制剂(nrti)。
31.根据权利要求30所述的方法,其中所述nrti包含以下中的一种或多种:替诺福韦;替诺福韦二吡呋酯(例如,富马酸替诺福韦二吡呋酯);替诺福韦艾拉酚胺;恩替卡韦;拉米夫定;阿德福韦;以及阿德福韦酯。
32.根据权利要求1至31中任一项所述的方法,其中在施用所述单剂量之前不超过28天,所述受试者的血清hbv dna浓度低于100iu/ml。
33.根据权利要求1至32中任一项所述的方法,其中在施用所述单剂量之前,所述受试者的血清hbsag浓度低于3,000iu/ml,并且任选地在施用所述单剂量之前,所述受试者的血清hbsag浓度低于1,000iu/ml。
34.根据权利要求1至32中任一项所述的方法,其中在施用所述单剂量之前不超过28天,所述受试者的血清hbsag浓度高于或等于3,000iu/ml,并且任选地在施用所述单剂量之前不超过28天,所述受试者的血清hbsag浓度高于或等于1,000iu/ml。
35.根据权利要求1至34中任一项所述的方法,其中在施用所述单剂量之前不超过28天,所述受试者对hbe抗原(hbeag)呈阴性。
36.根据权利要求1至35中任一项所述的方法,其中在施用所述单剂量之前不超过28天,所述受试者对抗hb抗体呈阴性。
37.根据权利要求1至36中任一项所述的方法,其中在施用所述单剂量之前,
38.根据权利要求1至37中任一项所述的方法,其中与在施用所述单剂量之前0天至28天所述受试者的血清hbsag(例如,血清中hbsag的浓度,例如使用雅培公司architect测定确定的)相比,在施用所述单剂量之后56天所述受试者的所述血清hbsag减少>2倍。
39.根据权利要求1至38中任一项所述的方法,其中在施用所述单剂量之后(例如,在施用所述单剂量之后56天),
40.根据权利要求1至39中任一项所述的方法,其中所述受试者是男性。
41.根据权利要求1至39中任一项所述的方法,其中所述受试者是女性。
42.一种包含抗体的药物组合物,其中所述抗体包含seq id no:91的重链氨基酸序列和seq id no:93的轻链氨基酸序列,其中所述药物组合物包含浓度在100mg/ml至200mg/ml的范围内,如100mg/ml、110mg/ml、120mg/ml、130mg/ml、140mg/ml、150mg/ml、160mg/ml、170mg/ml、180mg/ml、190mg/ml或200mg/ml,优选地150mg/ml的所述抗体,并且其中在向有需要的受试者施用所述组合物之后,在施用单剂量之后,至少1000ng/ml的抗体保持与血清hbsag不结合至少14天;并且所述受试者的基线血清hbsag水平低于3000iu/ml。
43.根据权利要求42所述的药物组合物,其中所述药物组合物包含至多6mg、至多18mg、至多75mg、至多90mg、至多300mg、至多900mg或至多3000mg的所述抗体。
44.根据权利要求42或43所述的药物组合物,其中所述药物组合物包含约75mg的所述抗体。
45.根据权利要求42或43所述的药物组合物,其中所述药物组合物包含约90mg的所述抗体。
46.根据权利要求42或43所述的药物组合物,其中所述药物组合物包含约300mg的所述抗体。
47.根据权利要求42或43所述的药物组合物,其中所述药物组合物包含约900mg的所述抗体。
48.根据权利要求42或43所述的药物组合物,其中所述药物组合物包含约3,000mg的所述抗体。
49.根据权利要求42至48中任一项所述的药物组合物,其中所述药物组合物进一步包含水,任选地usp水。
50.根据权利要求42至49中任一项所述的药物组合物,其中所述药物组合物进一步包含组氨酸,任选地在所述药物组合物中组氨酸浓度为10mm至40mm,如20mm。
51.根据权利要求42至50中任一项所述的药物组合物,其中所述药物组合物进一步包含二糖,如蔗糖,任选地5%、6%、7%、8%或9%,优选地约7%(w/v)。
52.根据权利要求42至51中任一项所述的药物组合物,其中所述药物组合物进一步包含表面活性剂,任选地聚山梨醇酯,优选地聚山梨醇酯80(ps80),其中任选地所述聚山梨醇酯存在范围为0.01%至0.05%(w/v),优选地0.02%(w/v)。
53.根据权利要求42至52中任一项所述的药物组合物,其中所述药物组合物的ph在5.8至6.2的范围内、在5.9至6.1的范围内,或为5.8、为5.9、为6.0、为6.1或为6.2。
54.根据权利要求42至53中任一项所述的药物组合物,其中所述药物组合物包含:
55.根据权利要求1至41中任一项所述的方法,其中所述受试者对hbeag呈阴性或对hbeag呈阳性。
技术总结
本公开涉及包含中和乙型肝炎病毒(HBV)感染的抗体的药物组合物。此外,本公开涉及药物组合物在治疗HBV感染中的用途。
技术研发人员:A·阿里兹佩,D·J·克卢捷,M-C·凡盖,S·V·古普塔,菲利普·S·庞,C·H·郑
受保护的技术使用者:维尔生物科技有限公司
技术研发日:
技术公布日:2024/1/16
- 还没有人留言评论。精彩留言会获得点赞!