212Pb-EB-PSMA-617在前列腺癌中的用途的制作方法
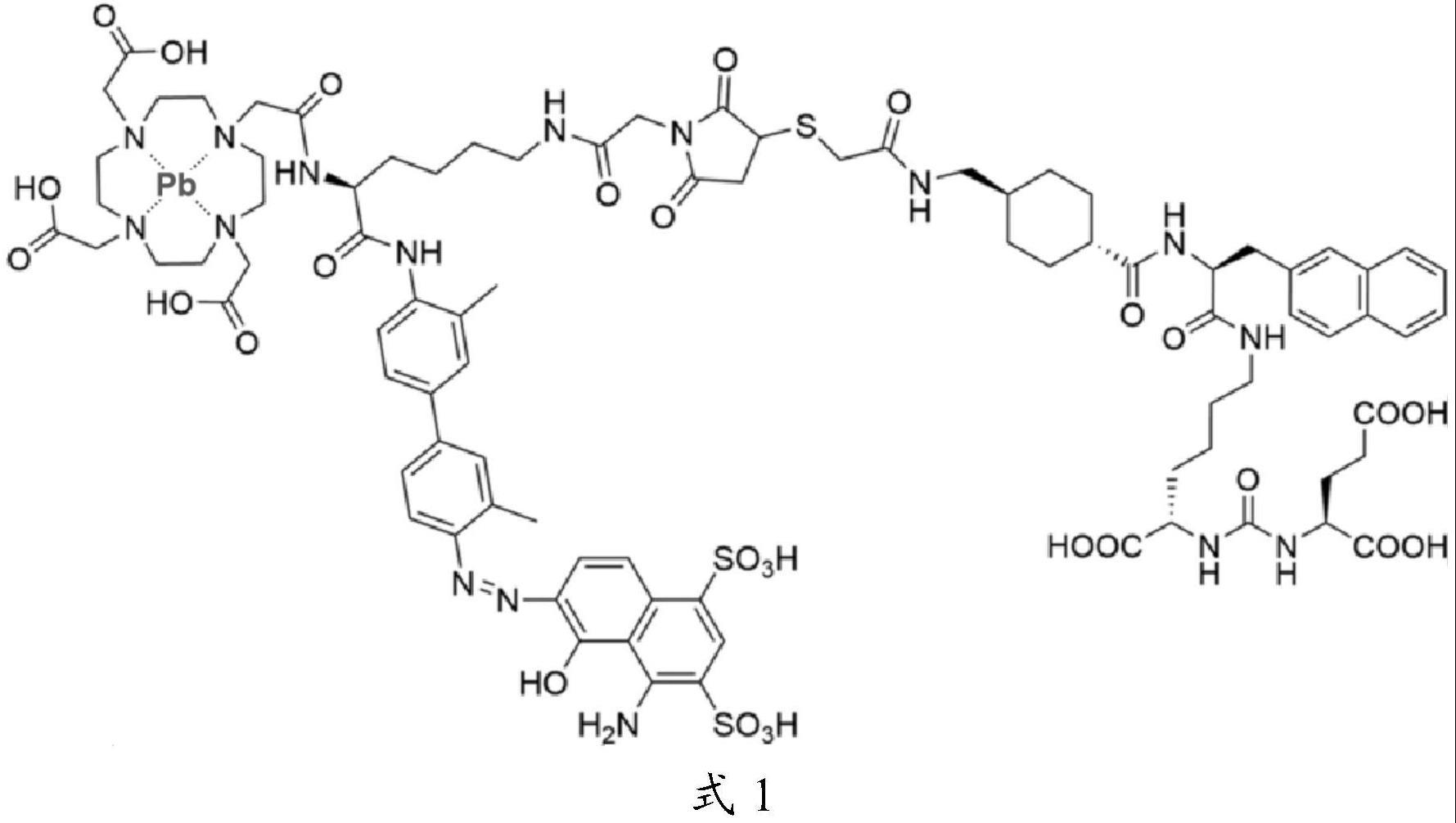
本申请属于药物,具体地,涉及212pb-eb-psma-617在前列腺癌中的用途。
背景技术:
1、前列腺癌是前列腺腺泡细胞异常无序生长的结果,也是男性最常见的恶性肿瘤。
2、前列腺特异性膜抗原(psma)是一种细胞表面糖蛋白,在正常前列腺组织中表达,也在超过80%的前列腺癌患者中高度表达。研究表明psma的表达水平与疾病的分期和疾病进展的风险密切相关。以psma为靶点进行的放射性配体疗法已有近10年的历史。最早使用的是小分子药物131i-mip-1059,60.7%接受治疗的男性前列腺特异抗原(psa)值下降>50%,在骨痛男性中,84.6%表示疼痛完全或中度减轻。随着螯合剂在放射性药物的应用,越来越多的金属元素如177lu,225ac,64cu标记的药物被不断开发提出。其中针对转移性去势抵抗前列腺癌的治疗产品177lu-psma-617已于2022年以商品名pluvicto在美国上市,这是放射治疗药物首次被批准用于此适应症的治疗,具有里程碑意义。这项批准基于一项关键的ⅲ期临床试验,以标准治疗为对照组,pluvicto+标准治疗组的中位总生存期为15.3个月(对照组为11.3个月),pluvicto将患者的死亡风险降低了38%,rpfs(放射影像学无进展生存期)更是达到了8.7个月。临床医生给予该产品极高的评价,表示:“pluvicto的获批是前列腺癌精准治疗发展的一大进步。”
3、除了psma-617外,其他小分子配体也在被广泛研究,以期达到更好的治疗效果,这包括psma-i&t,psma-r2,bispsma,psma-ttm等新的分子结构,以及对psma-617进行结构修饰。18年提出了用伊文氏蓝(eb)修饰的psma-617。eb是一种荧光染料,在白光下呈蓝色,在荧光显微镜绿色激发光下呈鲜红色。如果成药,eb可以通过与血浆白蛋白结合,从而提升药物分子在体内滞留的时间,提升药物在体内的摄取。177lu-eb-psma-617保留了与血清白蛋白的结合以及肿瘤细胞的高内化率。临床前实验表明,与psma-617相比,金属标记的eb-psma-617表现出更长的血液半衰期,从而延长了与psma结合的时间窗。单剂量1.85mbq的177lu-eb-psma-617足以根除小鼠体内已形成的pmsa+肿瘤。
4、相较于仅发射β粒子的177lu而言,能发射α粒子的核素也在被广泛关注。α辐射在组织中的短射程(<0.1毫米),仅对应于几个细胞直径,可以选择性地杀死癌细胞并减少对周围健康细胞的副作用。同时,α的高能量粒子(可达数mev)及其高线性能量转移(>100kev/μm)可通过dna双链断裂导致有效的细胞杀伤,这在很大程度上与细胞周期和氧合状态无关。因此靶向α标记的psma配体的疗法(tat)是一种很有前途的mcrpc治疗方法,但是只有少数α核素的半衰期在几小时到几天之间,适合常规临床使用。212pb可通过双功能螯合剂dota或者p-scn-bn-tcmc与其他配体链接。现有的临床前数据,使用212pb标记的psma靶向小分子配体治疗前列腺癌有良好的前景。
5、但是,目前尚未有报道212pb-eb-psma-617可以用于psma阳性的前列腺癌的治疗。
技术实现思路
1、本申请的目的在于提供212pb-eb-psma-617在psma阳性的前列腺癌中的应用。本申请中pc3-pip荷瘤鼠静脉注射给予不同剂量的212pb-eb-psma-617后,通过游标卡尺测量肿瘤大小,根据肿瘤体积绘制肿瘤生长曲线,考察不同剂量212pb-eb-psma-617对pc3-pip荷瘤鼠的抗肿瘤药效。
2、具体来说,本申请涉及如下方面:
3、1.212pb-eb-psma-617在制备治疗前列腺癌的药物中的用途。
4、2.根据项1所述的用途,其中212pb-eb-psma-617的单剂量为0.001mci-5mci/每kg受试者体重/次。
5、3.根据项2所述的用途,其中212pb-eb-psma-617的单剂量为0.001mci-100mci/受试者/次。
6、4、根据项1-3中任一项所述的用途,其中212pb-eb-psma-617的单剂量体积为1ml-30ml/受试者/次,212pb-eb-psma-617的施用浓度为1-30mci/ml。
7、5、根据项1-4中任一项所述的用途,其中212pb-eb-psma-617的施用频次为每3-16周一次。
8、6、根据项1-5中任一项所述的用途,其中212pb-eb-psma-617的单剂提供的总剂量为0.001mci-1.2ci/受试者。
9、7、根据项1-6中任一项所述的用途,其中212pb-eb-psma-617的单剂提供的总体积为1ml-300ml/受试者。
10、8、根据项1-7中任一项所述的用途,其中212pb-eb-psma-617的施用方式为静脉注射。
11、9、根据项1-8中任一项所述的用途,其中,所述前列腺癌是psma阳性的前列腺癌。
12、10、一种用于治疗前列腺癌的药物组合物,其包括212pb-eb-psma-617。
13、在本申请中,eb-psma-617可实现212pb标记,标记后经radio-itlc检测质控合格,放射性化学纯度(以下简称rcp)为99.68%;212pb-eb-psma-617在2~8℃条件下放置2h后rcp为98.93%,体外稳定性符合试验要求。试验期间,低剂量、中剂量和高剂量组均具有抑制肿瘤增殖的作用,其中高剂量组同剂量177lu-psma-617对比组相比,具有更好的抗肿瘤药效。
技术特征:
1.212pb-eb-psma-617在制备治疗前列腺癌的药物中的用途。
2.根据权利要求1所述的用途,其中212pb-eb-psma-617的单剂量为0.001mci-5mci/每kg受试者体重/次。
3.根据权利要求2所述的用途,其中212pb-eb-psma-617的单剂量为0.001mci-100mci/受试者/次。
4.根据权利要求1-3中任一项所述的用途,其中212pb-eb-psma-617的单剂量体积为1ml-30ml/受试者/次,212pb-eb-psma-617的施用浓度为1-30mci/ml。
5.根据权利要求1-4中任一项所述的用途,其中212pb-eb-psma-617的施用频次为每3-16周一次。
6.根据权利要求1-5中任一项所述的用途,其中212pb-eb-psma-617的单剂提供的总剂量为0.001mci-1.2ci/受试者。
7.根据权利要求1-6中任一项所述的用途,其中212pb-eb-psma-617的单剂提供的总体积为1ml-300ml/受试者。
8.根据权利要求1-7中任一项所述的用途,其中212pb-eb-psma-617的施用方式为静脉注射。
9.根据权利要求1-8中任一项所述的用途,其中,所述前列腺癌是psma阳性的前列腺癌。
10.一种用于治疗前列腺癌的药物组合物,其包括212pb-eb-psma-617。
技术总结
本申请涉及212Pb‑EB‑PSMA‑617在治疗前列腺癌中的应用,最终动物体重有增加,抗肿瘤药效有效。
技术研发人员:沈笛,白戈,徐新盛
受保护的技术使用者:北京先通国际医药科技股份有限公司
技术研发日:
技术公布日:2024/1/15
- 还没有人留言评论。精彩留言会获得点赞!