基于自体活化T细胞膜的药物递送纳米囊泡及制备方法与应用
本申请涉及生物,具体涉及基于自体活化t细胞膜的药物递送纳米囊泡及制备方法与应用。
背景技术:
1、生物大分子药物是指利用现代生物技术生产的源自生物体内或体外合成用于疾病的诊断、预防或治疗的生物大分子,主要包括蛋白质、多肽、抗体、核酸等,这些生物大分子药物通过生物合成而成,具有独特的多维结构,在生物生命活动中发挥了重要作用。生物大分子药物具有靶向性强,特异性高,效能高,在临床治疗中表现出疗效确切,毒副作用小等优势,已逐渐成为药物发展的重要研究方向。
2、然而,相较于小分子药物而言,生物大分子药物的尺寸较大大,分子量大,表面带有负电荷或正电荷,难以跨过细胞膜进入细胞内部进而发挥作用。为实现生物大分子药物的高效递送,人们开发了诸多生物大分子药物递送载体,例如脂质体、阳离子高分子、纳米颗粒等。但这些载体存在递送效率不高和安全隐患等问题。如何在保证安全性的同时提高生物大分子药物的递送效果,使生物大分子药物成功地与体内多种生物屏障相容,实现高效递送进入细胞以发挥作用,仍是生物大分子药物递送系统研究的难点和发展方向。
3、生物大分子药物已成为21世纪药物研发中最具发展前景的领域之一,在重大疾病治疗中已取得重大进展,但在体内递送方面仍存在诸多亟待解决的难题和障碍。近年来,通过研制各种生物大分子药物新剂型,在解决上述问题方面取得了一定进展,但临床使用效果不佳。鉴于生物大分子药物的重要性及对国家整体医药发展的带动性,生物大分子药物体内高效传递系统的构建研究对于解决生物大分子药物目前存在的瓶颈问题并实现产业化具有重大意义。构建多功能性与协同作用的生物大分子药物高效递送系统将是今后生物大分子药物发展的重要方向。
4、脂质纳米颗粒(lnps)是目前临床应用最成熟的药物载体,有望改变现有大分子药物治疗困境,虽然人们已经做出许多努力来提高脂质纳米颗粒(lnps)中所用阳离子脂质的功效,但其安全性问题不容忽视。阳离子脂质在递送核酸方面很早就取得了成功,但由于存在安全风险,它们在治疗方面的适用性大打折扣,临床应用受限。
技术实现思路
1、鉴于以上所述现有技术的缺点,本发明提供一种基于自体活化t细胞膜的药物递送纳米囊泡及制备方法与应用。
2、为实现上述目的,本申请的方案如下:
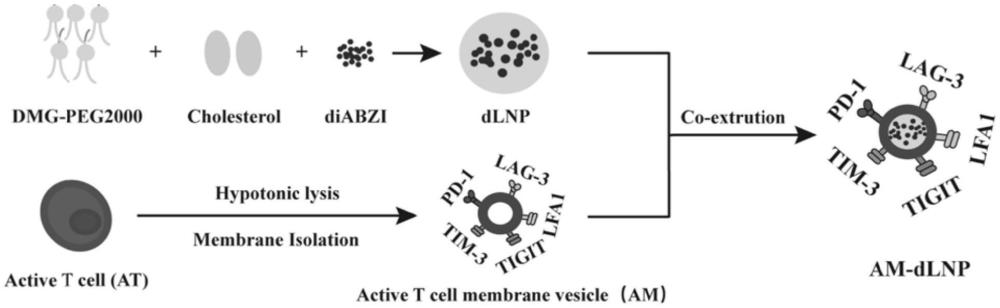
3、第一个方面,本发明提供一种药物递送纳米囊泡,所述药物递送纳米囊泡包括:阳离子脂质型体纳米颗粒、包埋于所述阳离子脂质型体纳米颗粒内部的二氨基苯并咪唑(英文简称diabzi,是一种sting激动剂)以及位于所述阳离子脂质型体纳米颗粒外表面的自体活化t细胞膜。
4、可选地,所述阳离子脂质型体纳米颗粒的平均直径为100-200nm。
5、可选地,所述阳离子脂质型体纳米颗粒的电动电位(即zeta电位)为-10~-25mv。
6、可选地,所述阳离子脂质型体纳米颗粒的包封率为55%-70%。
7、可选地,所述自体活化t细胞膜由balb/c小鼠脾脏或外周血分离的原代t细胞经活化、提取制得。
8、第二个方面,本发明还提供如上所述药物递送纳米囊泡的制备方法,包括以下步骤:
9、s1.活化原代t细胞,并提取膜碎片,得到活化t细胞膜;
10、s2.将所述二氨基苯并咪唑包埋于所述阳离子脂质型体纳米颗粒内部,得到包埋有二氨基苯并咪唑的阳离子脂质型体纳米颗粒;
11、s3.将所述活化t细胞膜涂敷于所述包埋有二氨基苯并咪唑的阳离子脂质型体纳米颗粒外表面,制得所述药物递送纳米囊泡。
12、可选地,步骤s1中,活化原代t细胞包括:
13、采用单克隆抗体活化原代t细胞,筛选表达黏附分子和免疫检查点的活化t细胞;
14、可选地,步骤s1中,提取膜碎片包括:
15、用渗裂解液裂解所述活化t细胞,然后再超声破碎以将所述活化t细胞的细胞膜破碎成膜碎片,离心,得到所述活化t细胞膜。
16、可选地,步骤s2中,采用共孵育法将所述二氨基苯并咪唑包埋于所述阳离子脂质型体纳米颗粒内部。
17、可选地,步骤s3中,采用挤出法将所述活化t细胞膜涂敷于所述包埋有二氨基苯并咪唑的阳离子脂质型体纳米颗粒外表面。
18、第三个方面,本发明还提供如上所述药物递送纳米囊泡和/或根据如上所述制备方法制得的药物递送纳米囊泡在制备抗肿瘤药物中的应用。
19、本发明的有益效果:
20、本发明通过研究不同活化阶段原代t细胞膜的分子表达,筛选出表达多种黏附分子和免疫检查点的活化t细胞膜,保证了载体的有效性、稳定性和利用度。
21、本发明的药物递送纳米囊泡高表达免疫检查点蛋白pd-1、tim-3、lag-3和tigit,实施有效的联合给药,递送二氨基苯并咪唑到高表达免疫检查点配体pd-l1、gal-3、gal-9及cd155的肿瘤细胞上发挥作用,可实现药物的有效富集,进而提高药物的生物利用度。
22、本发明中,通过sting激动剂二氨基苯并咪唑激活先天性和适应性免疫应答,增强肿瘤细胞和dc细胞表达分泌ifn-β,诱导dc成熟,促进t细胞浸润肿瘤;同时表达多种免疫检查点的活化t细胞膜竞争性解除多种免疫检查点的抑制效应,增强t细胞的杀伤肿瘤能力,实现协同抗肿瘤的疗效。
23、本发明将自体活化t细胞膜用于药物递送系统,生物安全性高,表达多种黏附分子和免疫抑制分子,能竞争性结合免疫检查点配体,解除免疫检查点对t细胞功能的抑制。此外,具备多靶点靶向性,能更有效的向肿瘤部位聚集,提高药物生物利用度,具有安全、增效、减毒的特点,以期为以肿瘤免疫微环境为靶点的肿瘤免疫治疗相关基础研究和技术研发奠定基础,提供理论参考。
技术特征:
1.一种药物递送纳米囊泡,其特征在于,所述药物递送纳米囊泡包括:阳离子脂质型体纳米颗粒、包埋于所述阳离子脂质型体纳米颗粒内部的二氨基苯并咪唑以及位于所述阳离子脂质型体纳米颗粒外表面的自体活化t细胞膜。
2.如权利要求1所述的药物递送纳米囊泡,其特征在于,所述阳离子脂质型体纳米颗粒的平均直径为100-200nm。
3.如权利要求1所述的药物递送纳米囊泡,其特征在于,所述阳离子脂质型体纳米颗粒的电动电位为-10~-25mv。
4.如权利要求1所述的药物递送纳米囊泡,其特征在于,所述阳离子脂质型体纳米颗粒的包封率为55%-70%。
5.如权利要求1所述的药物递送纳米囊泡,其特征在于,所述活化t细胞膜由balb/c小鼠脾脏或外周血分离的原代t细胞经活化后提取制得。
6.权利要求1-5任一项所述药物递送纳米囊泡的制备方法,其特征在于,包括以下步骤:
7.如权利要求6所述药物递送纳米囊泡的制备方法,其特征在于,步骤s1中,提取膜碎片包括:
8.如权利要求6所述药物递送纳米囊泡的制备方法,其特征在于,步骤s2中,采用共孵育法将所述二氨基苯并咪唑包埋于所述阳离子脂质型体纳米颗粒内部。
9.如权利要求6所述药物递送纳米囊泡的制备方法,其特征在于,步骤s3中,采用挤出法将所述活化t细胞膜涂敷于所述包埋有二氨基苯并咪唑的阳离子脂质型体纳米颗粒的外表面。
10.权利要求1-5任一项所述药物递送纳米囊泡和/或根据权利要求6-9任一项所述制备方法制得的药物递送纳米囊泡在制备抗肿瘤药物中的应用。
技术总结
本申请涉及生物技术领域,具体涉及基于自体活化T细胞膜的药物递送纳米囊泡及制备方法与应用。该药物递送纳米囊泡包括:阳离子脂质型体纳米颗粒、包埋于阳离子脂质型体纳米颗粒内部的二氨基苯并咪唑以及位于阳离子脂质型体纳米颗粒外表面的原代活化T细胞膜。本发明中,通过STING激动剂二氨基苯并咪唑(diABZI)激活先天性和适应性免疫应答,增强肿瘤细胞和DC细胞表达分泌IFN‑β,诱导DC成熟,促进T细胞浸润肿瘤;同时表达多种免疫检查点的活化T细胞膜竞争性解除多种免疫检查点的抑制效应,增强T细胞的杀伤肿瘤能力,实现协同抗肿瘤的疗效。
技术研发人员:程伟,杜丽,张晓莹
受保护的技术使用者:重庆医科大学附属第一医院
技术研发日:
技术公布日:2024/12/10
- 还没有人留言评论。精彩留言会获得点赞!