一种碱性蛋白酶及其编码基因和它们的应用的制作方法
本发明涉及基因工程领域,具体地,本发明涉及一种碱性蛋白酶及其编码基因和它们的应用。
背景技术:
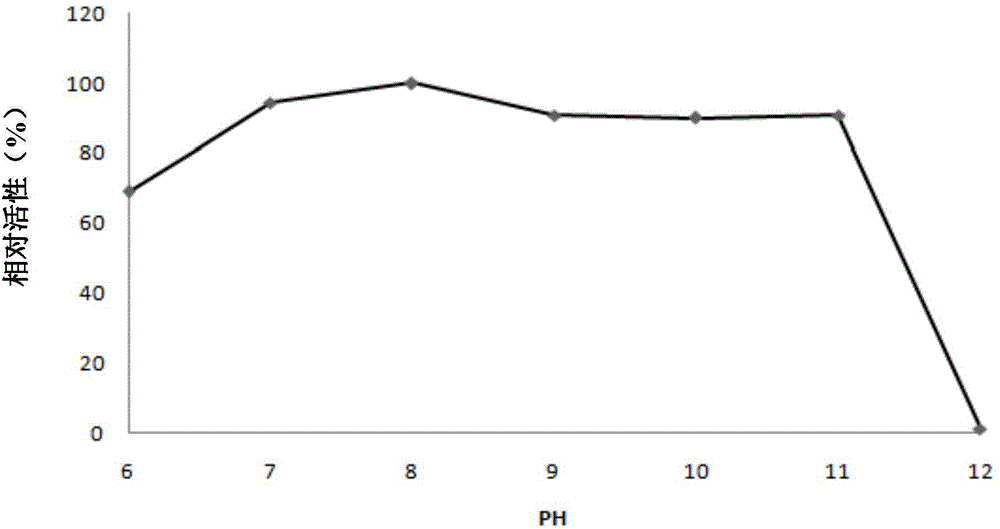
:碱性蛋白酶(AlkalineProtease)是指在碱性条件下水解蛋白质肽键的一类蛋白酶的总称,其最适pH多为9-11,属于内肽酶中的丝氨酸蛋白水解酶类,广泛存在于动、植物及微生物生物体中,在猪的胰脏中最早被发现。碱性蛋白酶是一类非常重要的工业用酶,主要应用于加酶洗涤剂、制革、丝绸、饲料、医药、食品、环保等领域,特别是在制革工业的浸水、脱毛、浸灰中具有重要的作用。皮革业是我国轻工业的重要支柱产业,我国的皮革已经成为国际皮革市场的重要部分,我国的皮革和皮革制品产量分别占世界总产量的10%和11%。然而制革业是污染严重的产业,每年排放制革废水1.5亿吨,仅次于造纸废水,约占全国工业废水总排放量的0.3%。而目前的废水处理方式主要为未处理直接排放或末端处理。通过在制革过程的浸水、脱毛、浸灰过程中添加碱性蛋白酶以减少或替代传统工艺过程中用到的石灰和硫化钠,不仅可以改善皮革的质量和增加产皮率而且节能减排,绿色高效。目前,碱性蛋白酶主要产生菌种有芽孢杆菌属的细菌和链霉菌(如灰色链霉菌、费氏链霉菌等)以及霉菌。目前用于工业化生产的碱性蛋白酶主要是芽孢杆菌野生菌发酵生产而来。虽然多个碱性蛋白酶基因已被克隆和表达,但仍然面临着在工业应用的碱性条件下酶活性低和稳定性差、表达量低 等问题,无法广泛用于工业化生产。因此筛选高活性和稳定性高的碱性蛋白酶,并构建高产工程菌株是提高碱性蛋白酶工业化应用水平的重点。技术实现要素:本发明的目的是克服现有技术的不足,提供一种活性高稳定性强的碱性蛋白酶及其编码基因和它们的应用。为了实现上述目的,第一方面,本发明提供了一种(a)或(b)所示的碱性蛋白酶:(a)由SEQIDNO:1所示的氨基酸序列组成的碱性蛋白酶;(b)SEQIDNO:1所示的氨基酸序列经过取代、缺失或添加一个或几个氨基酸且酶活性不变的由(a)衍生的蛋白质,或者,在SEQIDNO:1的氨基末端和/或羧基末端连接有标签的氨基酸序列所示的蛋白质。第二方面,本发明提供了一种能够编码第一方面所述的碱性蛋白酶的基因。第三方面,本发明提供了一种含有第二方面所述的基因的重组载体。第四方面,本发明提供了一种含有第三方面所述的重组载体的重组菌株。第五方面,本发明提供了一种制备碱性蛋白酶的方法,该方法包括:(1)培养第四方面所述的重组菌株,诱导编码碱性蛋白酶的基因的表达;(2)分离提纯所表达的碱性蛋白酶。第六方面,本发明提供了一种用于水解蛋白质的组合物,该组合物含有第一方面所述的碱性蛋白酶作为活性成分,以所述组合物的总重量为基准,所述碱性蛋白酶的含量为10-90%重量。第七方面,本发明提供了一种第一方面所述的碱性蛋白酶、第二方面所述的基因、第三方面所述的重组载体、第四方面所述的重组菌株以及第六方 面所述的组合物在水解蛋白质中的应用。本发明的碱性蛋白酶的最适反应pH值为10,最适温度60℃,在较宽的pH条件下和65℃能表现出较高的活性,稳定性强;对酪蛋白的最高比活力为35500U/mg,对角蛋白的最高比活力为14200U/mg,对羽毛粉的最高比活性为7100U/mg。本发明所提供的碱性蛋白酶可作为一种新型的酶制剂,在洗涤剂、制革、丝绸、饲料、医药、食品、环保以及生物技术等领域都有应用价值。本发明的其它特征和优点将在随后的具体实施方式部分予以详细说明。附图说明附图是用来提供对本发明的进一步理解,并且构成说明书的一部分,与下面的具体实施方式一起用于解释本发明,但并不构成对本发明的限制。在附图中:图1为本发明碱性蛋白酶的最适pH曲线;图2为本发明碱性蛋白酶的pH稳定曲线;图3为本发明碱性果蛋白酶的最适温度曲线;图4为本发明碱性蛋白酶在不同温度下保温30min的热稳定曲线;图5为本发明碱性蛋白酶受不同金属离子影响的曲线;图6为本发明碱性蛋白酶受表面活性剂和抑制剂影响的曲线。具体实施方式以下对本发明的具体实施方式进行详细说明。应当理解的是,此处所描述的具体实施方式仅用于说明和解释本发明,并不用于限制本发明。在本发明中,在未作相反说明的情况下,使用的术语“酶活力”的大小即酶含量的多少,用酶活力单位表示,即酶单位(U),本发明中酶单位的定 义是:在60℃和pH10的条件下,每分钟水解酪蛋白产生1微克酪氨酸所需的酶量为一个酶活力单位,即1U=1μg/min;“酶的比活力”代表每单位质量蛋白质的催化能力,能够反应酶活性大小,其值越大,表明酶活性越高,比活力的计算公式为:比活力(U/mg)=总酶活力单位数/mg总蛋白。本发明提供的碱性蛋白酶属于丝氨酸蛋白酶,具体为(a)或(b):(a)由SEQIDNO:1所示的氨基酸序列组成的碱性蛋白酶;(b)SEQIDNO:1所示的氨基酸序列经过取代、缺失或添加一个或几个氨基酸且酶活性不变的由(a)衍生的蛋白质,或者,在SEQIDNO:1的氨基末端和/或羧基末端连接有标签的氨基酸序列所示的蛋白质。其中,酶活性不变是指在相同的测定条件下,由(a)衍生的蛋白质的酶活力与(a)的酶活力之间的百分比(相对活性)不低于95%(或96%,或97%,或98%,或99%,或100%)。组成蛋白质的20种氨基酸残基,按照侧链极性可以分成四类:1、非极性的氨基酸:丙氨酸(Ala)、缬氨酸(Val)、亮氨酸(Leu)、异亮氨酸(Ile)、甲硫氨酸(Met)、苯丙氨酸(Phe)、色氨酸(Trp)和脯氨酸(Pro);2、极性不带电荷的氨基酸:甘氨酸(Gly)、丝氨酸(Ser)、苏氨酸(Thr)、半胱氨酸(Cys)、天冬氨酸(Asn)、谷氨酰胺(Gln)和酪氨酸(Tyr);3、带正电荷的氨基酸:精氨酸(Arg)、赖氨酸(Lys)和组氨酸(His);4、带负电荷的氨基酸:天冬氨酸(Asp)和谷氨酸(Glu)(参见“生物化学”(第二版)上册,沈同、王镜岩,第82-83页,高等教育出版社,1990年12月)。蛋白质中如果发生同属一个类别的氨基酸残基取代,例如由Arg取代Lys或由Leu取代Ile,所述残基在蛋白质结构域中所起的作用(比如提供正电荷或形成疏水囊袋结构的作用)没有改变,因此对蛋白质的立体结构并不会产生影响,因此仍然可以实现蛋白的功能。所述同属一个类别的氨基酸残基取代可以发生在上述碱性蛋白酶的任意一个氨基酸残基位置上。如前所述,本发明提供的碱性蛋白酶还可以进行修饰或突变,得到衍生的蛋白质。本发明所述“衍生的蛋白质”指与具有上述氨基酸序列的碱性蛋白酶具有氨基酸序列上的差异,也可以有不影响序列的修饰形式上的差异,或者兼而有之。这些蛋白包括天然或诱导的遗传变异体。所述诱导变异体可以通过各种技术得到,如辐射或诱变剂等产生的随机突变,也可以通过如定点突变法或其他已知分子生物学的技术。所述“衍生的蛋白质”还包括具有天然L型氨基酸的残基的类似物(如D型氨基酸),以及具有非天然存在的或合成的氨基酸(如β-氨基酸、γ-氨基酸等)的类似物。修饰(通常不改变一级结构,即不改变氨基酸序列)形式包括:体内或体外的蛋白的化学衍生形式如乙酰化或羧基化。修饰还包括糖基化,如那些在蛋白的合成和加工中或进一步加工步骤中进行糖基化修饰而产生的蛋白。这种修饰可以通过将蛋白暴露于进行糖基化的酶(如哺乳动物的糖基化酶或去糖基化酶)而完成。修饰形式还包括具有磷酸化氨基酸残基(如磷酸酪氨酸,磷酸丝氨酸,磷酸苏氨酸)的序列。还包括被修饰从而提高了其抗蛋白水解性能或优化了溶解性能的蛋白。为了方便纯化,还可以采用本领域常见的标签对(a)进行添加修饰,举例来说,(b)可以通过在(a)的氨基末端和/或羧基末端连接下表1所示的标签(如Poly-Arg、Poly-His、FLAG、Strep-tagⅡ和c-myc中的至少一种)而获得。所述标签不会影响本发明的碱性蛋白酶的活性,在实际应用过程中,可以根据需求选择是否添加标签。表1标签残基数氨基酸序列Poly-Arg5-6(通常为5个)RRRRR(SEQIDNO:3)Poly-His2-10(通常为6个)HHHHHH(SEQIDNO:4)FLAG8DYKDDDDK(SEQIDNO:5)Strep-tagⅡ8WSHPQFEK(SEQIDNO:6)c-myc10EQKLISEEDL(SEQIDNO:7)上述碱性蛋白酶可以通过人工合成得到,也可以先合成其编码基因,再通过生物表达获得。本发明还提供了能够编码上述碱性蛋白酶的基因。相应地,所述基因可以为如下的(1)或(2):(1)核苷酸序列如SEQIDNO:2所示的DNA分子;(2)在严格条件下与(1)限定的DNA序列杂交且编码的碱性蛋白酶的酶活性不变的DNA分子。其中,所述严格条件可以为:在6×SCC,0.5%SDS的溶液中,在65℃下杂交,然后用2×SCC,0.1%SDS和1×SCC,0.1%SDS各洗膜一次。酶活性不变是指在相同的测定条件下,由(2)编码的蛋白质的酶活力与(1)编码的蛋白质的酶活力之间的百分比(相对活性)不低于95%(或96%,或97%,或98%,或99%,或100%)。本领域公知,组成蛋白质的20种不同的氨基酸中,除Met(ATG)或Trp(TGG)分别为单一密码子编码外,其他18种氨基酸分别由2-6个密码子编码(Sambrook等,分子克隆,冷泉港实验室出版社,纽约,美国,第二版,1989,见950页附录D)。即由于遗传密码子的简并性,决定一个氨基酸的密码子大多不止一个,三联体密码子中第三个核苷酸的置换,往往不 会改变氨基酸的组成,因此编码相同蛋白的基因的核苷酸序列可以不同。本领域人员根据公知的密码子表,从本发明公开的氨基酸序列,以及由所述氨基酸序列得到的碱性蛋白酶活性不变的氨基酸序列,完全可以推导出能够编码它们的基因的核苷酸序列,通过生物学方法(如PCR方法、突变方法)或化学合成方法得到所述核苷酸序列,因此该部分核苷酸序列都应该包括在本发明范围内。相反,利用本文公开的DNA序列,也可以通过本领域公知的方法,例如Sambrook等的方法(分子克隆,冷泉港实验室出版社,纽约,美国,第二版,1989)进行,通过修改本发明提供的核酸序列,得到与本发明所述碱性蛋白酶活性一致的氨基酸序列。优选地,所述基因的核苷酸序列如SEQIDNO:2所示。如上所述,相应地,核苷酸序列的5'端和/或3'端还可以连接有上表1所示的标签的编码序列。本发明提供的核苷酸序列通常可以用聚合酶链式反应(PCR)扩增法、重组法、或人工合成的方法获得。例如,本领域技术人员根据本发明所提供的核苷酸序列,可以很容易得到模板和引物,利用PCR进行扩增获得有关序列。一旦获得了有关核苷酸序列,就可以用重组法大批量的获得有关氨基酸序列。通常将所得核苷酸序列克隆入载体,再转入基因工程菌中,然后通过常规的方法从增殖后的宿主细胞分离得到有关核苷酸序列。此外,还可用公知的人工化学合成的方法来合成有关核苷酸序列。本发明提供的重组载体含有本发明提供的基因。所述重组载体优选为重组质粒pET28a-AprA。重组载体中使用的“载体”可选用本领域已知的各种载体,如市售的各种质粒、粘粒、噬菌体及反转录病毒等,本发明优选pET28a质粒。重组载体构建可采用能够在载体多克隆位点具有切割位点的各种核酸内切酶(如对于pUC18,可用SalⅠ、BamH Ⅰ、EcoRⅠ等;对于pET28a,可用NdeⅠ、NheⅠ、EcoRⅠ、BamH、NcoI、Xho、HindⅢ等)进行酶切获得线性质粒,与采用相同核酸内切酶切割的基因片段连接,获得重组质粒。本发明优选采用NcoI和XhoI双酶切pET28a及与其连接的基因片段,经连接酶连接,构建得到重组载体pET28a-AprA。本发明提供的重组菌株含有本发明提供的重组载体。可以通过本领域常规的方法将所述重组载体转化、转导或者转染到宿主细胞(菌株)中,如氯化钙法化学转化、高压电击转化,优选电击转化。所述宿主细胞可以为原核细胞或真核细胞,优选为杆状菌(如大肠杆菌(Escherichiacoli)或枯草芽孢杆菌(Bacillussubtilis))或酵母菌(如巴斯德毕赤酵母(Pichiapastoris)或酿酒酵母(Saccharomycescerevisiae)),更优选地,所述宿主细胞为大肠杆菌(如大肠杆菌BL21(DE3)PLys或大肠杆菌DH5α)。本发明提供的制备碱性蛋白酶的方法包括:培养本发明提供的重组菌株,诱导编码碱性蛋白酶的基因的表达;分离提纯所表达的碱性蛋白酶。所述培养条件为常规的培养条件,如使用LB培养基(溶剂为水,溶质及其终浓度分别为:Tryptone10g/L,酵母提取物5g/L,NaCl10g/L),在35-37℃下培养至OD600为0.6。由于本发明提供的重组菌株中含有编码碱性蛋白酶的基因,其可以高效地表达碱性蛋白酶。培养后经过分离提纯,即可得到高纯度的碱性蛋白酶。可以采用本领域技术人员公知的方法进行分离提纯(如,往培养液中加入异丙基-β-d-硫代半乳糖苷(IPTG)至终浓度为0.2mM,20℃继续振荡培养20小时后收集菌体,用20mM的pH7.9的Tris-HCl缓冲液悬浮并超声破碎细胞,再经过纯化即可得到碱性蛋白酶),在此不再赘述。本发明提供的用于水解蛋白质的组合物含有本发明的碱性蛋白酶作为活性成分,以所述组合物的总重量为基准,所述碱性蛋白酶的含量为10-90%重量。所述组合物中还可以含有本领域技术人员公知的溶剂(如甘油、糖类 和蛋白酶抑制剂等蛋白保护剂)、激动剂(如氯化钙)等。所述组合物尤其适合于在碱性条件(如pH9-11的条件)下水解蛋白质。本发明还提供了本发明的上述碱性蛋白酶、基因、重组载体、重组菌株以及组合物在水解蛋白质中的应用。上述待水解的蛋白质可以为多种来源的蛋白质,优选为酪蛋白和/或角蛋白(所述角蛋白可以由羽毛粉等提供)。以下将通过实施例对本发明进行详细描述。下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。实施例中蛋白质(AprA酶液浓度)含量测定所用试剂盒为天根蛋白测定试剂盒CBBStainSolution,产品目录编号为PA102;所用酪蛋白购自Sigma,产品目录编号C3400。实施例1碱性蛋白酶及其编码基因等的获得(1)碱性蛋白酶(AprA)编码基因的克隆取分离自内蒙古碱湖土样的γ-变形菌(Gammaproteobacterium)C9,利用基因组大提法提取γ-变形菌C9的基因组DNA,紫外分光光度计测定DNA的纯度结果为:A260/A280=1.87,A260/A230=2.26。取总DNA溶液100μl(约100μgDNA),用限制性内切酶Sau3AI部分酶切,经琼脂糖凝胶电泳,回收3-8kb的DNA片段。然后进行连接反应,4℃连接反应16小时,连接体系如下(20μl):用连接反应产物电转化感受态大肠杆菌DH5α,然后涂于含100μg/ml氨苄青霉素(Amp)、24μg/mlIPTG、40μg/ml半乳糖苷(X-gal)以及1%脱脂牛奶的pH8(10%碳酸钠调节)的固体LB培养基上,37℃培养16-18小时,菌落周围有透明圈的即为阳性克隆。将阳性克隆在Amp-LB液体培养基中37℃培养12小时后,提取质粒用于测序。对阳性克隆中的重组质粒进行了测序,结果显示重组质粒中,在pUC118DNA骨架中插入了一个DNA片段,该DNA片段含有一个长1878bp的开放阅读框(ORF),其序列如序列表SEQIDNO:2所示,该全长基因编码含626个残基的氨基酸序列,如SEQIDNO:1所示,将该蛋白质(SEQIDNO:1)命名为AprA。(2)AprA的表达载体和重组菌株的构建根据SEQIDNO:2所示的核苷酸序列,设计引物对如下:正向引物5’-CATGCCATGGGCATGAAGAATGTTAAAACATT-3’(SEQIDNO:8),下划线部分为NcoI酶切位点;反向引物:5-ACCGCTCGAGCGGCTGGTAATTTGCTTCAA-3’(SEQIDNO:9),下划线部分为XhoI酶切位点。以γ-变形菌C9的总DNA为模板,用设计的引物进行PCR扩增,PCR反应体系如下(50μl):PCR扩增条件为:94℃预变性4min;94℃变性30s,55℃退火30s,72℃延伸2min,30个循环;最后72℃延伸10min。PCR产物用1%琼脂糖凝胶电泳检测产量和特异性,并用DNA纯化试剂盒(OMEGA)纯化。将纯化的PCR产物进行测序检测确为SEQIDNO:2所示DNA片段。将测序正确的PCR产物和质粒pET28a(来自Novogen)均经NcoI和XhoI双酶切并经琼脂糖电泳回收,然后将两个酶切产物进行连接反应,得到重组质粒,连接条件为4℃下16小时,连接反应体系如下(10μl):将测序验证正确的重组质粒命名为pET28a-AprA,并用其转化大肠杆菌BL21(DE3)PLys感受态细胞后涂布于含有50μg/ml卡那霉素和34μg/ml的LB固体平板上,37℃过夜培养得到含有pET28a-AprA的重组工程菌。(3)AprA的制备和纯化将得到的重组工程菌接种于含有50μg/ml卡那霉素和34μg/ml的LB培养基中,37℃过夜培养活化得到种子液,然后将种子液按1%的量接种于1000ml新鲜的LB培养基中(含50μg/ml卡那霉素和34μg/ml),37℃培养约3小时至OD600=0.6,加入IPTG至终浓度为0.2mM,20℃继续诱导培养20小时。将培养液8000g离心10min收集菌体,悬浮于100ml溶液A(20mMTris-HCl,pH8,0.5MNaCl,5mM咪唑)中,于冰浴中超声破碎(60w,30min;超声3s,停止3s),之后12000g离心15min除去细胞碎片,上清过Ni-IDA His·BindSuperflow纯化柱(Novogen),用5ml溶液A洗涤,再用10ml溶液B(20mMTris-HCl,pH8,0.5MNaCl,60mM咪唑)漂洗,然后用2ml溶液C(20mMTris-HCl,pH8,0.5MNaCl,1M咪唑)洗脱并收集洗脱液。将洗脱液用脱盐缓冲液(20mMTris-HCl,pH8)在AKTAFPLC系统上进行脱盐,获得纯化的AprA蛋白。实施例2碱性蛋白酶(AprA)的酶学性质的检测(1)标准酶活力测定方法取50μl实施例1获得的AprA酶液(稀释至0.5μg/ml)与150μL含1%酪蛋白的pH10的甘氨酸-NaOH缓冲液混匀后,在60℃下反应10min,加入200μl20%的三氯乙酸(TCA)终止反应,然后12000g离心15min,取50μl上清液加入250μl0.4M碳酸钠后再加入50μl福林酚试剂乙,40℃显色20min后,测定680nm吸光值(参照国标法SB/T10317-1999)。(2)AprA最适pH值和pH稳定性的测定在60℃下,将AprA酶液在不同pH值(pH7-12)的缓冲液中进行酶促反应以测定其最适pH值,其余条件同(1),所用缓冲液为pH7-8的50mM磷酸二氢钾-氢氧化钠缓冲液、pH9-10的50mM甘氨酸-NaOH缓冲液和pH11-12的50mM磷酸氢二钠-氢氧化钠缓冲液。结果如图1所示,AprA的最适作用pH为10。将酶液在不同pH(pH6-12)的缓冲液中于30℃下处理6小时,再测定酶活性,以研究酶的pH稳定性。所用缓冲液为pH6-8的50mM磷酸二氢钾-氢氧化钠缓冲液、pH9-10的50mM甘氨酸-NaOH缓冲液和pH11-12的50mM磷酸氢二钠-氢氧化钠缓冲液。结果如图2所示,AprA在pH7-11之间都很稳定,保持了90%以上的酶活性。(3)AprA最适温度和热稳定性的测定最适温度的测定在pH10的50mM甘氨酸-NaOH缓冲液体系(含1%酪蛋白)及不同的温度(40-100℃)下进行酶促反应,其余条件同(1)。酶最适反应温度测定结果(图3)显示,AprA的最适作用温度为60℃。将AprA用pH8的20mM的Tris-HCl缓冲液稀释至1μg/ml的浓度,然后在不同温度(50、55、60、65、70、75℃)下保温30min,测定残余的相对酶活力,其他具体测定条件同(1),绘制酶的热稳定性曲线。结果显示(见图4),AprA在50、55℃处理后酶活均有一定的提高,在60、65℃处理半小时仍具有85%以上的酶活性,因此AprA具有较好的热稳定性。(4)金属离子对AprA酶活性的影响用终浓度为6.7mmol/L的金属离子(K+、Ca2+、Mg2+、Zn2+、Co2+、Cu2+、Fe3+、A13+、Sr2+、Li+、Ni2+、Na+、Ag+、Mn2+、Ba2+,分别由KCl、CaCl2、MgSO4·7H2O、ZnSO4、CoSO4·7H2O、CuSO4·5H2O、Fe2(SO4)3、Al2(SO4)3·18H2O、SrCl2·6H2O、Li2SO4·H2O、NiSO4·6H2O、NaCl、AgNO3、MnSO4·H2O、BaCl2·H2O提供)以及EDTA预先加入到pH10的50mM甘氨酸-NaOH缓冲液体系(含1%酪蛋白)中,然后用稀释的酶液(浓度为1μg/ml)进行酶促反应(使得酶活反应体系的金属离子终浓度为5mmol/L),测定金属离子对酶活性的影响。以不加金属离子的底物和稀释的酶液进行酶促反应作为对照。其他具体测定条件同(1),以对照测得的酶活力为100%绘制金属离子对酶活力影响曲线,结果如图5所示。由图5可以看出上述金属离子对AprA基本没有激活作用,Fe3+、Ag+和EDTA对酶有明显抑制作用。(5)表面活性剂和抑制剂对AprA酶活性的影响用终浓度为1.34%的吐温20、吐温40、吐温80、TritonX155、平平加、JFC、SDS以及终浓度为6.7mmol/L的PMSF预先加入到pH10的50mM甘氨酸-NaOH缓冲液体系(含1%酪蛋白)中,然后用稀释的酶液(浓度为 1μg/ml)进行酶促反应(使得反应体系的终浓度为1%或者5mmol/L),测定对酶活性的影响。以不加表面活性剂或抑制剂的底物和稀释的酶液进行酶促反应作为对照。其他具体测定条件同(1),以对照测得的酶活力为100%绘制表面活性剂或抑制剂对酶活力影响曲线,结果如图6所示。由图6可以看出表面活性剂对酶活力具有一定的抑制作用,PMSF对酶抑制作用明显。(6)AprA的酶活性在最适的反应条件下(60℃和pH10),以酪蛋白为底物,其余条件同(1),AprA的比活力为35500U/mg。以角蛋白为底物,其余条件同(1),AprA的比活力为14200U/mg。以羽毛粉(将禽类羽毛粉碎得到,主要成分为角蛋白)为底物,其余条件同(1),AprA的比活力为7100U/mg。从以上实施例可以看出,本发明的碱性蛋白酶具有较高的酶活性和较强的稳定性。以上详细描述了本发明的优选实施方式,但是,本发明并不限于上述实施方式中的具体细节,在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,这些简单变型均属于本发明的保护范围。另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合,为了避免不必要的重复,本发明对各种可能的组合方式不再另行说明。此外,本发明的各种不同的实施方式之间也可以进行任意组合,只要其不违背本发明的思想,其同样应当视为本发明所公开的内容。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 蝎神经毒素AaIT及其编码基因与应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种花狭口蛙的基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种泽陆蛙基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 降低种子重量的白桦AP2基因及其编码蛋白的制造方法与工艺
- 可编码ArtRD蛋白基因及其蛋白和应用的制造方法与工艺
- 蝎神经毒素AaIT及其编码基因与应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种花狭口蛙的基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种泽陆蛙基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺