治疗癌症的方法与流程
本申请要求2016年2月29日提交的第62/301,510号美国临时申请的权益。上述申请的内容通过引用整体并入本文。
本发明涉及用于治疗癌症例如黑素瘤的方法和组合物。
背景技术:
靶向程序性死亡-1/配体(pd-1/pd-l1)轴释放的药剂抑制了抗肿瘤t细胞应答,在许多癌症中产生了明显的临床活性(wolchok.cell162:937,2015)。纳武单抗和帕博利珠单抗在25-45%的晚期黑色素瘤患者中诱导临床反应,现在在监管部门批准后被广泛使用(topalianetal.nengljmed366:2443-54,2012;hamidetal.nengljmed369:134-44,2013;herbstetal.nature515:563-7,2014;robertetal.nengljmed,372:2521-32,2015;robertetal.nengljmed,372:320-30,2014;larkinetal.nengljmed,373:1270-1,2015)。尽管具有这种活性,但可用于预测反应并指导治疗决策的临床上可获得的并经过验证的标记物仍然遥不可及。最近,浸润性t细胞克隆扩增和肿瘤细胞或免疫细胞的pd-l1表达被认为是治疗反应的潜在标志物(topalianetal.nengljmed366:2443-54,2012;herbstetal.nature515:563-7,2014;tumehetal.nature515:568-71,2014;weberetal.lancetoncol,16:375-84,2015)。
尽管有这些发现,但尚未系统地研究黑素瘤中的突变负荷和特异性致癌突变对抑制pd-1或pd-l1的药物的影响。此外,将基因组研究转化为常规临床实践仍然存在问题,因为全外显子组测序(wes)不是广泛可用的并且昂贵、耗时且技术上具有挑战性。
因此,需要新的用于治疗和诊断癌症(例如黑素瘤)的治疗和诊断方法,包括免疫疗法和基因组检测。
技术实现要素:
本发明至少部分基于以下发现,突变负荷与包括黑素瘤pd-1或pd-l1抑制剂的疗法的治疗效果相关。在一个实施方案中,通过例如使用基于杂交捕获的下一代测序(ngs)平台对来自患者样本的一小部分基因组或外显子组进行图谱绘制,可作为分析总突变负荷的有效替代。在另一个实施方案中,在单个基因(例如,nf1或lrp1b基因)处检测到的改变用作预测对疗法的反应的总突变负荷的替代或进一步替代。与例如全基因组或全外显子组测序相比,使用包括目标ngs平台的用于检测突变负荷的方法具有若干优点,包括但不限于更快,例如,更易于临床管理的周转时间(~2周)、标准化信息学管道以及更易于管理的成本。本文公开的方法具有优于诸如pd-l1表达的标记物的其他优点,因为它们产生客观度量(例如,突变负荷)而不是主观度量(例如,病理学评分)。本文公开的方法还允许同时检测可执行靶向治疗的改变,以及免疫治疗的突变负荷。这些方法可以为患有晚期黑素瘤的患者的抗pd-1和/或抗pd-l1疗法的应答提供临床上可操作的预测因子。
因此,本发明至少部分地提供了通过向个体施用有效量的靶向和/或抑制pd-1途径的药剂(例如,治疗剂)来治疗患有癌症(例如,黑素瘤)或具有患癌风险的个体的方法。在某些实施方案中,治疗剂是pd-1抑制剂或pd-l1抑制剂。在某些实施方案中,响应于对治疗剂作出的应答者状态值,施用治疗剂,例如pd-1抑制剂或pd-l1抑制剂。在某些实施方案中,应答者状态值包括来自个体的样本(例如,肿瘤样本)中的突变负荷的量度。在某些实施方案中,突变负荷的量度包括确定以下一项或多项:本文公开的预定组基因中体细胞改变的水平,在nf1基因处存在体细胞改变,在lrp1b基因处体细胞改变的数量,或本文公开的预定组基因中c至t转换的数量,或其任意组合。
治疗方法
在一个方面,本发明的特征在于一种治疗患有癌症(例如黑素瘤)的个体的方法。该方法包括:
(a)获得个体对疗法例如对包括pd-1抑制剂或pd-l1抑制剂的疗法的应答者状态值,其中所述应答者状态值包括样本(例如来自个体的黑素瘤样本或源自黑素瘤的样本)中的肿瘤突变负荷的量度;和
(b)响应于(例如与应答者状态的参考值相比)应答者状态值的增加,对个体施用疗法,从而治疗个体。
在某些实施方案中,应答者状态的参考值是对疗法无应答的应答者状态值。
在某些实施方案中,突变负荷的量度包括测定来自个体的样本中的以下所列中的一项、两项、三项或全部:
(i)在表1中列出的预定组基因处的体细胞改变水平(例如,一种或多种体细胞改变);
(ii)在nf1基因处存在体细胞改变或者不存在体细胞改变(例如,一种或多种体细胞改变);
(iii)在lrp1b基因处的体细胞改变(例如,一种或多种体细胞改变)的数量;或
(iv)在表1中列出的预定组基因处的c至t转换的数量(例如,一个或多个c至t转换)。
在某些实施方案中,响应于来自个体的样本的以下所列中的一项、两项、三项或全部,对个体施用疗法:
(i)与在表1中列出的预定组基因处的体细胞改变(例如,一种或多种体细胞改变)的参考水平相比,在表1中列出的预定组基因处的体细胞改变(例如,一种或多种体细胞改变)的水平增加;
(ii)在nf1基因处存在体细胞改变(例如,一种或多种体细胞改变);
(iii)与在lrp1b基因处的体细胞改变(例如,一种或多种体细胞改变)的参考数量相比,在lrp1b基因处的体细胞改变(例如,一种或多种体细胞改变)的数量增加;或者
(iv)与在表1中列出的预定组基因处的c至t转换(例如,一个或多个c至t转换)的参考数量相比,在表1中列出的预定组基因处的c至t转换(例如,一个或多个c至t转换)的数量增加。
另一方面,本发明的特征在于一种治疗患有癌症(例如黑素瘤)的个体的方法。该方法包括:向个体施用一种疗法,例如包括pd-1抑制剂或pd-l1抑制剂的疗法,其中个体已经具有或已经被鉴定为具有应答者状态值增加,例如与应答者状态参考值相比,其中所述应答者状态值包括样本(例如,来自个体的黑素瘤样本或源自黑素瘤的样本)中的突变负荷的量度,从而治疗个体。
在某些实施方案中,突变负荷的量度包括测定来自个体的样本的以下所列中的一项、两项、三项或全部:
(i)在表1中列出的预定组基因处的体细胞改变水平(例如,一种或多种体细胞改变);
(ii)在nf1基因处存在或者不存在体细胞改变(例如,一种或多种体细胞改变);
(iii)在lrp1b基因处的体细胞改变(例如,一种或多种体细胞改变)的数量;或
(iv)在表1中列出的预定组基因处的c至t转换的数量(一个或多个c至t转换)。
在某些实施方案中,响应于来自个体的样本的以下所列中的一项、两项、三项或全部,对个体施用疗法:
(i)与在表1中列出的预定组基因处的体细胞改变(例如,一种或多种体细胞改变)的参考水平相比,在表1中列出的预定组基因处的体细胞改变(例如,一种或多种体细胞改变)的水平增加;
(ii)在nf1基因处存在体细胞改变(例如,一种或多种体细胞改变);
(iii)与在lrp1b基因处的体细胞改变(例如,一种或多种体细胞改变)的参考数量相比,在lrp1b基因处的体细胞改变(例如,一种或多种体细胞改变)的数量增加;或者
(iv)与在表1中列出的预定组基因处的c至t转换(例如,一个或多个c至t转换)的参考数量相比,在表1中列出的预定组基因处的c至t转换(例如,一个或多个c至t转换)的数量增加。
在另一方面,本发明的特征在于一种治疗患有癌症(例如黑素瘤)的个体的方法。该方法包括:
(a)确定来自个体的样本(例如黑素瘤样本或源自黑素瘤的样本)的以下所列中的一项或多项:
(i)在预定组基因处(例如在表1中列出的预定组基因处)的体细胞改变水平(例如,一种或多种体细胞改变);
(ii)在nf1基因处存在或者不存在体细胞改变(例如,一种或多种体细胞改变);
(iii)在lrp1b基因处的体细胞改变(例如,一种或多种体细胞改变)的数量;或者
(iv)在表1中列出的预定组基因处的c至t转换的数量(一个或多个c至t转换);和
(b)对以下所列中的一项或多项作出响应:
(i)与在表1中列出的预定组基因处的体细胞改变(例如,一种或多种体细胞改变)的参考水平相比,在表1中列出的预定组基因处的体细胞改变(例如,一种或多种体细胞改变)的水平增加;
(ii)在nf1基因处存在体细胞改变(例如,一种或多种体细胞改变);
(iii)与在lrp1b基因处的体细胞改变(例如,一种或多种体细胞改变)的参考数量相比,在lrp1b基因处的体细胞改变(例如,一种或多种体细胞改变)的数量增加;或者
(iv)与在表1中列出的预定组基因处的c至t转换(例如,一个或多个c至t转换)的参考数量相比,在表1中列出的预定组基因处的c至t转换(例如,一个或多个c至t转换)的数量增加,
向个体施用例如包括pd-1抑制剂或pd-l1抑制剂的治疗。
选择疗法的方法
在一个方面,本发明的特征在于一种为患有癌症(例如黑素瘤)的个体选择疗法(例如包括pd-1抑制剂或pd-l1抑制剂的疗法)的方法。该方法包括:获得个体对疗法的应答者状态值,其中所述应答者状态值包括来自个体的样本(例如,黑素瘤样本或源自黑素瘤的样本)中的突变负荷的量度,其中例如与应答者状态的参考值相比,应答者状态值增加,表明所述个体是对疗法的应答者,或可能是对疗法的应答者,或者所述个体将对疗法作出应答,或可能将对疗法作出应答,从而选择疗法。
在某些实施方案中,突变负荷的量度包括测定来自个体的样本的以下所列中的一项、两项、三项或全部:
(i)在表1中列出的预定组基因处的体细胞改变水平(例如,一种或多种体细胞改变);
(ii)在nf1基因处存在或者不存在体细胞改变(例如,一种或多种体细胞改变);
(iii)在lrp1b基因处的体细胞改变(例如,一种或多种体细胞改变)的数量;或
(iv)在表1中列出的预定组基因处的c至t转换的数量(例如,一个或多个c至t转换)。
在某些实施方案中,响应于来自个体的样本的以下所列中的一项、两项、三项或全部,对个体施用疗法:
(i)与在表1中列出的预定组基因处的体细胞改变(例如,一种或多种体细胞改变)的参考水平相比,在表1中列出的预定组基因处的体细胞改变(例如,一种或多种体细胞改变)的水平增加;
(ii)在nf1基因处存在体细胞改变(例如,一种或多种体细胞改变);
(iii)例如与在lrp1b基因处的体细胞改变(例如,一种或多种体细胞改变)的参考数量相比,在lrp1b基因处的体细胞改变(例如,一种或多种体细胞改变)的数量增加;或者
(iv)例如与在表1中列出的预定组基因处的c至t转换(例如,一个或多个c至t转换)的参考数量相比,在表1中列出的预定组基因处的c至t转换(例如,一个或多个c至t转换)的数量增加。
评估个体或癌症的方法
在另一方面,本发明的特征在于一种评估患有癌症(例如黑素瘤)的个体的方法。该方法包括:
(a)获得个体对疗法例如对包括pd-1抑制剂或pd-l1抑制剂的疗法的应答者状态值,其中所述应答者状态值包括来自个体的样本(例如,黑素瘤样本或源自黑素瘤的样本)中的突变负荷的量度,和
(b)将个体鉴定为对疗法的应答者(例如,完全应答者或部分应答者)或无应答者,
其中应答者状态值等于或大于应答者状态的参考值,表明所述个体是对疗法的应答者或可能是对疗法的应答者,或者所述个体将对疗法作出应答,或可能将对疗法作出应答;或
其中应答者状态值小于应答者状态的参考值表示所述个体是对疗法的无应答者或可能是对疗法的无应答者,或者所述个体将不会对疗法作出应答,或可能不会对疗法作出应答。
在某些实施方案中,突变负荷的量度包括测定来自个体的样本的以下所列中的一项、两项、三项或全部:
(i)在表1中列出的预定组基因处的体细胞改变(例如,一种或多种体细胞改变)的水平;
(ii)在nf1基因处存在或者不存在体细胞改变(例如,一种或多种体细胞改变);
(iii)在lrp1b基因处的体细胞改变(例如,一种或多种体细胞改变)的数量;或
(iv)在表1中列出的预定组基因处的c至t转换的数量(一个或多个c至t转换)。
在某些实施方案中,响应于来自个体的样本的以下所列中的一项、两项、三项或全部,对个体施用疗法,例如包括pd-1抑制剂或pd-l1抑制剂的治疗:
(i)与在表1中列出的预定组基因处的体细胞改变(例如,一种或多种体细胞改变)的参考水平相比,在表1中列出的预定组基因处的体细胞改变(例如,一种或多种体细胞改变)的水平增加;
(ii)在nf1基因处存在体细胞改变(例如,一种或多种体细胞改变);
(iii)例如与在lrp1b基因处的体细胞改变(例如,一种或多种体细胞改变)的参考数量相比,在lrp1b基因处的体细胞改变(例如,一种或多种体细胞改变)的数量增加;或者
(iv)例如与在表1中列出的预定组基因处的c至t转换(例如,一个或多个c至t转换)的参考数量相比,在表1中列出的预定组基因处的c至t转换(例如,一个或多个c至t转换)的数量增加。
在某些实施方案中,该方法还包括对t细胞受体(tcr)基因(例如,一种或多种tcr基因)进行测序。在某些实施方案中,该方法还包括确定tcr基因的克隆性。
在一相关方面,提供了一种评估患者或患者群体的方法。该方法包括:鉴别、选择或获得患者或患者群体参与临床试验的信息或知识,获取患者或患者群体对疗法(例如,包括pd-1抑制剂或pd-l1抑制剂的疗法)的应答者状态值,并且如本文所述,将患者或患者群体鉴定为对疗法的应答者(例如,完全应答者或部分应答者)或者对疗法的无应答者,或者鉴定患者或患者群体是否会对所述疗法作出应答,或是否可能会对所述疗法作出应答。
另一方面,本发明的特征在于一种评估个体中癌症(例如黑素瘤)的方法,该方法包括:
(a)获得个体对疗法(例如,包括pd-1抑制剂或pd-l1抑制剂的疗法)的应答者状态值,其中所述应答者状态值包括来自个体的样本(例如,黑素瘤样本或源自黑素瘤的样本)中的突变负荷的量度,和
(b)确定癌症对疗法的应答,
其中应答者状态值等于或大于应答者状态的参考值,表明该癌症将对疗法作出应答,或可能将对疗法作出应答;或
其中应答者状态值小于应答者状态的参考值,表明该癌症将不会对疗法作出应答,或可能不会对疗法作出应答。
在某些实施方案中,突变负荷的量度包括测定来自个体的样本的以下所列中的一项、两项、三项或全部:
(i)在表1中列出的预定组基因处的体细胞改变(例如,一种或多种体细胞改变)的水平;
(ii)在nf1基因处存在或者不存在体细胞改变(例如,一种或多种体细胞改变);
(iii)在lrp1b基因处的体细胞改变(例如,一种或多种体细胞改变)的数量;或
(iv)在表1中列出的预定组基因处的c至t转换的数量(例如,一个或多个c至t转换)。
在某些实施方案中,响应于来自个体的样本的以下所列中的一项、两项、三项或全部,对个体施用疗法:
(i)例如与在表1中列出的预定组基因处的体细胞改变(例如,一种或多种体细胞改变)的参考水平相比,在表1中列出的预定组基因处的体细胞改变(例如,一种或多种体细胞改变)的水平增加;
(ii)在nf1基因处存在体细胞改变(例如,一种或多种体细胞改变);
(iii)例如与在lrp1b基因处的体细胞改变(例如,一种或多种体细胞改变)的参考数量相比,在lrp1b基因处的体细胞改变(例如,一种或多种体细胞改变)的数量增加;或者
(iv)例如与在表1中列出的预定组基因处的c至t转换(例如,一个或多个c至t转换)的参考数量相比,在表1中列出的预定组基因处的c至t转换(例如,一个或多个c至t转换)的数量增加。
在某些实施方案中,该方法还包括对t细胞受体(tcr)基因(例如,一种或多种tcr基因)进行测序。在某些实施方案中,该方法还包括确定tcr基因的克隆性。
本发明的其他方面或实施方案包括以下一种或多种。
应答者状态和突变负荷
本文所述的发明可以包括,例如,获得患有癌症(例如黑素瘤)的个体对疗法(例如包括pd-1抑制剂或pd-l1抑制剂的疗法)的应答者状态值。
在某些实施方案中,响应于例如与应答者状态的参考值相比应答者状态值的增加,对个体施用疗法,或者为个体选择疗法。在某些实施方案中,应答者状态的参考值是对疗法无应答的应答者状态值。
在某些实施方案中,应答者状态值包括来自个体的样本(例如,黑素瘤样本或源自黑素瘤的样本)中的突变负荷的量度。
在某些实施方案中,与突变负荷的参考水平相比,响应于(与突变负荷的参考水平相比)来自个体的样本中突变负荷水平的增加,对个体施用疗法,或者为个体选择疗法。在某些实施方案中,突变负荷的参考水平是来自对疗法无应答者的样本中的突变负荷水平。
在某些实施方案中,当来自个体的黑素瘤样本具有以下所列中的一项、两项、三项或全部时,该个体被鉴定为对疗法的应答者:
(i)与在表1中列出的预定组基因处的体细胞改变的参考水平相比,在表1中列出的预定组基因处的体细胞改变的水平增加;
(ii)在nf1基因处存在体细胞改变;
(iii)与在lrp1b基因处的体细胞改变的参考数量相比,在lrp1b基因处的体细胞改变的数量增加;或者
(iv)与在表1中列出的预定组基因处的c至t转换的参考数量相比,在表1中列出的预定组基因处的c至t转换的数量增加。
在某些实施方案中,当来自个体的样本具有以下所列中的一项、两项、三项或全部时,个体被鉴定为对疗法的无应答者:
(i)与在表1中列出的预定组基因处的体细胞改变的参考水平相比,在表1中列出的预定组基因处的体细胞改变的水平降低或者无变化;
(ii)在nf1基因处不存在体细胞改变;
(iii)与在lrp1b基因处的体细胞改变的参考数量相比,在lrp1b基因处的体细胞改变的数量相似、相同或者下降;或者
(iv)与在表1中列出的预定组基因处的c至t转换的参考数量相比,在表1中列出的预定组基因处的c至t转换的数量相似、相同或者下降。
在某些实施方案中,预定组基因包括表1中列出的基因中的至少约50个或更多,至少约100个或更多,至少约150个或更多,至少约200个或更多,至少约250个或更多,至少约300个或更多,或者全部基因。
在某些实施方案中,在表1中列出的预定组基因处的体细胞改变的参考水平,是来自对疗法无应答者的样本的在表1中列出的预定组基因处的体细胞改变的水平。
在某些实施方案中,在lrp1b基因处体细胞改变的参考数量,是来自对疗法无应答者的样本的在lrp1b基因处的体细胞改变的数量。
在某些实施方案中,在表1中列出的预定组基因处的c至t转换的参考数量是来自对疗法无应答者的样本中c至t转换的数量。
在某些实施方案中,在表1中列出的预定组基因处的体细胞改变的水平通过以下方法确定,该方法包括对表1中列出的预定组基因进行测序,例如,对表1中列出的预定组基因的编码区进行测序。在某些实施方案中,在nf1基因处存在或者不存在体细胞改变,通过以下方法确定,该方法包括对nf1基因进行测序,例如对nf1基因的编码区进行测序。在某些实施方案中,在lrp1b基因处体细胞改变的数量,通过以下方法确定,该方法包括对lrp1b基因进行测序,例如对lrp1b基因的编码区进行测序。在某些实施方案中,在表1中列出的预定组基因处的c至t转换的数量通过以下方法确定,该方法包括对表1中列出的预定组基因进行测序。
在某些实施方案中,该方法还包括,响应于突变负荷的量度,进行以下所列中的一项、两项、三项或全部:
(a)向个体施用剂量改变的疗法;
(b)改变个体的治疗方案或时程;
(c)与该疗法相组合,向例如无应答者或者部分应答者施用其他药剂;或者
(d)预测个体中癌症发展的时程。
在某些实施方案中,该方法还包括例如直接或间接地从个体获取样本(例如,黑素瘤样本或源自黑素瘤的样本),并如本文所述,评估样本的突变负荷或改变。
预定组基因中的体细胞改变
例如,响应于在表1中列出的预定组基因处的体细胞改变(例如,一种或多种体细胞改变)的水平增加,可以对患有癌症(例如,黑素瘤)的个体施用本文所述的疗法(例如,包括pd-1抑制剂或pd-l1抑制剂的疗法),或者为患有癌症(例如,黑素瘤)的个体选择本文所述的治疗方法。
在某些实施方案中,确定在表1中列出的预定组基因处的体细胞改变的水平包括,确定在表1中列出的基因中的约25个或更多基因(例如约50个或更多、约100个或更多、约150个或更多、约200个或更多、约250个或更多、约300个或更多基因)或表1中列出的全部基因处的体细胞改变的水平。
在某些实施方案中,确定在表1中列出的预定组基因处的体细胞改变水平包括,确定在预定组基因的编码区处的、例如被测序的预定组基因的编码区处的、每预选单位例如每兆碱基的体细胞改变的数量。
在某些实施方案中,响应于以下情况对个体施用疗法,或者为个体选择疗法:在表1中列出的预定组基因处的体细胞改变水平的增加,例如,与在表1中列出的预定组基因处的体细胞改变的参考水平相比,增加至少约2倍,至少约3倍,至少约5倍,至少约10倍,至少约15倍,至少约20倍,至少约30倍,至少约40倍或至少约50倍。
在某些实施方案中,响应于以下情况对个体施用疗法,或者为个体选择疗法:在表1中列出的预定组基因处的体细胞改变的数量测定为在预定组基因的编码区处每兆碱基的体细胞改变约3.3个或更多,例如,约5个或更多,约10个或更多,约15个或更多,约20个或更多,约25个或更多,约30个或更多,约35个或更多,约40个或更多,约45个或更多,或者约50个或更多。
在某些实施方案中,响应于以下情况,对个体施用疗法,或者为个体选择疗法:在表1中列出的预定组基因处的体细胞改变的数量测定为在预定组基因的编码区处每兆碱基的体细胞改变约23.1个或更多,例如,约25个或更多,约30个或更多,约35个或更多,约40个或更多,约45个或更多,或约50个或更多。
在某些实施方案中,响应于以下情况,对个体施用疗法,或者为个体选择疗法:在表1中列出的预定组基因处的体细胞改变的数量测定为在预定组基因的编码区处每兆碱基的体细胞改变在约3.3个至约23.1个之间,例如,在约5个至约23个之间,约10个至约23个之间,或约15个至约23个之间。
在某些实施方案中,与在表1中列出的预定组基因处的体细胞改变的参考水平相比,在表1中列出的预定组基因处的体细胞改变的水平增加,例如,增加至少约2倍,至少约3倍,至少约5倍,至少约10倍,至少约15倍,至少约20倍,至少约30倍,至少约40倍或至少约50倍,表明个体是对疗法的应答者。
在某些实施方案中,与在表1中列出的预定组基因处的体细胞改变的参考水平相比,在表1中列出的预定组基因处的体细胞改变的水平相似、相同或者降低,表明个体是对疗法的无应答者或可能是对疗法的无应答者,或者不会对疗法做出应答,或者可能不会对疗法做出应答。
在某些实施方案中,在表1中列出的预定组基因处的体细胞改变的数量测定为在表1中列出的预定组基因的编码区处的每兆碱基的体细胞改变约3.3个或更多,例如,约5个或更多,约10个或更多,约15个或更多,约20个或更多,约25个或更多,约30个或更多,约35个或更多,约40个或更多,约45个或更多,或者约50个或更多,表明个体是对疗法的应答者,或可能是对疗法的应答者,例如完全应答者或者部分应答者,或者将对疗法做出应答,或可能将对疗法做出应答。
在某些实施方案中,在表1中列出的预定组基因处的体细胞改变的数量测定为在表1中列出的预定组基因的编码区处每兆碱基的体细胞改变小于约3.3个,表明个体是对疗法的无应答者或可能是对疗法的无应答者,或者不会对疗法作出应答,或者可能不会对疗法作出应答。
在某些实施方案中,在表1中列出的预定组基因处的体细胞改变的数量测定为在表1中列出的预定组基因的编码区处每兆碱基的体细胞改变约23.1个或更多,例如,约25个或更多,约30个或更多,约35个或更多,约40个或更多,约45个或更多,或约50个或更多,表明个体是对疗法的应答者或可能是对疗法的应答者,例如完全应答者,或将对疗法作出应答或可能将对疗法作出应答。
在某些实施方案中,在表1中列出的预定组基因处的体细胞改变的数量测定为在表1中列出的预定组基因的编码区处每兆碱基的体细胞改变小于约23.1个,表明个体是对疗法的部分应答者或无应答者,或可能是对疗法的部分应答者或无应答者(或将会对疗法作出部分应答或不会对疗法作出应答,或者可能会对疗法作出部分应答或可能不会对疗法作出应答)。
在某些实施方案中,在表1中列出的预定组基因处的体细胞改变的数量测定为在表1中列出的预定组基因的编码区处每兆碱基的体细胞改变在约3.3个和约23.1个之间,例如,在约5个至约23个之间,约10个至约23个之间,或在约15个至23个之间,表明个体是对疗法的部分应答者或可能是对疗法的部分应答者(或将会对疗法作出部分应答,或可能会对疗法作出部分应答)。
nf1基因的改变
例如,响应于在nf1基因(例如,nf1基因的编码区)处的体细胞改变的数量的测定,可以对患有癌症(例如,黑素瘤)的个体施用本文所述的疗法(例如,包括pd-1抑制剂或pd-l1的抑制剂的疗法),或者为个体选择本文所述的疗法。
在某些实施方案中,响应于在nf1基因(例如,nf1基因的编码区)处存在体细胞改变的测定,对个体施用疗法,或者为个体选择疗法。
在某些实施方案中,在nf1基因的编码区处存在体细胞改变表明个体是对疗法的应答者或可能是对疗法的应答者。
在某些实施方案中,响应于以下情况,对个体施用疗法,或者为个体选择疗法:确定(a)在nf1基因的编码区处存在体细胞改变;和(b)在表1中列出的预定组基因处的体细胞改变的水平是在表1中列出的预定组基因的编码区处每兆碱基的体细胞改变约23.1个或更多,例如约25个或更多,约30个或更多,约35个或更多,约38.5个或更多,约40个或者更多,约45个或更多,或约50个或更多。
在某些实施方案中,响应于以下情况,对个体施用疗法,或者为个体选择疗法:确定(a)在nf1基因的编码区处存在体细胞改变;和(b)与以下样本(例如,黑素瘤样本或者源自黑素瘤的样本)中的在表1中列出的预定组基因处的体细胞改变的水平相比,在表1中列出的预定组基因处的体细胞改变的水平增加,例如,增加至少约2倍,至少约3倍,至少约5倍或至少约10倍,其中所述样本包括在braf基因处的体细胞改变、在nras基因处的体细胞改变,或者所述样本是对braf基因、nras基因和nf1基因而言的三重野生型(wt)。
lrp1b基因处的改变
例如,响应于lrp1b基因中存在体细胞改变的测定(例如,在lrp1b基因的编码区中),可以对患有癌症(例如,黑素瘤)的个体施用本文所述的疗法(例如,包括pd-1抑制剂或pd-l1的抑制剂的疗法),或者为患有癌症(例如,黑素瘤)的个体选择本文所述的疗法。
在某些实施方案中,响应于在lrp1b基因(例如,lrp1b基因的编码区)处存在约1个或更多、约2个或更多、约3个或更多、约4个或更多、或者约5个或更多数量的体细胞改变的测定,对个体施用疗法,或者为个体选择疗法。
在某些实施方案中,在lrp1b基因的编码区处存在约1个或更多、约2个或更多、约3个或更多、约4个或更多或约5个或更多数量的体细胞改变,表明个体是对疗法的应答者,或可能是对疗法的应答者,或将会对疗法作出应答或可能会对疗法作出应答。
在某些实施方案中,响应于以下情况,对个体施用疗法,或者为个体选择疗法:确定与在lrp1b基因的编码区处的体细胞改变的参考数量相比,在lrp1b的编码区处的体细胞改变的数量增加,例如,增加至少约2倍,至少约2.5倍,至少约2.8倍,至少约3倍,至少约3.5倍,至少约4倍或者至少约5倍。
在某些实施方案中,在lrp1b基因的编码区处的体细胞改变的参考数量,是来自对疗法的无应答者的样本(例如,黑素瘤样本或者源自黑素瘤的样本)中的在lrp1b基因的编码区处的体细胞改变的数量。
在某些实施方案中,在lrp1b基因的编码区处的体细胞改变的参考数量是0或1个体细胞改变。
c至t转换
例如,响应于对预定组基因(例如表1中列出的预定组基因)处的c至t转换的数量的测定,可以对患有癌症(例如,黑素瘤)的个体施用本文所述的疗法(例如,包括pd-1抑制剂或pd-l1的抑制剂的疗法),或者为患有癌症(例如,黑素瘤)的个体选择本文所述的疗法。
在某些实施方案中,响应于以下情况,对个体施用疗法,或者为个体选择疗法:确定存在约20个或更多、约30个或更多、约40个或更多、或约50个或更多的在表1中列出的预定组基因处的c至t转换。
在某些实施方案中,测定存在约20个或更多、约24个或更多、约30个或更多、约40个或更多或者约50个或更多的在表1中列出的预定组基因处的c至t转换,表明个体是对疗法的应答者或可能是对疗法的应答者。
在某些实施方案中,响应于以下情况,对个体施用疗法,或者为个体选择疗法:确定与在表1中列出的预定组基因处的c至t转换的参考数量相比,在表1中列出的预定组基因处的c至t转换的数量的增加,例如,增加至少约8倍,至少约10倍,至少约12倍,至少约15倍或至少约20倍。
在某些实施方案中,c至t转换的参考数量是来自对疗法无应答者的样本(例如,黑素瘤样本或源自黑素瘤的样本)中的c至t转换的数量。
在某些实施方案中,c至t转换的参考数量是在表1中列出的预定组基因处的约2个c至t转换。
改变的类型
如本文所述,可以使用各种类型的改变(例如,体细胞改变)来测量样本中的突变负荷。
在某些实施方案中,所述改变包括以下的一种或多种:沉默突变(例如,同义变异),尚未鉴定为与癌症表型相关的体细胞改变、乘客突变(例如,对克隆的适合性没有可检测的影响的变异)、意义不明的变异(vus)(例如,其致病性既不能被证实也不能被排除的变异)、点突变、编码短变异(例如,碱基取代或插入缺失)、非同义单核苷酸变异(snv)、剪接变异。
或者,或在组合中,在一些实施方案中,所述改变不包括以下的一种或多种:重排(例如易位)、功能性改变或种系突变。
在某些实施方案中,体细胞改变是沉默突变,例如同义变异。在某些实施方案中,体细胞改变尚未鉴定为与癌症表型相关。在某些实施方案中,体细胞改变是乘客突变,例如,对克隆的适合性没有可检测的影响的变异。在某些实施方案中,体细胞改变是意义不明的变异(vus),例如,其致病性既不能被证实也不能被排除的变异。在某些实施方案中,体细胞改变是点突变。在某些实施方案中,体细胞改变不包括重排,例如不包括易位。在某些实施方案中,体细胞改变是编码短变异,例如碱基取代或插入缺失。在某些实施方案中,体细胞改变是非同义单核苷酸变异(snv)。在某些实施方案中,体细胞改变是剪接变异。在某些实施方案中,体细胞改变不是功能性改变。
在某些实施方案中,所述改变不是种系突变。在其他实施方案中,体细胞改变与种系突变不相同或不相似(例如,可与之相区别)。在某些实施方案中,体细胞改变水平的增加是一种或多种类别或类型的体细胞改变(例如,重排、点突变、插入缺失或其任何组合)水平的增加。在某些实施方案中,体细胞改变水平的增加是一种类别或类型的体细胞改变(例如,仅重排、仅点突变或仅插入缺失)水平的增加。在某些实施方案中,体细胞改变水平的增加是在预选位置的体细胞改变(例如,本文所述的改变,例如在braf处的v600改变)水平的增加。在某些实施方案中,体细胞改变水平的增加是预选的体细胞改变(例如,本文所述的改变,例如在braf处的v600改变)水平的增加。
治疗剂和治疗方式
如本文所述,患有癌症的个体可以用疗法(例如免疫疗法)治疗,例如用包括pd-1抑制剂或pd-l1抑制剂的疗法治疗。
在某些实施方案中,pd-1的抑制剂是抗pd-1抗体。在某些实施方案中,pd-1抑制剂选自纳武单抗(ono-4538、bms-936558或mdx1106)、帕博利珠单抗(mk-3475或拉姆珠单抗(lambrolizumab))、皮地利珠单抗(pidilizumab)(ct-011)、medi0680(amp-514)、pdr001、regn2810、bgb-108、bgb-a317、shr-1210(hr-301210、shr1210或shr-1210)、pf-06801591或amp-224。
在某些实施方案中,pd-l1抑制剂是抗pd-l1抗体。在某些实施方案中,pd-l1抑制剂选自阿特珠单抗(atezolizumab)(mpdl3280a、rg7446或ro5541267)、yw243.55.s70、mdx-1105、度伐鲁单抗(durvalumab)(medi4736)或巴文西亚(msb0010718c)。
在某些实施方案中,pd-1抑制剂或pd-l1的抑制剂是pd-1受体,例如pd-1受体fc融合体,或者是pd-l1受体,例如pd-l1受体fc融合体。
在某些实施方案中,个体正在接受或已接受包括除pd-1抑制剂或pd-l1抑制剂之外的治疗剂或治疗方式的不同疗法。
在某些实施方案中,响应于以下的一项、两项、三项或全部的测定,停止所述的不同疗法:
(i)与在表1中列出的预定组基因处的体细胞改变的参考水平相比,在表1中列出的预定组基因处的体细胞改变的水平增加;
(ii)在nf1基因处存在体细胞改变;
(iii)与在lrp1b基因处的体细胞改变的参考水平相比,在lrp1b基因处的体细胞改变的数量增加;或者
(iv)与在表1中列出的预定组基因处的c至t转换的参考水平相比,在表1中列出的预定组基因处的c至t转换的数量增加。
在某些实施方案中,在停止所述不同疗法后施用所述疗法。在其他实施方案中,所述疗法与所述不同疗法组合施用。
在某些实施方案中,所述不同疗法选自化学疗法、放射疗法、免疫疗法、免疫放射性疗法、溶瘤病毒疗法、外科手术或其任何组合。
在某些实施方案中,所述不同疗法包括以下一种或多种:达卡巴嗪、替莫唑胺、白细胞介素-2(il-2)、干扰素、伊匹单抗、braf抑制剂、mek抑制剂、溶瘤病毒(talimogenelaherparepvec)、过继细胞转移或其任何组合。
在某些实施方案中,干扰素是重组干扰素α-2b或聚乙二醇干扰素α-2b。在某些实施方案中,braf抑制剂是维罗非尼或达拉菲尼。在某些实施方案中,mek抑制剂是考比替尼或曲美替尼。在某些实施方案中,过继细胞转移包括修饰的t细胞或修饰的树突细胞。
在某些实施方案中,个体正在接受或已接受免疫疗法,例如包括pd-1抑制剂或pd-l1抑制剂的疗法。在某些实施方案中,个体未在接受或尚未接受免疫疗法,例如包括pd-1抑制剂或pd-l1抑制剂的疗法。
黑素瘤
本文所述的发明可用于治疗癌症,例如黑素瘤,或用于评估患有癌症(例如黑素瘤)的个体。
黑素瘤可以是根据本领域技术人员已知的任何合适的黑素瘤分类系统定义的任何黑素瘤阶段或风险组。
在一些实施方案中,黑素瘤是0期、ia期、ib期、iia期、iib期、iic期、iii期或iv期黑素瘤中的任何一种,例如美国癌症联合委员会(ajcc)黑素瘤分期和分类系统所定义的0期、ia期、ib期、iia期、iib期、iic期、iii期或iv期黑素瘤中的任何一种。在一个实施方案中,根据本文提供的表2a和2b对黑素瘤进行分级或分类。
在一些实施方案中,例如,如balch等人在jclinoncol.2009;27(36):6199-6206中所述,黑素瘤是原位黑素瘤(例如,0期黑素瘤)、局部黑素瘤(例如,i期或ii期黑素瘤)、区域性转移性黑素瘤(例如,iii期黑素瘤)或者远处转移性黑素瘤(例如,iv期黑色素瘤)中的任一种。在一些实施方案中,黑素瘤是晚期黑素瘤,例如iii期或iv期黑素瘤。
在其他实施方案中,黑素瘤是1级、2级、3级、4级或5级黑素瘤中的任何一种,例如,根据clark的等级(weedon,skinpathology.2ndedition.2002.sydney:churchill-livingstone),1级(例如,局限于表皮的黑素瘤(原位黑素瘤))、2级(例如,侵入乳突状真皮层)、3级(例如,侵入乳突状真皮层和网状真皮层的交界处)、4级(例如,侵入网状真皮层)或5级(例如,侵入皮下脂肪)黑素瘤中的任何一种。
在一些实施方案中,黑素瘤是i期、ii期、iii期、iv期或iv期黑素瘤中的任何一种,例如,根据breslow的深度(breslow(1970)annalsofsurgery172(5):902-908),i期(例如,深度小于或等于0.75mm)、ii期(例如,深度为0.76mm-1.50mm)、iii期(例如,深度为1.51mm-2.25mm)、iv期(例如,深度为2.26mm-3.0mm)或v期(例如,深度大于3.0mm)黑素瘤中的任何一种。
在某些实施方案中,黑素瘤是晚期黑素瘤。在一些实施方案中,例如,根据ajcc分期和分类系统,晚期黑素瘤是iii期黑素瘤或iv期黑素瘤。在一个实施方案中,根据表2a和2b中描述的分期和分类,晚期黑素瘤是iii期黑素瘤或iv期黑素瘤。在一个实施方案中,晚期黑素瘤是iii期黑素瘤,例如本文所述的iii期黑素瘤。在另一个实施方案中,晚期黑素瘤是iv期黑素瘤,例如本文所述的iv期黑素瘤。
在某些实施方案中,黑素瘤是转移性黑素瘤。在一些实施方案中,例如,根据ajcc分期和分类系统,转移性黑素瘤是iii期黑素瘤或iv期黑素瘤。在一个实施方案中,根据表2a和2b中描述的分期和分类,转移性黑素瘤是iii期黑素瘤或iv期黑素瘤。在一个实施方案中,转移性黑素瘤是iii期黑素瘤,例如本文所述的iii期黑素瘤。在另一个实施方案中,转移性黑素瘤是iv期黑素瘤,例如本文所述的iv期黑素瘤。
在其他实施方案中,黑素瘤,例如晚期黑素瘤,包括,或被鉴定为或确定为具有本文所述的一种或多种基因(例如,表1中列出的一种或多种基因)的改变,例如如本文所述的改变。在某些实施方案中,黑素瘤包括或被鉴定为具有选自nf1、lrp1b、braf、nras、tp53、myc、apc/ctnnb1、igf1r/hgf、pten、cdkn2a、cdk4、cdk6和/或rb1的一种或多种基因的改变。
在某些实施方案中,黑素瘤包括或被鉴定为具有nf1基因的改变。在某些实施方案中,黑素瘤包括或被鉴定为具有lrp1b基因的改变。在某些实施方案中,黑素瘤包括或被鉴定为具有braf基因的改变。在某些实施方案中,黑素瘤包括或被鉴定为具有nras基因的改变。在某些实施方案中,黑素瘤包括或被鉴定为具有nf1基因的改变和lrp1b基因的改变。在某些实施方案中,黑素瘤包括或被鉴定为具有nf1基因的改变,但不包括或未被鉴定为具有braf基因的改变,不包括或未被鉴定为具有nras基因的改变,或者不包括或未被鉴定为具有braf基因的改变和nras基因的改变。在某些实施方案中,黑素瘤包括或被鉴定为具有lrp1b基因的改变,但不包括或未被鉴定为具有braf基因的改变,不包括或未被鉴定为具有nras基因的改变,或者不包括或未被鉴定为具有braf基因的改变和nras基因的改变。在某些实施方案中,黑素瘤被鉴定为三重野生型(wt)黑素瘤,例如,黑素瘤不包括或未被鉴定为具有nf1基因的改变、braf基因的改变和nras基因的改变中的任何一种。
在某些实施方案中,与nf1的野生型活性相比,nf1基因的改变导致nf1基因产物(例如,nf1蛋白)的活性降低。例如,该改变可导致nf1蛋白的gtp酶活化剂活性、磷脂酰胆碱结合活性和/或磷脂酰乙醇胺结合活性的改变(例如,降低)。在一个实施方案中,该nf1改变是,或者包括突变(例如,体细胞突变),例如取代(例如碱基取代)、插入或缺失。
在某些实施方案中,与braf的野生型活性相比,braf基因的改变导致braf基因产物(例如braf蛋白)的活性增加。例如,该改变可导致braf蛋白的激酶活性的改变(例如,增加)。在一个实施方案中,该braf改变是,或者包括突变(例如,体细胞突变),例如取代(例如碱基取代)、插入或缺失。在某些实施方案中,该改变是碱基取代。
在某些实施方案中,braf的改变位于密码子v600。在某些实施方案中,braf的改变是v600e改变。在某些实施方案中,braf的改变是v600k改变。在某些实施方案中,braf的改变是v600r改变。在某些实施方案中,braf的改变是v600d改变。
在某些实施方案中,braf的改变是除v600改变之外的改变。在某些实施方案中,braf的改变是k601改变。在某些实施方案中,braf的改变是k601e改变。在某些实施方案中,braf的改变是g469改变。在某些实施方案中,braf的改变是g469e改变。在某些实施方案中,braf的改变是d594改变。在某些实施方案中,braf的改变是d594g改变。在某些实施方案中,braf的改变是l597改变。在某些实施方案中,braf的改变是l597s改变。在某些实施方案中,braf的改变是s467改变。在某些实施方案中,braf的改变是s467l改变。
个体
在某些实施方案中,所述个体患有黑素瘤,例如本文所述的晚期黑素瘤,其中所述黑素瘤包括例如表1中列出的一种或多种基因处的改变,例如,如本文所述的改变。在某些实施方案中,黑素瘤包括或被鉴定为具有选自nf1、lrp1b、braf、nras、tp53、myc、apc/ctnnb1、igf1r/hgf、pten、cdkn2a、cdk4、cdk6和/或rb1的一种或多种基因的改变。在其他实施方案中,个体被鉴定为或以前已被鉴定为患有黑素瘤,例如包含c至t转换的晚期黑素瘤。
黑素瘤可以处于疾病的任何阶段,例如本文所述的任何阶段,包括但不限于晚期、复发、故态复萌或难治性阶段。用于黑素瘤的癌症分期系统包括,例如美国癌症联合委员会(ajcc)的黑素瘤分期和分类系统。例如,黑素瘤可以是0期、ia期、ib期、iia期、iib期、iic期、iii期或iv期黑素瘤中的任何一种,例如,根据本文提供的表2a和2b,例如,可以是0期、ia期、ib期、iia期、iib期、iic期、iii期或iv期黑素瘤中的任何一种。
在一个实施方案中,个体是人,例如患有黑素瘤(例如本文所述的晚期黑素瘤)的人类患者。
在一个实施方案中,个体正在经历或已经经历过不同治疗剂或治疗方式(例如,非pd-1和/或非pd-l1)的治疗。在一个实施方案中,所述不同治疗剂或治疗方式是化学疗法、放射疗法、免疫疗法、免疫放射性疗法、溶瘤病毒疗法、外科手术或其任何组合。在一个实施方案中,所述不同治疗剂或治疗方式包括以下的一种或多种:达卡巴嗪、替莫唑胺、白细胞介素-2(il-2)、干扰素(例如重组干扰素α-2b或聚乙二醇干扰素α-2b)、伊匹单抗、braf抑制剂(例如,维罗非尼或达拉菲尼)、mek抑制剂(例如,考比替尼或曲美替尼)、溶瘤病毒(talimogenelaherparepvec)和/或过继细胞转移(例如,修饰的t细胞或树突细胞)。
在一个实施方案中,响应于本文所述的突变负荷和/或存在改变的确定,停止所述不同的治疗剂或治疗方式(例如,非pd-1和/或非pd-l1检查点)。在其他实施方案中,个体已经鉴定为可能会对该不同的治疗剂或治疗方式作出反应,或者不可能会对该不同的治疗剂或治疗方式作出反应。
在某些实施方案中,个体是参与pd-1或pd-l1抑制剂临床试验的黑素瘤患者。在某些实施方案中,个体是参与不同的(例如,非pd-1和/或非pd-l1)治疗剂或治疗方式的临床试验的黑素瘤患者。
在一个实施方案中,个体年龄为60岁或更大。在另一个实施方案中,个体年龄在45至60岁之间。在另一个实施方案中,个体年龄为45岁或更年轻。在另一个实施方案中,个体年龄为30岁或更年轻。在一个实施方案中,个体年龄为45岁或更大,并且是男性。在另一个实施方案中,个体年龄为45岁或更年轻,并且是女性。在一个实施方案中,个体是高加索人。在一个实施方案中,个体具有黑素瘤的家族史。
系统
在一个方面,本发明的特征在于一种用于评估患有癌症(例如黑素瘤)的个体的系统。该系统包括:
至少一个可操作地连接到存储器的处理器,所述至少一个处理器在执行时被配置为:
(a)获得个体对疗法(例如,包括pd-1抑制剂或pd-l1抑制剂的疗法)的应答者状态值,其中所述应答者状态值包括样本(例如,来自个体的黑素瘤样本或源自黑素瘤的样本)中的突变负荷的量度,和
(b)将个体鉴定为对疗法的应答者(例如,完全应答者或部分应答者)或对疗法的无应答者,
其中应答者状态值等于或大于应答者状态的参考值,表明所述个体是对疗法的应答者或可能是对疗法的应答者,或者所述个体将会对疗法作出应答或可能会对疗法作出应答;或
其中应答者状态值小于应答者状态的参考值,表明所述个体是对疗法的无应答者或可能是对疗法的无应答者,或者所述个体不会对疗法作出应答或可能不会对疗法作出应答。
在某些实施方案中,突变负荷的量度包括测定来自个体的样本的以下所列中的一项、两项、三项或全部:
(i)在表1中列出的预定组基因处的体细胞改变水平(例如,一种或多种体细胞改变);
(ii)在nf1基因处存在体细胞改变(例如,一种或多种体细胞改变);
(iii)在lrp1b基因处的体细胞改变(例如,一种或多种体细胞改变)的数量;或
(iv)在表1中列出的预定组基因处的c至t转换的数量(例如,一个或多个c至t转换)。
在某些实施方案中,响应于来自个体的黑素瘤样本的以下所列中的一项、两项、三项或全部,对个体施用疗法或为个体选择疗法:
(i)与在表1中列出的预定组基因处的体细胞改变(例如,一种或多种体细胞改变)的参考水平相比,在表1中列出的预定组基因处的体细胞改变(例如,一种或多种体细胞改变)的水平增加;
(ii)在nf1基因处存在体细胞改变(例如,一种或多种体细胞改变);
(iii)与在lrp1b基因处的体细胞改变(例如,一种或多种体细胞改变)的参考水平相比,在lrp1b基因处的体细胞改变(例如,一种或多种体细胞改变)的数量增加;或
(iv)与在表1中列出的预定组基因处的c至t转换(例如,一个或多个c至t转换)的参考水平相比,在表1中列出的预定组基因处的c至t转换(例如,一个或多个c至t转换)的数量增加。
试剂盒、核酸制剂和反应混合物
一方面,本发明的特征在于一种试剂盒。该试剂盒包括:
(a)一种或多种能够检测以下一项或多项的检测试剂:
(i)在表1中列出的预定组基因处的体细胞改变(例如,一种或多种体细胞改变),
(ii)在nf1基因处的体细胞改变(例如,一种或多种体细胞改变),
(iii)在lrp1b基因处的体细胞改变(例如,一种或多种体细胞改变),
(iv)c至t转换(例如,一个或多个c至t转换);和
(b)用于确定黑素瘤样本和/或治疗黑素瘤的个体的突变负荷的说明,以及
在某些实施方案中,试剂盒还包含(c)pd-1抑制剂或pd-l1抑制剂或其组合物。
另一方面,本发明的特征在于一种纯化的或分离的来源于样本(例如黑素瘤样本或源自黑素瘤的样本)的核酸制剂。所述制剂包括以下的一项或多项:
(i)在表1中列出的预定组基因处的体细胞改变(例如,一种或多种体细胞改变),
(ii)在nf1基因处的体细胞改变(例如,一种或多种体细胞改变),
(iii)在lrp1b基因处的体细胞改变(例如,一种或多种体细胞改变),
(iv)c至t转换(例如,一次或多次c至t转换)。
在某些实施方案中,该制剂用于确定置于测序装置中或者测序装置的样本架中的黑素瘤样本的突变负荷。
在另一方面,本发明的特征在于一种反应混合物。该反应混合物包括:
(a)一种或多种能够检测以下一项或多项的检测试剂:
(i)在表1中列出的预定组基因处的体细胞改变(例如,一种或多种体细胞改变),
(ii)在nf1基因处的体细胞改变(例如,一种或多种体细胞改变),
(iii)在lrp1b基因处的体细胞改变(例如,一种或多种体细胞改变),或
(iv)c至t转换(例如,一个或多个c至t转换);和
(b)一种来源于样本(例如,黑素瘤样本或源自黑素瘤的样本)的核酸,该核酸包含以下的一项或多项:
(i)在表1中列出的预定组基因处的体细胞改变(例如,一种或多种体细胞改变),
(ii)在nf1基因处的体细胞改变(例如,一种或多种体细胞改变),
(iii)在lrp1b基因处的体细胞改变(例如,一种或多种体细胞改变),或
(iv)c至t转换(例如,一个或多个c至t转换)。
在某些实施方案中,反应混合物用于确定置于测序装置中或者测序装置的样本架中的样本的突变负荷。
在相关方面,本发明的特征在于一种制备反应混合物的方法。该方法包括:使一种或多种能够检测以下一项或多项的检测试剂与下述一种核酸组合:
(i)在表1中列出的预定组基因处的体细胞改变(例如,一种或多种体细胞改变),
(ii)在nf1基因处的体细胞改变(例如,一种或多种体细胞改变),
(iii)在lrp1b基因处的体细胞改变(例如,一种或多种体细胞改变),或
(iv)c至t转换(例如,一个或多个c至t转换),
一种来源于黑素瘤样本的核酸,其包括以下的一项或多项:
(i)在表1中列出的预定组基因处的体细胞改变(例如,一种或多种体细胞改变),
(ii)在nf1基因处的体细胞改变(例如,一种或多种体细胞改变),
(iii)在lrp1b基因处的体细胞改变(例如,一种或多种体细胞改变),或
(iv)c至t转换(例如,一个或多个c至t转换)。
除非另外定义,否则本文使用的所有技术术语和科学术语具有与本发明所属领域的普通技术人员通常理解的含义相同的含义。尽管与本文所述的那些类似或等同的方法和材料可用于实践或检验本发明,但下文描述了合适的方法和材料。本文提及的所有出版物、专利申请、专利和其他参考文献都通过引用整体并入。在发生矛盾的情况下,受控于本说明书(包括定义)。另外,材料、方法和实施例仅是说明性的而不是限制性的。
在附图和以下描述中阐述了本发明的一个或多个实施方案的细节。本发明特有的其他特征、目的和优点将从说明书和附图以及权利要求中显而易见。
附图说明
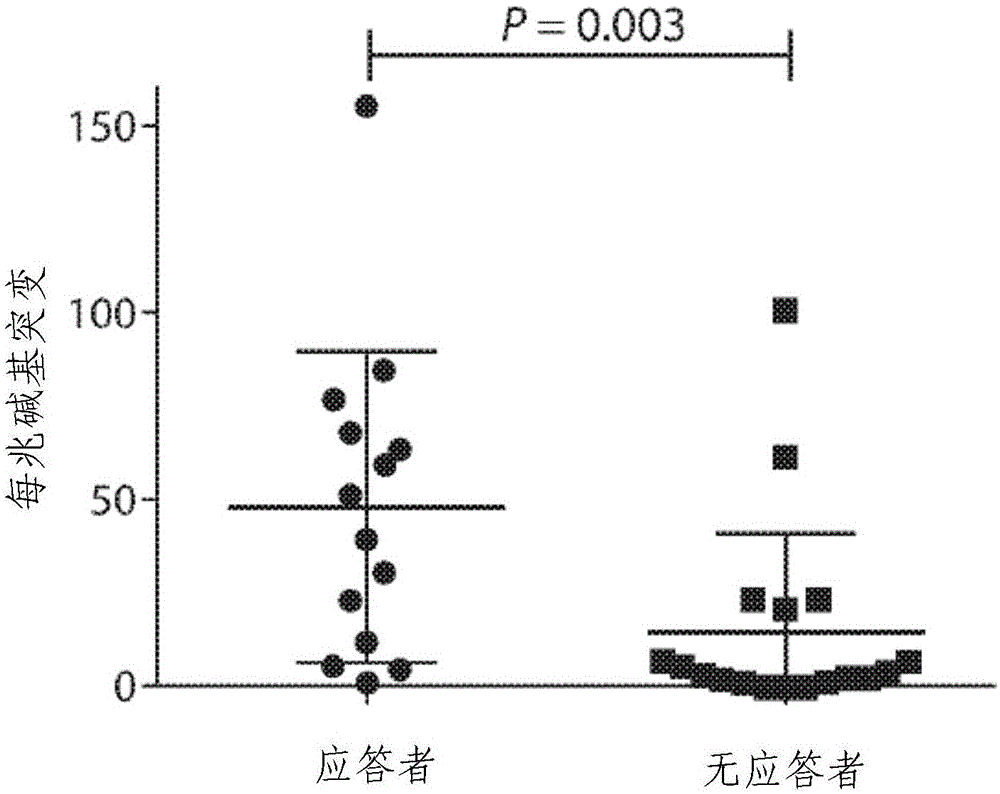
图1a示出初始群组中应答者与无应答者的突变负荷。
图1b示出在验证群组中应答者与无应答者的突变负荷。
图1c示出具有高、中和低突变负荷的患者的无进展存活率。
图1d示出具有高、中和低突变负荷的患者的总存活率。
图2a示出跨越一系列潜在阈值的突变负荷的表现。垂直条表示基于局部表现最大值和临床相关性选择的阈值。
图2b示出3.3个突变/兆碱基(mb)(低突变负荷组)和23.1个突变/mb(高突变负荷组)的突变负荷截断值的接受者操作曲线(roc)。
图3a示出应答者与无应答者中具有皮肤/未知原发性的肿瘤中的突变负荷。
图3b示出应答者与无应答者中具有非皮肤原发性(肢端、粘膜、葡萄膜)的肿瘤中的突变负荷。
图3c示出应答者与无应答者中的基因扩增和缺失。
图4a示出应答者与无应答者中观察到的突变总数量。
图4b示出应答者与无应答者中观察到的c>t转换的总数量。
图4c示出应答者与无应答者中观察到的核苷酸改变的类型。
图4d示出具有braf突变、nras突变、nf1突变/丢失和“三重wt”(定义为braf、nras和nf1的野生型)的患者的突变负荷。braf非v600突变包括在除1名患有并发nf1突变的患者之外的braf群组中。一名患有nrasq61r突变和并发nf1突变的患者被纳入nras群组。
图5a示出使用包含在杂交捕获ngs组中的315个基因的tcga皮肤黑素瘤(skcm)样本中的突变负荷与通过全外显子组测序评估的突变高度相关。
图5b示出使用全外显子组测序(wes)的tcga中的突变负荷组和存活率。
图5c示出使用315个测试(fm)基因的tcga中的突变负荷组和存活率。
图6示出每个样本的计算的突变负荷(上);单个突变的颜色编码矩阵,拷贝数改变;和临床特征(中);和单个样本的突变光谱(下)。
图7a示出应答者与无应答者中意义未知的lrp1b突变/变异。
图7b示出具有和不具有lrp1b突变的黑素瘤中的突变的总数量。
图7c示出lrp1b突变的数量与黑素瘤tcga中的总突变量之间的关联。
图8a示出应答者与无应答者中的t细胞受体(tcr)克隆性。
图8b示出应答者与无应答者中的t细胞分数。
图8c示出“理想”样本(定义为在不采用其他先前疗法的情况下进行抗pd-1/抗pd-l1治疗的4个月内获得的那些样本)中应答者与无应答者中的tcr克隆性。
图8d示出这些“理想”样本(定义为在不采用其他先前疗法的情况下进行抗pd-1/抗pd-l1治疗的4个月内获得的那些样本)中的t细胞分数。
图9a示出突变负荷和t细胞受体(tcr)克隆性之间的相关性。
图9b示出突变负荷和t细胞分数之间的相关性。
具体实施方式
本发明至少部分地基于以下发现:通过例如使用基于杂交捕获的ngs平台,在几百个基因中检测到的突变的数量与包括pd-1或pd-l1的疗法的治疗效果相关。在某些实施方案中,将患者分组(例如,三组),以将大多数患者准确预测为“高”突变负荷群组和“低”突变负荷群组,从而为晚期黑素瘤和其他癌症提供临床上可行的对抗pd-1和/或抗pd-l1疗法的应答的标志物。在其他实施方案中,几种基因(例如nf1、lrp1b)的改变也与总突变负荷和抗pd-1或抗pd-l1疗法的效益相关。
不受理论束缚,一般认为产生免疫原性肿瘤新抗原的可能性随着突变的发展以概率方式(probablilisticfashion)增加,增加了免疫识别的可能性(gubinandschreiber.science350:158-9,2015)。然而,评估总突变负荷需要全外显子组测序(wes)。这种方法需要专门的组织处理、匹配的正常标本,并且目前主要作为研究工具进行。鉴于在临床环境中执行wes的技术和信息学挑战,需要检测突变负荷的替代方法。本文所述的包括经验证的基于杂交捕获的ngs平台的方法具有若干实用优点,包括例如更临床可行的周转时间(~2周)、标准化信息学管道以及更易管理的成本。这种方法比pd-l1表达等标志物更具其他优势,因为它产生了一个客观量度(突变负荷)而不是主观量度(免疫组化评分)(hansenandsiu.jamaoncol2(1):15-6,2016)。此外,该平台有助于同时检测与靶向治疗相关的可操作的改变。
鉴定用于抗pd-1或抗pd-l1疗法的准确预测性生物标志物具有若干直接临床应用。在黑素瘤中,可以预见具有高突变负荷的患者可以接受例如抗pd-1单一疗法,而具有中/低突变负荷的患者可以采用例如具有更有效(但毒性更大)的纳武单抗和伊匹单抗的组合治疗(larkinetal.nengljmed,2015)。其他癌症(例如nsclc)可能对抗pd-1具有较低的总体应答率(rizvietal.lancetoncol16:257-65,2015;garonetal.nengljmed,2015)。在这些疾病中,这种方法可以在抗pd-1和其他活性剂(例如细胞毒性化学疗法)之间对患者进行分组。此外,鉴定“异常值”(例如,不能应答的高突变负荷肿瘤)的基因组和免疫特征是主要需求。
因此,本发明至少部分地提供了通过向个体施用靶向和/或抑制pd-1途径的有效量的药剂(例如,治疗剂)来治疗患有癌症或者有患癌症(例如黑素瘤)风险的个体的方法。在某些实施方案中,该治疗剂是pd-1抑制剂或pd-l1抑制剂。在某些实施方案中,响应于对治疗剂的应答者状态值,施用治疗剂,例如pd-1抑制剂或pd-l1抑制剂。在某些实施方案中,应答者状态值包括来自个体的癌症样本(例如黑素瘤样本或源自黑素瘤的样本)中的突变负荷的量度。在某些实施方案中,突变负荷的量度包括确定本文公开的预定组基因中的体细胞改变水平、在nf1基因处存在体细胞改变、在lrp1b基因处体细胞改变的数量、本文公开的预定组基因处的c至t转换的数量或其任何组合。还公开了用于评估个体或选择疗法的方法和系统、核酸制剂、试剂盒、反应混合物和制备反应混合物的方法。
某些术语在下面和整个说明书中定义。
如本文所用,冠词“一个”和“一种”指的是一个或多于一个(例如,至少一个)的冠词语法对象。
除非上下文另有明确说明,否则术语“或”在本文中用于表示术语“和/或”并且可与术语“和/或”互换使用。在本文的某些地方使用术语“和/或”并不意味着术语“或”的使用不能与术语“和/或”互换,除非上下文另有明确说明。
“约”和“近似”通常表示考虑到测量的性质或精度,测量的量的可接受的误差度。示例性误差度在给定值或给定的值范围的20%以内,通常在10%以内,更通常地,在5%以内。
本文使用的术语“获取”或“获得”是指通过“直接获取”或“间接获取”物理实体或值来获得物理实体的拥有或值(例如数值)。“直接获取”意味着执行过程(例如,执行合成方法或分析方法)以获得物理实体或值。“间接获取”是指从另一方或来源(例如,直接获得物理实体或值的第三方实验室)接收物理实体或值。直接获取物理实体包括执行包括物理物质(例如起始材料)的物理变化在内的过程。示例性变化包括由两种或更多种起始材料制造物理实体、剪切或破碎物质、分离或纯化物质、将两个或多个单独的实体组合成混合物、进行包括断裂或形成共价键或非共价键的化学反应。直接获取值包括执行包括样本或另一物质的物理变化的过程,例如,执行包括物质(例如样本、分析物或试剂)的物理变化的分析过程(在本文中有时称为“物理分析”),执行分析方法,例如,包括以下一种或多种的方法:从另一种物质中分离或纯化物质,例如分析物或其片段或其它衍生物;将分析物或其片段或其它衍生物与另一种物质(例如缓冲液、溶剂或反应物)混合;或者,例如通过在分析物的第一原子和第二原子之间共价键或非共价键的断裂或者形成共价键或非共价键,来改变分析物或其片段或其它衍生物的结构;或者,例如通过在试剂的第一原子和第二原子之间共价键或非共价键的断裂或者形成共价键或非共价键,来改变试剂或其片段或其它衍生物的结构。
本文使用的术语“获取序列”是指通过“直接获取”或“间接获取”序列来获得核苷酸序列或拥有氨基酸序列。“直接获取序列”是指执行过程(例如,执行合成方法或分析方法),例如执行测序方法(例如,下一代测序(ngs)方法),以获得序列。“间接获取序列”是指从另一方或来源(例如,直接获得序列的第三方实验室)接收序列的信息或知识,或从其接收序列。获得的序列不必是完整序列,例如,对至少一个核苷酸进行测序,或获得鉴定本文公开的突变存在于个体中的信息或知识构成“获取序列”。
直接获取序列包括执行包括物理物质(例如起始材料,例如组织样本,例如活体组织切片,或分离的核酸(例如dna或rna)样本)的物理变化在内的过程。示例性变化包括由两种或更多种起始材料制备物理实体、剪切或破碎物质(例如基因组dna片段)、分离或纯化物质(例如,从组织中分离核酸样本)、将两个或多个单独的实体组合成混合物、进行包括断裂或形成共价键或非共价键的化学反应。直接获取值包括执行包括如上所述的样本或另一物质的物理变化的过程。
本文使用的术语“获取样本”是指通过“直接获取”或“间接获取”样本来获得样本(例如组织样本或核酸样本)。“直接获取样本”意指执行过程(例如,执行诸如手术或提取的物理方法)以获得样本。“间接获取样本”是指从另一方或来源(例如,直接获得样本的第三方实验室)接收样本。直接获取样本包括执行包括物理物质(例如起始材料,例如组织,例如人类患者中的组织或以前从患者分离的组织)的物理变化在内的过程。示例性变化包括从起始材料制造物理实体、解剖组织或刮擦组织;分离或纯化物质(例如样本组织或核酸样本);将两个或多个单独的实体组合成混合物;进行包括断裂或形成共价键或非共价键的化学反应。例如,如上所述,直接获取样本包括执行包括样本或另一物质的物理变化的过程。
本文所用的基因或基因产物(例如,表1中列出的基因或基因产物、nf1基因或基因产物或lrp1b基因或基因产物)的“改变”是指基因或基因产物内存在一个突变或多个突变,例如,与正常基因或野生型基因相比,影响基因或基因产物的完整性、序列、结构、数量或活性的突变。改变可以是与正常或健康组织或细胞(例如,对照物)中的数量、结构和/或活性相比,癌组织或癌细胞中在数量、结构和/或活性方面的改变,并与疾病状态(例如癌症)相关。例如,与癌症相关或预测对抗癌治疗剂的应答的基因或基因产物可具有或起因于,与正常健康的组织或细胞相比,癌症组织或癌细胞中的改变了的核苷酸序列(例如,突变)、氨基酸序列、染色体易位、染色体内倒位、拷贝数、表达水平、蛋白质水平、蛋白质活性、或表观遗传修饰(例如甲基化或乙酰化状态)、或翻译后修饰。示例性突变包括但不限于点突变(例如,沉默、错义或无义)、缺失、插入、倒位、复制、扩增、易位、染色体间和染色体内重排。突变可以存在于基因的编码区或非编码区中。在某些实施方案中,所述改变与表型相关(或不相关),例如癌表型(例如,癌症风险、癌症进展、癌症治疗或癌症治疗的抗性中的一种或多种)。在某些实施方案中,术语“改变”和“突变”在本文中可互换使用。
如本文所用,“功能性改变”包括与参考序列(例如野生型或未突变序列)相比,对细胞分裂、生长或存活具有影响(例如促进细胞分裂、生长或存活)的改变。在某些实施方案中,功能性改变通过包含在功能性改变的数据库例如cosmic数据库(cancer.sanger.ac.uk/cosmic;forbesetal.nucl.acidsres.2015;43(d1):d805-d811)中来识别。在某些实施方案中,功能性改变是具有已知功能状态的改变,例如,cosmic数据库中出现的已知的体细胞改变。在其他实施方案中,功能性改变是具有可能的功能状态的改变,例如肿瘤抑制基因中的截短。在某些实施方案中,功能性改变是驱动突变,例如,在其微环境中为克隆提供选择性优势的改变,例如通过增加细胞存活或繁殖。在一些实施方案中,功能性改变可引起克隆扩增。在某些实施方案中,功能性改变是能够引起以下一种或多种的改变:(a)生长信号的自给自足;(b)例如对抗生长信号的不敏感性降低;(c)细胞凋亡减少;(d)复制潜能增加;(e)持续的血管生成;或(f)组织浸润或转移。在其他实施方案中,功能性改变不是乘客突变,例如,是对细胞克隆的适合性具有可检测的影响的改变。在其他实施方案中,功能性改变不是意义不明的变异(vus),例如,变异的致病性既不能被证实也不能被排除。
“结合实体”是指可以直接或间接连接分子标签的任何分子,其能够特异性结合分析物。结合实体可以是核酸序列上的亲和标记物。在某些实施方案中,结合实体允许核酸从混合物(例如抗生物素蛋白分子,或结合半抗原或其抗原结合片段的抗体)中分离。示例性结合实体包括但不限于生物素分子、半抗原、抗体、抗体结合片段、肽和蛋白质。
“互补的”是指两条核酸链的区域之间或相同核酸链的两个区域之间的序列互补性。已知如果第二核酸区域的残基是胸腺嘧啶或尿嘧啶,那么第一核酸区域的腺嘌呤残基能够和与第一核酸区域反向平行的第二核酸区域的残基形成特定的氢键(“碱基配对”)。类似地,已知如果第二核酸链的残基是鸟嘌呤,那么第一核酸链的胞嘧啶残基能够和与第一核酸链反向平行的第二核酸链的残基碱基配对。当核酸的第一区域与相同核酸或不同核酸的第二区域以反向平行方式排列时,两个区域互补,则第一区域的至少一个核苷酸残基能够与第二区域的残基碱基配对。在某些实施方案中,第一区域包含第一部分,第二区域包含第二部分,由此,当第一部分和第二部分以反向平行方式排列时,至少约50%、至少约75%、至少约90%或至少约95%的第一部分的核苷酸残基能够与第二部分中的核苷酸残基碱基配对。在其他实施方案中,第一部分的所有核苷酸残基都能够与第二部分中的核苷酸残基碱基配对。
术语“癌症”或“肿瘤”在本文中可互换使用。这些术语是指存在具有致癌细胞典型特征的细胞,例如不受控制的增殖、永生、转移潜能、快速生长和增殖速率,以及某些特征性形态特征。
术语“肿瘤”或“赘生的”细胞是指细胞或组织中的异常增殖阶段,例如过度增殖阶段,其可包括良性、恶变前、恶性(癌症)或转移阶段。
如果癌症的至少一种症状得到缓解、终止、减缓或预防,则癌症被“抑制”。如本文所述,如果癌症的复发或转移得到减少、减缓、延迟或预防,癌症也被“抑制”。
术语“抑制”或“抑制剂”包括给定分子(例如免疫检查点抑制剂)的某些参数(例如活性)的降低。例如,抑制活性,这个术语包括,例如抑制pd-1或pd-l1的至少5%、10%、20%、30%、40%、50%、60%或更多的活性。因此,抑制不必是100%。抑制剂可以直接(例如通过结合靶标)或间接(例如通过干扰与靶标相关的活性)抑制靶标。抑制剂还可以抑制两种或更多种不同的靶标(例如,同时地或顺序地),例如具有多特异性(例如,双特异性)。如本文所述,pd-1抑制剂或pd-l1抑制剂可以抑制pd-1、pd-l1或两者均可。
术语“程序性死亡1”或“pd-1”包括亚型、哺乳动物的例如人的pd-1、人pd-1的物种同源物和包含至少一个与pd-1的共同表位的类似物。pd-1的氨基酸序列,例如人pd-1,是本领域已知的(例如,shinoharatetal.(1994)genomics23(3):704-6;fingerlr,etal.gene(1997)197(1-2):177-87)。
术语“pd-配体1”或“pd-l1”包括亚型、哺乳动物的例如人的pd-l1、人pd-l1的物种同源物和包含至少一个与pd-l1的共同表位的类似物。pd-l1的氨基酸序列,例如人pd-l1,是本领域已知的。
如本文所述,术语“插入缺失”是指细胞核酸中一个或多个核苷酸的插入、缺失或两者均有。在某些实施方案中,插入缺失包括一个或多个核苷酸的插入和缺失,其中插入和缺失都在核酸附近。在某些实施方案中,插入缺失导致核苷酸总数量的净变化。在某些实施方案中,插入缺失导致约1个至约50个核苷酸的净变化。
如本文所述,“化学治疗剂”是指用于治疗病症,特别是癌症的化学物质,例如细胞毒性剂或细胞抑制剂。
如本文所述,“癌症疗法”和“癌症治疗”是同义词。
如本文所述,“化疗”和“化学疗法”和“化学治疗剂”是同义词。
本文中可互换使用的术语“同源性”或“同一性”是指两个多核苷酸序列之间或两个多肽序列之间的序列相似性,同一性是更严格的比较。短语“百分比同一性或同源性”和“同一性或同源性%”是指在两个或更多个多核苷酸序列或两个或更多个多肽序列的比较中发现的序列相似性的百分比。“序列相似性”是指两个或更多个多核苷酸序列之间碱基对顺序(通过任何合适的方法测定)的百分比相似性。两个或更多个序列的相似性可以是0-100%的任意值,或其间的任何整数值。可以通过比较每个序列中可以为比较目的而比对的位置来确定同一性或相似性。当比较序列中的位置被相同的核苷酸碱基或氨基酸占据时,那些分子在该位置是相同的。多核苷酸序列之间的相似性或同一性程度是多核苷酸序列共有的位置处的相同核苷酸或匹配核苷酸的数量的函数。多肽序列的同一性程度是多肽序列共有的位置处相同氨基酸数量的函数。多肽序列的同源性或相似性的程度是多肽序列共有的位置处氨基酸数量的函数。如本文所述,术语“基本上相同”是指至少75%、至少80%、至少85%、至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更多的同一性或同源性。
如本文所述的“可能”或“增加的可能性”是指项目、客体、事项或人将发生的概率增加。因此,在一个实例中,相对于参照个体或者个体组,可能会对使用pd-1抑制剂或pd-l1抑制剂的单独或组合治疗作出反应的个体对使用该抑制剂的单独或组合治疗作出反应的可能性增加。
“不太可能”指的是相对于参照物,事件、项目、客体、事项或人发生的概率降低。因此,相对于参照个体或者个体组,不太可能对使用pd-1抑制剂或pd-l1抑制剂的单独或组合治疗作出反应的个体对使用激酶抑制剂的单独或组合治疗作出反应的可能性降低。
“测序”核酸分子需要确定分子中至少1个核苷酸的同一性。在一些实施方案中,确定了分子中少于所有核苷酸的同一性。在其他实施方案中,确定了分子中大多数核苷酸或所有核苷酸的同一性。
如本文所述,“下一代测序或ngs或ng测序”是指以高通量方式(例如,超过105个分子同时测序)确定单个核酸分子(例如,在单分子测序中)或者用于单个核酸分子的克隆扩增替代物(proxide)的核苷酸序列的任何测序方法。在一个实施方案中,可以通过对由测序实验产生的数据中其同源序列出现的相对次数进行计数,来估计文库中核酸种类的相对丰度。下一代测序方法是本领域已知的,并且描述于例如metzker,m.(2010)naturebiotechnologyreviews11:31-46中,该文献通过引用并入本文。下一代测序可以检测样本中少于5%的核酸中存在的变异。
“样本”“组织样本”“患者样本”“患者细胞或组织样本”或“试样”各自指从个体或患者获得的组织和细胞,例如循环细胞。组织样本的来源可以是来自新鲜、冷冻和/或保存的器官、组织样本、活体组织切片或抽出物的实体组织;血液或任何血液成分;体液,例如脑脊髓液、羊水、腹膜液或间质液;或来自妊娠期或个体发育的任何时期的细胞。组织样本可含有本质上不与组织天然混合的化合物,例如防腐剂、抗凝血剂、缓冲剂、固定剂、营养素、抗生素等。在一个实施方案中,将样本保存为冷冻样本或甲醛或多聚甲醛固定的石蜡包埋(ffpe)组织制剂。例如,样本可以嵌入基质中,例如ffpe块或冷冻样本。
如本文所述的“肿瘤核酸样本”是指来自肿瘤样本或癌症样本的核酸分子。通常,它是来自肿瘤样本或癌症样本的dna,例如基因组dna,或源自rna的cdna。在某些实施方案中,肿瘤核酸样本是经纯化或分离的(例如,将其从其天然状态中分离)。
如本文所述的“对照”或“参照”“核酸样本”是指来自对照样本或参照样本的核酸分子。通常,它是dna,例如基因组dna,或源自rna的cdna,不包含基因或基因产物中的改变或变异,例如不包含突变。在某些实施方案中,参照核酸样本或对照核酸样本是野生型序列或非突变序列。在某些实施方案中,参照核酸样本是经纯化或分离的(例如,将其从其天然状态中分离)。在其他实施方案中,参照核酸样本来自非肿瘤样本,例如血液对照品、正常邻近组织(nat)或来自相同个体或不同个体的任何其他非癌样本。
如本文所述,“与询问位置相邻”是指足够接近的位点,使得与该位点互补的检测试剂可用于区分突变(例如,本文所述的改变)与参考序列(例如,靶核酸中的非突变序列或野生型序列)。如本文所述,直接相邻是在2个核苷酸之间没有间插核苷酸的情况。
如本文所述,“相关突变”是指距定义突变预定距离以内(就核苷酸序列或一级氨基酸序列而言)的突变,例如本文所述的突变体。在一些实施方案中,相关突变在n以内,其中n是距定义突变2、5、10、20、30、50、100或200个核苷酸(n不包括限定相关突变和定义突变的核苷酸)。在一些实施方案中,相关突变是易位突变。
如本文所述,“询问位置”包含至少一个核苷酸(或者,在多肽的情况下,氨基酸残基),其对应于在目标突变(例如,被鉴定的突变)中突变的核苷酸(或氨基酸残基),或者在被分析(例如,被测序)的核酸或者被回收的核酸(或蛋白质)中突变的核苷酸(或氨基酸残基)。
本文所述的“参考序列”,例如,作为突变序列的比较物,是在询问位置具有与被分析的突变体不同的核苷酸或氨基酸的序列。在一个实施方案中,参考序列对于至少该询问位置是野生型的。
序号例如(a)、(b)、(i)等仅仅是为了便于阅读说明书和权利要求而给出。在说明书或权利要求中使用序号不要求步骤或要素按照字母或数字顺序或它们的呈现顺序执行。
以下更详细地描述本发明中的各个方面。在整个说明书中列出了其他定义。
疗法和药剂
“用于治疗”、“治疗”以及该术语的其他形式是指单独或与第二药剂组合施用一种药剂,例如治疗剂,其量可有效阻止癌症的生长,使癌的重量或体积缩减,以延长个体的预期存活时间和/或肿瘤等的进展时间。在这些个体中,治疗可包括但不限于抑制肿瘤生长、减少肿瘤质量、减少转移性病灶的大小或数量、抑制新转移病灶的发展、延长存活期、延长无进展存活期、延长进展时间和/或提高生活质量。如果癌症的至少一种症状得到缓解、终止、减缓或预防,则癌症“被治疗”。如果癌症的复发或转移被减少、减缓、延迟或预防,癌症也“被治疗”。
如本文所述,除非另有说明,否则术语“预防”“防止”和“阻止”关注在个体开始患有癌症的再生长之前产生的作用和/或抑制或降低癌症的严重性的作用。
如本文所述,除非另有说明,药剂的“治疗有效量”是足以在癌症的治疗或控制中提供治疗效果或延迟或最小化与癌症相关的一种或多种症状的量。化合物的治疗有效量是指单独使用或与其他治疗剂组合使用的治疗剂的量,其为在癌症的治疗或控制中提供治疗效果的量。术语“治疗有效量”可包括改善整体治疗、减少或避免癌症的症状或原因或增强另一种治疗剂的治疗功效的量。
如本文所述,除非另有说明,药剂的“预防有效量”是足以防止癌症再生长或与癌症相关的一种或多种症状或预防其复发的量。药剂的预防有效量是指单独使用或与其他治疗剂组合使用的药剂的量,其为在预防癌症方面提供预防效果的量。术语“预防有效量”可包括改善总体预防或增强另一种预防剂的预防功效的量。
术语“患者”或“个体”包括人(例如,任何年龄组的男性或女性),例如儿科患者(例如,婴儿、儿童、青少年)或成年患者(例如,年轻成人、中年成人或高龄成人)。在某些实施方案中,个体是具有如本文所述的黑素瘤或具有患有本文所述黑素瘤的风险的成年个体(例如,男性或女性成年个体)。在某些实施方案中,个体是年龄为10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90岁或以上的个体。在某些实施方案中,个体年龄为0-10岁、10-20岁、20-30岁、30-40岁、40-50岁、50-60岁、60-70岁、70-80岁或80-90岁。在某些实施方案中,个体年龄在25岁至29岁之间。在其他实施方案中,个体年龄在15岁至29岁之间。在一些实施方案中,个体是女性并且年龄在15岁至29岁之间。在某些实施方案中,个体年龄为65岁或更高。
当术语“患者”或“个体”与化合物或药物施用联合使用时,则患者是化合物或药物的治疗、观察和/或施用的对象。
如本文所述的药剂,例如治疗剂,可以与第二治疗剂或不同的治疗方式(例如抗癌剂)组合施用,和/或与手术和/或放射程序组合施用。
“与......组合”并不意味着必须同时施用疗法或治疗剂和/或将其配制为一起递送,尽管这些递送方法在本发明的范围内。药物组合物可以与一种或多种其他另外的疗法或治疗剂同时施用,或在其之前或在其之后施用。通常,每种药剂将以针对该药剂确定的剂量和/或时间表施用。还应理解,组合中使用的治疗剂可以在单一组合物中一起施用或在不同组合物中单独施用。在方案中使用的特定组合将考虑第一治疗活性剂与其他治疗活性剂的相容性和/或要实现的所需治疗效果。
如本文所述,术语“应答者”包括响应于治疗、肿瘤尺寸减小或体内癌症程度减轻或者显示一个或多个(例如,大多数或所有)癌症体征消失的个体,例如,如recist1.1标准所定义。
如本文所述,术语“部分应答者”包括响应于治疗、肿瘤尺寸减小或体内癌症程度减轻的个体,例如,如recist1.1标准所定义。
如本文所述,术语“完全应答者”包括响应于治疗、大多数或所有癌症体征消失的个体,例如,如recist1.1标准所定义。癌症不一定在完全应答者中治愈。
如本文所述,术语“无应答者”包括肿瘤尺寸没有减小或者体内癌症程度没有减轻的个体,例如,如recist1.1标准所定义。
在一些实施方案中,按照标准的部分应答或完全应答的定义(recist1.1标准)或持续至少12个月的非典型免疫相关应答,个体可以被分类为应答者(例如,完全应答者或部分应答者)或无应答者。在一些实施方案中,具有混合应答需要额外的全身治疗或在小于12个月内引起临床恶化(例如,由临床医生确定)的个体被认为是无应答者(例如,在额外的全身治疗或临床恶化之前、之时或之后)。在某些实施方案中,基于成像和临床医生笔记的临床评论对疗法应答进行分类。例如,在eisenhaueretal.eurjcancer.2009;45(2):228-247中描述了recist1.1标准。
在一些实施方案中,基于每个预选单位(例如,每兆碱基),在预定的一组基因中,例如,预定组基因的编码区,应答者(例如,完全应答者或部分应答者)具有约3.3个或更多体细胞改变的样本(例如,肿瘤样本)突变负荷。在一些实施方案中,基于每个预选单位(例如,每兆碱基),在预定的一组基因中,例如,预定组基因的编码区,应答者(例如,完全应答者)具有约23.1个或更多体细胞改变的样本(例如,肿瘤样本)突变负荷。在一些实施方案中,基于每个预选单位(例如,每兆碱基),在预定的一组基因中,例如,预定组基因的编码区,应答者(例如,部分应答者)具有约3.3个或更多但少于23.2个的体细胞改变的样本(例如,肿瘤样本)突变负荷。在一些实施方案中,基于每个预选单位(例如,每兆碱基),在预定的一组基因中,例如,预定组基因的编码区,无应答者具有少于约3.3个体细胞改变的样本(例如,肿瘤样品)突变负荷。
在一些实施方案中,应答者(例如,完全应答者或部分应答者)是患者组的成员(例如,在临床试验中),其具有至少约29%(例如,至少约35%,至少约40%,至少约50%,至少约60%,至少约70%,至少约80%,至少约85%,至少约90%,或至少约95%)的客观应答率(orr)。在一些实施方案中,应答者(例如,完全应答者)是患者组的成员,其具有至少约85%(例如,至少约90%或至少约95%)的客观应答率(orr)。在一些实施方案中,应答者(例如,部分应答者)是患者组的成员,其具有约29%至约85%(例如,约30%至约80%,约40%至约70%,或约50%至约60%之间)的客观应答率(orr)。在一些实施方案中,无应答者是患者组的成员,其具有小于约25%(例如,小于约20%或小于约10%)的客观应答率(orr)。
示例性治疗剂和治疗方式
药剂,例如治疗剂,可以是小分子、蛋白质、多肽、肽、抗体分子、核酸(例如、sirna、反义rna或微rna)、小分子或免疫细胞治疗。本文描述了示例性药剂和药剂种类。
在一个实施方案中,药剂(例如治疗剂)结合和/或抑制pd-1或pd-l1。在一个实施方案中,所述药剂是抗体分子。本文可互换使用的术语“抗体”和“抗体分子”是指免疫球蛋白分子和免疫球蛋白分子的免疫活性部分,即含有特异性结合抗原的抗原结合位点的分子,例如本发明特征的多肽。特异性结合本发明特征的给定多肽的分子是结合多肽但基本上不结合样本中的其他分子的分子,例如天然含有多肽的生物样本。免疫球蛋白分子的免疫活性部分的实例包括f(ab)和f(ab’)2片段,其可通过用酶(例如胃蛋白酶)处理抗体而产生。本发明提供了多克隆抗体和单克隆抗体。如本文所述,术语“单克隆抗体”或“单克隆抗体组合物”是指抗体分子群,其仅含有一种能够与特定表位发生免疫反应的抗原结合位点。本领域已知针对pd-1的抗体或针对pd-l1的抗体,以及产生针对多肽靶标(例如pd-1或pd-l1)的抗体的技术。
示例性pd-1抑制剂
在某些实施方案中,pd-1抑制剂是抗pd-1抗体。在某些实施方案中,pd-1抑制剂选自纳武单抗(ono-4538、bms-936558或mdx1106)、帕博利珠单抗(mk-3475或拉姆珠单抗)、皮地利珠单抗(ct-011)、medi0680(amp-514)、pdr001、regn2810、bgb-108、bgb-a317、shr-1210(hr-301210、shr1210或shr-1210)、pf-06801591或amp-224。
在其他实施方案中,pd-1抑制剂是选自纳武单抗、帕博利珠单抗或皮地利珠单抗的抗pd-1抗体。
在一些实施方案中,抗pd-1抗体是纳武单抗(cas登记号:946414-94-4)。纳武单抗的其他名称包括mdx-1106、mdx-1106-04、ono-4538或bms-936558。纳武单抗是一种完全人igg4单克隆抗体,其可特异性阻断pd1。纳武单抗(克隆5c4)和特异性结合pd1的其他人单克隆抗体公开于例如us8,008,449和wo2006/121168中。在一个实施方案中,pd-1抑制剂是纳武单抗,并且具有分别在us8,008,449和wo2006/121168中公开为seqidno:2和seqidno:3的重链氨基酸序列和轻链氨基酸序列(或基本上相同的或类似的氨基酸序列,例如,与指定的氨基酸序列相似度至少为85%、90%、95%或更高的序列)。
在一些实施方案中,抗pd-1抗体是帕博利珠单抗。帕博利珠单抗(也称为拉姆珠单抗、mk-3475、mk03475、sch-900475或
在一些实施方案中,抗pd-1抗体是皮地利珠单抗。皮地利珠单抗(ct-011;curetech)是与pd-1结合的人源化igg1k单克隆抗体。皮地利珠单抗和其他人源化抗pd-1单克隆抗体公开在wo2009/101611中。
其他抗pd-1抗体包括amp514(amplimmune),尤其是例如us8,609,089、us2010028330和/或us20120114649中公开的抗pd1抗体。
示例性pd-l1抑制剂
在某些实施方案中,pd-l1抑制剂是抗pd-l1抗体。在某些实施方案中,pd-l1抑制剂选自阿特珠单抗(mpdl3280a、rg7446或ro5541267)、yw243.55.s70、mdx-1105、度伐鲁单抗(medi4736)或巴文西亚(msb0010718c)。
在一些实施方案中,pd-l1抑制剂是抗体分子。在一些实施方案中,抗pd-l1抑制剂选自yw243.55.s70、mpdl3280a、medi-4736、msb-0010718c或mdx-1105。
在一些实施方案中,抗pd-l1抗体是msb0010718c。msb0010718c(也称为a09-246-2;merckserono)是与pd-l1结合的单克隆抗体。msb0010718c和其他人源化抗pd-l1抗体公开于例如wo2013/079174中,并且具有在wo2013/079174中分别公开为seqidno:24和seqidno:25的重链可变区氨基酸序列和轻链可变区氨基酸序列(或基本上与其相同或相似的序列,例如,与指定的氨基酸序列的相似度至少为85%、90%、95%或更高的氨基酸序列)。
在一个实施方案中,pd-l1抑制剂是yw243.55.s70。yw243.55.s70抗体是wo2010/077634中描述的抗pd-l1抗体(在wo2010/077634中重链可变区氨基酸序列和轻链可变区氨基酸序列分别示为seqidno:20和seqidno:21),并具有其中公开的序列(或与其基本相同或相似的氨基酸序列,例如,与指定序列的相似度为至少85%、90%、95%或更高的氨基酸序列)。
在一个实施方案中,pd-l1抑制剂是mdx-1105。mdx-1105,也称为bms-936559,是wo2007/005874中描述的抗pd-l1抗体,并且具有其中公开的序列(或与其基本相同或相似的序列,例如,与指定序列的相似度为至少85%、90%、95%或更高的序列)。
在一个实施方案中,pd-l1抑制剂是mdpl3280a(基因泰克(genentech)/罗氏公司(roche))。mdpl3280a是与pd-l1结合的人fc优化的igg1单克隆抗体。mdpl3280a和其他针对pd-l1的人单克隆抗体公开于美国专利号7,943,743和美国公开号20120039906中。
其他疗法
本文所述的治疗可以提供给对不同疗法(例如非抗pd-1和/或非抗pd-l1治疗剂或治疗方式)具有不令人满意的应答的患者。在一个实施方案中,个体正在经历或已经历过不同疗法(例如非抗pd-1和/或非抗pd-l1治疗剂或治疗方式)的治疗。所述不同疗法可以是小分子、蛋白质、多肽、肽、抗体分子、核酸(例如,sirna、反义rna或微rna)或细胞。
在一个实施方案中,所述不同疗法选自化学疗法、放射疗法、免疫疗法、免疫放射性疗法,溶瘤病毒疗法、外科手术或其任何组合。在一个实施方案中,所述不同疗法包括以下一种或多种:达卡巴嗪、替莫唑胺、白细胞介素-2(il-2)、干扰素、ctla-4抑制剂(例如,抗ctla-4抗体,例如伊匹单抗)、braf抑制剂、mek抑制剂、溶瘤病毒(talimogenelaherparepvec)、过继细胞转移或其任何组合。在一个实施方案中,所述不同疗法包括以下一种或多种:达卡巴嗪、替莫唑胺、白细胞介素-2(il-2)(例如,重组干扰素α-2b或聚乙二醇干扰素α-2b)、干扰素、伊匹单抗、braf抑制剂(例如,维罗非尼或达拉菲尼)、mek抑制剂(例如,考比替尼或曲美替尼)、溶瘤病毒(talimogenelaherparepvec)、过继细胞转移(例如,修饰的t细胞或修饰的树突细胞)或其任何组合。
本文所述的药剂(例如治疗剂)可单独施用或组合施用,例如与其他化学治疗剂或程序组合施用,其用量足以减少或抑制肿瘤细胞生长,和/或治疗或预防个体中的癌症。
核酸抑制剂
在另一个实施方案中,所述药剂是核酸抑制剂,其选自反义分子、核酶、双链rna分子、三螺旋分子,其与编码突变的核酸杂交,或与阻断或减少突变的mrna表达的转录调节区杂交。
在一个实施方案中,核酸拮抗剂是靶向编码突变的mrna的sirna。也可以使用其他类型的拮抗核酸,例如dsrna、核酶、三螺旋形成体或反义核酸。因此,提供了分离的核酸分子,该核酸分子是编码突变的核酸分子的核酸抑制剂,例如反义rnai。
“反义”核酸可包括与编码蛋白质的“有义”核酸互补(例如,与双链cdna分子的编码链互补或与mrna序列互补)的核苷酸序列。反义核酸可以与编码一个或多个突变的完整核苷酸序列互补,或仅与其一部分互补。在另一个实施方案中,反义核酸分子与编码一个或多个突变(例如,5’非翻译区和3’非翻译区)的核苷酸序列的编码链的“非编码区”反义。反义剂可包括,例如,约8个至约80个核碱基(即,约8个至约80个核苷酸),例如约8个至约50个核碱基,或约12个至约30个核碱基。反义化合物包括核酶、外部指导序列(egs)寡核苷酸(寡酶)和其他与靶核酸杂交并调节其表达的短催化rna或催化寡核苷酸。反义化合物可包括一段至少八个连续的核碱基,其与靶基因中的序列互补。寡核苷酸不需要与其靶核酸序列100%互补即可特异性杂交。当寡核苷酸与靶标的结合干扰靶分子的正常功能以导致效用丧失时,寡核苷酸是可特异性杂交的,并且存在足够程度的互补性以避免在需要特异性结合的条件下进行寡核苷酸与非靶标序列的非特异性结合,所述条件即体内测定或治疗处理情况下的生理条件或体外测定情况下进行测定的条件。
反义寡核苷酸与mrna的杂交可以干扰mrna的一种或多种正常功能。受干扰的mrna的功能包括所有关键功能,例如,rna转移到蛋白质翻译位点、从rna翻译成蛋白质、剪接rna以产生一种或多种mrna和催化可能由rna参与的活动。特定蛋白质与rna的结合也可能受到与rna的反义寡核苷酸杂交的干扰。
示例性的反义化合物包括与靶核酸特异性杂交的dna序列或rna序列,例如编码本文所述突变的mrna。互补区可以延伸约8个至约80个核碱基。化合物可包括一个或多个修饰的核碱基。修饰的核碱基是本领域已知的。也可获得经修饰的核酸试剂的描述。参见,例如,美国专利号4,987,071、5,116,742和5,093,246;woolfetal.(1992)procnatlacadsciusa;antisensernaanddna,d.a.melton,ed.,coldspringharborlaboratory,coldspringharbor,n.y.(1988);89:7305-9;haselhoffandgerlach(1988)nature334:585-59;helene,c.(1991)anticancerdrugdes.6:569-84;helene(1992)ann.n.y.acad.sci.660:27-36;和maher(1992)bioassays14:807-15。
反义核酸分子通常施用于个体(例如,通过在组织部位直接注射),或原位产生,使得它们与编码突变的细胞mrna和/或基因组dna杂交或结合,从而(例如,通过抑制转录和/或翻译)抑制蛋白质的表达。或者,可以修饰反义核酸分子以靶向选定的细胞,然后全身施用。对于全身施用,可以修饰反义分子(例如,通过将反义核酸分子连接到与细胞表面受体或抗原结合的肽或抗体上),使得它们特异性结合选定细胞表面上表达的受体或抗原。也可以使用本文所述的载体将反义核酸分子递送至细胞。为了获得足够的细胞内反义分子浓度,优选将反义核酸分子置于强polii或poliii启动子控制下的载体构建体。
在另一个实施方案中,反义核酸分子是α-异头核酸分子。α-异头核酸分子与互补rna形成特异性双链杂交体,其中与通常的β-单元相反,链彼此平行(gaultieretal.(1987)nucleicacids.res.15:6625-6641)。反义核酸分子还可以包含2’-o-甲基核糖核苷酸(inoueetal.(1987)nucleicacidsres.15:6131-6148)或嵌合rna-dna类似物(inoueetal.(1987)febslett.215:327-330)。
sirna是小双链rna(dsrna),其任选地包括突出端。例如,sirna的双链体区长度为约18个至25个核苷酸,例如长度为约19、20、21、22、23或24个核苷酸。通常,sirna序列与靶mrna精确互补。特别地,dsrna和sirna可用于沉默哺乳动物细胞(例如人细胞)中的基因表达。sirna还包括短发夹rna(shrna),该短发夹rna具有29个碱基对的茎和2个核苷酸的3’突出端。参见,例如,clemensetal.(2000)proc.natl.acad.sci.usa97:6499-6503;billyetal.(2001)proc.natl.sci.usa98:14428-14433;elbashiretal.(2001)nature.411:494-8;yangetal.(2002)proc.natl.acad.sci.usa99:9942-9947;siolasetal.(2005),nat.biotechnol.23(2):227-31;美国专利公开号20040086884、20030166282、20030143204、20040038278和20030224432。
在另一个实施方案中,本发明特征的反义核酸是核酶。对编码突变的核酸具有特异性的核酶可包括与本文公开的突变cdna的核苷酸序列互补的一个或多个序列,以及具有负责mrna切割的已知催化序列的序列(参见美国专利号5,093,246或haselhoffandgerlach(1988)nature334:585-591)。例如,可构建四膜虫l-19ivsrna的衍生物,其中活性位点的核苷酸序列与编码突变的mrna中待切割的核苷酸序列互补。参见,例如,cech等人的美国专利号4,987,071;和cech等人的美国专利号5,116,742。或者,突变mrna可用于从rna分子库中选择具有特异性核糖核酸酶活性的催化性rna。参见,例如,bartel,d.andszostak,j.w.(1993)science261:1411-1418。
突变基因的抑制可以通过靶向与突变调节区互补的核苷酸序列以形成三螺旋结构来实现,所述三螺旋结构阻止突变基因在靶细胞中的转录。通常参见helene,c.(1991)anticancerdrugdes.6:569-84;helene,c.i(1992)ann.n.y.acad.sci.660:27-36;和maher,l.j.(1992)bioassays14:807-15。可以通过产生所谓的“之字形”核酸分子来增加可以靶向三螺旋形成的潜在序列。之字形分子以交替的5’-3’、3’-5’方式合成,使得它们与双链体的第一条链碱基配对,然后与双链体的另一条链碱基配对,消除了在双链体的一条链上存在相当大一段嘌呤或嘧啶的必要性。
本发明还提供了可检测的经标记的寡核苷酸引物和探针分子。通常,这种标记是化学发光的、荧光的、放射性的或比色的。
可以在碱基部分、糖部分或磷酸骨架处修饰突变的核酸分子,以改善例如分子的稳定性、杂交或溶解性。对于具有修饰的合成寡核苷酸的非限制性实例,参见toulmé(2001)naturebiotech.19:17和fariaetal.(2001)naturebiotech.19:40-44。这种亚磷酰胺寡核苷酸可以是有效的反义剂。
例如,可以修饰核酸分子的脱氧核糖磷酸主链以产生肽核酸(参见hyrupb.etal.(1996)bioorganic&medicinalchemistry4:5-23)。如本文所述,术语“肽核酸”或“pna”是指核酸模拟物,例如dna模拟物,其中脱氧核糖磷酸骨架被假肽骨架取代,并且仅保留了四个天然核碱基。pna的中性骨架使得可以在低离子强度的条件下与dna和rna进行特异性杂交。pna寡聚体的合成可以使用hyrupb.etal.(1996)supraandperry-o'keefeetal.proc.natl.acad.sci.93:14670-675中所述的标准固相肽合成方案进行。
突变核酸分子的pna可用于治疗和诊断应用。例如,pna可用作反义剂或反基因剂,用于通过例如诱导转录或翻译扣留或抑制复制来进行基因表达的序列特异性调节。突变核酸分子的pna也可用于分析基因中的单碱基对突变(例如,通过pna指导的pcr钳制);作为与其他酶组合使用时(例如,s1核酸酶(hyrupb.etal.(1996)supra))的“人工限制酶”;或作为用于dna测序或杂交的探针或引物(hyrupb.etal.(1996)supra;perry-o'keefesupra)。
在其他实施方案中,寡核苷酸可以包括其他附加的基团,例如肽(例如,用于体内靶向宿主细胞受体),或促进跨细胞膜(参见,例如,letsingeretal.(1989)proc.natl.acad.sci.usa86:6553-6556;lemaitreetal.(1987)proc.natl.acad.sci.usa84:648-652;w088/09810)或血脑屏障(参见例如wo89/10134)转运的试剂。另外,寡核苷酸可以用杂交触发的切割剂(参见,例如,kroletal.(1988)bio-techniques6:958-976)或插入剂(参见,例如,zon(1988)pharm.res.5:539-549)来修饰。为此,寡核苷酸可以与另一分子(例如,肽、杂交触发的交联剂、转运剂或杂交触发的切割剂)缀合。
在一些实施方案中,提供本文所述的核酸抑制剂用于抑制包含体外变异的核酸的表达。
癌症
本文所述的发明可用于治疗癌症或评估患有癌症的个体。
示例性癌症包括但不限于黑素瘤、b细胞癌、例如多发性骨髓瘤、乳腺癌、肺癌(例如非小细胞肺癌或nsclc)、支气管癌、结肠直肠癌、前列腺癌、胰腺癌、胃癌、卵巢癌、膀胱癌、脑或中枢神经系统癌、外周神经系统癌、食道癌、宫颈癌、子宫或子宫内膜癌、口腔癌或咽癌、肝癌、肾癌、睾丸癌、胆道癌、小肠癌或阑尾癌、唾液腺癌、甲状腺癌、肾上腺癌、骨肉瘤、软骨肉瘤、血液组织癌、腺癌、炎性肌纤维母细胞瘤、胃肠道间质瘤(gist)、结肠癌、多发性骨髓瘤(mm)、骨髓增生异常综合征(mds)、骨髓增生性疾病(mpd)、急性淋巴细胞白血病(all)、急性髓细胞白血病(aml)、慢性粒细胞性白血病(cml)、慢性淋巴细胞性白血病(cll)、真性红细胞增多症、霍奇金淋巴瘤、非霍奇金淋巴瘤(nhl)、软组织肉瘤、纤维肉瘤、粘液肉瘤、脂肪肉瘤、骨原性肉瘤、脊索瘤、血管肉瘤、内皮肉瘤、淋巴管肉瘤、淋巴管内皮肉瘤、滑膜瘤、间皮瘤、尤文氏瘤、平滑肌肉瘤、横纹肌肉瘤、鳞状细胞癌、基底细胞癌、腺癌、汗腺癌、皮脂腺癌、乳头状癌、乳头状腺癌、髓样癌、支气管癌、肾细胞癌、肝癌、胆管癌、绒毛膜癌、精原细胞瘤、胚胎癌、肾母细胞瘤、膀胱癌、上皮癌、神经胶质瘤、星形细胞瘤、成神经管细胞瘤、颅咽管瘤、室管膜瘤、松果体瘤、血管母细胞瘤、听神经瘤、少突胶质细胞瘤、脑膜瘤、神经母细胞瘤、视网膜母细胞瘤、滤泡性淋巴瘤、弥漫性大b-细胞淋巴瘤、套细胞淋巴瘤、肝细胞癌、甲状腺癌、胃癌、头颈癌、小细胞癌、原发性血小板增多症、特发性髓样化生、嗜酸性粒细胞增多症、系统性肥大细胞增多症、常见嗜酸性粒细胞增多症、慢性嗜酸性粒细胞白血病、神经内分泌癌、类癌瘤,以及它们的转移性病变。
黑素瘤
本发明至少部分地提供了治疗个体中的癌症(例如黑素瘤)的方法。在某些实施方案中,所述方法包括治疗癌症,例如黑素瘤,其具有本文所述的变异(例如,表1中公开的基因的改变,例如,本文所述的nf1基因或lrp1b基因处的改变)。该方法包括向个体施用治疗剂,例如免疫治疗剂,例如pd-1抑制剂或pd-l1抑制剂。
在某些实施方案中,癌症是黑素瘤。在某些实施方案中,癌症是晚期黑素瘤。在某些实施方案中,癌症是转移性黑素瘤。在某些实施方案中,癌症(例如黑素瘤)具有再发生或复发的高风险。在某些实施方案中,癌症(例如黑素瘤)具有高转移风险。在一些实施方案中,黑素瘤是根据本领域技术人员已知的任何合适的黑素瘤分类系统定义的任何阶段或风险组的黑素瘤。
在某些实施方案中,黑素瘤是0期、ia期、ib期、iia期、iib期、iic期、iii期或iv期黑素瘤中的任何一种。在其他实施方案中,黑素瘤是美国癌症联合委员会(ajcc)黑素瘤分期系统所定义的0期、ia期、ib期、iia期、iib期、iic期、iii期或iv期黑素瘤中的任何一种。在一些实施方案中,黑素瘤是根据本领域技术人员已知的任何合适的黑素瘤分类系统定义的任何阶段的黑素瘤。在其他实施方案中,黑素瘤是表2a-2b中列出的0期、ia期、ib期、iia期、iib期、iic期、iii期或iv期黑素瘤中的任何一种。
在某些实施方案中,黑素瘤是iii期或iv期黑素瘤。在某些实施方案中,黑素瘤是iii期黑素瘤。在某些实施方案中,根据本领域技术人员已知的任何合适的黑素瘤分类系统,黑素瘤是iii期黑素瘤。在某些实施方案中,癌症是表2a-2b中列出的iii期黑素瘤。在某些实施方案中,黑素瘤是iv期黑素瘤。在某些实施方案中,根据本领域技术人员已知的任何合适的黑素瘤分类系统,黑素瘤是iv期黑素瘤。在某些实施方案中,癌症是表2a-2b中列出的iv期黑素瘤。
在某些实施方案中,黑素瘤是晚期黑素瘤。在一些实施方案中,晚期黑素瘤是iii期黑素瘤或iv期黑素瘤,例如,如表2a-2b中所示。在某些实施方案中,黑素瘤是转移性黑素瘤。在一些实施方案中,转移性黑素瘤是iii期黑素瘤或iv期黑素瘤,例如,如表2a-2b中所示。
表2a皮肤黑素瘤的tnm分期分类*
缩写:na,不适用;ldh,乳酸脱氢酶。
*balchetal.“finalversionof2009ajccmelanomastagingandclassification,”jclinoncol.2009;27(36):6199-6206。
表2b皮肤黑素瘤的解剖阶段分组*
*balchetal.“finalversionof2009ajccmelanomastagingandclassification,”jclinoncol.2009;27(36):6199-6206。
在某些实施方案中,黑素瘤是皮肤黑素瘤。在其他实施方案中,黑素瘤是非皮肤黑素瘤。
在某些实施方案中,癌症,例如黑素瘤,例如晚期黑素瘤或转移性黑素瘤,包括或被鉴定为或确定为具有改变,例如本文所述的改变,例如在本文所述的基因处的改变。在某些实施方案中,癌症,例如黑素瘤,例如晚期黑素瘤或转移性黑素瘤,包括或被鉴定为或确定为具有表1中所述基因处的改变。在其他实施方案中,癌症,例如,黑素瘤,例如晚期黑素瘤或转移性黑素瘤,包括或被鉴定为或确定为具有表1中所述基因处的多个改变。在其他实施方案中,癌症,例如黑素瘤,例如晚期黑素瘤或转移性黑素瘤,包括或被鉴定为或确定为具有表1中所述的多个基因处的多个改变。
在某些实施方案中,癌症,例如黑素瘤,例如晚期黑素瘤或转移性黑素瘤,包括或被鉴定为或确定为具有nf1基因处的改变,例如,如本文所述的nf1基因处的改变。
在某些实施方案中,与nf1的野生型活性相比,nf1基因处的改变导致nf1基因产物(例如,nf1蛋白质)的活性降低。例如,改变可导致gtp酶活化剂的活性以及磷脂酰胆碱结合活性和/或nf1的磷脂酰乙醇胺结合活性的改变(例如,降低)。在某些实施方案中,改变导致ras的活化升高。
在一个实施方案中,nf1基因处的改变是突变或者包含突变(例如,体细胞突变),例如取代(例如碱基取代)、插入或缺失。例如,在wiesneretal.amjsurgpathol.2015;39(10):1357-62;krauthammeretal.natgenet.2015;47(9):996-1002中描述了与黑素瘤相关的示例性nf1改变。nf1基因的其他改变描述于例如cosmic数据库(cancer.sanger.ac.uk/cosmic;forbesetal.nucl.acidsres.2015;43(d1):d805-d811)中。
在某些实施方案中,癌症,例如黑素瘤,例如晚期黑素瘤或转移性黑素瘤,包括或鉴定为或确定为具有lrp1b基因处的改变,例如,如本文所述的lrp1b基因处的改变。
在某些实施方案中,与lrp1b的野生型活性相比,lrp1b基因处的改变导致lrp1b基因产物(例如,lrp1b蛋白质)的活性降低。例如,改变可导致lrp1b的钙离子结合和/或低密度脂蛋白受体活性的改变(例如,降低)。
在一个实施方案中,lrp1b基因处的改变是突变或包含突变(例如,体细胞突变),例如取代(例如碱基取代)、插入或缺失。例如,在nikolaevetal.natgenet.2011;44(2):133-9中描述了与黑素瘤相关的示例性lrp1b改变。lrp1b基因中的其他改变描述于例如cosmic数据库(cancer.sanger.ac.uk/cosmic;forbesetal.nucl.acidsres.2015;43(d1):d805-d811)中。
在其他实施方案中,癌症,例如黑素瘤,例如晚期黑素瘤或转移性黑素瘤,包括或鉴定为或确定为具有braf基因处的改变,例如,如本文所述的braf基因处的改变。
在某些实施方案中,与braf的野生型活性相比,braf基因处的改变导致braf基因产物(例如braf蛋白质)的活性增加。例如,改变可导致braf的一种或多种以下活性的改变:atp结合钙、离子结合、相同蛋白质结合、map激酶活性、蛋白质激酶活性或蛋白丝氨酸/苏氨酸激酶活性。在某些实施方案中,所述改变导致braf的激酶活性的改变(例如,增加)。
在一个实施方案中,braf改变是突变或包含突变(例如,体细胞突变),例如取代(例如碱基取代)、插入或缺失。在某些实施方案中,改变是碱基取代。
在某些实施方案中,braf处的改变位于密码子v600。在某些实施方案中,braf处的改变是v600e改变。在某些实施方案中,braf处的改变是v600k改变。在某些实施方案中,braf处的改变是v600r改变。在某些实施方案中,braf处的改变是v600d改变。
在某些实施方案中,braf处的改变是除v600改变之外的改变。在某些实施方案中,braf处的改变是k601改变。在某些实施方案中,braf处的改变是k601e改变。在某些实施方案中,braf处的改变是g469改变。在某些实施方案中,braf处的改变是g469e改变。在某些实施方案中,braf处的改变是d594改变。在某些实施方案中,braf处的改变是d594g改变。在某些实施方案中,braf处的改变是l597改变。在某些实施方案中,braf处的改变是l597s改变。在某些实施方案中,braf处的改变是s467改变。在某些实施方案中,braf处的改变是s467l改变。
在其他实施方案中,癌症,例如黑素瘤,例如晚期黑素瘤或转移性黑素瘤,包括或鉴定为或确定为具有nras基因处的改变,例如,如本文所述的nras基因处的改变。
在某些实施方案中,与nras的野生型活性相比,nras基因处的改变导致nras基因产物(例如,nras蛋白质)的活性增加。例如,改变可导致nras的gtp酶活性的改变(例如,降低)。在某些实施方案中,nras蛋白质包含降低内在gtp水解的改变,例如,产生组成型激活nras。
在一个实施方案中,nras改变是突变或包含突变(例如,体细胞突变),例如取代(例如碱基取代)、插入或缺失。在某些实施方案中,改变是碱基取代。
在某些实施方案中,nras处的改变位于密码子q61。在某些实施方案中,nras处的改变是q61h改变。在某些实施方案中,nras处的改变是q61k改变。在某些实施方案中,nras处的改变是q61l改变。在某些实施方案中,nras处的改变是q61p改变。在某些实施方案中,nras处的改变是q61q改变。在某些实施方案中,nras处的改变是q61r改变。
在其他实施方案中,nras处的改变是g12改变。在某些实施方案中,nras处的改变是g12a改变。在某些实施方案中,nras处的改变是g12c改变。在某些实施方案中,nras处的改变是g12d改变。在某些实施方案中,nras处的改变是g12r改变。在某些实施方案中,nras处的改变是g12s改变。在某些实施方案中,nras处的改变是g12v改变。在某些实施方案中,nras处的改变是g13改变。在某些实施方案中,nras处的改变是g13c改变。在某些实施方案中,nras处的改变是g13d改变。在某些实施方案中,nras处的改变是g13r改变。在某些实施方案中,nras处的改变是g13v改变。在某些实施方案中,nras处的改变是s17改变。在某些实施方案中,nras处的改变是s17n改变。
突变负荷
如本文所述,术语“突变负荷”或“变异负荷”是指在预定的一组基因处(例如,在预定组基因的编码区中)每个预选单元(例如,每兆碱基)的改变(例如一个或多个改变,例如,一种或多种体细胞改变)的水平(例如,数量)。可以例如基于全基因组或外显子组,或基于基因组或外显子组的子集测量突变负荷。在某些实施方案中,可以对基于基因组或外显子组的子集测量的突变负荷进行外推,以确定全基因组或外显子组突变负荷。
在某些实施方案中,测量来自个体(例如本文所述的个体)的样本(例如,肿瘤样本,例如,黑素瘤样本或从黑素瘤获得的样本或源自黑素瘤的样本)中的突变负荷。在某些实施方案中,通过测定以下的一项、两项、三项或全部来测量突变负荷:
(i)在表1中列出的预定组基因处的体细胞改变水平,
(ii)在nf1基因处存在体细胞改变,
(iii)在lrp1b基因处的体细胞改变的数量,或
(iv)c至t转换的数量。
在某些实施方案中,在表1中列出的预定组基因处的体细胞改变水平与突变负荷(例如,全基因组突变负荷或外显子组突变负荷)相关。在某些实施方案中,nf1基因处体细胞改变的存在与突变负荷(例如,基于在表1中列出的预定组基因处的体细胞改变水平测量的突变负荷,或全基因组突变负荷或外显子组突变负荷)相关。在某些实施方案中,在lrp1b基因处体细胞改变的数量与突变负荷(例如,基于在表1中列出的预定组基因处的体细胞改变水平测量的突变负荷,或全基因组突变负荷或外显子组突变负荷)相关。在某些实施方案中,c至t转换的数量与突变负荷(例如,基于在表1中列出的预定组基因处的体细胞改变水平测量的突变负荷,或全基因组突变负荷或外显子组突变负荷)相关。
术语“突变负荷”“变异负荷”“突变负担”和“变异负担”在本文中可互换使用。在肿瘤的情况下,突变负荷在本文中也称为“肿瘤变异负荷”“肿瘤突变负荷”或“tmb”。
与癌症相关的示例性基因
本文所述的发明包括,例如,通过(例如,如本文所公开的)测定与癌症相关的预定组基因中的体细胞改变(例如,一种或多种体细胞改变)的水平来测量突变负荷。
在某些实施方案中,测定表1中列出的基因或基因产物中体细胞改变的水平。在某些实施方案中,测定表1中列出的基因的编码区中的体细胞改变的水平。
表1示例性基因
神经纤维瘤蛋白1(nf1)
本文所述的发明包括,例如,确定nf1基因处存在改变(例如,体细胞改变),或者,例如,通过确定nf1基因处存在改变(例如,体细胞改变)测量突变负荷。
神经纤维瘤蛋白1(nf1)基因,也称为wss、nfns或vrnf,编码一种作为ras信号转导途径的负调节物的蛋白质。该基因中的突变与例如1型神经纤维瘤病、幼年型髓单核细胞白血病和沃森综合征有关。该基因的mrna经历rna编辑(cga>uga->arg1306term),导致翻译过早终止。对于该基因,还描述了编码不同亚型的剪接转录物变体。
人nf1的核苷酸和氨基酸序列描述于以下文献中,例如,wallaceetal.science.1990;249:181-186,erratum:wallaceetal.science.1990;250:1749-1749(同种型1);marchuketal.genomics.1991;11:931-940(同种型1);cawthonetal.cell.1990;62:193-201(同种型1);bernardsetal.dnacellbiol.1992;11:727-734(同种型1和2);lietal.genomics.1995;25:9-18(同种型1和2);nishietal.oncogene.1991;6:1555-1559(同种型1和2);andersenetal.mol.cell.biol.1993;13:487-495(同种型2);suzukietal.biochem.biophys.res.commun.1991;181:955-961(同种型2);suzukietal.biochem.biophys.res.commun.1992;187:984-990(同种型3);martinetal.cell.1990;63:843-849(同种型4);suzukietal.tohokuj.exp.med.1995;175:225-233(同种型5);和xuetal.cell.1990;62:599-608(同种型1和6)。
人nf1的其他变体、突变和多态性也描述于以下文献中,例如,upadhyayaetal.hum.mutat.1994;4:83-101;shenetal.j.med.genet.1996;33:2-17;lietal.cell.1992;69:275-281(变体glu-1444);upadhyayaetal.hum.mol.genet.1992;1:735-740(变体nf1met-2164和asn-2192);tassabehjietal.am.j.hum.genet.1993;53:90-95(变体gly-his-glu-gln-gln-lys-leu-pro-ala-ala-thr-leu-ala-leu-1733ins);shenetal.hum.mol.genet.1993;2:1861-1864(变体met-991del);purandareetal.hum.mol.genet.1994;3:1109-1115(变体nf1asp-1166和arg-1440);abernathyetal.hum.mutat.1994;3:347-352(变体nf12387-asn-phe-2388del);upadhyayaetal.j.med.genet.1995;32:706-710(变体nf1ala-2631);gasparinietal.hum.genet.1996;97:492-495(变体nf1arg-629);wuetal.hum.mutat.1996;8:51-56(变体nf1arg-1035);upadhyayaetal.hum.genet.1997;99:88-92(变体nf1ser-1412;gln-1440;glu-1444和gly-1489);maynardetal.hum.genet.1997;99:674-676(变体nf1arg-844和pro-898);hudsonetal.hum.mutat.1997;9:366-367(变体nf1arg-1952);upadhyayaetal.hum.mutat.1997;10:248-250(变体nf1gly-338和trp-1611);kloseetal.hum.mol.genet.1998;7:1261-1268(变体nf1pro-1276);krkljusetal.hum.mutat.1998;11:411-411(变体nf1gly-1204,变体his-765);messiaenetal.genet.med.1999;1:248-253(变体nf1pro-508);petersetal.hum.mutat.1999;13:337-337(变体nf1pro-1446);fahsoldetal.am.j.hum.genet.2000;66:790-818(变体nf1pro-216;pro-357;cys-491;pro-549;thr-581;arg-583;phe-665;pro-695;pro-763;ser-777;lys-780;pro-781;pro-847;ser-1156;pro-1250;gln-1276;pro-1276;pro-1446;val-1605和ile-2507,变体glu-176);arsetal.hum.mol.genet.2000;9:237-247(变体nf1ser-117;trp-1204;pro-1446and2387-asn-phe-2388del),erratumarsetal.hum.mol.genet.2000;9:659-659;boulandetetal.hum.mutat.2000;16:274-275(变体nf1phe-844);kaufmannetal.am.j.hum.genet.2001;69:1395-1400(变体spinalfsnfpro-2088);hanetal.hum.genet.2001;109:487-497(变体nf1lys-780;cys-784;pro-1147;cys-1193;arg-1444;ser-1785;asn-2012和lys-2357);kluweetal.hum.mutat.2002;19:309-309(变体nf1phe-82;arg-784和glu-1444);baralleetal.am.j.med.genet.a2003;119:1-8(变体nfnsglu-1459del);wangetal.hum.genet.2003;112:117-123(变体nf1tyr-93;val-604;arg-844和pro-898,变体asp-74;glu-176;arg-712和gln-1276);delucaetal.hum.mutat.2003;21:171-172(变体nf1lys-780;pro-847;glu-848andarg-968;asn-1444;leu-1953del和arg-2001);kluweetal.j.med.genet.2003;40:368-371(变体nf1arg-578;pro-920和ala-2221);zatkovaetal.hum.mutat.24:491-501(变体nf1val-186,变体nf1val-186的表征);delucaetal.hum.mutat.2004;23:629-629(变体nf1asn-157;arg-629;ser-777;lys-780;arg-784;pro-847;glu-848;arg-968;asn-1444;leu-1953del和arg-2001,变体glu-176);mattocksetal.j.med.genet.2004;41:e48-e48(变体nf1arg-31;pro-145;arg-324;val-337;cys-489;pro-532;arg-574;arg-629;phe-665;phe-844;pro-844;met-991del;val-1073;arg-1196;gly-1276;gln-1276;glu-1430;glu-1459del和gly-1489,变体glu-176和cys-873);ferneretal.j.med.genet.2004;41:837-841(变体nf1pro-1243);bertolaetal.am.j.med.genet.a2005;136:242-245(变体nf1arg-844);delucaetal.am.j.hum.genet.2005;77:1092-1101(变体nfnsarg-194;glu-1444;thr-1451;leu-1453和glu-1459del);sjoeblometal.science.2006;314:268-274(变体ile-1187;leu-1951和arg-2745);upadhyayaetal.am.j.hum.genet.2007;80:140-151(变体nf1met-991del);nystrometal.clin.genet.76:524-534(变体nfnsphe-1411);pontietal.hered.cancerclin.pract.2011;9:6-6(变体nf1thr-160);thomasetal.eur.j.hum.genet.2012;20:411-419(变体glu-176;thr-330;asp-393;leu-393;pro-519;thr-776和phe-1484);nemethovaetal.ann.hum.genet.2013;77:364-379(变体nf1trp-93;arg-1048;arg-1189;arg-1661(同种型1)和thr-1918(同种型1);以及ben-salemetal.childsnerv.syst.2014;30:1183-1189(变体nf1pro-2125)。
低密度脂蛋白受体相关蛋白1b(lrp1b)
本文所述的发明包括,例如,确定lrp1b基因处的改变(例如,体细胞改变)的数量,或者,例如,通过确定lrp1b基因处的改变(例如,体细胞改变)的数量测量突变负荷。
低密度脂蛋白受体相关蛋白1b(lrp1b)基因,也称为lrp-dit、lrp-1b或lrpdit,属于低密度脂蛋白(ldl)受体基因家族。由于它们与多个配体的相互作用,这些受体在正常细胞功能和发育中发挥着广泛的作用。
人lrp1b的核苷酸和氨基酸序列描述于以下文献中,例如,liuetal.cancerres.2000;60:1961-1967;lieetal.genomics2000;69:271-274。
个体评估
可评估个体(例如患者)对本文所述疗法(例如癌症免疫疗法,例如包括pd-1抑制剂或pd-l1抑制剂的疗法)的应答者状态。例如,评估可以包括确定癌症(例如本文所述的癌症)中的突变负荷和/或存在改变(例如本文所述的改变或本文所述基因处的改变)。例如,可以通过获取来自患者的肿瘤样本中的突变负荷的知识来评估患者。或者,或此外,例如,可以通过例如ngs方法确定患者的基因组序列来评估患者。或者,或此外,对患者的评估可包括直接测定患者中突变的存在,例如通过诸如southern印迹杂交、northern印迹杂交、或rt-pcr(例如qrt-pcr)测定来检测突变的核酸(例如,dna或rna)。或者,或此外,可以通过诸如免疫组织化学、蛋白质印迹、免疫沉淀或免疫磁珠测定来评估患者蛋白质突变的存在。
在一个方面,临床试验的结果,例如成功或不成功的临床试验,可以重新用来鉴定用于(例如,子集患者群体)治疗癌症的药剂。通过一种示例性方法,可以重新评估临床试验中使用的候选药剂以确定试验中该药剂是否可有效治疗具有特定水平的突变负荷或含有特定突变的肿瘤。例如,可以鉴定参与药剂(例如,免疫检查点调节剂)临床试验的个体。可以评估经历症状改善(例如癌症(例如,黑素瘤)症状改善,例如肿瘤尺寸减小或肿瘤生长速率降低)的患者的突变负荷和/或突变的存在。也可以评估没有经历癌症症状改善的患者的突变负荷和/或突变的存在。在一个实施方案中,在发现肿瘤样本中具有预定水平的突变负荷的患者比不具有这种预定水平的突变负荷的患者更可能对测试药剂作出应答的情况下,则确定该药剂对具有预定突变负荷水平的患者来说,是一种合适的治疗选择。在另一个实施方案中,在发现携带突变的患者比不携带这种突变的患者更可能对测试药剂作出应答的情况下,则确定该药剂对携带突变的患者来说是合适的治疗选择。
对患者的“重新评估”可以包括,例如,获得来自个体的肿瘤样本(例如黑素瘤样本)中的突变负荷的知识。或者,或此外,对患者的重新评估可包括例如通过ngs方法确定患者的基因组序列或临床试验患者的子集。或者,或此外,对患者的重新评估可包括直接测定患者中突变的存在,例如通过诸如rt-pcr(例如qrt-pcr)测定来检测突变的核酸(例如,rna)。或者,或此外,可以通过诸如免疫组织化学、蛋白质印迹、免疫沉淀或免疫磁珠测定来重新评估患者蛋白质突变的存在。
检测核酸和多肽的方法
用于评估改变的基因、突变和/或基因产物的方法是本领域技术人员已知的。在一个实施方案中,通过选自以下一种或多种的方法在核酸分子中检测改变(例如,突变):核酸杂交测定、pcr(ssp)的选择性抑制、hplc或质谱基因分型。
其他的示例性方法包括传统的“直接探针”方法,例如southern印迹杂交和“比较探针”方法,例如比较基因组杂交(cgh),例如基于cdna或基于寡核苷酸的cgh。该方法可以以多种形式使用,包括但不限于基底(例如膜或玻璃)结合方法或基于阵列的方法。
在某些实施方案中,评估方法包括针对本文所述改变的探针/引物。
在一个实施方案中,可以设计探针/引物以检测其突变或相互易位。这些探针/引物适用于例如pcr扩增。使用含有dna片段的探针,所述dna片段与存在于染色体的不同部分中的dna碱基序列基本上互补。可用于本发明的探针的实例,以及探针的标记和与样本的杂交描述于vysis有限公司(vysis,inc.)的两件美国专利中(bittner等的美国专利号:5,491,224和6,277,569)。
染色体探针的长度通常为约50个至约105个核苷酸。较长的探针通常包含长度为约100个至约500个核苷酸的较小片段。与着丝粒dna和基因座特异性dna杂交的探针可商购获得,例如,购自vysis有限公司(丹尼森市,ill.)、molecularprobes有限公司(尤金,俄勒冈州)、或cytocell公司(牛津郡,英国)。或者,可以通过标准技术由染色体或基因组dna以非商业化的方式制备探针。例如,可以使用的dna来源包括基因组dna、克隆的dna序列、包含一个染色体或一个染色体(例如人染色体)的一部分和宿主的正常染色体补体的体细胞杂种以及通过流式细胞术或显微切割纯化的染色体。目标区域可以通过克隆或通过聚合酶链式反应(pcr)的位点特异性扩增来分离。参见,例如,nathandjohnson,biotechnichistochem.,1998,73(1):6-22,wheelessetal.,cytometry1994,17:319-326和美国专利号5,491,224。
待使用的探针与染色体的特定区域杂交,以确定该区域是否存在细胞遗传学异常。一种细胞遗传学异常是缺失。虽然缺失可以是一条或多条完整染色体的缺失,但缺失通常涉及一条或多条染色体的一部分缺失。如果从细胞中删除探针中包含的染色体的整个区域,则通常不会发生该探针与来自该细胞的dna的杂交,并且该染色体上不会存在信号。如果从细胞中删除部分包含在探针内的染色体区域,则仍然可以发生该探针与来自该细胞的dna的杂交,但可能存在较少的信号。例如,将信号的丢失与来自对照细胞的dna的探针杂交进行比较,所述对照细胞不包含探针要检测的遗传异常。在一些实施方案中,为检测细胞遗传学异常的存在,至少列举1、5、10、20、30、40、50、60、70、80、90、100、110、120、130、140、150、160、170、180、190、200个或更多的细胞。
待检测的细胞遗传学异常可包括但不限于,非相互易位、平衡易位、染色体内倒位、点突变、缺失、基因拷贝数变化、基因表达水平的变化、和种系突变。具体地,一种类型的细胞遗传学异常是复制。复制可以是整个染色体的复制,也可以是小于整个染色体的区域的复制。如果探针中包含的染色体区域在细胞中复制,那么与探针中包含的染色体区域没有异常的对照细胞中存在的信号数量相比,该探针与来自细胞的dna的杂交通常将产生至少一个额外信号。
标记染色体探针以便可以检测它们杂交的染色体区域。探针通常直接用荧光团标记,荧光团是一种在吸收较低波长/较高能量的光后发荧光的有机分子。荧光团允许探针在没有二级检测分子的情况下可视化。在将荧光团与核苷酸共价连接后,可以用标准技术例如切口平移、随机引发和pcr标记将核苷酸直接掺入探针中。或者,探针内的脱氧胞苷核苷酸可以用接头诱导转氨。然后荧光团与转氨基的脱氧胞苷核苷酸共价连接。参见美国专利号5,491,224。
美国专利号5,491,224描述了探针标记为许多具有与其共价键合的荧光标记的胞嘧啶残基。荧光标记的胞嘧啶碱基的数量足以产生可检测的荧光信号,而单独的如此标记的dna区段基本上保留其相对于待检测的染色体或染色体区域的特异性互补结合(杂交)特性。这种探针通过以下步骤制备:取未标记的dna探针区段,用连接基团转氨化区段中的许多脱氧胞苷核苷酸,或将荧光标记与至少一部分转氨基化的脱氧胞苷碱基共价键合。
也可以通过切口平移、随机引物标记或pcr标记来标记探针。使用荧光(直接)或半抗原(间接)标记的核苷酸进行标记。标记物的代表性非限制性实例包括:amca-6-dutp、级联蓝-4-dutp、荧光素-12-dutp、罗丹明-6-dutp、德克萨斯红-6-dutp、cy3-6-dutp、cy5-dutp、生物素(bio)-11-dutp、洋地黄毒苷(dig)-11-dutp或二硝基苯基(dnp)-11-dutp。
探针也可以用生物素或洋地黄毒苷间接标记,或用放射性同位素例如32p和3h标记,尽管然后还需要二级检测分子或进一步处理以使探针可视化。例如,用生物素标记的探针可以通过与可检测标志物缀合的抗生物素蛋白检测。例如,抗生物素蛋白可以与酶标志物(例如碱性磷酸酶或辣根过氧化物酶)缀合。可以使用酶的底物和/或催化剂在标准比色反应中检测酶标志物。碱性磷酸酶的催化剂包括5-溴-4-氯-3-吲哚基磷酸盐和硝基蓝四唑盐。二氨基苯甲酸酯可用作辣根过氧化物酶的催化剂。
还可以制备探针,使得荧光标记或其他标记在杂交之前或杂交期间不是dna的一部分,并且在杂交后添加以检测与染色体杂交的探针。例如,可以使用具有掺入dna的抗原分子的探针。杂交后,使用与抗原分子反应的特异性抗体检测这些抗原分子。这些抗体本身可以掺入荧光染料,或者可以使用具有结合的荧光染料的第二抗体检测。
无论如何处理或修饰,通常纯化探针dna,以便在用于杂交之前除去未反应的残余产物(例如,未掺入dna中的荧光染料分子)。
在杂交之前,根据本领域熟知的方法使染色体探针变性。探针可以在杂交条件下与染色体dna杂交或退火。“杂交条件”是促进探针和靶染色体dna之间退火的条件。由于不同探针的退火将根据探针长度、碱基浓度等而变化,因此通过改变探针浓度、杂交温度、盐浓度和本领域熟知的其他因素来促进退火。
通过改变浓度、碱基组成、复杂性和探针的长度以及盐浓度、温度和孵育时长来促进杂交条件。例如,原位杂交通常在含有1-2×ssc、50-65%甲酰胺和阻断dna的杂交缓冲液中进行,以抑制非特异性杂交。通常,如上所述,杂交条件包括约25℃至约55℃的温度,以及约0.5小时至约96小时的孵育时长。
可以通过一系列洗涤除去染色体探针与靶区域外的dna的非特异性结合。改变每次洗涤中盐的温度和浓度以控制洗涤的严格性。例如,对于严格性高的条件,可以使用0.2×至约2×的ssc和约0.1%至约1%的非离子型洗涤剂(例如诺纳德p-40(np40)),在约65℃至约80℃下进行洗涤。通过降低洗涤温度或通过增加洗涤液中盐的浓度可以降低严格性。在一些应用中,必须阻断重复序列的杂交能力。因此,在一些实施方案中,trna、人基因组dna或cot-1dna用于阻断非特异性杂交。洗涤后,使载玻片排水并风干,然后将封固剂、复染剂(例如dapi)和盖玻片施加到载玻片上。在检查之前,可以立即查看载玻片或在-20℃下保存。
在cgh方法中,第一核酸集合(例如,来自样本,例如可能的肿瘤)用第一标记物标记,而第二核酸集合(例如,对照物,例如,来自健康细胞/组织)用第二标记物标记。核酸杂交的比值由结合阵列中每根纤维的两个(第一和第二)标记物的比值确定。在存在染色体缺失或增殖的情况下,将检测来自两个标记物的信号的比值的差异,并且该比值将提供拷贝数的量度。基于阵列的cgh也可以用单色标记进行(与用两种不同的染料标记对照物和可能的肿瘤样本相反,并在杂交前将它们混合,由于阵列上探针的竞争性杂交,将产生比值)。在单色cgh中,标记对照物并与一个阵列杂交,读取绝对信号,标记可能的肿瘤样本并与第二阵列(具有相同内容)杂交,读取绝对信号。基于来自两个阵列的绝对信号计算拷贝数差异。
适用于本发明特征的方法的杂交方案描述于例如albertson(1984)emboj.3:1227-1234;pinkel(1988)proc.natl.acad.sci.usa85:9138-9142;epopub.no.430,402;methodsinmolecularbiology,vol.33:insituhybridizationprotocols,choo,ed.,humanapress,totowa,n.j.(1994)等。在一个实施方案中,使用以下文献中的杂交方案:pinkel,etal.(1998)naturegenetics20:207-211,或kallioniemi(1992)proc.natlacadsciusa89:5321-5325(1992)。基于阵列的cgh描述于美国专利号6,455,258中,其内容通过引用并入本文。
在另一个实施方案中,基于扩增的测定可用于测量存在/不存在和拷贝数。在这种基于扩增的测定中,核酸序列在扩增反应(例如,聚合酶链式反应(pcr))中充当模板。在定量扩增中,扩增产物的量将与原始样本中的模板量成比例。与适当对照物(例如健康组织)的比较提供了拷贝数的量度。
“定量”扩增的方法是本领域技术人员熟知的。例如,定量pcr涉及使用相同的引物同时共扩增已知量的控制序列。这提供了可用于校准pcr反应的内标。定量pcr的详细方案描述于innis,etal.(1990)pcrprotocols,aguidetomethodsandapplications,academicpress,inc.n.y.。使用定量pcr分析测量微卫星基因座处的dna拷贝数描述于ginzonger,etal.(2000)cancerresearch60:5405-5409。已知的基因核酸序列足以使本领域技术人员能够常规选择引物以扩增基因的任何部分。也可以使用荧光定量pcr。在荧光定量pcr中,定量基于(例如taqman和sybrgreen)荧光信号的量。
其他合适的扩增方法包括但不限于连接酶链式反应(lcr)(参见wuandwallace(1989)genomics4:560,landegren,etal.(1988)science241:1077,andbarringeretal.(1990)gene89:117)、转录扩增(kwoh,etal.(1989)proc.natl.acad.sci.usa86:1173)、自我持续序列复制(guatelli,etal.(1990)proc.nat.acad.sci.usa87:1874)、点pcr(dop-pcr)和连接子接头pcr(linkeradapterpcr)等。
核酸样本
多种组织样本可以是本方法中使用的核酸样本的来源。可以从个体的样本(例如,肿瘤样本、正常相邻组织(nat)、血液样本或任何正常对照物)中分离基因组dna片段或亚基因组dna片段。在某些实施方案中,组织样本作为冷冻样本或者甲醛或多聚甲醛固定的石蜡包埋(ffpe)组织制剂保存。例如,样本可以包埋在基质中,例如ffpe块或冷冻样品。分离步骤可包括单个染色体的流式分选;和/或微切割个体的样本(例如,肿瘤样本、nat、血液样本)。在某些实施方案中,样本包含循环肿瘤dna(ctdna)。
用于从组织样本中dna分离、片段化和处理的方案是本领域已知的,描述于wo2012/092426,题为“optimizationofmultigeneanalysisoftumorsamples”,该文献通过引用整体并入本文。从甲醛或多聚甲醛固定的、石蜡包埋的(ffpe)组织中分离核酸(例如dna)的其他方法公开于以下文献中,例如,croninm.etal.,(2004)amjpathol.164(1):35-42;masudan.etal.,(1999)nucleicacidsres.27(22):4436-4443;spechtk.etal.,(2001)amjpathol.158(2):419-429;ambionrecoveralltmtotalnucleicacidisolationprotocol(ambion,cat.no.am1975,september2008);
诱饵设计
诱饵可以是核酸分子,例如dna分子或rna分子,其可以通过杂交(例如,互补)以捕获靶核酸。在一个实施方案中,诱饵是rna分子。在其他实施方案中,诱饵包括结合实体,例如亲和标签,其允许捕获和分离(例如通过结合结合实体)由诱饵和与诱饵杂交的核酸形成的杂交体。在一个实施方案中,诱饵适合于溶液相杂交。
诱饵可以通过以下文献描述的方法和杂交条件来生产和使用:us2010/0029498,gnirke,a.etal.(2009)natbiotechnol.27(2):182-189,wo2012/092426,题为“optimizationofmultigeneanalysisoftumorsamples”,其各自通过引用并入本文。
测序
本发明还包括对核酸进行测序的方法。在一个实施方案中,可以使用本领域已知的多种测序反应中的任何一种来直接测序突变的至少一部分。在一个实施方案中,将突变序列与相应的参考(对照)序列进行比较。
在一个实施方案中,通过包括以下一种或多种的方法测定包含本文所述改变的核酸分子的序列:将寡核苷酸(例如本文所述的一种突变的等位基因特异性寡核苷酸)与所述核酸分子杂交;杂交引物或引物组(例如引物对),其扩增包含等位基因的突变的区域;扩增(例如,特异性扩增)包含等位基因的突变的区域;将衔接子寡核苷酸连接到包含等位基因的突变的核酸的一端;产生对突变存在具有特异性的光学信号,例如比色信号;将包含突变的核酸与第二核酸(例如与基底连接的第二核酸)杂交;产生对突变存在具有特异性的信号,例如电信号或荧光信号;将核苷酸掺入与含有该突变的核酸杂交的寡核苷酸中。
在另一个实施方案中,通过包括以下一种或多种的方法测定序列:确定来自单个核酸分子的核苷酸序列,例如,其中对应于该序列的信号源自单个分子,与之相反的是例如来自多个克隆扩增分子的信号之和;确定单个核酸分子的克隆扩增替代物(proxies)的核苷酸序列;大规模并行短读长测序;基于模板的测序;焦磷酸测序;实时测序,其包括在dna合成过程中成像染料标记核苷酸的连续掺入;纳米孔测序;杂交测序;基于纳米晶体管阵列的测序;聚合酶克隆测序;基于扫描隧道显微镜(stm)的测序;或基于纳米线分子传感器的测序。
可以使用本领域已知的任何测序方法。示例性测序反应包括基于由maxam和gilbert(proc.natlacadsciusa(1977)74:560)或sanger(sangeretal.(1977)proc.nat.acad.sci74:5463)开发的技术。在进行测定时(biotechniques(1995)19:448)可以使用各种自动测序程序中的任何一种,包括质谱测序(参见,例如,美国专利号5,547,835和国际专利申请公开号wo94/16101,题为dnasequencingbymassspectrometrybyh.
核酸分子的测序也可以使用下一代测序(ngs)方法进行。下一代测序方法包括以高度并行的方式(例如,同时对超过105个分子进行测序)确定单个核酸分子的核苷酸序列或用于单个核酸分子的克隆扩增替代物的核苷酸序列的任何测序方法。在一个实施方案中,可以通过对由测序实验产生的数据中其同源序列的相对出现次数进行计数来估计文库中核酸种类的相对丰度。下一代测序方法是本领域已知的,并且描述于例如metzker,m.(2010)naturebiotechnologyreviews11:31-46中,该文献通过引用并入本文。
在一个实施方案中,下一代测序允许确定单个核酸分子的核苷酸序列(例如,helicosbiosciences的heliscope基因测序系统,和pacificbiosciences的pacbiors系统)。在其它实施方案中,测序方法确定用于单个核酸分子的克隆扩增替代物的核苷酸序列(例如,solexa测序仪,illumina公司,圣地亚哥,加利福尼亚州;454生命科学公司(454lifesciences)(布兰福德,康涅狄格州)和iontorrent)。例如,大规模并行短读长测序(例如,solexa测序仪,illumina公司,圣地亚哥,加利福尼亚州),其与产生较少但较长读长的其他测序方法相比,每个测序单元产生更多的序列碱基。下一代测序的其他方法或机器包括,但不限于,由454生命科学公司(布兰福德,康涅狄格州)、应用生物系统公司(appliedbiosystems)(福斯特市,加利福尼亚州;solid测序仪)以及helicosbiosciencescorporation(剑桥市,马萨诸塞州)提供的测序仪。
下一代测序平台包括,但不限于,罗氏/454的基因组测序仪(gs)flx系统、illumina/solexa的基因组分析仪(ga)、life/apg的支持寡核苷酸连接检测(solid)系统、polonator的g.007系统、helicosbiosciences的heliscope基因测序系统和pacificbiosciences的pacbiors系统。ngs技术可包括一个或多个步骤,例如模板制备、测序和成像,以及如wo2012/092426,题为“optimizationofmultigeneanalysisoftumorsamples”中所描述的数据分析,该文献通过引用并入本文。
可通过本文所述的方法(例如测序方法)检测各种类型的改变,例如体细胞改变和种系突变。在某些实施方案中,通过使用sgz算法的方法进一步鉴定种系突变。sgz算法在国际申请公开号wo2014/183078和美国申请公开号2014/0336996中描述,其内容通过引用整体并入。
数据分析
在生成ngs读数后,可以将它们与已知的参考序列比对或从头组装。
例如,通过将ngs读数与参考序列(例如,野生型序列)比对,可以鉴定样本(例如肿瘤样本)中的单核苷酸多态性和结构变体等遗传变异。以下文献中描述了ngs的序列比对方法,例如,trapnellc.和salzbergs.l.naturebiotech.,2009,27:455-457。从头组装的实例描述于以下文献中,例如,warrenr.etal.,bioinformatics,2007,23:500-501;butlerj.etal.,genomeres.,2008,18:810-820;zerbinod.r.andbirneye.,genomeres.,2008,18:821-829。可以使用来自一个或多个ngs平台的读数据来执行序列比对或组装,例如混合罗氏/454和illumina/solexa的读数数据。用于数据分析的算法和方法描述于wo2012/092426,题为“optimizationofmultigeneanalysisoftumorsamples”,其通过引用并入本文。
报告
本文所述的方法可以包括向个体或另一个人或实体(例如护理人员、例如医生、例如肿瘤科医生、医院、诊所、第三方付款人、保险公司或政府机构)提供报告,例如以电子形式、网络形式或纸质形式提供报告。该报告可以包括该方法得出的结果,例如,对疗法的应答者状态值的鉴定、对突变负荷值的鉴定、本文所述的基因处改变的数量的鉴定和/或表明本文所述的改变存在或不存在,或野生型序列。在一个实施方案中,生成报告,例如纸质或电子形式的报告,其鉴定对疗法的应答者状态值、突变负荷值、本文所述的基因处改变的数量或本文所述的改变的存在或不存在,并且可选地包括患者的标识符,所述值、数量或包含改变的序列就是从该患者获得。
该报告还可以包括关于如本文所述的改变或野生型序列在癌症(例如黑素瘤)中的作用的信息。此类信息可包括关于预后、抗性或潜在的治疗策略或建议的治疗策略的信息,例如,如本文所述的药剂,例如癌症疗法(例如,癌症免疫疗法,例如pd-1抑制剂或pd-l1抑制剂)。该报告可包括关于治疗策略的可能有效性、治疗策略的可接受性或将治疗策略应用于患者的可取性的信息,例如,具有下述情况的患者:对疗法具有预定的应答者状态值、预定水平的突变负荷、在本文所述基因处预定数量的改变或测试中和实施方案中以及报告中鉴定的序列、改变或突变。例如,该报告可以包括对药物给药的信息或建议,例如,以预选剂量或以预选治疗方案给药,例如与其他药物联合施用于患者。在一个实施方案中,并非方法中鉴定的所有突变均是报告中鉴定的。例如,该报告可以限于与癌症的发生、预后、阶段或癌症对治疗(例如,预选的治疗策略)的易感性具有预选水平的相关性的基因处的突变。在实施该方法的实体收到样本后的7、14或21天内,可以将报告递送到例如本文所述的实体。
在另一方面,本发明的特征在于一种生成报告(例如,个性化癌症治疗报告)的方法,其通过以下步骤实现:从个体获得样本(例如,肿瘤样本,例如,黑素瘤样本),获得对疗法的应答者状态值,确定样本中的突变负荷,确定基因的改变数量,或检测样本中本文所述的突变,并基于对疗法的应答者状态值、突变负荷值、基因改变的数量或检测到的突变来选择疗法。在一个实施例中,生成对所选择的疗法作注释的报告,或者例如基于对疗法的应答者状态值、突变负荷的值、基因的改变的数量或检测到的突变,按照优先顺序,列出两个或更多个治疗策略的报告。在另一个实施方案中,进一步向个体(例如患者)施用所选择的治疗方法。
试剂盒
在一个方面,本发明的特征在于一种试剂盒,例如,包含具有本文所述改变(例如本文所述基因处的改变)的寡核苷酸。任选地,试剂盒还可包含作为突变寡核苷酸的野生型对应物的寡核苷酸。
在某些实施方案中,试剂盒包括:
(a)一种或多种或多种能够检测以下一项或多项的检测试剂:
(i)在表1中列出的预定组基因处的体细胞改变,
(ii)在nf1基因处的体细胞改变,
(iii)在lrp1b基因处的体细胞改变,或
(iv)c至t转换;和
(b)用于测定黑素瘤样本中的突变负荷和/或是否存在一种或多种上述改变的说明书。
在一些实施方案中,试剂盒还包括pd-1抑制剂或pd-l1抑制剂或其组合物。在一些实施方案中,试剂盒还对用于治疗个体的黑素瘤作了说明。
试剂盒可包括载体,例如,一种被分隔以在封闭限制下接纳一个或多个容器装置的装置。在一个实施方案中,容器包含寡核苷酸,例如如上所述的引物或探针。试剂盒的组分可用于例如诊断或鉴定患者肿瘤样本中的突变。试剂盒的探针或引物可用于本领域已知的任何测序或核苷酸检测测定,例如测序测定,例如ngs方法、rt-pcr或原位杂交。
在一些实施方案中,试剂盒的组分可用于例如诊断或鉴定患者肿瘤样本中的突变和/或评估患者肿瘤样本中的突变负荷,并因此鉴定合适的治疗剂以治疗癌症。
本发明特征的试剂盒可包括,例如,测定阳性对照物和测定阴性对照物、核苷酸、酶(例如,rna或dna聚合酶或连接酶)、溶剂或缓冲液、稳定剂、防腐剂、二抗(例如抗hrp抗体(igg))和检测试剂。
寡核苷酸可以以任何形式提供,例如液体、干燥的、半干燥的或冻干形式,或以冷冻条件储存的形式提供。
通常,寡核苷酸和试剂盒中的其他组分以无菌的形式提供。在液体溶液中提供寡核苷酸,例如包含本文所述突变的寡核苷酸,或与本文所述的改变互补的寡核苷酸,液体溶液通常是水溶液,例如无菌水溶液。当寡核苷酸以干燥形式提供时,通常通过添加合适的溶剂来完成重构。可任选地在试剂盒中提供溶剂,例如无菌缓冲液。
试剂盒可包括一个或多个用于组合物(包含适合用于测定的浓度的寡核苷酸)的容器,或用于测定中稀释的说明书。在一些实施方案中,试剂盒包括用于寡核苷酸和测定组分以及信息材料的单独容器、分隔器或隔室。例如,寡核苷酸可以容纳在瓶子或小瓶中,信息材料可以容纳在塑料套管或小包中。在其他实施方案中,试剂盒的单独成分容纳在单个未分隔的容器内。例如,寡核苷酸组合物容纳在瓶子或小瓶中,瓶子或小瓶上以标签形式贴有信息材料。在一些实施方案中,试剂盒包括多个(例如,一包)单独的容器,每个容器包含寡核苷酸的一种或多种单元形式(例如,用于一种测定)。例如,试剂盒包括多个安瓿、箔包或泡罩包,其中的每一个包含用于测序或检测肿瘤样本中突变的单个寡核苷酸单元。试剂盒的容器可以是气密的和/或防水的。容器可以贴上标签使用。
对于基于抗体的试剂盒,试剂盒可包括:(1)与突变多肽结合的第一抗体(例如,附着于固体支持物);任选地,(2)第二种不同的抗体,其与多肽或第一抗体结合并与可检测的试剂缀合。
在一个实施方案中,试剂盒可包括用于进行测序和解释测序或诊断的信息材料。在另一个实施方案中,试剂盒可以提供关于向何处报告(例如,向治疗中心或医疗保健供应商报告)测定结果的指导。试剂盒可以包括用于报告本文所述的测序或诊断测定的结果的表格,以及关于向何处发送此类表格的地址和联系信息或其他相关信息;或用于在在线数据库或在线应用程序(例如,应用程序)中报告结果的url(统一资源定位符)地址。在另一个实施方案中,取决于测定结果,信息材料可以包括关于患者是否应该接受特定化学治疗药物治疗的指导。
试剂盒的信息材料不限于其形式。在许多情况下,信息材料,例如说明书,以印刷品形式(例如印刷文字、图和/或照片,例如标签或印刷纸)提供。然而,信息材料也可以以其他格式提供,例如以计算机可读材料、视频记录或音频记录格式提供。在另一个实施方案中,试剂盒的信息材料是联系信息,例如,物理地址、电子邮件地址、网站或电话号码,其中试剂盒的用户可以获得关于测序或诊断测定和/或其用于本文所述的方法的实质性信息。信息材料也可以以任何格式组合提供。
在一些实施方案中,将生物样本提供给测定供应商,例如服务供应商(例如第三方机构)或医疗保健供应商,它们在测定中评估样本并提供结果。例如,在一个实施方案中,测定供应商从个体接收生物样本,例如血液样本或组织样本,例如活组织检查样本,并使用本文所述的测定法(例如测序测定法或原位杂交测定)评估样本,并确定样本包含突变。然后,测定供应商(例如服务供应商或医疗保健供应商)可以推断出个体是或者不是特定药物或特定癌症治疗方案的候选者。
检测试剂
另一方面,本发明的特征在于一种检测试剂,例如一种纯化的制剂或分离的制剂。检测试剂可以区分具有本文所述改变的核酸或蛋白质序列,例如包含本文所述改变的核酸分子,本文所述改变为例如,在表1中列出的预定组基因处的体细胞改变;在nf1基因处的体细胞改变;在lrp1b基因处的体细胞改变;或c至t转换。
检测试剂(例如基于核酸的检测试剂)可用于鉴定在例如样本(例如获自或源自黑素瘤(例如晚期黑素瘤或转移性黑素瘤)的核酸样本)中的靶核酸(例如,dna,例如基因组dna或cdna,或rna)中的突变。检测试剂(例如基于抗体的检测试剂)可用于鉴定在样本(例如从黑素瘤细胞(例如,晚期黑素瘤细胞或转移性黑素瘤细胞)获得或源自黑素瘤细胞或由其产生的蛋白质样本)中的靶蛋白质中的突变。
在一个实施方案中,检测试剂包括核酸分子,例如dna、rna或混合的dna/rna分子,其包含与靶核酸上的核酸序列互补的序列(被检测试剂结合的靶核酸上的序列,在本文中称为“检测试剂结合位点”,而对应于检测试剂结合位点的检测试剂的部分称为“靶结合位点”)。在一个实施方案中,检测试剂结合位点与询问位置相关地设置,使得检测试剂与检测试剂结合位点的结合(或在某些实施方案中,缺乏结合)允许突变体与本文所述的用于突变体的参考序列相区分(核酸分子包含本文所述的改变,例如,在表1中列出的预定组基因处的体细胞改变;在nf1基因处的体细胞改变;在lrp1b基因处的体细胞改变;和/或c至t转换)。检测试剂可以用例如标记物或其他部分(例如,允许捕获的部分)修饰。
在一个实施方案中,检测试剂包括核酸分子,例如dna、rna或混合的dna/rna分子,其(例如在它的靶结合位点中)包括询问位置,并且可以(例如,通过检测试剂与靶核酸的结合亲和力,或者反应能力,例如与检测试剂的连接反应或延伸反应的能力)区分突变(例如本文所述的改变)和参考序列。在一些实施方案中,询问位置可以对应于检测试剂或靶结合位点的末端核苷酸(例如3’末端核苷酸或5’末端核苷酸)、紧邻3’末端核苷酸或5’末端核苷酸的核苷酸或另一内部核苷酸。
在一些实施方案中,检测试剂对包含本文所述改变的靶核酸的亲和力与包含参考序列的靶核酸的亲和力的差异,允许确定突变(或参考)序列的存在或不存在。通常,在检测条件下,此类检测试剂将显示出仅与突变体或仅与参考序列的实质上较高水平的结合,例如,将显示出仅与突变或仅与参考序列的实质水平的结合。
在一些实施方案中,结合允许(或抑制)后续反应,例如涉及检测试剂或靶核酸的后续反应。例如,结合可以允许通过例如dna聚合酶将一个或多个核苷酸连接或添加到核酸,例如检测试剂,其可以被检测并用于区分突变体和参考物。在一些实施方案中,询问位置位于检测试剂或其靶结合位点的末端或足够靠近末端,使得杂交或化学反应(例如,通过例如dna聚合酶,向检测试剂添加一个或多个核苷酸)仅在检测试剂和靶核酸在询问位置处完美匹配时发生或者以实质上较高的速率发生,或者仅当检测试剂和靶核酸在询问位置的1、2或3个核苷酸以内的核苷酸位置处完美匹配时发生或者以实质上较高的速率发生。
在一个实施方案中,检测试剂包含核酸,例如dna、rna或混合的dna/rna分子,其中分子或其靶结合位点与询问位置相邻(或位于侧翼),例如直接相邻,并且其可以在靶核酸中区分本文所述的突变和参考序列。
在一些实施方案中,检测试剂结合位点与询问位置相邻,例如,检测试剂的5’末端核苷酸或3’末端核苷酸,或其靶结合位点与询问位置相邻,例如与询问位置的距离在0(直接相邻)至1000、500、400、200、100、50、10、5、4、3、2或1个核苷酸之间。在一些实施方案中,反应的结果将随着询问位置处核苷酸的同一性而变化,从而允许区分突变体和参考序列。例如,在询问位置存在第一个核苷酸时,第一反应优于第二反应。例如,在连接反应或引物延伸反应中,取决于询问位置处核苷酸的同一性,产物将在电荷、序列、大小或对进一步反应(例如限制性切割)的易感性方面有所不同。在一些实施方案中,检测试剂包含配对分子(例如正向引物和反向引物),允许扩增(例如通过pcr扩增)包含询问位置的双链体。在这样的实施方案中,突变的存在可以通过扩增产物的性质的差异来确定,例如,通过由包含询问位置的序列和在询问位置处具有参考核苷酸的相应序列导致的、在大小、序列、电荷或对反应的易感性方面的差异来确定。在一些实施方案中,特征性扩增产物的存在或不存在表明了询问位点处的核苷酸的同一性,因此允许检测突变。
在一些实施方案中,检测试剂或其靶结合位点与询问位置直接相邻,例如,检测试剂的5’末端核苷酸或3’末端核苷酸直接与询问位置相邻。在一些实施方案中,询问位置处核苷酸的同一性将决定反应(例如涉及检测试剂的反应,例如检测试剂一端的修饰)的性质。例如,在询问位置存在第一个核苷酸时,第一反应优于第二反应。举例来说,在询问位置存在第一个核苷酸时,例如存在与突变相关的核苷酸时,可以促进第一反应,例如向检测试剂中添加互补核苷酸的反应。举例来说,在询问位置处存在a将导致具有例如第一比色标记物的t的掺入,而在询问位置处存在g将导致具有例如第二比色标记物的c的掺入。在一个实施方案中,该位置处第一核苷酸的存在将导致检测试剂与第二核酸的连接。例如,如果第三核酸在询问位点处具有精确匹配,则第三核酸可以与足够靠近询问位点的靶核酸杂交,它将与检测试剂连接。连接产物的检测或其不存在表明了询问位点处核苷酸的同一性,因此允许检测突变。
可以使用各种读数。例如,检测试剂与突变体或参考序列的结合之后可以与和检测试剂相关联的部分(例如标记物,例如放射性标记物或酶标记物)结合。在一些实施方案中,标记物包含猝灭剂和信号传导剂,并且杂交导致这两种成分之间的距离改变,例如,距离增加及使信号传导剂不猝灭。在一些实施方案中,检测试剂可包括允许与反应混合物的其他组分分离的部分。在一些实施方案中,结合允许通过例如酶、例如dna聚合酶的核酸酶活性、例如限制酶对结合的检测试剂进行切割。可以通过核酸的出现或消失或通过分离猝灭剂和与检测试剂相关联的信号传导剂来检测切割。在一些实施方案中,结合可保护或者赋予靶标对进一步化学反应(例如通过限制酶,例如标记或降解)的易感性。在一些实施方案中,与检测试剂结合允许靶核酸的捕获、分离或物理操作,从而允许鉴定。在一些实施方案中,结合可导致检测试剂或靶标的可检测定位,例如,结合可捕获靶核酸或置换第三核酸。结合可以允许组分(例如检测试剂)中的延伸或其他尺寸变化,从而允许区分突变体和参考序列。结合可以允许例如通过pcr产生区分突变体与参考序列的扩增子。
在一个实施方案中,检测试剂或靶结合位点的长度在5至500、5至300、5至250、5至200、5至150、5至100、5至50、5至25、5至20、5至15、或5至10个核苷酸之间。在一个实施方案中,检测试剂或靶结合位点的长度在10至500、10至300、10至250、10至200、10至150、10至100、10至50、10至25、10至20、或10至15个核苷酸之间。在一个实施方案中,检测试剂或靶结合位点的长度在20至500、20至300、20至250、20至200、20至150、20至100、20至50、或20至25个核苷酸之间。在一个实施方案中,检测试剂或靶结合位点足够长以区分突变体和参考序列,并且长度小于100、200、300、400或500个核苷酸。
本文所述的突变蛋白质可通过与一试剂(例如,底物,例如用于催化活性或功能活性的底物或抗体,其与突变体和参照蛋白质发生不同反应)反应而与参照物(例如,非突变蛋白质或野生型蛋白质)区分开来。在一个方面,本发明包括一种使具有预定水平的突变负荷的样本和/或包含本文所述的突变蛋白质的样本与这种试剂接触,并确定突变蛋白质是否存在于样本中的方法。
在反应混合物的一个实施方案或制备反应混合物的方法中,检测试剂包括对含有本文所述改变的核酸特异的探针或引物,或者对本文所述突变蛋白质特异的抗体。在反应混合物的一个实施方案或制备反应混合物的方法中,改变是本文所述基因(例如表1中描述的基因,例如nf1基因或lrp1b基因)处的体细胞改变。
核酸的制备及其用途
另一方面,本发明的特征在于纯化的或分离的赘生细胞核酸制剂或肿瘤细胞核酸制剂,例如dna、例如基因组dna或cdna、或rna,其包含本文所述的询问位置,可用于确定样本的突变负荷或是否存在本文披露的改变。核酸包括询问位置,并且通常在询问位置的一侧或两侧上具有附加的序列。此外,核酸可含有异源序列,例如通常连接到核酸的一个末端或两个末端的衔接子序列或引发序列。核酸还包括标记物或其他部分,例如允许分离或定位的部分。
在某些实施方案中,纯化的或分离的例如来源于黑素瘤样本的核酸制剂,包括以下一项或多项:
(i)在表1中列出的预定组基因处的体细胞改变;
(ii)在nf1基因处的体细胞改变;
(iii)在lrp1b基因处的体细胞改变;或
(iv)c至t转换。
在一些实施方案中,该制剂用于确定样本(例如黑素瘤样本)的突变负荷。在一些实施方案中,将制剂置于测序装置中或者测序装置的样本架中。
在一些实施方案中,核酸长度为20至1000、30至900、40至800、50至700、60至600、70至500、80至400、90至300或100至200个核苷酸(带有异源序列或不带异源序列)。在一个实施方案中,核酸长度为40至1000、50至900、60至800、70至700、80至600、90至500、100至400、110至300或120至200个核苷酸(带有异源序列或不带异源序列)。在另一个实施方案中,核酸长度为50至1000、50至900、50至800、50至700、50至600、50至500、50至400、50至300或50至200个核苷酸(带有异源序列或不带异源序列)。在一些实施方案中,核酸具有足够的长度以允许测序(例如,通过化学测序或通过测定突变体和参照制剂之间的tm的差异),但任选地长度小于100、200、300、400或500个核苷酸(带有异源序列或不带异源序列)。这些制剂可用于测序来自样本(例如赘生性样本或肿瘤样本)核酸。在一个实施方案中,通过原位扩增在基底上提供的核酸来提供纯化的制剂。在一些实施方案中,纯化的制剂在空间上不同于基底上的其他核酸(例如其他扩增的核酸)。
在一个实施方案中,纯化的或分离的核酸制剂源自黑素瘤,例如晚期黑素瘤。此类制剂可用于确定黑素瘤中的突变负荷和/或黑素瘤中存在或不存在改变(例如本文所述的改变)的序列。
在另一方面,本发明的特征在于一种测定本文所述的改变的询问位置的序列的方法,包括:
(a)提供纯化的或分离的核酸制剂,例如dna,例如含有本文所述的询问位置的基因组dna或cdna或rna;和
(b)通过破坏或形成化学键(例如,在检测试剂或靶序列中的共价化学键或非共价化学键)的方法测序,以确定询问位置处核苷酸的同一性。该方法允许确定是否存在本文所述的改变。
在一个实施方案中,测序包括使包含本文所述改变的核酸与本文所述的检测试剂接触。
在一个实施方案中,测序包括测定物理性能,例如包含本文所述改变的核酸的双链形式的稳定性,例如可以区分突变体和参考序列的tm。
反应混合物和装置
在一个方面,本发明的特征在于含有检测试剂和核酸的反应混合物,其中核酸为例如dna,例如基因组dna或cdna、或rna,其含有本文所述的询问位置,可用于测定样本的突变负荷或是否存在所公开的改变。在一个实施方案中,核酸是从黑素瘤(例如晚期黑素瘤)获得或源自黑素瘤。
另一方面,本发明的特征在于含有检测试剂和核酸的反应混合物,其中核酸为例如dna,例如基因组dna或cdna、或rna,含有本文所述的询问位置,可用于测定样本的突变负荷或是否存在所公开的改变,设置在用于确定物理性能或化学性能(例如双链体的稳定性,例如tm)的装置或该装置的样本架中。在一个实施方案中,该装置是热量计。在一个实施方案中,包含本文所述改变的核酸是从黑素瘤(例如晚期黑素瘤)获得或源自黑素瘤。
在某些实施方案中,本文所述的反应混合物包括:
(a)一种或多种能够检测以下一项或多项的检测试剂:
(i)在表1中列出的预定组基因处的体细胞改变,
(ii)在nf1基因处的体细胞改变,
(iii)在lrp1b基因处的体细胞改变,
(iv)c至t转换;和
(b)源自黑素瘤样本的核酸,其包含以下一项或多项:
(i)在表1中列出的预定组基因处的体细胞改变,
(ii)在nf1基因处的体细胞改变,
(iii)在lrp1b基因处的体细胞改变,
(iv)c至t转换。
本文所述的检测试剂可用于测定样本的突变负荷或样本中是否存在本文所公开的改变。在一些实施方案中,样本包括源自黑素瘤(例如晚期黑素瘤)的核酸。细胞可来自赘生性样本或肿瘤样本,例如取自赘生物或肿瘤的活体组织切片;来自循环肿瘤细胞,例如来自外周血;或来自血液样本或血浆样本。在一个实施方案中,核酸源自例如黑素瘤,例如晚期黑素瘤。
因此,一方面,本发明的特征在于制备反应混合物的方法,该方法包括将能够检测本文所述改变的检测试剂与源自样本的包括有本文所述改变的询问位置的序列的核酸组合。在某些实施方案中,该方法包括使一种或多种检测试剂与一种核酸组合,其中该检测试剂能够检测以下一项或多项:(i)在表1中列出的预定组基因处的体细胞改变,(ii)在nf1基因处的体细胞改变,(iii)在lrp1b基因处的体细胞改变,或(iv)c至t转换;其中该核酸源自肿瘤细胞或肿瘤样本(例如黑素瘤细胞或黑素瘤样本),包括以下一项或多项:(i)在表1中列出的预定组基因处的体细胞改变,(ii)在nf1基因处的体细胞改变,(iii)在lrp1b基因处的体细胞改变,或(iv)c至t转换。
在反应混合物的一个实施方案或制备反应混合物的方法中:检测试剂包括核酸,例如dna、rna或混合的dna/rna分子,其与靶核酸(检测试剂结合位点)上的核酸序列互补,其中检测试剂结合位点与询问位置相关地设置,使得检测试剂与检测试剂结合位点的结合允许突变序列和参考序列的区分用于本文所述的突变序列或事件。
在反应混合物的一个实施方案或制备反应混合物的方法中:靶核酸序列源自黑素瘤,例如本文所述的晚期黑素瘤。在反应混合物的一个实施方案或制备反应混合物的方法中:突变是本文所述的改变,包括:取代,例如本文所述的碱基取代。
本文所述的改变可以通过与一种与突变体和参照物具有不同反应的酶反应,而与参照物(例如非突变序列或野生型序列)区分开。例如,它们可以通过用一种对突变体和参照序列具有不同活性的限制酶进行切割来区分。例如,本发明包括使包含本文所述改变的核酸与这种酶接触并确定是否存在能够区分突变体与参照序列的切割产物的方法。
在一个方面,本发明提供了一种限制酶切割产物的纯化制剂,其可以区分突变体和参照序列,其中切割产物的一端由一种在突变体和参照序列之间差异切割的酶限定。在一个实施方案中,切割产物包括询问位置。
检测突变多肽
还可以通过检测表达的多肽或定量表达的多肽来检测和/或定量突变多肽(例如,由表1中列出的基因编码的多肽,例如突变的nf1多肽或lrp1b多肽)的活性或水平。可以通过本领域技术人员已知的许多方法中的任何一种来检测和定量突变的多肽。这些方法可包括分析生化方法,例如电泳、毛细管电泳、高效液相色谱(hplc)、薄层色谱(tlc)、高扩散色谱等;或各种免疫方法,例如流体沉淀反应或凝胶沉淀反应、免疫扩散(单或双)、免疫电泳、放射免疫测定(ria)、酶联免疫吸附测定(elisas)、免疫荧光测定、蛋白质印迹、免疫组织化学(ihc)等。技术人员可以采用已知的蛋白质/抗体检测方法。
用于检测突变多肽的另一种试剂是能够结合对应于一种多肽的多肽的抗体分子,例如具有可检测标记的抗体。本文描述了用于产生抗体的技术。关于探针或抗体,术语“标记的”旨在包括通过将可检测物质与探针或抗体偶联(即物理连接)进行的探针或抗体的直接标记,以及通过与另一种被直接标记的试剂的反应进行的探针或抗体的间接标记。间接标记的实例包括使用荧光标记的二级抗体对一级抗体的检测,以及用生物素对dna探针进行末端标记,这样使得可以用荧光标记的链霉抗生物素蛋白对间接标记进行检测。
在另一个实施方案中,抗体是标记的抗体,例如放射性标记的抗体、发色团标记的抗体、荧光团标记的抗体或酶标记的抗体。在另一个实施方案中,使用与突变蛋白质特异性结合的抗体衍生物(例如,与底物或与蛋白质或与蛋白质-配体对(例如,生物素-链霉抗生物素蛋白)的配体缀合的抗体)或抗体片段(例如,单链抗体、分离的抗体高变区等)。
可以使用本领域技术人员已知的技术分离来自细胞的突变多肽。所用的蛋白质分离方法可以是,例如,harlow和lane(harlowandlane,1988,antibodies:alaboratorymanual,coldspringharborlaboratorypress,coldspringharbor,纽约)描述的方法。
使用电泳技术检测蛋白质的方法是本领域技术人员熟知的(参见r.scopes(1982)proteinpurification,springer-verlag,n.y.;deutscher,(1990)methodsinenzymologyvol.182:guidetoproteinpurification,academicpress,inc.,n.y.)。
在另一个实施方案中,蛋白质印迹(免疫印迹)分析用于检测和定量样本中多肽的存在。
在另一个实施方案中,使用免疫测定法检测多肽。如本文所述,免疫测定是利用抗体特异性结合被分析物的测定。因此,免疫测定的特征在于检测多肽与抗体的特异性结合,而不是使用其他物理特性或化学特性来分离、靶向和定量被分析物。
使用许多免疫结合测定方法中的任何一种检测和/或定量突变的多肽(参见,例如,美国专利号4,366,241;4,376,110;4,517,288和4,837,168)。关于一般免疫测定的综述,还可参见asai(1993)methodsincellbiologyvolume37:antibodiesincellbiology,academicpress,inc.newyork;andstites&terr(1991)basicandclinicalimmunology7thedition。
筛选方法
另一方面,本发明的特征在于一种方法或测定法,用于筛选可用于治疗具有预定水平的突变负荷和/或具有本文所述改变的肿瘤的药剂。
该方法包括使具有预定水平的突变负荷和/或具有本文所述的改变的细胞或组织(例如肿瘤细胞或肿瘤组织)与候选药剂接触;检测与细胞或组织(例如肿瘤细胞或肿瘤组织)相关的参数的变化,例如肿瘤生长、血管生成、细胞凋亡或转移的变化。该方法可任选地包括将该参数的值与参考值进行比较,例如,将从使用候选药剂的肿瘤样本获得的参数的值,与从没有使用候选药剂的肿瘤样本获得的参数的值进行比较。在一个实施方案中,如果检测到与肿瘤相关的参数(例如肿瘤生长、血管生成、细胞凋亡或转移的变化)减少,则鉴定为候选药剂。
评估的示例性参数包括以下中的一个或多个:(i)细胞(例如肿瘤细胞)活性的变化,例如细胞的增殖、形态或致肿瘤性的变化;(ii)动物个体中存在的肿瘤的变化,例如肿瘤的大小、外观、增殖的变化;或(iii)与细胞(例如肿瘤细胞)的活性相关的核酸或多肽或蛋白质的水平(例如表达水平)的变化。
在一个实施方案中,接触步骤在培养的细胞中进行,例如在具有预定水平的突变负荷和/或具有本文所述改变的细胞中进行。在另一个实施方案中,接触步骤在体内细胞(个体中存在的肿瘤细胞)中进行,例如在动物个体(例如,体内动物模型)中进行。
在其他实施方案中,在培养的细胞中检测细胞活性的变化,例如,在具有预定水平的突变负荷和/或具有本文所述的改变的细胞(例如,哺乳动物细胞、肿瘤细胞或肿瘤细胞系、重组细胞)中检测细胞活性的变化。在一个实施方案中,细胞是从具有预定水平的突变负荷的肿瘤中分离的细胞。在一个实施方案中,细胞是重组细胞,其被修饰以表达包含本文所述改变的核酸,例如,是用包含本文所述改变的核酸转染的重组细胞。转染的细胞可以显示在对表达的突变的应答方面的变化,例如增殖增加、形态的变化、致肿瘤性增加和/或获得转化的表型。可以检测在候选药剂存在下细胞(例如重组细胞)的任何活性的变化。例如,在候选药剂存在下,增殖、致瘤性、转化形态中的一种或多种的降低可以表示,该药剂治疗具有预定水平的突变负荷和/或具有本文所述的改变的肿瘤的有效性。
在另一个实施方案中,检测动物个体(例如,体内动物模型)中存在的肿瘤的变化。在一个实施方案中,动物模型是患有肿瘤的动物或异种移植物,其包含具有预定水平的突变负荷和/或具有本文所述的改变的细胞(例如,具有预定水平的突变负荷和/或具有本文所述的改变的致瘤细胞)。可以将候选药剂施用于动物个体并检测肿瘤的变化。在一个实施方案中,评估肿瘤的变化,包括肿瘤生长、肿瘤大小、肿瘤负荷、存活中的一种或多种变化。肿瘤生长、肿瘤大小、肿瘤负荷中的一种或多种的减少,或者存活增加表明候选药剂对治疗具有预定水平的突变负荷和/或具有本文所述改变的肿瘤是有效的。
在某些实施方案中,可以重复和/或组合本文所述的筛选方法。在一个实施方案中,可以在动物个体中进一步测试在本文所述的基于细胞的测定中评估的候选药剂。
在一个实施方案中,候选药剂是免疫检查点分子的调节剂,例如抑制剂,例如pd-1抑制剂或pd-l1抑制剂。在一个实施方案中,候选药剂是小分子化合物、核酸(例如,反义、sirna、适配体、核酶、微小rna)或抗体分子(例如,与变异dna编码的蛋白质结合的完整抗体或其抗原结合片段,例如嵌合的抗体分子、人源化或人抗体分子)。候选药剂可以从文库(例如,抑制剂的商业文库)获得或合理设计。
候选药剂可以使用本领域已知的组合文库方法中的任何一种方法获得,包括:生物文库;拟肽文库(具有以下性质的分子文库:所述分子具有肽功能性但具有新的非肽骨架,其对酶促降解具有抗性但仍保持生物活性;参见,例如,zuckermann,r.n.etal.(1994)j.med.chem.37:2678-85);空间可寻址的平行固相文库或溶液相文库;需要反卷积的合成文库方法;“一珠一化合物”文库方法;以及使用亲和层析选择的合成文库方法。生物文库和拟肽文库方法限于肽文库,而其他四种方法适用于肽,非肽寡聚物或化合物的小分子文库(lam(1997)anticancerdrugdes.12:145)。
用于产生抗体的噬菌体展示和组合方法是本领域已知的,例如描述于美国专利号5,223,409,国际申请公开号wo92/18619,wo91/17271,wo92/20791,wo92/15679,wo93/01288,wo92/01047,wo92/09690,wo90/02809;huseetal.(1989)science246:1275-1281;fuchsetal.(1991)bio/technology9:1370-1372;clacksonetal.(1991)nature352:624-628;garradetal.(1991)bio/technology9:1373-1377;hoogenboometal.(1991)nucacidres19:4133-4137;barbasetal.(1991)pnas88:7978-7982;hawkinsetal.(1992)jmolbiol226:889-896;hayetal.(1992)humantibodhybridomas3:81-85;grametal.(1992)pnas89:3576-3580;griffthsetal.(1993)emboj12:725-734。
嵌合抗体可以通过本领域已知的重组dna技术产生,参见国际申请公开号wo86/01533,wo87/02671,cabillyetal.美国专利号4,816,567;betteretal.(1988science240:1041-1043);liuetal.(1987)pnas84:3439-3443;liuetal.,1987,j.immunol.139:3521-3526;sunetal.(1987)pnas84:214-218;nishimuraetal.,1987,canc.res.47:999-1005;woodetal.(1985)nature314:446-449;shawetal.,1988,j.natlcancerinst.80:1553-1559。
可以通过cdr-移植或cdr取代产生人源化抗体或cdr-移植的抗体,其中可以替换免疫球蛋白链的一个、两个或所有cdr。参见,例如美国专利号5,225,539;jonesetal.1986nature321:552-525;verhoeyanetal.1988science239:1534;beidleretal.1988j.immunol.141:4053-4060。人源化抗体也在本发明的范围内,其中特定氨基酸已被取代、缺失或添加。从供体中选择氨基酸的标准描述于us5,585,089中。用于人源化抗体的其他技术描述于美国专利号us5,693,761、us5,693,762;欧洲专利号ep519596;morrison,s.l.,1985,science229:1202-1207;oietal.,1986,biotechniques4:214。
可以使用携带人免疫球蛋白基因而不是小鼠系统的转基因小鼠产生人单克隆抗体。来自目标抗原免疫的转基因小鼠的脾细胞用于产生分泌人mab的杂交瘤,所述人mab对来自人蛋白质的表位具有特异性亲和力(参见,例如,国际申请公开号wo91/00906,wo91/10741,wo92/03918,wo92/03917;bruggemanetal.1991eurjimmunol21:1323-1326;bruggemanetal.1993yearimmunol7:33-40;tuaillonetal.1993pnas90:3720-3724;lonberg,n.etal.1994nature368:856-859;green,l.l.etal.1994naturegenet.7:13-21;morrison,s.l.etal.1994proc.natl.acad.sci.usa81:6851-6855)。
用于合成分子文库的方法的实例可以在本领域中找到,例如dewittetal.(1993)proc.natl.acad.sci.u.s.a.90:6909;erbetal.(1994)proc.natl.acad.sci.usa91:11422;zuckermannetal.(1994).j.med.chem.37:2678;choetal.(1993)science261:1303;carrelletal.(1994)angew.chem.int.ed.engl.33:2059;carelletal.(1994)angew.chem.int.ed.engl.33:2061;gallopetal.(1994)j.med.chem.37:1233。
化合物文库可以在溶液中呈现(例如,houghten(1992)biotechniques13:412-421),或在珠上(lam(1991)nature354:82-84)、芯片上(fodor(1993)nature364:555-556)、细菌上(ladner,美国专利号5,223,409),孢子上(ladner美国专利号5,223,409)、质粒上(culletal.(1992)procnatlacadsciusa89:1865-1869)或噬菌体上(scottandsmith(1990)science249:386-390;devlin(1990)science249:404-406;cwirlaetal.(1990)proc.natl.acad.sci.87:6378-6382;felici(1991)j.mol.biol.222:301-310;ladnersupra.)呈现。
本发明的其他实施方案包括以下内容。
本发明的特征还在于一种分离的核酸分子或一种核酸分子的分离的制剂,其包括本文所述的改变。此类核酸分子或其制剂可包括本文所述的改变或可用于检测例如序列改变。
本发明的特征还在于一种适合作为探针、引物、诱饵或文库成员的核酸分子(例如核酸片段),其包括可用于鉴定本文所述的改变或否则基于本文所述的改变,或位于所述改变的侧翼或与其杂交。在某些实施方案中,探针、引物或诱饵分子是允许捕获、检测或分离含有本文所述改变(例如表1中列出的基因处的改变,例如nf1基因或lrp1b基因处的改变)的核酸分子的寡核苷酸。
寡核苷酸可包括与包含本文所述的改变的核酸分子或核酸分子片段基本上互补的核苷酸序列。核酸分子(例如寡核苷酸)与靶序列之间的序列不需要具有精确的同一性,只要序列足够互补以允许捕获、检测或分离靶序列即可。在一个实施方案中,核酸片段是探针或引物,其包含长度为约5个至25个(例如10个至20个,或10个至15个)核苷酸的寡核苷酸。在其他实施方案中,核酸片段是诱饵,其包含长度为约100个至300个核苷酸、130个至230个核苷酸或150个至200个核苷酸的寡核苷酸。
在一个实施方案中,核酸片段可用于鉴定或捕获(例如通过杂交)包含本文所述改变(例如表1中列出的基因处的改变,例如nf1基因或lrpib基因处的改变)的核酸分子。例如,核酸片段可以是探针、引物或诱饵,用于(例如通过杂交)鉴定或捕获本文所述的改变。
本文所述的探针或引物可用于例如pcr扩增。在检测基于pcr的一个示例性实施方案中,可以使用例如引物或引物对进行突变的扩增,以例如扩增位于本文所述改变的侧翼的序列。
在其他实施方案中,核酸片段包括诱饵,所述诱饵包括与包含本文所述改变的核酸分子杂交的核苷酸序列,从而允许捕获或分离所述核酸分子。在一个实施方案中,诱饵适合于溶液相杂交。在其他实施方案中,诱饵包括结合实体(例如亲和标签),该结合实体允许捕获和分离(例如通过与结合实体结合)由诱饵和与诱饵杂交的核酸形成的杂交体。
在其他实施方案中,核酸片段包括含有本文所述核酸分子的文库成员。在一个实施方案中,文库成员包括突变,例如导致本文所述改变的碱基取代。
可以使用例如放射性标记物、荧光标记物、生物发光标记物、化学发光标记物、酶标记物、结合对标记物对核酸片段进行可检测的标记,或者核酸片段可以包括亲和标签、标签或标识符(例如,衔接子、条形码或其他序列标识符)。
另一方面,本发明的特征在于一种包含本文所述改变的多肽(例如,包含本文所述改变的纯化多肽)、其生物活性片段或抗原性片段,以及试剂(例如,与包含本文所述改变的多肽结合的抗体分子),用于调节包括本文所述改变的多肽活性的方法,以及检测包含本文所述改变的多肽的方法。
在另一个实施方案中,多肽或片段是肽,例如含有本文所述改变的免疫原性肽或蛋白质。此类免疫原性肽或蛋白质可用于产生对包含本文所述改变的多肽或蛋白质特异的抗体。在其他实施方案中,此类免疫原性肽或蛋白质可用于疫苗制剂。疫苗制剂可包括其他组分,例如佐剂。
另一方面,本发明的特征在于结合多肽的抗体分子,所述多肽包含本文所述的改变或本文所述的片段。在一些实施方案中,抗体可以区分野生型多肽和突变多肽(例如包含本文所述改变的多肽)。用于产生抗体分子的技术是本领域已知的,并且描述于例如wo2012/092426,题为“optimizationofmultigeneanalysisoftumorsamples”,其通过引用并入本文。
例如可以在以下任何编号的段落中定义本发明:
1.一种治疗患有黑素瘤的个体的方法,该方法包括:
(a)获得个体对包括pd-1抑制剂或pd-l1抑制剂的疗法的应答者状态值,其中所述应答者状态值包括来自个体的黑素瘤样本或源自黑素瘤的样本中的肿瘤突变负荷(tmb)的量度;和
(b)响应于应答者状态值的增加,例如与应答者状态的参考值相比,向个体施用疗法,
从而治疗个体。
2.一种治疗患有黑素瘤的个体的方法,该方法包括:
向个体施用包括pd-1抑制剂或pd-l1抑制剂的疗法,
其中个体已经具有或已经被鉴定为具有应答者状态值的增加,例如与应答者状态的参考值相比,
其中所述应答者状态值包括来自个体的黑素瘤样本或源自黑素瘤的样本中的肿瘤突变负荷的量度,
从而治疗个体。
3.一种为患有黑素瘤的个体选择包括pd-1抑制剂或pd-l1抑制剂的疗法的方法,该方法包括:
获得个体对疗法的应答者状态值,
其中所述应答者状态值包括来自个体的黑素瘤样本或源自黑素瘤的样本中的肿瘤突变负荷的量度,
其中应答者状态值的增加,例如与应答者状态的参考值相比,表明所述个体是对疗法的应答者,或可能是对疗法的应答者,或者所述个体将对治疗作出应答,或可能将对治疗作出应答,
从而选择疗法。
4.一种评估患有黑素瘤的个体的方法,该方法包括:
(a)获得个体对包括pd-1抑制剂或pd-l1抑制剂的疗法的应答者状态值,其中所述应答者状态值包括来自个体的黑素瘤样本或源自黑素瘤的样本的肿瘤突变负荷的量度,和
(b)将个体鉴定为对疗法的应答者(例如,完全应答者或部分应答者)或无应答者,
其中应答者状态值等于或大于应答者状态的参考值,表明所述个体是对疗法的应答者或可能是对疗法的应答者,或者将对疗法作出应答,或可能将对疗法作出应答;或者
其中应答者状态值小于应答者状态的参考值表示所述个体是对疗法的无应答者或可能是对疗法的无应答者,或者所述个体将不会对疗法作出应答,或可能将不会对疗法作出应答,从而评估个体。
5.根据权利要求1-4中任一项所述的方法,其中所述肿瘤突变负荷的量度包括测定的来自个体的样本的以下中的一项、两项、三项或全部:
(i)在表1中列出的预定组基因处的体细胞改变(例如,一种或多种体细胞改变)的水平;
(ii)在nf1基因处存在体细胞改变(例如,一种或多种体细胞改变);
(iii)在lrp1b基因处的体细胞改变(例如,一种或多种体细胞改变)的数量;或
(iv)在表1中列出的预定组基因处的c至t转换的数量(例如,一个或多个c至t转换)。
6.根据权利要求1-5中任一项所述的方法,其中响应于来自个体的样本的以下所列中的一项、两项、三项或全部,对个体施用疗法或为个体选择疗法:
(i)与在表1中列出的预定组基因处的体细胞改变(例如,一种或多种体细胞改变)的参考水平相比,在表1中列出的预定组基因处的体细胞改变(例如,一种或多种体细胞改变)的水平增加;
(ii)在nf1基因处存在体细胞改变(例如,一种或多种体细胞改变);
(iii)与在lrp1b基因处的体细胞改变(例如,一种或多种体细胞改变)的参考水平相比,在lrp1b基因处的体细胞改变(例如,一种或多种体细胞改变)的数量增加;或者
(iv)与在表1中列出的预定组基因处的c至t转换(例如,一个或多个c至t转换)的参考水平相比,在表1中列出的预定组基因处的c至t转换(例如,一个或多个c至t转换)的数量增加。
7.一种治疗患有黑素瘤的个体的方法,该方法包括:
(a)测定来自个体的黑素瘤样本或源自黑素瘤的样本的以下所列中的一项或多项:
(i)在表1中列出的预定组基因处的体细胞改变水平(例如,一种或多种体细胞改变);
(ii)在nf1基因处存在或者不存在体细胞改变(例如,一种或多种体细胞改变);
(iii)在lrp1b基因处的体细胞改变(例如,一种或多种体细胞改变)的数量;或者
(iv)在表1中列出的预定组基因处的c至t转换的数量;
(b)对以下中的一项或多项作出应答:
(i)与在表1中列出的预定组基因处的体细胞改变(例如,一种或多种体细胞改变)的参考水平相比,在表1中列出的预定组基因处的体细胞改变(例如,一种或多种体细胞改变)的水平增加;
(ii)在nf1基因处存在体细胞改变(例如,一种或多种体细胞改变);
(iii)与在lrp1b基因处的体细胞改变(例如,一种或多种体细胞改变)的参考数量相比,在lrp1b基因处的体细胞改变(例如,一种或多种体细胞改变)的数量增加;或者
(iv)与在表1中列出的预定组基因处的c至t转换的参考数量相比,在表1中列出的预定组基因处的c至t转换的数量增加,
向个体施用包括pd-1抑制剂或pd-l1抑制剂的疗法,从而治疗个体。
8.根据权利要求1-7中任一项所述的方法,其中应答者状态的参考值是对疗法的无应答者的应答者状态值。
9.根据权利要求1-8中任一项所述的方法,其中肿瘤突变负荷的参考水平相比自个体的样本中肿瘤突变负荷水平的增加,对个体施用疗法或为个体选择疗法。
10.根据权利要求9所述的方法,其中肿瘤突变负荷的参考水平是来自对疗法无应答者的黑素瘤样本或源自黑素瘤的样本中的肿瘤突变负荷水平。
11.根据权利要求1-10中任一项所述的方法,其中当来自个体的样本具有以下所列中的一项、两项、三项或全部时,所述个体被鉴定为对疗法的应答者:
(i)与在表1中列出的预定组基因处的体细胞改变的参考水平相比较,在表1中列出的预定组基因处的体细胞改变的水平增加;
(ii)在nf1基因处存在体细胞改变;
(iii)与在lrp1b基因处的体细胞改变的参考水平相比较,在lrp1b基因处的体细胞改变的数量增加;或者
(iv)与在表1中列出的预定组基因处的c至t转换的参考水平相比较,在表1中列出的预定组基因处的c至t转换的数量增加。
12.根据权利要求1-11中任一项所述的方法,其中当来自个体的样本具有以下所列中的一项、两项、三项或全部时,所述个体被鉴定为对疗法的无应答者:
(i)与在表1中列出的预定组基因处的体细胞改变的参考水平相比,在表1中列出的预定组基因处的体细胞改变的水平降低或者无变化;
(ii)在nf1基因处不存在体细胞改变;
(iii)与在lrp1b基因处的体细胞改变的参考水平相比,在lrp1b基因处的体细胞改变的数量相似、相同或者下降;或者
(iv)与在表1中列出的预定组基因处的c至t转换的参考水平相比,在表1中列出的预定组基因处的c至t转换的数量相似、相同或者下降。
13.根据权利要求1-12中任一项所述的方法,其中所述预定组基因包括表1中列出的基因中的至少约50个或更多,至少约100个或更多,至少约150个或更多,至少约200个或更多,至少约250个或更多,至少约300个或更多,或者全部基因。
14.根据权利要求1-13中任一项所述的方法,其中在表1中列出的预定组基因处的体细胞改变的参考水平,是来自对疗法无应答者的黑素瘤样本或源自黑素瘤的样本中的在表1中列出的预定组基因处的体细胞改变的水平。
15.根据权利要求1-14中任一项所述的方法,其中在lrp1b基因处体细胞改变的参考水平,是来自对疗法无应答者的黑素瘤样本或源自黑素瘤的样本中的在lrp1b基因处的体细胞改变的水平。
16.根据权利要求6-15中任一项所述的方法,其中在表1中列出的预定组基因处的c至t转换的参考水平是来自对疗法无应答者的黑素瘤样本或源自黑素瘤的样本中c至t转换的水平。
17.根据权利要求5-16中任一项所述的方法,其中在表1中列出的预定组基因处的体细胞改变的水平通过下述方法确定,所述方法包括对表1中列出的预定组基因进行测序,例如,对表1中列出的预定组基因的编码区进行测序。
18.根据权利要求5-17中任一项所述的方法,其中在nf1基因处存在或者不存在体细胞改变,通过下述方法确定,所述方法包括对nf1基因进行测序,例如对nf1基因的编码区进行测序。
19.根据权利要求5-18中任一项所述的方法,其中在lrp1b基因处体细胞改变的数量,通过下述方法确定,所述方法包括对lrp1b基因进行测序,例如对lrp1b基因的编码区进行测序。
20.根据权利要求5-19中任一项所述的方法,其中在表1中列出的预定组基因处的c至t转换的数量通过下述方法确定,所述方法包括对表1中列出的预定组基因进行测序。
21.根据权利要求1-20中任一项所述的方法,其还包括,响应于肿瘤突变负荷的量度,进行以下所列中的一项、两项、三项或全部:
(a)向个体施用改变了剂量的疗法;
(b)改变个体的治疗方案或时程;
(c)与所述疗法相组合,向例如无应答者或者部分应答者施用其他的药剂;或者
(d)预测个体中黑素瘤发展的时程。
22.根据权利要求5-21中任一项所述的方法,其中测定在表1中列出的预定组基因处的体细胞改变的水平包括,测定在表1中列出的基因中的约25个或更多,例如约50个或更多、约100个或更多、约150个或更多、约200个或更多、约250个或更多、约300个或更多基因或所有基因处的体细胞改变的水平。
23.根据权利要求5-22中任一项所述的方法,其中测定在表1中列出的预定组基因处的体细胞改变的水平包括,确定在预定组基因的编码区处的、例如被测序的预定组基因的编码区处的每预选单位例如每兆碱基的体细胞改变的数量。
24.根据权利要求1-23中任一项所述的方法,其中响应于在表1中列出的预定组基因处的体细胞改变的水平的增加,例如,与在表1中列出的预定组基因处的体细胞改变的参考水平相比,增加至少约2倍,至少约3倍,至少约5倍,至少约10倍,至少约15倍,至少约20倍,至少约30倍,至少约40倍或至少约50倍,对个体施用疗法,或者为个体选择疗法。
25.根据权利要求1-24中任一项所述的方法,其中响应于以下情况,对个体施用疗法,或者为个体选择疗法:在表1中列出的预定组基因处的体细胞改变的数量测定为在预定组基因的编码区处每兆碱基的体细胞改变约3.3个或更多,例如,约5个或更多,约10个或更多,约15个或更多,约20个或更多,约25个或更多,约30个或更多,约35个或更多,约40个或更多,约45个或更多,或者约50个或更多。
26.根据权利要求1-25中任一项所述的方法,其中响应于以下情况,对个体施用疗法,或者为个体选择疗法:在表1中列出的预定组基因处的体细胞改变的数量测定为在预定组基因的编码区处每兆碱基的体细胞改变约23.1个或更多,例如,约25个或更多,约30个或更多,约35个或更多,约40个或更多,约45个或更多,或者约50个或更多。
27.根据权利要求1-26中任一项所述的方法,其中响应于以下情况,对个体施用疗法,或者为个体选择疗法:在表1中列出的预定组基因处的体细胞改变的数量测定为在预定组基因的编码区处每兆碱基的体细胞改变在约3.3个至约23.1个之间,例如,在约5个至约20个之间,在约10个至约20个之间,或在约15个至约20个之间。
28.根据权利要求1-27中任一项所述的方法,其中与在表1中列出的预定组基因处的体细胞改变的参考水平相比,在表1中列出的预定组基因处的体细胞改变的水平增加,例如,增加至少约2倍,至少约3倍,至少约5倍,至少约10倍,至少约15倍,至少约20倍,至少约30倍,至少约40倍或至少约50倍,表明个体是对疗法的应答者。
29.根据权利要求1-28中任一项所述的方法,其中与在表1中列出的预定组基因处的体细胞改变的参考水平相比,在表1中列出的预定组基因处的体细胞改变的水平相似、相同或者降低,表明个体是对疗法的无应答者。
30.根据权利要求1-29中任一项所述的方法,其中在表1中列出的预定组基因处的体细胞改变的数量测定为在预定组基因的编码区处每兆碱基的体细胞改变约3.3个或更多,例如,约5个或更多,约10个或更多,约15个或更多,约20个或更多,约25个或更多,约30个或更多,约35个或更多,约40个或更多,约45个或更多,或者约50个或更多,表明个体是对疗法的应答者,例如完全应答者或者部分应答者。
31.根据权利要求1-30中任一项所述的方法,其中在表1中列出的预定组基因处的体细胞改变的数量测定为在预定组基因的编码区处每兆碱基的体细胞改变小于约3.3个,表明个体是对疗法的无应答者。
32.根据权利要求1-31中任一项所述的方法,其中在表1中列出的预定组基因处的体细胞改变的数量测定为在预定组基因的编码区处每兆碱基的体细胞改变约23.1个或更多,例如,约25个或更多,约30个或更多,约35个或更多,约40个或更多,约45个或更多,或者约50个或更多,表明个体是对疗法的应答者,例如完全应答者。
33.根据权利要求1-32中任一项所述的方法,其中在表1中列出的预定组基因处的体细胞改变的数量测定为在预定组基因的编码区处每兆碱基的体细胞改变小于约23.1个,表明个体是对疗法的部分应答者或者无应答者。
34.根据权利要求1-33中任一项所述的方法,其中在表1中列出的预定组基因处的体细胞改变的数量测定为在表1中列出的预定组基因的编码区处每兆碱基的体细胞改变在约3.2(例如约3.3)个至约20个之间,例如,在约5个至约20个之间,在约10个至约20个之间,或者在约15个至约20个之间,表明个体是对疗法的部分应答者。
35.根据权利要求1-34中任一项所述的方法,其中响应于在nf1基因的编码区处存在的体细胞改变的测定,对个体施用疗法,或者为个体选择疗法。
36.根据权利要求1-35中任一项所述的方法,其中在nf1基因的编码区中存在体细胞改变表明个体是对疗法的应答者,或者可能是对疗法的应答者,或者将对疗法作出应答,或者可能将对疗法作出应答。
37.根据权利要求1-36中任一项所述的方法,其中响应于以下的测定,对个体施用疗法,或者为个体选择疗法:
(a)在nf1基因的编码区处存在体细胞改变;和
(b)在表1中列出的预定组基因处的体细胞改变的水平是,表1中列出的预定组基因的编码区中每兆碱基的体细胞改变的数量为约35个或更多,约38.5个或更多,约40个或更多,约45个或更多,或者约50个或更多。
38.根据权利要求1-37中任一项所述的方法,其中响应于以下的测定,对个体施用疗法,或者为个体选择疗法:
(a)在nf1基因的编码区处存在体细胞改变;和
(b)表1中列出的预定组基因中体细胞改变的水平增加,例如,与黑素瘤样本或者源自黑素瘤的样本的在表1中列出的预定组基因处的体细胞改变的水平相比,增加至少约2倍,至少约3倍,至少约5倍或至少约10倍,包括braf基因中的体细胞改变,nras基因中的体细胞改变,或者是braf基因、nras基因和nf1基因的三重wt(野生型)。
39.根据权利要求1-38中任一项所述的方法,其中响应于lrp1b基因中存在约1个或更多、约2个或更多、约3个或更多、约4个或更多或者约5个或更多数量的体细胞改变的测定,对个体施用疗法,或者为个体选择疗法。
40.根据权利要求1-39中任一项所述的方法,其中在lrp1b基因处存在约1个或更多、约2个或更多、约3个或更多、约4个或更多或者约5个或更多数量的体细胞改变,表明个体是对疗法的应答者或可能是对疗法的应答者,或者将对疗法作出应答,或可能将对疗法作出应答。
41.根据权利要求1-40中任一项所述的方法,其中响应于测定的在lrp1b处体细胞改变的数量的增加,例如,与在lrp1b基因处体细胞改变的参考数量相比,增加至少约2倍,至少约2.5倍,至少约2.8倍,至少约3倍,至少约3.5倍,至少约4倍或者至少约5倍,对个体施用疗法,或者为个体选择疗法。
42.根据权利要求41所述的方法,其中在lrp1b基因处体细胞改变的参考数量,是来自对疗法的无应答者的黑素瘤样本或者源自黑素瘤的样本的在lrp1b基因处的体细胞改变的数量。
43.根据权利要求41或42所述的方法,其中在lrp1b基因处体细胞改变的参考数量是0或1个体细胞改变。
44.根据权利要求1-43中任一项所述的方法,其中响应于以下情况,对个体施用疗法,或者为个体选择疗法:确定在表1中列出的预定组基因处存在约20个或更多、约25个或更多、约30个或更多、约40个或更多或者约50个或更多的c至t转换。
45.根据权利要求1-44中任一项所述的方法,其中确定在表1中列出的预定组基因处存在约20个或更多、约25个或更多、约30个或更多、约40个或更多或者约50个或更多的c至t转换,表明个体是对包括pd-1抑制剂或pd-l1抑制剂的疗法的应答者。
46.根据权利要求1-45中任一项所述的方法,其中响应于以下情况,对个体施用疗法,或者为个体选择疗法:确定在表1中列出的预定组基因处的c至t转换的数量的增加,例如,与在表1中列出的预定组基因处的c至t转换的参考数量相比,增加至少约8倍,至少约10倍,至少约12倍,至少约15倍或者至少约20倍。
47.根据权利要求46所述的方法,其中c至t转换的参考数量是来自对疗法无应答者的黑素瘤样本或源自黑素瘤的样本中的c至t转换的数量。
48.根据权利要求46或47所述的方法,其中,c至t的转换的参考数量是大约两个c至t的转换。
49.根据权利要求1-48中任一项所述的方法,其中个体正在接受或已经接受包括除pd-1抑制剂或pd-l1抑制剂之外的治疗剂或治疗方式的不同疗法。
50.根据权利要求49所述的方法,其中,响应于测定的以下中的一项、两项、三项或全部,停止所述不同疗法:
(i)与在表1中列出的预定组基因处的体细胞改变的参考水平相比,在表1中列出的预定组基因处的体细胞改变的水平增加;
(ii)在nf1基因处存在体细胞改变;
(iii)与在lrp1b基因处的体细胞改变的参考水平相比,在lrp1b基因处的体细胞改变的数量增加;或
(iv)与在表1中列出的预定组基因处的c至t转换的参考水平相比,在表1中列出的预定组基因处的c至t转换的数量增加。
51.根据权利要求49或50所述的方法,其中在停止所述不同疗法后,施用所述疗法。
52.根据权利要求49或50所述的方法,其中所述疗法与所述不同疗法组合施用。
53.根据权利要求49-52中任一项所述的方法,其中所述不同疗法选自化学疗法、放射疗法、免疫疗法、免疫放射性疗法、溶瘤病毒疗法、外科手术或它们的任意组合。
54.根据权利要求49-53中任一项所述的方法,其中所述不同疗法包括以下的一种或多种:达卡巴嗪、替莫唑胺、白细胞介素-2(il-2)、干扰素、伊匹单抗、braf抑制剂、mek抑制剂、溶瘤病毒(talimogenelaherparepvec)、过继细胞转移或它们的任意组合。
55.根据权利要求54所述的方法,其中所述干扰素是重组干扰素α-2b或聚乙二醇干扰素α-2b。
56.根据权利要求54所述的方法,其中所述braf抑制剂是维罗非尼或达拉菲尼。
57.根据权利要求54所述的方法,其中所述mek抑制剂是考比替尼或曲美替尼。
58.根据权利要求54所述的方法,其中所述过继细胞转移包括修饰的t细胞或修饰的树突细胞。
59.根据权利要求1-58中任一项所述的方法,其中所述pd-1抑制剂是抗pd-1抗体。
60.根据权利要求59所述的方法,其中所述pd-1抑制剂选自纳武单抗(ono-4538、bms-936558或mdx1106)、帕博利珠单抗(mk-3475或拉姆珠单抗)、皮地利珠单抗(ct-011)、medi0680(amp-514)、pdr001、regn2810、bgb-108、bgb-a317、shr-1210(hr-301210、shr1210或shr-1210)、pf-06801591或amp-224。
61.根据权利要求1-58中任一项所述的方法,其中所述pd-l1抑制剂是抗pd-l1抗体。
62.根据权利要求61所述的方法,其中所述pd-l1抑制剂选自阿特珠单抗(mpdl3280a、rg7446或ro5541267)、yw243.55.s70、mdx-1105、度伐鲁单抗(medi4736)或巴文西亚(msb0010718c)。
63.根据权利要求1-62中任一项所述的方法,其中所述体细胞改变包括以下一种或多种:沉默突变(例如,同义变异)、尚未鉴定为与癌症表型相关的体细胞改变、乘客突变(例如,对克隆的适合性没有可检测的影响的变异)、意义不明的变异(vus)(例如,其致病性既不能被证实也不能被排除的变异)、点突变、编码短变异(例如,碱基取代或插入缺失)、非同义单核苷酸变异(snv)、剪接变异。
64.根据权利要求1-63中任一项所述的方法,其中所述改变(例如,体细胞改变)不包括以下的一种或多种:重排(例如易位)、功能性改变或种系突变。
65.根据权利要求1-64中任一项所述的方法,其中所述体细胞改变是沉默突变,例如同义变异。
66.根据权利要求1-64中任一项所述的方法,其中所述体细胞改变尚未鉴定为与癌症表型相关。
67.根据权利要求1-64中任一项所述的方法,其中所述体细胞改变是乘客突变,例如,对克隆的适合性没有可检测的影响的变异。
68.根据权利要求1-64中任一项所述的方法,其中所述体细胞改变是意义不明的变异(vus),例如,其致病性既不能被证实也不能被排除的变异。
69.根据权利要求1-64中任一项所述的方法,其中所述体细胞改变是点突变。
70.根据权利要求1-64中任一项所述的方法,其中所述体细胞改变不包括重排,例如不包括易位。
71.根据权利要求1-64中任一项所述的方法,其中所述体细胞改变是编码短变异,例如,碱基取代或插入缺失。
72.根据权利要求1-64中任一项所述的方法,其中所述体细胞改变是非同义单核苷酸变异(snv)。
73.根据权利要求1-64中任一项所述的方法,其中所述体细胞改变是剪接变异。
74.根据权利要求1-64中任一项所述的方法,其中所述体细胞改变不是功能性改变。
75.根据权利要求1-64中任一项所述的方法,其中所述体细胞改变不是种系突变。
76.一种评估患有黑素瘤的个体的系统,其包括:
至少一个可操作地连接到存储器的处理器,所述至少一个处理器在执行时被配置为:
(a)获得个体对包括pd-1抑制剂或pd-l1抑制剂的疗法的应答者状态值,其中所述应答者状态值包括来自个体的黑素瘤样本或源自黑素瘤的样本中的肿瘤突变负荷的量度;和
(b)将个体鉴定为对疗法的应答者(例如,完全应答者或部分应答者)或者对疗法的无应答者,其中应答者状态值等于或大于应答者状态的参考值,表明所述个体是对疗法的应答者或可能是对疗法的应答者,或者将对疗法作出应答或可能将对疗法作出应答;或
其中应答者状态值小于应答者状态的参考值,表明所述个体是对疗法的无应答者或可能是对疗法的无应答者,或者将不会对疗法作出应答或可能不会对疗法作出应答,从而评估个体。
77.根据权利要求76所述的系统,其中所述肿瘤突变负荷的量度包括测定来自个体的样本的以下所列中的一项、两项、三项或全部:
(i)在表1中列出的预定组基因处的体细胞改变水平(例如,一种或多种体细胞改变);
(ii)在nf1基因处存在体细胞改变(例如,一种或多种体细胞改变);
(iii)在lrp1b基因处的体细胞改变(例如,一种或多种体细胞改变)的数量;或
(iv)在表1中列出的预定组基因处的c至t转换的数量。
78.根据权利要求76或77所述的系统,其中响应于来自个体的样本的以下所列中的一项、两项、三项或全部,对个体施用疗法或为个体选择疗法:
(i)与在表1中列出的预定组基因处的体细胞改变的参考水平相比,在表1中列出的预定组基因处的体细胞改变的水平增加;
(ii)在nf1基因处存在体细胞改变;
(iii)与在lrp1b基因处的体细胞改变的参考水平相比,在lrp1b基因处的体细胞改变的数量增加;或者
(iv)与在表1中列出的预定组基因处的c至t转换的参考水平相比,在表1中列出的预定组基因处的c至t转换的数量增加。
79.一种试剂盒,其包括:
(a)一种或多种能够检测以下一项或多项的检测试剂:
(i)在表1中列出的预定组基因处的体细胞改变(例如,一种或多种体细胞改变),
(ii)在nf1基因处的体细胞改变(例如,一种或多种体细胞改变),
(iii)在lrp1b基因处的体细胞改变(例如,一种或多种体细胞改变),
(iv)在表1中列出的预定组基因处的c至t转换(例如,一个或多个c至t转换);
(b)用于确定黑素瘤样本或源自黑素瘤的样本中的肿瘤突变负荷和/或治疗个体的黑素瘤的说明书;以及,任选地
(c)pd-1抑制剂或pd-l1抑制剂或其组合物。
80.一种纯化或分离的核酸制剂,其中所述核酸来源于黑素瘤样本或源自黑素瘤的样本,所述制剂包括以下一项或多项:
(i)在表1中列出的预定组基因处的体细胞改变(例如,一种或多种体细胞改变),
(ii)在nf1基因处的体细胞改变(例如,一种或多种体细胞改变),
(iii)在lrp1b基因处的体细胞改变(例如,一种或多种体细胞改变),
(iv)在表1中列出的预定组基因处的c至t转换(例如,一个或多个c至t转换);
其中所述制剂用于确定置于测序装置中或者测序装置的样本架中的样本的肿瘤突变负荷。
81.一种反应混合物,其包括:
(a)一种或多种能够检测以下一项或多项的检测试剂:
(i)在表1中列出的预定组基因处的体细胞改变(例如,一种或多种体细胞改变),
(ii)在nf1基因处的体细胞改变(例如,一种或多种体细胞改变),
(iii)在lrp1b基因处的体细胞改变(例如,一种或多种体细胞改变),
(iv)在表1中列出的预定组基因处的c至t转换(例如,一个或多个c至t转换);
(b)来源于黑素瘤样本或源自黑素瘤的样本的核酸,其包含以下的一项或多项:
(i)在表1中列出的预定组基因处的体细胞改变(例如,一种或多种体细胞改变),
(ii)在nf1基因处的体细胞改变(例如,一种或多种体细胞改变),
(iii)在lrp1b基因处的体细胞改变(例如,一种或多种体细胞改变),
(iv)在表1中列出的预定组基因处的c至t转换(例如,一个或多个c至t转换);
其中所述反应混合物用于确定置于测序装置中或者测序装置的样本架中的样本的肿瘤突变负荷。
82.一种制备反应混合物的方法,该方法包括:
使一种或多种检测试剂与核酸组合,其中所述检测试剂能够检测以下一项或多项:
(i)在表1中列出的预定组基因处的体细胞改变(例如,一种或多种体细胞改变),
(ii)在nf1基因处的体细胞改变(例如,一种或多种体细胞改变),
(iii)在lrp1b基因处的体细胞改变(例如,一种或多种体细胞改变),
(iv)在表1中列出的预定组基因处的c至t转换(例如,一个或多个c至t转换);
所述核酸来源于黑素瘤样本或源自黑素瘤的样本,其包括以下的一项或多项:
(i)在表1中列出的预定组基因处的体细胞改变(例如,一种或多种体细胞改变),
(ii)在nf1基因处的体细胞改变(例如,一种或多种体细胞改变),
(iii)在lrpib基因处的体细胞改变(例如,一种或多种体细胞改变),
(iv)在表1中列出的预定组基因处的c至t转换(例如,一个或多个c至t转换);
从而制备所述反应混合物。
实施例
实施例1:靶向下一代测序鉴别针对pd-1阻断的应答标志物
概要
阻断程序性死亡-1及其配体(pd-1/pd-l1)的治疗性抗体在相当大比例的黑素瘤患者中诱导持久的应答。本研究试图确定使用基于杂交体捕获的下一代测序(ngs)组鉴定的突变的数量和/或类型是否与黑素瘤中对抗pd-1的应答相关。
使用来自抗pd-1/pd-l1治疗的患者的存档黑素瘤样本,对236-315个基因进行基于杂交体捕获的下一代测序,并且对来自两个中心的初始群组和验证群组进行t细胞受体(tcr)测序。
与非应答者相比,对抗pd-1或抗pd-l1有应答的患者在初始群组(中值45.6对3.9个突变/mb;p=0.003)和验证群组(37.1对12.8个突变/mb;p=0.002)中具有较高的突变负荷。与中等突变负荷组和低突变负荷组相比,高突变负荷组的应答率、无进展存活率(pfs)和总存活率(os)均较高。具有nf1突变的黑素瘤具有高突变负荷(中值62.7个突变/mb)和高应答率(74%),而braf/nras/nf1野生型黑素瘤具有较低的突变负荷。在这些存档样本中,tcr克隆性未预测应答。ngs平台中315个基因的突变数量与在癌症基因组图谱(cancergenomeatlas)样本中通过全外显子组测序检测到的突变数量强相关,但与存活率无关。
因此,由基于杂交体捕获的ngs平台测定的突变负荷通过应答可能性对患者进行有效的分组。该方法可以为对抗pd-1和/或抗pd-l1疗法的应答提供临床可行预测因子。
方法
患者
根据美国健康保险流通与责任法案(hipaa)指南评估了受保护的健康信息。根据irb批准的方案可追溯地选择患者和样本。所有患者均有转移性黑素瘤并开始抗pd-1(纳武单抗或帕博利珠单抗)或抗pd-l1(阿特珠单抗)治疗作为临床试验的一部分或作为标准治疗。所有患者都具有通过放射照相成像测定的可评估的应答,或具有排除进一步成像的快速临床进展。每个研究方案或标准治疗以8-12周的间隔进行横断面成像。通过病历和肿瘤影像学检查获得基线特征、治疗应答、无进展存活率(pfs)和总存活率(os)。如果患者经历了recist1.1(eisenhauerea,etal.eurjcancer2009;45:228–47;n=30)所述的典型的部分应答或完全应答,或者经历了持续至少12个月(n=2)的非典型免疫相关应答,则被归类为应答者,如果他们没有作出应答,则被归类为无应答者。
大多数被测试的、福尔马林固定的、石蜡包埋的(ffpe)样本仅用于研究目的(n=40)。这些样本包括具有剩余可用ffpe的所有患者,其在分析时具有可评估的治疗应答。还包括用抗-pd-1/pd-l1治疗的患者,所述抗pd-1/pd-l1已经用于临床目的的测试(例如,用于鉴定可操作的突变;n=25)。大多数样本是在开始治疗前12个月内获得的(n=43)。其他样本在治疗前12个月以前获得(n=15),或甚至在治疗开始后不久获得(n=7)。具有可用组织的所有预处理样品严格进行研究目的的免疫组库测序(immunoseq)。
下一代测序(ngs),例如靶向ngs和癌症基因组图谱(tcga)分析
使用经广泛验证的美国临床实验室改进修正案认证的基于杂交体捕获的ngs平台(
为了计算总突变负荷,对涉及表1中列出的基因的测试中检测到的体细胞性突变的数量进行定量,并使用以下算法将该值外推至外显子组整体。对在测试中检测到的所有短变体改变、碱基取代和插入缺失进行计数。还对包括沉默改变的所有编码改变进行计数,而未对非编码改变进行计数。已知功能状态(在cosmic数据库中发生已知的体细胞性改变;cancer.sanger.ac.uk/cosmic)和可能功能状态(肿瘤抑制基因中的截短体)的改变未计算在内。因为该测试优先分析已知在癌症中反复突变的基因,所以进行该校正以避免突变负荷向上偏移。使用dbsnp数据库(www.ncbi.nlm.nih.gov/snp)、exac数据库(具有不少于2个的计数)(exac.broadinstitute.org)和sgz(体细胞种系接合性)算法(例如,如国际申请公开号wo2014/183078和美国申请公开号2014/0336996中所述,其内容通过引用整体并入)排除和过滤预测的种系变异体。使用大于60000个临床样本的群组精化sgz算法以进一步降低调用种系变体的机会。为了计算每兆碱基(mb)的突变负荷,使计数的突变总数除以测试的编码区靶区域,236基因版本和315基因版本分别覆盖0.91兆碱基和1.25兆碱基。
使用癌症基因组数据服务器-r(cgds-r)api(其提供从cgds中提取数据的一组功能),从cbioportal(www.cbioportal.org/public-portal)检索来自tcga(包括263个有临床数据的)的345个皮肤黑素瘤肿瘤样本的匹配体细胞突变和临床数据。使用tcga,将测试中测序的315个基因中的非同义突变的数量与通过全外显子组测序(wes)(n=20,022)由所有编码基因鉴定的总突变数进行比较。还评估了这些样本的存活数据。
t细胞受体测序
使用测量水平的immunoseqtm(先前已描述于adaptivebiotechnologies;tumehetal.nature515:568-71,2014;gerlingeretal.jpathol,2013),在预处理ffpe肿瘤样本中评估tcr测序和克隆性定量以及t细胞分数的测定。如下计算t细胞克隆性:根据数据集中所有生产性tcr序列的克隆丰度计算香农(shannon)熵。通过将香农熵除以唯一的生产性tcr序列的数量的对数来归一化香农熵。然后将该归一化的熵值倒转(1-归一化熵)以产生克隆性度量标准。
统计分析
使用曼-惠特尼u检验(mannwhitneyutest)比较应答者和无应答者之间的突变负荷。计算在一系列值上的突变负荷的表现,并且使用roc曲线从一系列临床有意义的值中的局部最大值中选择低、中和高组的阈值。roc用于从初始群组中鉴定最佳突变截止值以在验证群组中进行评估。使用χ2检验比较具有特定基因组变化的患者之间的应答率,并且未对多重比较进行校正。使用曼-惠特尼u检验比较应答者和无应答者之间的t细胞克隆性和t细胞分数。在tcga样本中,使用斯皮尔曼试验(spearmantest)(cancergenomeatlasnetwork.cell2015;161:1681-96)将315个测试基因中鉴定的突变数与所有编码基因(n=20,022)相关联。tcga中的存活率也与通过wes和测试基因计算的突变负荷相关联,并且使用cox比例风险在突变负荷组之间进行比较。pfs和os由kaplan-meier评估,并且如果患者无进展和/或存活,则在最后一次随访中对患者进行检查。使用时序检验比较突变组之间的高、中和低突变的pfs和os。进行cox比例风险分析以评估突变负荷的影响,其受控于阶段、年龄、性别和既往伊匹单抗。使用graphpadprism(版本6.05)和rstatisticalcomputingpackage(版本3.2.1)进行所有分析。
结果
通过基于杂交体捕获的ngs评估的突变负荷与抗pd-1或抗pd-l1治疗的应答相关
在用抗pd-1或抗pd-l1疗法治疗的患者的样本中进行基于杂交体捕获的ngs(表3)。在初始群组中,抗pd-1或抗pd-l1应答者中的突变负荷明显大于无应答者(中值45.6对3.9个突变/mb;p=0.003,图1a)中的突变负荷。在验证群组(中值37.1对12.8个突变/mb,p=0.002;图1b)中观察到类似的差异。与其他样本相比,在开始治疗的12个月内获得的“最佳”样本的结果相似(表4)。
表3初始群组和验证群组的临床特征
表4在治疗前12个月内获得的样本的结果(“最佳”)与从治疗开始大于12个月后或者开始治疗后不久获得的样本的结果(“非最佳”)
评估特定截止是否可用于根据对疗法的应答可能性对患者进行分类。在初始群组中使用最优化的roc,似乎将患者分为三组具有优于二元截止分类的预测能力(图2a-2b)。患者分为高(>23.1个突变/mb)突变负荷组、中(3.3-23.1个突变/mb)突变负荷组和低(<3.3个突变/mb)突变负荷组。使用这些阈值,在高突变负荷组中观察到优良的客观应答率(orr),其次是中突变负荷组和低突变负荷组(82%对36%对10%的应答率;χ2p=0.003,表5)。这些截止值应用于验证群组;优良的orr也发生在高突变负荷组(88%对29%对25%,χ2p=0.001)。集合初始群组和验证群组,orr在高(85%)突变负荷组中最高,其次是中(29%)突变负荷组和低(14%)突变负荷组(p<0.001)。
表5根据突变负荷分层的应答率
然后评估其他临床结果。在两个群组中,无进展存活率(pfs)与突变负荷相关;与中突变负荷组和低突变负荷组(中值未达到89天对86天,p<0.001;图1c)相比,在高突变负荷组中观察到优良的pfs。总存活率(os)遵循类似的模式(中值未达到300天对375天,p<0.001;图1d)。值得注意的是,尽管orr似乎在中突变负荷组中比在低突变负荷组中更高,但pfs和os在这些组之间表现相似。使用针对年龄、性别、阶段和既往伊匹单抗进行调整的cox比例风险模型(pfs高对低hr,0.14,p<0.001;oshr0.09,p<0.001;表6-7),高突变负荷也与优良的os和pfs相关。
表6基线变量的os调整的cox比例风险模型
*ci:置信区间
表7基线变量的pfs调整的cox比例风险模型
*ci:置信区间
非皮肤黑素瘤(包括肢端亚型)的突变远少于源于皮肤的黑素瘤的突变,并且对免疫疗法的应答可能较不频繁,而不明原因黑素瘤的突变谱反映了皮肤黑素瘤(hodise,watsonir,kryukovgv,etal.cell150:251-63,2012;krauthammeretal.natgenet44:1006-14,2012;postowetal.oncologist18:726-32,2013;lukeetal.cancer,2013;johnsonetal.oncologist20:648-52,2015)。为了排除非皮肤黑素瘤的混淆,分别评估皮肤/未知来源的黑素瘤中的突变负荷,并且在应答者中观察到更高的突变负荷(中值,39.0对14.4个突变/mb,p<0.001;图3a)。在患有非皮肤黑素瘤的患者中,在14名患者(尽管仅有2名应答者)中未发现突变负荷的差异(中值,4.5对2.2个突变/mb,p=0.714;图3b)。
接下来,评估特定类型的基因组变化是否与应答相关。总体鉴定的突变(包括具有已知或可能的功能意义的突变)与对疗法的应答强相关(中值46.5对6.0个突变,p<0.001;图4a)。还发现c>t转换(与紫外辐射损伤高度相关)在应答者中更多(中值33.5对3.0次转换,p<0.001;图4b)。尽管频率较低(图4c),大多数其他核苷酸变体也更常见于应答者中。相比之下,组之间的基因扩增和缺失是相似的(图3c)。
然后研究特定“驱动突变”定义的子集之间的突变负荷是否不同。在braf、nras、nf1和“三重wt”(野生型)黑素瘤之间观察到明显差异(中值12.0对17.6对62.7对2.2个突变/mb,p<0.001)(图4d)。具有nf1突变的黑素瘤先前已与慢性紫外线损伤和高突变负荷相关联(cancergenomeatlasnetwork.cell161:1681-96,2015;krauthammeretal.natgenet44:1006-14,2012)。相比之下,“三重wt”组具有极低的突变负荷。
为了确定在这种基于杂交体捕获的ngs组中测序的236-315基因处的突变负荷是否可以作为wes的总基因组突变负荷的鲁棒相关物,评估了345个存档tcga样本(cancergenomeatlasnetwork.electronicaddressimo,cancergenomeatlasn:genomicclassificationofcutaneousmelanoma.cell161:1681-96,2015)。在这些基因中鉴定的突变总数与这些样本中的总外显子组突变数量强相关(r=0.995,p<0.001;图5a)。这种相关性在具有高突变负荷的样本中显得特别稳健。为了评估在未选择的患者(未接受抗pd-1/pd-l1)中突变负荷是否与改善结果相关,评估具有可评估的存活数据(n=263)的tcga样本的存活率。使用测试的基因(p=0.14)或wes(p=0.06)未观察到明显相关性。对于低、中、高突变负荷组,os差异使用wes(中值,os43.4个月对103.0个月对68.0个月,p=0.001)和测试基因(中值,47.3对112.5个月对61.5个月,p=0.008)。使用三个突变负荷组,具有中突变负荷的患者经历最长的存活期(中对低,hr=2.1,p=0.008;图5b-5c)。
特异性突变和对抗pd-1或抗pd-l1疗法的应答
接下来,检查特定癌症相关基因的突变以评估它们对抗pd-1的应答的影响。该分析集中于先前描述的预测为功能性的改变,并且除非另有说明,否则排除意义不明的变异(vus)。鉴定了在应答者或无应答者中更频繁改变的几种基因(表8,图6)。一些基因组改变与突变负荷相关;例如,nf1改变在应答者中更常见(50%对21%,p=0.015;orr74%),而“三重wt”患者更常见于无应答组(13%对35%,p=0.045)。以较小的数量,应答与先前与免疫疗法应答相关联的基因改变相关(nras;johnsonetal.cancerimmunolres3:288-95,2015),与t细胞排除相关(ctnnb1;sprangeretal.nature,523:231-5,2015)或与pd-l1调节相关(myc;caseyetal.science352:227-31,2016)。pten的丢失与pd-l1表达(在胶质母细胞瘤中)和免疫抑制细胞因子谱(在黑素瘤中)有关(pengetal.cancerdiscov,2015)。虽然pten丢失的两位患者都没有应答,但在比较应答者和无应答者时(13%对15%,p=0.76),pten失活性突变的发生率有明显差异。myc扩增在无应答者中似乎更常见,但结论受到样本量的限制。与无应答者中的brca2突变(33个中的2个)相比,brca2突变(包括vus)在应答者中更常出现(32个中的5个);与缺乏这些突变的黑素瘤相比,具有brca2突变的黑素瘤具有更高的突变负荷(中值,68.2对15.9个突变/mb;p=0.028;hugoetal.cell165:35-44,2016)。
表8应答者和无应答者中的改变的基因
lrp1b突变和总突变负荷
观察到lrp1b处的频繁突变。该推定的肿瘤抑制基因是一个大的1.9-mb基因,被称为共同的脆弱位点(基因组极不稳定的区域;smithetal.cancerlett232:48-57,2006)。假设是本文检测到的突变可能作为总突变负荷和应答的单个基因替代物(总外显子突变负荷的“生物计”)。在应答者中,与1名无应答者(34%对3%,p=0.008)相比,11名患者携带lrp1b突变。当扩展到vus时,应答者平均具有2.8个突变/vus,而无应答者则为0.9个(p=0.016;图7a);75%的应答者具有≥1个突变/vus,而38%的无应答者具有≥1个突变/vus(p=0.002)。为了在更大的群体中进行研究,查询了tcga(cancergenomeatlasnetwork.cell161:1681-96,2015)。与缺乏lrp1b突变的黑素瘤相比,具有lrp1b突变的黑素瘤具有明显更多的总突变(中值542对比219,p<0.001;图7b),并且突变负荷与每个肿瘤的lrp1b突变数量相关(spearman’sr=0.54,p<0.001;图7c)。这些数据表明,对甚至单个经常突变的基因进行测序可以提供对全基因组突变负荷的了解,甚至可以与抗pd-1反应相关联。目前尚不清楚lrp1b突变是否具有内在的免疫效应。
t细胞受体(tcr)克隆性与临床益处或突变负荷无关
然后研究t细胞浸润和克隆性是否与突变负荷相关,是否可以通过在可用肿瘤样本中进行tcrngs来增强该方法的预测能力(n=42)。tcrβ链库的克隆性增加(和多样性降低)可能表明肿瘤特异性抗原群体的预先存在的浸润,并且与抗pd-1的应答相关(tumehetal.nature515:568-71,2014)。观察到tcr克隆性与对抗pd-1的应答无关(中值0.11对0.11,p=0.54;图8a)。此外,t细胞分数与应答无关(中值0.13对0.09,p=0.11;图8b)。由于时间或干预疗法可以调节tcr克隆性/t细胞浸润,因此评估了在开始抗pd-1而无任何间隔的治疗的4个月内获得的样本子集。在该组(n=14)中,观察到应答者中克隆性和t细胞分数增加的非统计学明显趋势(图8c-8d;tumehetal.nature515:568-71,2014)。t细胞克隆性和t细胞分数也与突变负荷无关(图9a-9b)。
在该研究中,发现由基于数百个基因杂交体捕获的ngs平台检测到的突变数量与抗pd-1/抗pd-l1的益处强烈相关。证实并验证了抗pd-1应答与黑素瘤中突变负荷之间的联系。特别是,将患者分组(例如,“高”,“中”和“低”突变负荷群组)提供了对晚期黑色素瘤和可能的其他癌症中的抗pd-1/抗pd-l1作出应答的临床可行的标志物。本研究中“中”突变负荷组和“低”突变负荷组之间的存活率没有差异,这可能意味着存在“阈值效应”,并且对应答和存活率的影响可能在“高”突变负荷组中最为明显。
几种基因的改变与抗pd-1的益处相关。虽然某些遗传变化可能直接影响免疫微环境,但研究结果表明,其他改变可能仅仅与突变负荷相关或有助于增加突变负荷(例如,nf1、lrp1b和brca2)。
总之,由基于杂交体捕获的ngs平台确定的晚期黑素瘤中的突变负荷与两个独立群组中对抗pd-1或抗pd-l1疗法的应答强相关。这在“高”突变负荷组中尤其明显,该组包括大于40%的研究样本。这些数据表明,通过这种严格验证的方法测试突变负荷可以改善治疗决策,使得能够更合理地使用昂贵的药物,并进入精确免疫疗法的新时代。
以引用方式并入
与具体地和单独地指明每个单独的出版物、专利或专利申请通过引用并入本文一样,本文提及的所有出版物、专利和专利申请均通过引用整体并入本文。在冲突的情况下,本申请(包括本文中的任何定义)将进行限制。
同样通过引用整体并入的是任何多核苷酸和多肽序列,其参考与公共数据库中的条目相关的登录号,公共数据库例如由万维网地址为tigr.org的美国基因组研究所(tigr)和/或万维网地址为ncbi.nlm.nih.gov的美国国家生物技术信息中心(ncbi)维护的数据库。
等同方案
本领域技术人员将认识到或者能够仅使用常规的实验确定本文所述具体实施方案的许多等同方案。这些等同方案旨在由所附权利要求涵盖。
- 还没有人留言评论。精彩留言会获得点赞!