制备取代卟啉药物化合物和组合物的方法与流程
本申请要求2016年12月20日提交的序列号为62/436,743的美国临时专利申请的权益,其公开内容通过引用以其整体并入本文。
政府资助声明
本发明在由国立卫生研究院(thenationalinstitutesofhealth)授予的基金号码(grantnumber)为1ul1rr024128-01和5-p30-ca14236-29的政府支持下进行。政府对本发明享有一定的权利。
发明领域
本发明涉及用于制备取代卟啉,包括mn(iii)邻位n-丁氧基乙基吡啶基卟啉的方法和中间体,以及包含所述取代卟啉,包括mn(iii)邻位n-丁氧基乙基吡啶基卟啉的组合物。
发明背景
化合物mn(iii)邻位n-丁氧基乙基吡啶基卟啉(式001;有时缩写为mntnbuoe-2-pyp5+)是已知的并记载于z.rajic等人,freeradicalbiology&medicine53,1828-1834(2012)中。
该化合物被描述为具有各种活性,包括例如治疗炎性肺病、神经退行性疾病、辐射损伤、癌症、糖尿病、心脏病或镰状细胞疾病。一般参见batinic-haberle等人的美国专利no.8616089。然而,难以制备用于药物用途的足够纯形式的该化合物,并因此其新的合成方法将是极其有用的。
发明概述
本发明的一个方面涉及一种制备式001化合物的方法:
其中x为阴离子(例如cl、pf6、甲苯磺酸根、苯磺酸根、甲磺酸根等),该方法包括:
a)提供在ph为10至12(例如11)的水溶液中的式001-2化合物:
其中x为阴离子(例如cl、pf6、甲苯磺酸根、苯磺酸根、甲磺酸根等),然后
(b)将mncl2x4h2o合并至所述水溶液中以产生混合溶液;然后
(c)氧化(oxygenating)所述混合溶液,同时
(d)监控并定期调节所述混合溶液的ph以保持其ph为7.6或7.8与8.2或8.4之间(例如,保持ph为8),同时继续氧化所述混合溶液足以产生所述式001化合物的时间。
本发明的另一方面涉及一种制备式001-2化合物的方法
其中x为阴离子(例如cl、pf6、甲苯磺酸根、苯磺酸根、甲磺酸根等),该方法包括以下步骤:
(a)提供在含三正辛基胺(oct3n)的极性非质子溶剂(例如,二甲基甲酰胺)的加热的溶液中的化合物h2t-2-pyp
其中将所述加热的溶液除氧(例如,通过采用惰性气体如氮气或氩气喷雾(sparging));然后
(b)将所述加热的溶液与对甲苯磺酸2-丁氧基乙酯合并以产生液体混合物;
(c)在升高的温度(例如,85至105℃)保持所述液体混合物足以在中间液体中产生中间产物(即,bmx-001-2-ots)的时间(例如,45-60小时);然后
(d)任选地,将所述中间液体与絮凝剂(例如有机或无机絮凝剂,诸如粉末状纤维素(例如,solkafloc))合并,使得中间产物与絮凝剂分离;
(e)当存在时,将所述絮凝剂与所述中间液体分离(例如,通过过滤、沉降、离心或其组合),然后
(f)用水性洗涤液洗涤所述絮凝剂以产生携带有所述中间反应产物的水溶液;和
(g)将所述水溶液与所述阴离子的盐合并以产生所述式001-2化合物。
本发明的另一方面涉及一种制备式002化合物的方法:
其中每个r独立地为c4-c12烷基和x为阴离子(例如cl、pf6、甲苯磺酸根、苯磺酸根、甲磺酸根等),该方法包括:
a)提供在ph为10至12(例如11)的水溶液中的式002-2化合物:
其中每个r独立地为c4-c12烷基和x为阴离子(例如cl、pf6、甲苯磺酸根、苯磺酸根、甲磺酸根等),然后
(b)将mncl2x4h2o合并至所述水溶液中以产生混合溶液;然后
(c)氧化所述混合溶液,同时
(d)监控并定期调节所述混合溶液的ph以保持其ph为7.6或7.8与8.2或8.4之间(例如,保持ph为8),同时继续氧化所述混合溶液足以产生所述式002化合物的时间。
本发明的另一方面涉及一种制备式002-2化合物的方法:
其中每个r独立地为c4-c12烷基和x为阴离子(例如cl、pf6、甲苯磺酸根、苯磺酸根、甲磺酸根等),该方法包括以下步骤:
(a)提供在含三正辛基胺(oct3n)的极性非质子溶剂(例如,二甲基甲酰胺)的加热的溶液中的化合物h2t-2-pyp
其中将所述加热的溶液除氧(例如,通过采用惰性气体如氮气或氩气喷雾);然后
(b)将所述加热的溶液与对甲苯磺酸2-烷氧基乙酯合并以产生液体混合物;
(c)在升高的温度(例如,85至105℃)保持所述液体混合物足以在中间液体中产生中间产物(即,bmx-001-2-ots)的时间(例如,45-60小时);然后
(d)任选地,将所述中间液体与絮凝剂(例如有机或无机絮凝剂,诸如粉末状纤维素(例如,solkafloc))合并,使得中间产物与絮凝剂分离;
(e)当存在时,将所述絮凝剂与所述中间液体分离(例如,通过过滤、沉降、离心或其组合),然后
(f)用水性洗涤液洗涤所述絮凝剂以产生携带有所述中间反应产物的水溶液;和
(g)将所述水溶液与所述阴离子的盐合并以产生所述式002-2化合物。
本发明的进一步的方面涉及一种包含在药学上可接受的载体中的金属化的吡啶基-卟啉的药物组合物,其中所述组合物中的所有金属化的吡啶基-卟啉的至少80重量%、85重量%、90重量%或95重量%为式001或式002化合物
其中x为药学上可接受的阴离子,并且每个r独立地为c4-c12烷基。
本发明的另一方面涉及本发明的组合物在治疗炎性肺病、神经退行性疾病、辐射损伤、癌症、糖尿病、心脏病或镰状细胞疾病中的用途。
应注意,就一个实施方案描述的本发明的方面可并入不同实施方案中,即使没有与其相关地具体描述。也就是说,所有实施方案和/或任何实施方案的特征都可以以任何方式和/或组合来合并。因此,申请人保留修改任何原始提交的权利要求和/或提交任何新权利要求的权利,包括能够修改任何原始提交的权利要求以从属于和/或并入任何其它的一个或多个权利要求的任何特征(尽管没有以这种方式提出原始权利要求)的权利。下面记载的说明书中详细解释本发明的这些和其它目的和/或方面。本领域普通技术人员在阅读下列附图和优选实施方案的详述时会认识到本发明的其它特征、优点和细节,这样的描述仅举例说明本发明。
附图简述
图1示出mn(iii)卟啉的结构。
图2示出tlc板以及粗混合物和由“meobu/3-py”系统的tlc点回收的物质的esi-ms分析,这最初被认为得到mntmobu-3-pyp5+。在1:1:8=饱和kno3h2o:h2o:ch3cn系统中进行tlc-sio2。在m/z370-500区域中的esi-ms峰对应于离子对(mnp5++2hfba–)3+/3。
图3示出在不同的n-甲氧基烷基吡啶基卟啉制剂中在吡啶基氮上带有“n”个甲氧基烷基和“4-n”个甲基(n=0至4)的种类的混合物的分布。
图4示出在不同的n-甲氧基烷基吡啶基卟啉制剂中整体甲基化(与甲氧基烷基化相对)的水平。
图5示出在甲苯磺酸烷氧基烷基酯的存在下n-吡啶基卟啉的相互竞争的烷氧基烷基化和甲基化反应的提议的反应机理。吡啶已被用作用于n-吡啶基卟啉的吡啶基基团的替代种类。对于甲苯磺酸的甲氧基乙酯、甲氧基丁酯、甲氧基戊酯或甲氧基己酯而言,r=甲基且n分别=0、2、3或4。对于甲苯磺酸丁氧基乙酯的情况,r=丁基且n=0。
图6示出在m06-2x/6-311++g(2d,p)//m06-2x/6-31+g(d)dft水平针对与图5中给出的机理相关联的种类计算的吉布斯自由能曲线。在适当情况下考虑压缩和离子对效应。
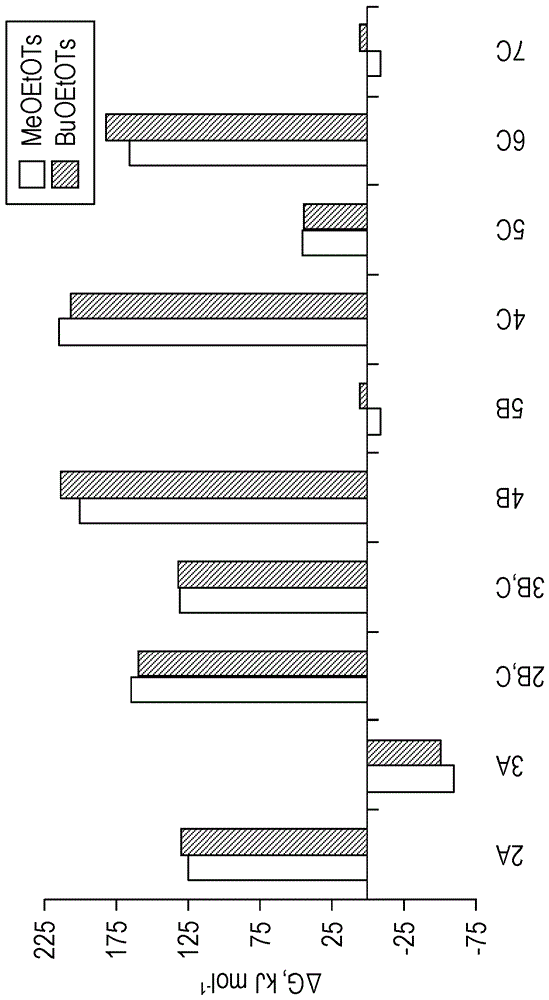
图7示出在m06-2x/6-311++g(2d,p)//m06-2x/6-31+g(d)dft水平针对与图5中给出的机理相关联的种类计算的meoetots和nbuoetots系统的吉布斯自由能的比较。在适当情况下考虑压缩和离子对效应。
说明性实施方案的详述
下面参照附图更充分描述本发明,其中示出本发明的实施方案。然而,本发明可以以许多不同的形式实施并且不应该被解释为限于本文阐述的实施方案;相反,提供这些实施方案使得本公开将是彻底和完整的,并且将充分地传达本发明的范围给本领域的技术人员。
本发明的说明书中使用的术语仅用于描述具体实施方案的目的,且不旨在限制本发明。如本发明说明书和所附权利要求书中所用的,除非上下文中另有明确说明,单数形式“一个”、“一种”和“这个”意图也包括复数形式。
除非另有定义,本文使用的所有术语(包括技术术语和科学术语)具有与本发明所属领域普通技术人员通常理解的相同含义。应进一步理解,术语,诸如常用字典中定义的那些,应当被理解为具有与它们在本申请和相关领域的背景下的含义一致的含义,并且不应以理想化或过于正式的含义进行解释,除非本文中明确如此定义。本发明的说明书中使用的术语仅用于描述具体实施方案的目的,且不旨在限制本发明。本文中提到的所有出版物、专利申请、专利和其它参考文献都以其整体通过引用并入。如果术语中存在矛盾,则以本说明书为准。
同样,本文所用的“和/或”指代并涵盖一个或多个相关列出项目的任何以及所有可能的组合,以及当被解释为替代形式(“或”)时不含组合。
除非上下文另外指明,否则特别意指本文所述的本发明的各种特征可以任意组合使用。此外,本发明还考虑在本发明的一些实施方案中,可以排除或省略本文所示的任何特征或特征组合。举例而言,如果说明书陈述复合物(complex)包含组分a、b和c,则其明确意指可以省略和放弃a、b或c中的任一项或其组合。
本文所用的过渡短语“基本上由...组成”(和语法上的变体)被解释为涵盖要求保护的发明所列举的物质或步骤和“不实质上影响要求保护的发明的基本和新颖的特征的那些”。参见,inreherz,537f.2d549,551-52,190u.s.p.q.461,463(ccpa1976)(原件中强调);还参见mpep§2111.03。因此,本文中使用的术语“基本上由...组成”不应被解释为等同于“包含”。
本文所用的术语“约”,当指可测量值,例如量或浓度等时,意在涵盖规定值的±10%、±5%、±1%、±0.5%或甚至±0.1%的变化以及该规定值。例如,“约x”,在x是可测量的值的情况下,是指包括x和x的±10%、±5%、±1%、±0.5%或甚至±0.1%的变化。本文中提供的可测量值的范围可以包括任何其它范围和/或其中的个别值。
本文所用的“药学上可接受的”是指化合物、阴离子或组合物适合于施用于主体,以实现本文所述的治疗,而根据疾病的严重程度和治疗的必要性没有过度有害的副作用。
根据本发明的实施方案提供了制备式002化合物的方法:
其中每个r独立地为c4-c12烷基和x为阴离子(例如cl、pf6、甲苯磺酸根、苯磺酸根、甲磺酸根等)。在一些实施方案中,在式002化合物中的所有r基团是相同的,并且是c4-c12烷基(例如,c4、c5、c6、c7、c8、c9、c10、c11、或c12烷基)。在一些实施方案中,r为c4-c6烷基。在一些实施方案中,提供了一种制备式001化合物的方法:
其中x为阴离子(例如cl、pf6、甲苯磺酸根、苯磺酸根、甲磺酸根等)。
在一些实施方案中,本发明的方法包括(a)提供在ph为10至12的水溶液中的式002-2化合物:
其中每个r独立地为c4-c12烷基和x为阴离子(例如cl、pf6、甲苯磺酸根、苯磺酸根、甲磺酸根等),(b)将mncl2.4h2o合并至所述水溶液中以产生混合溶液;(c)氧化所述混合溶液;和(d)监控并定期调节所述混合溶液的ph以保持其ph为7.6或7.8至8.2或8.4(例如,保持ph为8),同时继续氧化所述混合溶液足以产生式002化合物的时间。可以在氧化所述混合溶液的同时连续地、定期地(例如每10、20、30或40分钟)和/或不连续地监控ph。在一些实施方案中,在式002-2化合物中的所有r基团是相同的,并且是c4-c12烷基(例如,c4、c5、c6、c7、c8、c9、c10、c11或c12烷基)。在一些实施方案中,r为c4-c6烷基。
在一些实施方案中,本发明的方法包括(a)提供在ph为10至12的水溶液中的式001-2化合物:
其中x为阴离子(例如cl、pf6、甲苯磺酸根、苯磺酸根、甲磺酸根等),(b)将mncl2.4h2o合并至所述水溶液中以产生混合溶液;(c)氧化所述混合溶液;和(d)监控并定期调节所述混合溶液的ph以保持其ph为7.6或7.8至8.2或8.4(例如,保持ph为8),同时继续氧化所述混合溶液足以产生式001化合物的时间。
在本发明的方法中,水溶液可具有10.0、10.1、10.2、10.3、10.4、10.5、10.6、10.7、10.8、10.9、11.0、11.1、11.2、11.3、11.4、11.5、11.6、11.7、11.8、11.9或12.0的ph。在一些实施方案中,所述水溶液可具有10.5至11.5的ph。在一些实施方案中,所述水溶液可具有约11的ph。
在氧化所述混合溶液的同时,可以将所述混合溶液保持在和/或调节至7.6、7.7、7.8、7.9、8.0、8.1、8.2、8.3或8.4的ph。在一些实施方案中,在氧化所述混合溶液的同时,可以将所述混合溶液保持在和/或调节至约8.0的ph,或所述ph可以是在7.6或7.8至8.2或8.4范围内或介于7.6或7.8与8.2或8.4之间。在监控步骤期间,如果所述混合溶液具有小于7.6或7.8的ph,则可以通过将碱加入所述混合溶液调节所述混合溶液的ph。或者,如果在监控步骤期间,所述混合溶液具有大于8.2或8.4的ph,则可以通过将酸加入所述混合溶液调节所述混合溶液的ph。所述监控步骤可通过在氧化步骤期间使所述混合溶液接触ph传感器和/或检测器进行。
提供式001-2或式002-2化合物的步骤可通过提供分别包含式001-2化合物或式002-2化合物的吡啶基卟啉连同一种或多种不同的吡啶基卟啉的组合物进行。吡啶基卟啉的组合物可以所有吡啶基卟啉的至少约80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98或99重量%或更多的量包含式001-2化合物或式002-2化合物。
本发明的方法可以产生式002化合物,其量为由式002-2化合物或包含式002-2化合物的组合物产生的所有锰吡啶基-卟啉的至少约80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98或99重量%或更多。
在一些实施方案中,本发明的方法可以产生式001的化合物,其量为由式001-2化合物或包含式002-2化合物的组合物产生的所有锰吡啶基-卟啉的至少约80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98或99重量%或更多。
在一些实施方案中,由本发明方法产生的所有锰吡啶基-卟啉的不超过20、19、18、17、16、15、14、13、12、11、10、9、8、7、6或5重量%或更少由式(iii)、(iv)、(v)、(vi)、(vii)和(viii)化合物组成:
其中x为如上文所述的阴离子。
在一些实施方案中,由本发明方法产生的所有锰吡啶基-卟啉的不超过20、19、18、17、16、15、14、13、12、11、10、9、8、7、6或5重量%或更少由式(iiia)、(iva)、(va)、(via)、(viia)和(viiia)化合物组成:
其中每个r独立地为c4-c12烷基和x为如上文所述的阴离子。在一些实施方案中,式(iiia)、(iva)、(va)、(via)、(viia)或(viiia)化合物的所有r基团是相同的并且为c4-c12烷基(例如c4、c5、c6、c7、c8、c9、c10、c11或c12烷基)。在一些实施方案中,r为c4-c6烷基。
根据一些实施方案,提供了一种制备式002-2化合物的方法:
其中每个r独立地为c4-c12烷基和x为阴离子(例如cl、pf6)。在一些实施方案中,式002-2化合物中的所有r基团是相同的并且为c4-c12烷基(例如,c4、c5、c6、c7、c8、c9、c10、c11或c12烷基)。在一些实施方案中,r为c4-c6烷基。在一些实施方案中,提供了一种制备式001-2化合物的方法
其中x为阴离子(例如cl、pf6)。制备式002-2或式001-2化合物的方法可包括以下步骤:(a)提供在含三正辛基胺(oct3n)、三异丙醇胺、三正癸基胺和/或三正十二烷基胺的极性非质子溶剂(例如,二甲基甲酰胺)的加热的溶液中的化合物h2t-2-pyp
其中,将所述加热的溶液除氧;(b)将所述加热的溶液与对甲苯磺酸2-烷氧基乙酯(例如针对式001-2化合物的对甲苯磺酸2-丁氧基乙酯)合并以产生液体混合物;(c)在升高的温度保持所述液体混合物足以在中间液体中产生中间产物的时间;(d)任选地,将所述中间液体与絮凝剂合并,使得所述中间产物与所述絮凝剂分离;(e)当存在时,将所述絮凝剂与所述中间液体分离,(f)用水性洗涤液洗涤所述絮凝剂以产生携带有中间反应产物的水溶液;和(g)将所述水溶液与所述阴离子的盐合并以产生所述式002-2化合物或式001-2化合物。
在一些实施方案中,所述加热的溶液可以通过采用惰性气体如氮气或氩气喷雾来除氧。
一些实施方案包括在升高的温度(在约85至约105℃的范围内)保持所述液体混合物足以在中间液体中产生中间产物的时间(在约45至约60小时的范围内)。在一些实施方案中,所述中间产物是bmx-001-2-ots。在一些实施方案中,可以将所述液体混合物保持在约85、90、95、100或105℃或其中的任何范围的升高的温度,持续约45、50、55或60小时或其中的任何范围的时间。
所述絮凝剂可以是有机或无机絮凝剂,诸如,例如,粉末状纤维素(例如,solkafloc)。可以使用任何合适的方法(诸如,例如,通过过滤、沉降、离心或其组合)将所述絮凝剂与所述中间液体分离。
在一些实施方案中,所述合并步骤(b)采用包含小于1重量%(相对于所述对甲苯磺酸2-烷氧基乙酯)的四氢呋喃(thf)的对甲苯磺酸2-烷氧基乙酯(例如,对甲苯磺酸2-丁氧基乙酯组合物)进行。尽管不希望束缚于任何特定的理论,该步骤可用于从对甲苯磺酸2-烷氧基乙酯(例如,对甲苯磺酸2-丁氧基乙酯)中除去四氢呋喃和/或用于降低最终组合物中除了bmx-001之外的不希望的产物。
三正辛基胺、三异丙醇胺、三正癸基胺和/或三正十二烷基胺可以相对于h2t-2-pyp过量约5至约25摩尔的量存在于所述极性非质子溶剂中。例如,三正辛基胺、三异丙醇胺、三正癸基胺和/或三正十二烷基胺可以相比于h2t-2-pyp过量约5、10、15或20摩尔的量存在于所述极性非质子溶剂中。
本发明的方法可以产生一种或多种污染中间体化合物。由于在吡啶基氮上的错误取代产生的污染中间化合物可包括式(ia)和/或(iia)化合物:
其中每个r独立地为c4-c12烷基和x为阴离子(例如cl、pf6、甲苯磺酸根、苯磺酸根、甲磺酸根等)。在一些实施方案中,式(ia)或(iia)化合物中的所有r基团都相同并且是c4-c12烷基(例如,c4、c5、c6、c7、c8、c9、c10、c11或c12烷基)。在一些实施方案中,r为c4-c6烷基。
在一些实施方案中,由于在吡啶基氮上的错误取代产生的污染中间化合物可包括式(i)和/或(ii)化合物:
其中x为阴离子(例如cl、pf6、甲苯磺酸根、苯磺酸根、甲磺酸根等)。
在金属化期间由于烷氧基乙基(例如,丁氧基乙基)链断裂产生的污染金属化化合物(考虑到如上文所述的污染物,其可能从先前步骤就已经存在)可包括:
其中每个r独立地为c4-c12烷基和x为阴离子(例如cl、pf6、甲苯磺酸根、苯磺酸根、甲磺酸根等)。
在一些实施方案中,在金属化期间由于丁氧基乙基链断裂产生的污染金属化化合物(考虑到如上文所述的污染物,其可能从先前步骤就已经存在)可以包括:
其中x为阴离子(例如cl、pf6、甲苯磺酸根、苯磺酸根、甲磺酸根等)。
本发明的化合物和组合物可用于治疗人类和其它哺乳动物主体中各种疾病的任何一种,包括但不限于治疗炎性肺病、神经退行性疾病、辐射损伤、癌症、糖尿病、心脏病、镰状细胞疾病等。一般参见batinic-haberle等人,美国专利no.8616089。
在一些实施方案中,提供了一种药物组合物,其包含根据本发明的方法制备的化合物。在一些实施方案中,药物组合物可以包含在药学上可接受的载体中的金属化的吡啶基-卟啉,其中所述组合物中的所有所述金属化的吡啶基-卟啉的至少约80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99或100重量%为式001化合物或式002化合物:
其中x为药学上可接受的阴离子并且每个r独立地为c4-c12烷基。
药学上可接受的阴离子x可选自cl、pf6甲苯磺酸根、甲磺酸根和苯磺酸根。药学上可接受的载体可以是水性载体。
排除所述组合物中药学上可接受的载体的重量,本发明的药物组合物可以包含小于约2、1.8、1.5、1.3或1重量%的游离锰。
在一些实施方案中,所述组合物中所有金属化吡啶基-卟啉的不超过20、19、18、17、16、15、14、13、12、11、10、9、8、7、6、5、4、3、2或1重量%由式(iiia)、(iva)、(va)、(via)、(viia)和(viiia)化合物组成:
其中每个r独立地为c4-c12烷基和x为阴离子(例如cl、pf6、甲苯磺酸根、苯磺酸根、甲磺酸根等)。
在一些实施方案中,所述组合物中所有金属化吡啶基-卟啉的不超过20、19、18、17、16、15、14、13、12、11、10、9、8、7、6、5、4、3、2或1重量%由式(iii)、(iv)、(v)、(vi)、(vii)和(viii)化合物组成:
其中x为如上文给出的阴离子。
在一些实施方案中,本发明的化合物可以具有一种或多种(例如,1、2、3、4或更多种)阻转异构体。因此,本发明的组合物可包含化合物的一种或多种(例如,1、2、3、4或更多种)阻转异构体,诸如,例如,式001化合物或式002化合物。
在一些实施方案中,式001化合物或式002化合物可具有四种阻转异构体,其中4种阻转异构体的结构是相同的,除了四个吡啶基上的每个上的侧链(例如,-ch2-ch2-o-ch2-ch2-ch2-ch3)的位置。该阻转异构体可通过如下事实创建:它们必须伸展到卟啉环的平面上方或下方,并且它们可以被空间位阻固定并且不容易相互转化。该四种阻转异构体可以如下:阻转异构体#1-所有四个侧链在卟啉环的同一侧(即,α-α-α-α),阻转异构体#2–三个侧链在卟啉环的一侧并且一个在另一侧(即,α-α-α-β),阻转异构体#3-两个链在环上方且两个在下方,且它们变换位置(即,α-β-α-β),和阻转异构体#4-两个链在环上方且两个在环下方,且侧链彼此相邻(即,α-α-β-β)。在一些实施方案中,式001的化合物可具有由下列表示的结构:
在一些实施方案中,本发明的式001化合物可具有和/或本发明的组合物可包含阻转异构体#1(即,α-α-α-α),其量为式001化合物的约5重量%至约15重量%,阻转异构体#2(即,α-α-α-β),其量为式001化合物的约45重量%至约55重量%,阻转异构体#3(即,α-β-α-β),其量为式001化合物的约10重量%至约20重量%,和阻转异构体#4(即,α-α-β-β),其量为式001化合物的约20重量%至约30重量%。
本发明的药物组合物可用于治疗主体中的炎性肺病、神经退行性疾病、辐射损伤、癌症、糖尿病、心脏病和/或镰状细胞疾病。本文使用的“治疗”(及其语法变体)指对主体赋予益处的任何类型的治疗,并且可意指主体疾病的严重度被降低、至少部分改善或减轻,和/或与所述疾病或病症相关联的至少一种临床症状的一些减轻、缓解或减少和/或所述疾病或病症的进展的延迟。
在一些实施方案中,本发明的药物组合物可以以治疗有效量施用。本文使用的“治疗有效”量是足以治疗(本文中所定义)主体的量。本领域技术人员应当理解治疗效果无需是完全或治愈的,只要对主体提供一些益处。在一些实施方案中,治疗有效量可以通过施用本发明的药物组合物来实现。
本发明发现在兽医和医学应用两者中的用途。适合用本发明的药物组合物治疗的主体包括但不限于哺乳动物主体。本发明的哺乳动物包括但不限于犬科动物、猫科动物、牛科动物、羊(caprines)、马(equines)、绵羊(ovines)、猪(porcines)、啮齿类动物(例如大鼠和小鼠)、兔类动物、灵长类动物(例如猿和人),非人类灵长类动物(例如,猴、狒狒、黑猩猩、大猩猩)等,以及子宫内的哺乳动物。需要根据本发明治疗的任何哺乳动物主体都是合适的。两种性别以及处于任何发育阶段(即新生儿、婴幼儿、少年、青少年、成年人)的人类主体均可根据本发明治疗。在本发明的一些实施方案中,主体是哺乳动物,且在某些实施方案中,主体是人。人类主体包括所有年龄的男性和女性,包括胎儿、新生儿、婴幼儿、少年、青少年、成年人和老年人主体以及怀孕主体。
在一些实施方案中,本发明的药物组合物可在动物主体特别是哺乳动物主体(诸如小鼠、大鼠、狗、猫、家畜和马)上实施,以用于兽医目的和/或用于药物筛选和/或药物开发目的。
本发明的化合物可在药物载体中根据已知技术进行配制用于施用。参见,例如,remington,thescienceandpracticeofpharmacy(第9版1995)。在根据本发明的药物制剂的制备中,所述化合物(包括其生理学上可接受的盐)通常尤其与可接受的载体混合。当然,所述载体必须在与制剂中的任何其它成分相容的意义上是可接受的并且必须对患者无害。该载体可以是固体或液体或两者,且优选与化合物一起配制成单位剂量制剂,例如,片剂,其可以含有0.01重量%或0.5重量%至95重量%或99重量%的化合物。可以将一种或多种化合物并入本发明的制剂中,其可以通过任何药学上熟知的技术制备,包括混合各组分,任选地包括一种或多种辅助成分。
本发明的制剂包括适合于口服、直肠、局部、口腔(例如舌下)、阴道、肠胃外(例如,皮下、肌内、皮内或静脉内)、局部(即,皮肤和粘膜表面二者,包括气道表面)和经皮施用的那些,尽管在任何给定情况下最合适的途径将取决于所治疗的病症的性质和严重程度和正使用的具体化合物的性质。
适用于口服施用的制剂可以离散单元呈现,如胶囊、扁囊剂、锭剂或片剂,其各自包含预定量的化合物;作为粉末或颗粒;作为在水性液体或非水性液体中的溶液或混悬剂、或作为水包油或油包水乳剂。这样的制剂可以通过药学上任何适宜的方法制备,该方法包括使所述化合物和合适的载体(其可含有一种或多种如上文所述的辅助成分)结合的步骤。一般来说,本发明的制剂制备如下:通过将所述化合物与液体或细碎的固体载体或二者均匀地和紧密地混合,然后如果需要的话使所得混合物成形。例如,片剂可以通过压制或模制含有所述化合物(任选地和一种或多种辅助成分)的粉末或颗粒来制备。压制片剂可以通过在合适的机器中压制自由流动形式的化合物制备,所述自由流动形式例如任选与粘合剂、润滑剂、惰性稀释剂、和/或表面活性/分散剂混合的粉末或颗粒。模制片剂可以通过在合适的机器中将用惰性液体粘合剂润湿的粉末状化合物成型而制备。
适合于口腔(舌下)施用的制剂包括在矫味基质(通常为蔗糖和阿拉伯胶或黄蓍胶)中包含所述化合物的锭剂;和在惰性基质(例如明胶和甘油或蔗糖和阿拉伯胶)中包含所述化合物的锭剂(pastilles)。
适合于肠胃外施用的本发明的制剂包括所述一种或多种化合物的无菌水性和非水性注射溶液,所述制剂优选与预期的接受者的血液等渗。这些制剂可以含有抗氧化剂、缓冲剂、抑菌剂和使制剂与预期的接受者的血液等渗的溶质。水性的和非水性的无菌混悬剂可以包括助悬剂和增稠剂。所述制剂可以存在于单位\剂量或多剂量容器(例如密封安瓿和小瓶)中,且可储存在冷冻干燥(冻干)条件下,仅需在即刻使用前添加无菌液体载体(例如盐水或注射用水)。可以用先前所描述种类的无菌粉末、颗粒剂和片剂来制备即时注射溶液和混悬剂。例如,在本发明的一个方面,提供了一种在密封容器中的单位剂量形式的包含一种或多种活性化合物或其盐的可注射的、稳定的、无菌的组合物。所述化合物或盐以冻干物形式提供,其能够与合适的药学上可接受的载体重构以形成适于将其注射入主体的液体组合物。所述单位剂型通常包含约10毫克至约10克的所述化合物或盐。当所述化合物或盐基本上不溶于水时,可以足以将所述化合物或盐在水性载体中乳化的量使用生理学上可接受的足够量的乳化剂。一种这样有用的乳化剂是磷脂酰胆碱。
适合于直肠施用的制剂优选以单位剂量栓剂存在。这些可以通过将所述化合物与一种或多种常规固体载体例如可可脂混合、然后使所得混合物成形而制备。此外,本发明提供本文公开的化合物及其盐的脂质体制剂。用于形成脂质体混悬剂的技术是本领域中公知的。当所述化合物或其盐是水溶性盐时,使用常规脂质体技术,其可以并入脂质囊泡中。在这种情况下,由于所述化合物或盐的水溶解度,所述化合物或盐将主要被夹带在脂质体的亲水中心或核心内。所采用的脂质层可以是任何常规组合物,并且可以含有胆固醇或可不含胆固醇。当感兴趣的化合物或盐是水不溶性时,再次使用常规脂质体形成技术,该盐可主要被夹带在形成脂质体的结构的疏水脂质双层内。在任一实例中,产生的脂质体可以在尺寸上减小,如通过使用标准超声处理和均化技术。当然,包含本文公开的化合物或其盐的脂质体制剂可冻干以产生可用药学上可接受的载体(诸如水)重构的冷冻干产物,以再生脂质体混悬剂。
其它药物组合物可从本文所公开的不溶于水的化合物或其盐来制备,例如水性基乳液(aqueousbaseemulsion)。在这种情况下,组合物将包含足够量的药学上可接受的乳化剂以乳化所需量的所述化合物或其盐。特别有用的乳化剂包括磷脂酰胆碱和卵磷脂。
除了本发明的一种或多种化合物之外,药物组合物可以含有其它添加剂,例如ph调节添加剂。特别地,有用的ph调节剂包括酸,如盐酸;碱或缓冲剂,如乳酸钠、乙酸钠、磷酸钠、柠檬酸钠、硼酸钠或葡糖酸钠。另外,所述组合物可以含有微生物防腐剂。有用的微生物防腐剂包括对羟基苯甲酸甲酯,对羟基苯甲酸丙酯和苄醇。当制剂置于设计用于多剂量使用的小瓶时,通常使用微生物防腐剂。当然,如指出的,本发明的药物组合物可以使用本领域中公知的技术冻干。
如上文所指出的,本发明提供药物组合物,其包含在药学上可接受的载体中的本发明的化合物(包括其药学上可接受的盐),用于口服、直肠、局部、口腔、肠胃外、肌内、皮内或静脉内和经皮施用。
用在如本文中所描述的任何特定方法中的如本文所描述的任何特定化合物的有效量(例如治疗上有效或治疗有效量)或剂量将取决于多种因素而变化,例如所治疗的病症、施用途径、主体的一般状况(例如,年龄、性别、重量等)等。通常(例如,对于口服或肠胃外施用),所述剂量可以为从约0.01、0.05或0.1毫克每千克主体体重(mg/kg),至多约1、5或10mg/kg。对于局部给药,该化合物可以以任何合适的量包括在待应用的药学上可接受的组合物中,典型地为所述组合物重量的从0.01、0.1或1重量%,至多10、20或40重量%或更多,这再次取决于诸如所治疗的病症、主体的状况等因素。
本文描述的化合物可以直接施用或通过将药学上可接受的前药(其转而在体内转化为活性剂)施用于主体而施用。术语“前药”指在体内迅速转化产生上式的母体化合物的化合物,例如,通过在血液中水解。详尽的讨论在t.higuchi和v.stella,prodrugsasnoveldeliverysystems,a.c.s.symposiumseries的第14卷和edwardb.roche,ed.,bioreversiblecarriersindrugdesign,americanpharmaceuticalassociationandpergamonpress,1987中提供,二者都通过引用并入本文。还参见美国专利no.6,680,299。实例包括由主体在体内代谢为具有如本文所述化合物的活性的活性药物的前药,其中该前药是醇或羧酸基团的酯,如果这样的基团是存在于化合物中的话;醇基的缩醛或缩酮,如果这样的基团是存在于化合物中的话;胺基团的n-曼尼希碱或亚胺,如果这样的基团是存在于化合物中的话;或羰基的席夫碱、肟、缩醛、烯醇酯、噁唑烷或噻唑烷,如果这样的基团是存在于化合物中的话,如美国专利no.6680324和美国专利no.6680322中所描述的。
以下非限制性实施例中更详细地解释本发明。
实施例1-8
由2-丁氧基乙醇和5,10,15,20-四(2-吡啶基)卟啉(h2t-2-pyp)合成bmx-001
这些实施例描述了通过下列总体方案由上述起始试剂合成上述化合物:
h2t-2-pyp是已知的。参见例如i.batinic-haberle等人,daltontrans.2004,1696-1702。bmx-001-1或对甲苯磺酸2-丁氧基乙酯也是已知的。参见例如r.tipson,onestersofp-toluenesulfonicacid,j.org.chem.9,235-241(1944)。上文的“ts”是指对甲苯磺酸根。前述总体方案和其具体实施方案的步骤在下文中更详细地解释。
实施例1
bmx-001-1的合成
将2-丁氧基乙醇(7.0kg,59.2mol)和水(12l,housero水)装入配有机械搅拌器、热电偶探头和蒸馏头的100lslytherm玻璃夹套反应器中。在静态(static)氮气下,将该批料搅拌并冷却至0-5℃。加入50wt%naoh(5.45kg,68.1mol)的溶液同时保持0-30℃。注:该加料需要30分钟完成。将对甲苯磺酰氯(10.2kg,53.3mol)在四氢呋喃(thf)(28.0l)中的溶液加入该批料中同时保持5–20℃。注:该加料需要90分钟完成。使该批料温热至20–25℃并搅拌1小时。1小时后,将有机层进行取样,浓缩,并通过1hnmr(cdcl3)针对残留的对甲苯磺酰氯进行分析。在20-25℃下1小时后,对甲苯磺酰氯含量<1wt%,且反应被认为完成。加入mtbe(21l)并通过加入6mhcl水溶液(1.7l)将该批料调节至ph=7.0-7.5。注:初始ph为14,和最终ph为7.0。分离有机层,用饱和盐水(1.4l)在水(12.6l,housero水)中的溶液洗涤,并通过真空蒸馏浓缩(23-26英寸hg,40–45℃批处理温度(batchtemp))直到蒸馏停止。将批料冷却到20-30℃,并用水(4x28l,housero水)洗涤。加入mtbe(14l),并用饱和盐水(1.4l)在水(12.6l,housero水)中的溶液洗涤该批料。然后用thf(14.0l)稀释有机层并通过真空蒸馏浓缩该批料(23-26英寸hg,40–45℃批处理温度)直到蒸馏停止。然后将批料冷却至20-25℃,并针对残留的水(karlfisher<0.1wt%)和thf(1hnmr(cdcl3)8wt%thf)进行分析。在通过残留的水<0.1wt%的规格之后,使用5微米尼龙滤布增泽过滤该批料,以除去残留的nacl。这提供了bmx-001-1[13.4kg,85%产率(针对thf含量修正),2.5wt%thf],为浅黄色液体。
在这个实施例中,优化试剂和溶剂的当量以最大化bmx-001-1的转化率和产率。
在后处理阶段,必须移除有机溶剂以用水洗液洗去残留的2-丁氧基乙醇。在有机溶剂(mtbe、thf、ch2cl2、etoac、ipac和庚烷)的存在下,2-丁氧基乙醇将不会分配到水层中。
尽管不希望束缚于任何特定理论,bmx-001-1中残留的thf的量可能是相关的过程参数。thf将在接下来步骤中使用的反应条件下与bmx-001-1反应并产生难以除去的bmx-001-2-cl杂质。为了最小化这种杂质,bmx-001-1中的thf的量应小于1重量%(相对于bmx-001-1)。
2-丁氧基乙醇可能含有甲醇杂质,并因此将形成甲苯磺酸甲酯。由于甲基化极其快速(由于小甲基缺乏位阻问题),即使微量的甲醇也会导致产生少量的具有三个丁氧基乙基链和一个甲基链的杂质。
实施例2-3
bmx-001-2-pf6和bmx-001-2-cl的合成
实施例2
bmx-001-2-pf6的合成
用n2喷雾h2t-2-pyp(100g,161.6mmol)、三正辛基胺(oct3n)(572g,1.62mol)和n,n-二甲基甲酰胺(dmf)(6.0l)的溶液15分钟,然后加热至80℃(内部温度)。在80℃,除去喷雾管并将该批料置于n2缓慢吹扫下。将该批料加热至105℃并加入bmx-001-1(8.8kg,32.3mol,含有2.5wt%thf)同时保持85–105℃。在加料完成后,将批料再加热至105℃。该反应的进展由hplc监控。在45小时后,通过hplc该反应被认为完成。将该反应冷却至室温,并通过18英寸(11微米)鲨鱼皮滤纸上的solkafloc薄垫过滤。然后将滤液经75分钟缓慢加入含有solkafloc40nf(1.0kg,internationalfiber)和mtbe(60l)的混合物的烧瓶中。在加料完成后,将浆液搅拌15分钟,然后使用18英寸(11微米)鲨鱼皮滤纸过滤。
用thf(2.5l)和mtbe(2.5l)的1/1溶液洗涤含有bmx-001-2-ots的solkafloc固体。然后在真空下在室温干燥solkafloc固体20小时。
使用水(10l,housero水)将粗bmx-001-2-ots从solkafloc冲洗掉。将滤液用darcog60活性炭(40g)处理,并在室温搅拌1小时。然后将混合物通过solkafloc40nf薄垫过滤以提供bmx-001-2-ots的水溶液。
用饱和盐水(saturatedaqueousbrine)(2.5l)处理bmx-001-2-ots水溶液。将批料转移到22l烧瓶中,经60分钟缓慢加入nh4pf6(200g)在水(600ml,housero水)中的溶液。将得到的红色浆液搅拌65分钟,然后使用具有5微米尼龙滤布的10英寸吸滤器(nutsche)过滤。在真空下在过滤器上干燥固体41小时,将n2施加至滤饼顶部。这提供了bmx-001-2-pf6[217g,84%产率,通过hplc的88.7%(auc),2.7wt%水],为红色固体。
在此实施例中,已优化了溶剂(dmf)的体积、bmx-001-1的当量和oct3n的当量以最大化h2t-2-pyp至bmx-001-2的转化率并最小化在105℃持续加热期间杂质的形成。
此外,通过沉淀至solkafloc上分离bmx-001-2-ots的特征用于降低中间体“出油(oilingout)”到反应器壁上。用水从solkafloc中提取bmx-001-2-ots并直接转化成bmx-001-2-pf6有助于避免有问题的水性后处理,其中产物分配至水相和有机相二者中。引入木炭处理和添加nacl也有助于降低bmx-001-2-pf6的沉淀过程中的出油。
实施例3
bmx-001-2-cl的合成
将bmx-001-2-pf6(200g)加入到50l二醇夹套玻璃反应器中。向反应器中加入丙酮(10.0l),并将该混合物搅拌直到固体溶解。然后将甲基异丁基酮(mibk)(10.0l)加入反应器中,并将批料搅拌15分钟。在氮气气氛下经65分钟将aliquat336(441galfaaesar)在丙酮(2.0l)和mibk(2.0l)中的溶液逐滴加入该批料中。这产生红色固体的细浆液。在搅拌另外30分钟后,将浆液使用具有5微米尼龙滤布的10英寸吸滤器过滤。在过滤过程中,将混合物保持在n2正压下,以避免水分污染。然后将固体用1/1丙酮/mibk(2x10.0l)的混合物洗涤,并在真空下干燥17小时,将n2施加至滤饼顶部。这提供了bmx-001-2-cl[147g,100%产率,通过hplc的88.7%(auc)]为红色固体。
在这个实施例中,mibk作为较小危害性的et2o的替代品用作沉淀bmx-001-2-cl的反溶剂。另外,aliquat®336是用来代替nbu4ncl以使pf6阴离子与cl阴离子交换。aliquat®336具有在丙酮和mibk中更好的溶解性,并更易于在分离bmx-001-2-cl期间洗掉。
实施例4
任选的bmx-001-2-cl的纯化
塞柱:bmx-001-2-cl(145g)通过硅胶(1.5kg,silicycle)塞柱使用1/3/3饱和kcl水溶液(fisher)/水(housero水)/ch3cn(fisher7)作为洗脱剂纯化。收集七个暗红色的级分,并且通过hplc分析。合并前三个级分(≥88.9%auc),并浓缩至原始体积的1/3,以除去ch3cn。用水(12.0l,housero水)稀释该混合物,并转移至22l反应器中。经60分钟将nh4pf6(300g,synquest)在水(900ml,housero水)中的溶液缓慢加入该批料中。将得到的紫色浆液搅拌30分钟,然后使用具有5微米尼龙滤布的10英寸吸滤器过滤。将固体在真空下在过滤器上干燥62小时。这提供了bmx-001-2-pf6[155g,75%产率,通过hplc的90.4%(auc)],为红紫色固体。
bmx-001-2-pf6转化回bmx-001-2-cl:将bmx-001-2-pf6(153g)加入到22l反应器中。加入丙酮(7.65l),并将该混合物搅拌直到固体溶解。然后将mibk(7.65l,pharmco)加入反应器中并搅拌该批料15分钟。在氮气气氛下经70分钟将aliquat®336(337g,alfaaesar)在丙酮(1.5l,safc)和mibk(1.5l,pharmco)中的溶液逐滴加入该批料中。这产生红色固体的细浆液。在搅拌另外30分钟后,将浆液使用有5微米尼龙滤布的10英寸吸滤器过滤。在过滤过程中,将混合物保持在n2正压下,以避免水分污染。然后将固体用1/1丙酮(safc)/mibk(pharmco)(2x7.7l)的混合物洗涤并在真空下干燥16小时,将n2施加至滤饼顶部。这提供了bmx-001-2-cl[120g,100%产率,通过hplc的90.4%(auc)],为红色固体。
任选的采用kcl、ch3n和水的sio2层析可以用于提高bmx-001-2-cl的纯度约1至2%(通过hplc的auc)。kcl对于这个层析是重要的。kcl使卟啉形成聚集体并作为单带通过固定相。没有kcl,该物质不会从固定相中洗脱出来。
实施例5-8
bmx-001-pf6和bmx-001的合成
实施例5
“粗”bmx-001-pf6的合成
向22l反应器中加入bmx-001-2-cl(120g),接着加入水(12.0l,housero水)。将混合物搅拌15分钟,然后用1mnaoh水溶液将ph调节至ph=11.0。向该溶液中以单份加入mncl2x4h2o(306g,safc),并将所得混合物在环境温度搅拌。在加入mncl2x4h2o之后,使用¼英寸的聚丙烯管使空气以0.1cfm的流速鼓泡通过该批料。前两个小时,监控批料的ph并通过每30分钟添加额外的1mnaoh调节至ph8.0。该反应通过hplc监控,以确定金属插入和中间体mn(ii)卟啉氧化成所需的mn(iii)卟啉。在5小时后,该反应被认为完成。将混合物使用10英寸吸滤器(5微米尼龙滤布)和solkafloc40nf垫过滤。
将滤液转移至22l反应器中,并经60分钟将nh4pf6(270g,synquest)在水(810ml,housero水)中的溶液缓慢加入到批料中。将得到的红色浆液搅拌35分钟,然后使用有5微米尼龙滤布的10英寸吸滤器过滤。将固体在真空下在过滤器上干燥40小时。这提供了bmx-001-pf6[174g,94%产率,通过hplc的89.4%(auc),2.9wt%水],为红色固体。
尽管不希望束缚于任何特定理论,据信初始ph调节至ph11可以帮助实现bmx-001-2-cl与mncl2x4h2o迅速和干净的金属化。优化mncl2x4h2o的当量(15eq.)以最小化bmx-001中残留的mn。尽管不希望束缚于任何特定理论,金属化过程中的ph控制可以有助于确保顺利金属化(smoothmetalation)和/或随后的mn(ii)中间体空气氧化成需要的bmx-001的mn(iii)氧化态。
实施例6
“粗”bmx-001的合成
将bmx-001-pf6(170g)加入到22l反应器中。加入丙酮(7.65l,safc)并将混合物搅拌直至固体溶解。随后向该反应器加入mibk(7.65l,pharmco),并将批料搅拌15分钟。在氮气气氛下经100分钟将aliquat®336(334g,alfaaesar)在丙酮(1.5l,safc)和mibk(1.5l,pharmco)中的溶液逐滴加入该批料。这产生红色固体的细浆液。搅拌另外75分钟后,将浆液使用具有5微米尼龙滤布的10英寸吸滤器过滤。在过滤过程中,将混合物保持在n2正压下,以避免水分污染。然后将固体用1/1丙酮(safc)/mibk(pharmco)(2x8.5l)的混合物洗涤并在真空下干燥22小时,将n2施加至滤饼顶部。这提供了bmx-001[117g,99%产率,通过hplc的89.4%(auc)],为棕色固体。
在这个实施例中,bmx-001被转化为bmx-001-pf6,然后转化回bmx-001以降低残余锰的水平。本实施例中再次包括使用mibk代替et2o(有害的)作为沉淀bmx-001的反溶剂,和使用aliquat®336®代替nbu4ncl以使pf6阴离子与cl阴离子交换。
实施例7
bmx-001-pf6的合成
向22l反应器中加入bmx-001-2-cl(110g),接着加入水(8.8l,housero水)。经60分钟将nh4pf6(248g,synquest)在水(743ml,housero水)中的溶液缓慢加入该批料。将得到的红色浆液搅拌另外40分钟,然后使用具有5微米尼龙滤布的10英寸吸滤器过滤。将固体用水(2x1.0l,housero水)洗涤,然后在真空下在过滤器上干燥68小时。这提供了bmx-001-pf6[145g,92%产率,通过hplc的89.1%(auc),3.7wt%水],为红色固体。
尽管不希望束缚于任何特定的理论,这个附加的沉淀可能有助于减少与bmx-001混合的游离的残留mn的量。
实施例8
bmx-001的合成
将bmx-001-pf6(140g)加入到22l反应器中。加入丙酮(6.3l,safc)并将混合物搅拌直至固体溶解。随后将mibk(6.3l,pharmco)加入该反应器,并且将该批料搅拌15分钟。在氮气气氛下经90分钟将aliquat®336(275g,alfaaesar)在丙酮(1.3l)和mibk(1.3l,pharmco)中的溶液逐滴加入该批料。这产生红色固体的细浆液。在搅拌另外45分钟后,将浆液使用具有5微米尼龙滤布的10英寸吸滤器过滤。在过滤过程中,将混合物保持在n2正压下,以避免水分污染。然后将固体用1/1丙酮(safc)/mibk(pharmco)(2x7.0l)的混合物洗涤并在真空下干燥44小时,将n2施加至滤饼顶部。将bmx-001固体转移到玻璃盘,并在真空烘箱内干燥,直到达到恒定质量。注:将固体在环境温度干燥,并将缓慢流动的n2引入到烘箱中,以帮助清洁顶部空间的溶剂蒸气。在真空烘箱内95小时后,干燥直到达到恒定质量。这提供了bmx-001[96.7g,100%产率,通过hplc的89.99%(auc)],为棕色固体。
尽管不希望束缚于任何特定的理论,这个附加的沉淀步骤可能有助于减少与bmx-001混合的游离的残留mn的量。
实施例9
下面的描述是领先的且指导基于金属的具有氧化还原活性的治疗性的mn(iii)内消旋-四(n-正丁氧基乙基吡啶基)卟啉,mntnbuoe-2-pyp5+(bmx-001)(其目前在i/ii期临床试验中作为癌症患者的正常组织的辐射防护剂)的制备的研究。n-取代的吡啶基卟啉是mn(iii)络合物的配体,该mn(iii)络合物是迄今合成的最有效的超氧化物歧化酶(sod)模拟物的一种。为了促进它们的设计,从而改善它们的物理和化学性质和生物利用度/毒性特征,进行了通过烷氧基烷基化反应将氧原子置于n-烷基吡啶基链中的系统性研究。本文示出的是在由相应的甲苯磺酸酯进行烷氧基烷基化反应期间发生的未预见的结构重排。使用综合实验和计算方法来解决参与吡啶基氮季铵化的重排机理,代替单一产物,其导致产生各种混合的n-烷氧基烷基化和n-烷基化的吡啶基卟啉。所述重排机理包括以链长依赖性方式形成中间烷基氧鎓阳离子,其随后驱动相互竞争的n-烷氧基烷基化对(versus)原位n-烷基化的速差动力学和热力学。使用许多烷氧基烷基甲苯磺酸酯,使用与氧原子相邻的烷基片段的不同长度,使我们能够识别将实现合成具有高纯度和优异治疗潜能的单一化合物的烷基片段的集合。
阳离子mn(iii)卟啉是用于治疗与扰乱的细胞氧化还原环境(通常被描述成氧化应激态)相关的疾病的最有效sod模拟物和氧化还原-活性实验治疗剂的一种。在n-烷基-取代的吡啶基-或咪唑基mn卟啉中,它们的邻位异构体是在体外和体内被研究最多的化合物。这些化合物包括mn(iii)内消旋-四-(n-乙基吡啶鎓-2-基)卟啉(mnte-2-pyp5+,aeol10113,bmx-010)、mn(iii)内消旋-四-(n,n’-二乙基咪唑鎓-2-基)卟啉(mntde-2-imp5+,aeol10150)、mn(iii)内消旋-四-(n-正己基吡啶鎓-2-基)卟啉(mntnhex-2-pyp5+)和更近期地,mn(iii)内消旋-四-(n-正丁氧基乙基吡啶鎓-2-基)卟啉(mntnbuoe-2-pyp5+,bmx-001)(图1)。
氧化还原活性治疗剂的开发已经与强效的sod模拟物合成的进展相平行。mn(iii)2-n-烷基吡啶基卟啉成为有效的sod模拟物,其中的一些几乎达到sod酶的活性。尽管mnp的固有的抗氧化剂功效是物理化学控制的,但它们的生物活性还依赖于它们的毒性和生物利用度,其转而取决于例如尺寸和亲脂性的因素。对控制固有的sod活性中的mnp的关键结构特征、化合物稳定性、亲脂性、生物利用度、亚细胞定位和药代动力学的理解已经为优化其它相关化合物做了准备。
已经通过侧链吡啶鎓基团的控制修饰而主动地寻求基于mnp的治疗剂的优化。短烷基链类似物,例如mnte-2-pyp5+,是低亲脂性的并因此对脑组织具有低有效性,这限制了其在治疗中枢神经系统疾病中的使用。然而,短烷基链衍生物mnte-2-pyp5+在一系列疾病模型中的成功的临床前特征已经将其在加拿大推进到i/ii期临床试验。长烷基链类似物,例如mntnhex-2-pyp5+,在细胞中以比其乙基类似物更高的水平累积。然而,亲脂性n-烷基吡啶基卟啉的全身施用受到与它们的表面活性剂/胶束性质相关的毒性的阻碍。为了减少由长烷基侧链带来的表面活性剂特征,设想了用氧原子代替该烷基链的ch2基团以获得烷氧基烷基类似物的策略。然而,此类方法的实际执行是有困难的。
本文描述的是阻碍那些研究的陷阱和最终引导我们开发卓越的sod模拟物—mntnbuoe-2-pyp5+的实验和计算研究(图1)。临床前研究中的mntnbuoe-2-pyp5+的显著的生物学效应和安全毒性特征(例如在大鼠comet分析中缺少基因毒性)已经证明其适于临床(pursuittowardclinics);确实,mntnbuoe-2-pyp5+目前处在针对胶质瘤患者的i/ii期临床试验中(nct02655601)作为正常大脑的辐射防护剂,并将很快进入针对头颈癌患者的唾液腺和口腔黏膜的辐射防护的另一试验中。更具体地,本文中示出阻碍氧化的侧链mnp的开发的杂质(例如为邻位、间位和对位mn(iii)n-吡啶基卟啉的甲氧基烷基(mo烷基)衍生物(烷基=et、n-bu、n-pen和n-hex))涉及含甲基的mnp的出乎预料的形成。污染程度随着甲氧基烷基链的长度而变化并严重限制了一些甲氧基烷基结构体的使用,因为含甲基-和甲氧基烷基-的物质的分离是困难的。这转而有损样品的生物测试。对这些杂质的性质和来源(其困扰所有的甲氧基烷基mnp制剂)的认识会促进亲脂性无毒的基于mnp的治疗剂领域中未来在合成上的努力。densityfunctionaltheory在m06-2x水平研究了与相互竞争的甲基化/甲氧基烷基化反应相关的机理并与实验数据很好地相关联。本文所示的总体结果需要重新评价先前公开的对fe(iii)和mn(iii)卟啉二者(例如fp-15、mntteg-2-pyp5+和mntmoe-2-pyp5+)的peg和甲氧基烷基数据25,26。
材料和方法
试剂。h2t-2-pyp、h2t-3-pyp和h2t-4-pyp购买自frontierscientifi,甲苯磺酸2-甲氧基乙酯(>98%)、4-甲氧基丁醇(>98%)、6-溴己-1-醇(>95%)购买自tciamerica,5-甲氧基戊醇(penthanol)(98%)购买自karlindustriesinc,对甲苯磺酰氯(98%)购买自alphaaesar,吡啶(99%)和四正丁基氯化铵水合物(98%)购买自aldrich,mncl2×4h2o(99.7%)和己烷购买自j.t.baker,和nh4pf6(99.99%纯)购买自gfschemicals。无水乙醚和丙酮购买自emdchemicals,绝对甲醇、乙酸乙酯、二氯甲烷、氯仿、乙腈、edta和kno3购买自mallinckrodt,98%无水n,n-二甲基甲酰胺(保持在4-å分子筛上)、塑料背板(plastic-backed)的硅胶tlc板(z122777-25ea)购买自sigma-aldrich和二氧化硅(siliaflash®g60,70-230目)购买自silicycle(canada)。如前所述制备6-甲氧基己-1-醇和h2tmoe-2-pyp4+26,27。所有其它的化学品按原样使用。
甲苯磺酸4-甲氧基丁酯、5-甲氧基戊酯和6-甲氧基己酯。如前文所述进行合成28,29。简言之,在0℃下向含有0.048mol合适的甲氧基醇(4-甲氧基丁醇:5.00g;5-甲氧基戊醇:5.67g;6-甲氧基己醇:6.40g)的50mlchcl3溶液中加入吡啶(7.763ml,0.096mol),然后逐滴加入对甲苯磺酰氯(13.73g,0.072mol)的50mlchcl3溶液。在0℃下搅拌该反应混合物2h(对于4-甲氧基丁醇和5-甲氧基戊醇)或4.5h(对于6-甲氧基己醇)。在用h2o(4x100ml)、2mhcl(4x100ml)、饱和nahco3溶液(直到ph~6)和h2o(3x100ml)萃取之后,用无水na2so4干燥有机相并过滤。在旋转蒸发仪中蒸发溶液并通过快速层析法(combiflash仪器,流动相=hex:etoac)纯化油状残留物。合并含所需产物的级分并在旋转蒸发仪上蒸发以获得无色油。1h、13cnmr和ms数据与提出的结构一致。产率:甲苯磺酸4-甲氧基丁酯:84.7%(10.50g);甲苯磺酸5-甲氧基戊酯:76.7%(10.03g);甲苯磺酸6-甲氧基己酯:90%(12.37g)。
mn卟啉。对于其它相关的烷基系统,如前文所述进行h2t-x-pyp(x=2、3或4)的甲氧基烷基化和随后的mn金属化以制备mntmoe-x-pypcl5、mntmobu-x-pypcl5、mntmopen-x-pypcl5和mntmohex-x-pypcl5(x=2、3或4)30。向h2t-x-pyp(x=2、3或4)(20mg,0.032mmol)在无水dmf(2ml,在105℃下预热15min)中的溶液中加入适当的甲苯磺酸酯(甲苯磺酸2-甲氧基乙酯,meoetots:3.67g,0.016mol;甲苯磺酸4-甲氧基丁酯,meobuots:4.18g,0.016mol;甲苯磺酸5-甲氧基戊酯,meopenots:4.00g,0.016mol;对甲苯磺酸6-甲氧基己酯,meohexots:2.20g,0.008mol)。通过tlc使用1:1:8饱和kno3水溶液(kno3-saturatedh2o):h2o:乙腈作为流动相跟踪反应进程。将反应混合物过滤到含h2o和氯仿的分液漏斗中并用氯仿萃取几次。针对mn(iii)n-烷基吡啶基卟啉,如前文所述进行氯化物盐的分离、采用mncl2的金属化和作为氯化物盐的mn卟啉的分离30。在真空下在室温下干燥产物。根据所用的起始甲苯磺酸甲氧基烷基酯和卟啉将分离的固体标记为“甲氧基烷基链/卟啉异构体”;简易形式(shortform)分别用于甲苯磺酸酯(即meoet、meobu、meopen、meohex)和卟啉异构体(2-py、3-py和4-py代表邻位、间位和对位的n-吡啶基卟啉系统)。未尝试在高温下干燥固体以避免可能的热脱烷基化,如先前针对相关的mnte-2-pyp的报告31。值得注意的是tlc和esi-ms分析表明固体完全季铵化但不是单一化合物(参见结果和讨论部分)。
mn络合物的分析。如前文所述进行电化学、电喷雾离子化质谱(esi-ms)、紫外可见分光光度仪和sod样活性29,32。使用gaussian09软件在m06-2x/6-311++g(2d,p)//m06-2x/6-31+g(d)dft水平33-38进行所有量子化学计算39。在105℃下进行所有频率的计算并用于表征最小值和过渡态。已经针对n,n-二甲基甲酰胺(dmf)使用cpcm连续介质溶剂化模型(cpcmcontinuumsolvationmodel)40考虑了溶剂效应。对于在溶液中优化的结构40,已经由理想气体配分函数获得反应物、过渡态和产物的自由能,并校准以包括对标准1moll-1浓度的气体压缩功41(或释放自由能42)。由于在dmf中形成离子对而产生的库仑稳定化能(coulombicstabilizationenergy)也已经借助于将每个离子近似为球体而包括在最终的结果中,所述球体的体积被认为与溶质空腔的体积相同43;离子对中阳离子和阴离子之间的距离被认为是两个球体半径的总和。
结果和讨论
采用甲苯磺酸甲氧基烷基酯季铵化mn(iii)n-吡啶基卟啉被相互竞争的原位甲基化损害。已经开发了氧化的烷基侧链的引入作为一种降低mn(iii)n-烷基吡啶基卟啉的毒性的方式。我们在本文中记载了与这种合成策略相关联的合成缺陷。深入了解合成方法有益于开发mntnbuoe-2-pyp5+,为其通向临床做准备。采用四种合适链长的甲苯磺酸酯(即meoetots、meobuots、meopenots和meohexots)进行n-吡啶基卟啉的所有三种异构体的甲氧基烷基化,占12种制剂。由相关烷基衍生物的合成和纯化路径进行调整并包括在105℃在dmf中h2t-x-pyp(x=2、3或4)与合适的甲苯磺酸酯的反应继之以在室温在水性条件下采用mncl2的金属化。分离的固体都没有显示为单一化合物(参见下文)。
通过tlc监控甲氧基烷基化反应。所述制剂没有一个产生单一tlc点。确实,tlc板示出一些制剂是几乎均匀分布的至少五种产物的混合物。当起始卟啉已经完全消耗掉并且所得点特征不再随时间变化时认为反应完成。而对于带有长烷基链(例如正己基)的邻位异构体,存在多于一个tlc点是正常的,因为它们是阻转异构体的混合物,在带有短烷基链(例如甲基和乙基)的邻位异构体的情况下总是观察到单一tlc点,以及对于间位和对位异构体,未预期其阻转异构现象。基于以下证据排除(ruleout)由于mnp不完全季铵化导致的tlc点的起源:(a)持久的加热时间和附加量的甲氧基烷基化试剂未改变tlc特征;(b)分离的物质的紫外可见光谱被在完全季铵化的mnp的预期区域中的界限清楚的soret带表征(部分季铵化会将soret带迁移至更高的波长);(c)分离的mnp的伏安图是对称的并且没有肩,表明仅存在一种mnp种类(其不是这种情况,考虑到tlc分析),或样品含有具有几乎相同的mn(iii)/mn(ii)金属中心的还原电势e½的非常紧密相关的种类的混合物。具有不同季铵化程度的种类的混合物会产生不清晰的伏安图,这在任何制剂中都没有观察到。esi-ms谱图示出一组峰,典型的为化合物的混合物的峰并与tlc数据一致。如其它部分报告的,七氟丁酸根阴离子(hfba–)在排除mnp破碎的条件下用作esi-ms分析的离子配对剂。所有样品的esi-ms谱图都表征为两组峰(图2)。从m/z385至m/z520的第一组发生在有规律地与离子对簇(mnp5++2hfba–)3+/3相关联的区域中,而在m/z685–890处的第二组涉及离子对(mnp5++3hfba–)2+/2。尽管在每种情况下观察到对应于完全季铵化的甲氧基烷基化种类的预期的峰,但这些峰总是伴随着较低m/z值和有时强度更大的其它峰。通过将esi-ms分析与通过tlc-sio2进行的样品的预分离(饱和kno3(水溶液(aq)):h2o:ch3cn,1:1:8v/v/v)相结合实现表征这些系统的突破。分离各tlc点,并且通过esi-ms分别分析由各tlc点回收的mnp。作为典型的情况,“meobu/3-py”物质的tlc分析产生4个点。在esi-ms分析之后,获得四个mnp5+-类型的化合物的4个干净的谱图特征,其对应于(mnp5++2hfba–)3+/3离子对区域的谱图特征示于图2中。值得注意的是图2中的各谱图都含有在初始分离的样品的m/z385–520区域中的四个峰的一个;对于其它谱图区域而言同样如此(未示出)。在图2中的每个化合物的esi-ms数据与完全季铵化的mnp5+种类(与2个hfba–阴离子离子配对)一致,其中甲氧基烷基基团的数量从4降至1并且甲基基团的数量相应地从0升至3,保持吡啶基基团处的取代基的总数等于4。样品中甲基基团数量越大,tlcrf值越小,这与随着吡啶基侧链的长度减小mnp5+极性的增加(降低的亲脂性)的先前数据一致11,12,30。在相关的邻位系统中,“meobu/3-py”(图2)在m/z386.2和m/z685.5处的额外的峰,清楚地对应于根本不含甲氧基丁基基团而是含4个甲基的良好表征的化合物,即mntm-3-pyp5+。采用meobu/2-py系统看到类似的情况。值得注意的是一些分离固体的元素分析和c/n比惊人地好。因此,基于元素分析,没有提示一些制剂离单一化合物有多远。
考虑到所有mnp5+种类,无论侧链的类型为甲基和/或甲氧基烷基,都应该具有共同的与离子化、离子配对和离子抑制作用有关的类似特征,esi-ms谱图中的峰强度用作各个个体种类对整体的分离混合物的贡献的粗量度。图3中描绘了12种制剂的每个中的期望的四甲氧基烷基化的卟啉相对于其中吡啶基相反被一个、两个、三个或四个甲基季铵化的副产物的分布比例。在图4中展现出在甲氧基烷基化破坏(detriment)中发生的整体甲基化程度。如通过目测定性判断地,图2中的esi-ms数据与tlc点的相对颜色强度一致。分布数据(图3)和甲基化对甲氧基烷基化的程度(图4)的检测表明甲基化的可行性和程度随卟啉异构体和所用的甲苯磺酸甲氧基烷基酯二者的性质而变化。下文中总结了这些系统中的一般趋势:(i)不期望的甲基化在邻位异构体系统中比在间位或对位异构体系统中更显著;(ii)通过使用meoetots和meohexots有利于甲氧基烷基化(与甲基化相反),而采用meobuots和meopenots时,甲基化占主导并且目标四甲氧基烷基化的mnp最少;(iii)甲基化支配meopenots系统,“meopen/x-py”(x=2、3或4)固体特别富集于mntm-x-pyp5+种类(x=2、3或4)中:邻位系统中企图的甲氧基戊基化导致不期望的mntm-2-pyp5+作为分离的混合物中的主要化合物。很明显,甲基化与甲氧基烷基化相互竞争。反应混合物中甲基的来源和对这个竞争的机理的思考在下文中描述。
机理研究:相互竞争的甲氧基烷基化对甲基化。通过实验和计算数据确认甲苯磺酸甲氧基烷基酯作为甲氧基烷基和甲基二者的原位源的作用,这还有助于解释导致相互竞争的甲氧基化和甲基化反应的可能的一种或多种机理。
在100-105℃在净dmf中持续加热之后,n-吡啶基卟啉保持不变,这表明甲基的来源既非起始卟啉批料中的某杂质也非通过单独的dmf热分解原位产生的某化合物。这与制备相应的n-烷基吡啶基卟啉种类(烷基=et、nbu、nhex、nhep等)的压倒性的数据一致,其中从未观察到甲基化。能够推测到甲基化可能产生自在甲苯磺酸甲氧基烷基酯存在的反应条件下涉及dmf的分解的某方法。为了明确地排除dmf参与作为甲基的来源,在氘化dmf(d6-dmf)中进行h2t-2-pyp与meobuots的季铵化反应,并且分离的物质的esi-ms产物分布特征与采用非氘化dmf观察到的相同。另外,确实发生了甲基化,但没有观察到峰同位素迁移(预期如果甲基化采用d6-dmf作为-cd3基团来源),这再次确定了甲苯磺酸甲氧基烷基酯为甲基化种类的原位源。
甲苯磺酸甲氧基烷基酯通过1h和13cnmr光谱、tlc、esi-ms和gc/ms进行了彻底的分析,并且没有检测到能够导致甲基化的杂质。这支持了甲基化种类可能经由dmf中的某热过程而原位产生的假设。这代表了卟啉独立性路径。因此,在类似于卟啉季铵化中使用的条件下研究甲苯磺酸甲氧基烷基酯的热稳定性。因此,在100℃在dmf中加热甲苯磺酸甲氧基烷基酯,同时通过tlc和esi-ms监控转变。在7小时加热之后,在meoetots和meohexots的情况下没有观察到变化。相反,在meobuots和meopenots的情况下明显地形成新产物。粗物质的esi-ms谱图表明在m/z187存在峰,这与在反应混合物中存在甲苯磺酸甲酯(meots)一致。这些物质与真正meots样品的tlc共洗脱确认了在100℃在dmf中加热meobuots和meopenots之后形成meots。因此,meots的原位形成能够解释在n-吡啶基卟啉的甲氧基烷基化期间观察到的竞争性甲基化反应。
如预期地,甲苯磺酸甲氧基烷基酯meobuots和meopenots对于在较低温度转变成meots更稳定。在60-80℃范围的温度,在dmf中加热meobuots和meopenots分别达45h和21h之后检测meots。尽管这个信息对于卟啉甲氧基烷基化本身不那么重要(因为甲氧基烷基化,与有规律的烷基化类似,在这些温度相当缓慢,这允许累积meots并因此甲基化),但证实了meobuots更倾向于转变成meots而非meopenots。这个原位产生meots的相对倾向(relativepropensity)与相比于meobuots系统甲基化在meopenots系统中占上风的事实有关(图3)。注意,meots比其更长的烷基类似物(例如et、nbu、nhex等)显著地反应更快。
很明显,图3中所示的mnp种类分布起因于两个竞争性反应之间的平衡:甲氧基烷基化和甲基化。另外,图4中给出的甲基化程度是各种效应组合的结果,诸如,未季铵化吡啶基的可用性、原位产生的甲基化剂的累积和吡啶基对于甲苯磺酸甲氧基烷基酯和甲基化剂的相对反应性。构想了三种可能的路径来适应在这些系统中观察到的净转变(图5)。通过计算研究各路径的机理和反应特征从而解释整体的竞争反应性倾向对n-吡啶基卟啉异构体和甲苯磺酸甲氧基烷基酯链的长度二者的依赖性。在图5中,由游离吡啶环表示n-吡啶基卟啉的吡啶基基团。通过在n-吡啶基卟啉中的四个吡啶基的每个独立于彼此反应的事实证明使用吡啶作为吡啶基的替代品是合理的;这样的简化考虑到了更精确的计算。
路径a(图5)描绘了与期望的甲氧基烷基化反应相关的机理,这被认为是遵循通过过渡态(ts)2a进行的常规sn2机理以产生甲氧基烷基吡啶鎓的相应的甲苯磺酸盐(产物3a)。甲基化反应当然涉及甲苯磺酸甲氧基烷基酯的重排以原位产生甲基化剂,为其预想了两个有利(complimentary)路径(b和c):在路径b和c二者中,起始的甲苯磺酸甲氧基烷基酯重排成甲基氧鎓环烷烃的甲苯磺酸盐作为共同的中间体(3b,c)。然后,这个中间体可能与吡啶(路径b)或甲苯磺酸酯(路径c)直接反应。路径b探索这个氧鎓盐的甲基化性质,因为之前有通过三烷基氧鎓盐进行烷基化的文献。在路径c中,甲基氧鎓环烷烃的甲苯磺酸盐进一步重排以产生稳定产物meots和相应的环醚(产物5c)。路径c中的甲基化剂为meots,其然后与吡啶反应以产生甲基吡啶鎓的甲苯磺酸盐。
已经使用m06-2x杂化含动能密度的广义梯度近似泛函(m06-2xhybridmetageneralizedgradientapproximationfunctional)在dft水平进行对图5中示出的机理的量子化学计算,其已经在不含金属的种类的热化学、热化学动力学和非共价相互作用研究中显示出良好的性能。已经在采用6-31+g(d)基组优化的几何构形中进行采用6-311++g(2d,p)基组的单点计算。还已经采用更小的6-311+g(d,p)基组进行初步的单点计算。在采用两个基组获得的结果之间没有定性上的区别,然而已经观察到两组结果之间最高达6kjmol-1的变化。由于所有实验反应都在105℃下在dmf中进行,所有自由能数据都在这个温度使用针对dmf的cpcm连续溶剂化模型计算。由于在研究系统中没有预期具体的溶质-溶剂相互作用(例如氢键),证明使用连续溶剂化模型是合理的。另外,cpcm模型已经在非水性溶液中的化合物的势垒高度和反应能量的研究中示出良好的性能。在图6中给出反应物、过渡态和产物的自由能。这些值包括与使溶质从1atm的标准态气相浓度移动至1moll-1的标准态溶液相浓度相关联的压缩功校准。这个效应对于其中反应物和产物之间的分子性发生变化(诸如在1→2a、2b,c→3b,c、4b→5b、4c→5c和6c→7c(=5b)步骤中)的反应或步骤是相关的,并导致自由能变化的显著降低(在105℃降低~10.8kjmol-1)。对于meoetots,压缩功效应导致2b,c与2a之间的能量差的增加,而对于meobuots和meopenots,其导致这个能量差的减小,但这样的减小不足以反转2a和2b,c的能量排序。另一方面,在meohexots的情况下,此类效应导致2b,c和2a能量的反转(图6)。由于离子对形成产生的库仑稳定化能,如在3a、3b,c、4b和5b中一样,为~5kjmol–1;并且此类校准对整体自由能特征影响很小。
路径b和c以包括或形成氧杂环烷烃作为过渡态、中间体或产物为标志。meoetots、meobuots、meopenots和meohexots因此分别与相应的杂环氧杂环丙烷(环氧乙烷、环氧化物(epoxide))、氧杂环戊烷(环氧丁烷、四氢呋喃)、氧杂环己烷(环氧戊烷、四氢吡喃)和氧杂环庚烷(环氧己烷)相关联。尽管图4示出n-吡啶基卟啉的甲基化,无论异构体类型如何,都按以下顺序meopetots>meobuots>meohexots>meoetots有优势,值得注意的是这个整体的反应性大致上与相应的杂环四氢吡喃(6-元环)>四氢呋喃(5-元环)≈环氧己烷(7-元环)>>环氧化物(3-元环)的稳定性趋势相关联51,例外是meohexots系统,其示出与meoetots的那些类似的甲基化水平(图4);这个明显的不一致将在后面解决。对于meoetots系统,其中按照路径b或c进行的甲基化取决于不稳定的三元环种类的形成,直接甲氧基烷基化(路径a)比其它路径明显更有利(大于39kj·mol-1)(比较图6中的第一过渡态2a和2b,c的能量),这与这种情况下证实的非常低水平的甲基化一致。在meobuots和meopenots系统中,与5-和6-元环的预组装相关联的第一能量势垒在路径b和c中小于在路径a中(即2b,c<2a),然而过渡态2b,c和2a的能量差(~6kj·mol-1)显著小于meoetots系统的相应能量差。然而,甚至这个相对小的能量差似乎也足够高以与后文讨论的其它效应一起产生贡献,导致在这两个系统中获得高得多程度的甲基化(图3和4);能量差大致等于2rt,鉴于对arrhenius方程指数因子的贡献,其因此导致对反应速率常数产生很大的影响。另一点是随着从与3-元环种类的中间性相关联的系统至与5-元环种类的中间性相关联的系统至与6-元环种类的中间性相关联的系统即meoetots至meobuots至meopenots系统,第一步(1→2)的最低活化能降低。因此,在从meoetots变成meobuots系统时,预测活化能降低~5kj·mol-1,而在从meobuots变成meopenots系统时,活化能进一步降低~4kj·mol-1(图6)。
在反应速率的控制中的另一特征可能是给定的原子撞击与期望的转变相关联的恰当原子从而形成富有成效的ts。例如,对于形成ts2a,吡啶环的n-原子必须到达与meo烷基ots中的甲苯磺酸酯基团直接结合的c-原子(图5),从而得到有效的过渡态2a,其以导致不发生反应的很多与其它原子的无效碰撞为代价。因此,此类有利的相遇和有效的碰撞的可能性随着甲苯磺酸酯侧链延长而降低。因此,预期此类效应应该导致按五元环系统和六元环系统(即分别为meobuots和meopenots系统)的过渡态2a需要而在结构上组装该系统的可能性进一步降低(除去势垒高度的影响),这最终转变成对于这个较长侧链的甲苯磺酸酯而言路径a的降低的有效的可能性。这些特定的meobuots和meopenots系统之间的此类作用大小的差别应该几乎可忽略,因为它们分别仅仅是在侧链中的6或7个核心原子中的一个c-原子不同。还预期这种类型的统计学效应也与形成过渡态2b,c相关,这涉及分子内杂环形成(图5)。通过n单键形成的给定链的旋转异构体的数量(最小值)为3n52。在目前的情况下,n与杂环中的单键数量相一致,因为只有这些键与闭环可能性相关。给定的最小值的群体(population)可以通过玻尔兹曼分布与其能量相联系。对于meobuots,预期最低的能量最小值为总计243种可能的构象异构体(n=5)中对应于形成ts2b,c的特定的5-元环构象异构体的前体。与meobuots中的3-元环和4-元环的前体类似的构象异构体对于产生期望的反应(o-原子撞击内部的非活化的ch2基团)是无效的,并且另外由于环张力51,它们的能量应该相当地更高。因此,即使存在它们贡献相对大量的构象异构体的事实,但预期它们的玻尔兹曼群体很小。因此,假定它们的发生代表对于形成ts2b,c而言基本上可忽略的障碍是合理的。对于meopenots同样合理,因为2b,c的期望的前体为来自729种可能的构象异构体(n=6)的6-元环,并且该无效的5-元环、4-元环和3-元环构象异构体的能量更高并且为升序的(5-元环<4-元环<3-元环)。另一方面,在meohexots的情况下,其中存在2187个最小值(n=7),期望的反应涉及形成7-元环,在所有可能的前体环中,其不是最低能量环。因此,鉴于产生无效的6-元前体环构象异构体,形成ts2b,c是困难的,所述6-元前体环构象异构体由于其较低的能量51,具有比期望的有效的7-元环构象异构体的相应群体更高的玻尔兹曼群体。总之,与由于活化势垒的唯一效应而预期的相比,在meohexots的情况下的净效应(neteffect)在于阻碍ts2b,c的形成。这些组合的能量和构象异构因素解释了通过实验观察到的这个系统的低水平的甲基化(图4),接近于在meetots系统中发现的甲基化水平。然后,提出统计学和能量势垒效应的净结果使得在meohexots中有效形成ts2b,c如同在meoetots的情况下一样不利。
图6揭示对于meoetots和meohexots二者,产物3a的形成在热力学上比5b更有利,即甲氧基烷基化路径比甲基化路径更有利。然而,对于meoetots,产物和反应物之间的能量差为~50kj·mol-1,对于meohexots,这个差值仅为~1kj·mol-1。因此,对于这两个系统,路径a(甲氧基烷基化)在动力学和热力学上都比路径b和c更有利,然而热力学效应对于meohexots而言非常小。另一方面,对于meobuots和meopenots,5b的形成在热力学上比3a的形成更有利,分别相差~23kj·mol-1和~37kj·mol-1。因此,对于meobuts和meopenots,路径b和c(导致甲基化反应)在动力学和热力学上都比路径a更有利。
对于meoetots,过渡态4b和4c之间的相对稳定性似乎是次要的,因为在第一步中已经避免了路径b和c(涉及2b,c的形成),因为2a的自由能明显低于2b,c的自由能(图6)。相反地,对于meohexots而言,过渡态4b和4c之间的相对稳定性(图6)可能在阻碍5b的形成中起作用,这与通过实验观察到的低甲基化产率相一致(图4)。尽管事实是此类差值(为~12.8kj·mol-1)相对高,但产物5c的形成可能是不可忽略的,因此导致甲基化吡啶鎓种类5b的产率的进一步降低。以相对高的量形成甲基化产物5c可通过在实验条件下使用的大过量的meo烷基ots进行解释,因为ts4c的形成涉及双分子反应,其速率取决于甲苯磺酸酯的浓度。相反地,由ts4b形成5b的速率独立于meo烷基ots浓度。另外,5c的形成也通过如下事实证明是合理的:在105℃下在dmf中加热的单独的meo烷基ots已经通过实验示出产生甲基化剂meots。相比于meohexots,对于meobuots和meopenots系统,甲基化路径的盛行(prevalence)可能产生自ts4b对4c相对稳定性的进一步增加(~2.2kj·mol-1)以及3a和5b的大得多的相对热力学稳定性(和对于meohexots而言其它前述效应)。
路径b和c通过常规的甲基氧鎓盐作为中间体进行。甲基氧鎓盐与其甲苯磺酸根抗衡离子或与吡啶(或n-吡啶基卟啉的吡啶基团)的反应代表限定总体甲基化(分别是路径c或路径b的结果)中的关键步骤。各甲基氧鎓阳离子的形成导致与该阳离子紧密靠近的甲苯磺酸根阴离子的伴随形成。考虑到这取决于吡啶基团从溶液主体有效扩散至甲基氧鎓阳离子中间体,则吡啶(或n-吡啶基卟啉)以及时的方式接近甲基氧鎓阳离子不是必然允许的。因此,产生稳定的甲基化剂meots的这个阳离子与甲苯磺酸根的反应,其最终会促进甲基化(路径c),应该以甲基基团从氧鎓阳离子中间体直接转化成吡啶或n-吡啶基卟啉为代价而发生。
用以描述n-吡啶基卟啉的甲氧基烷基化对甲基化反应的由路径a、b和c给出的所提出的机理之间的折中平衡与图2、3和4中所示的实验数据一致,特别是在与各种系统中的卟啉异构体的完全季铵化所需的反应时间相结合分析时。总之,完成n-吡啶基卟啉与2-甲氧基乙基和6-甲氧基己基(6-methoxythexyl)链的甲氧基烷基化反应所需的时间与具有相等链长的相应烷基类似物观察到的类似。与meobuots和meopenots反应产生完全季铵化的mnp混合物显著更慢。例如,邻位n-吡啶基卟啉与meoetots和meohexots的反应按预期持续~24小时,而采用meobuots和meopenots的完全季铵化在4小时的显著短的时间范围内实现。这些缩短的反应时间与更高水平的甲基化种类相关联,这可认为吡啶基不能甲氧基烷基化并非常快速地导致获得占主导的甲基化,但完全季铵化的产物。随着侧链延长,n-吡啶基卟啉的吡啶基和甲苯磺酸酯的活化ch2基团之间的有效碰撞变得在统计学上没那么可能发生,对于较长侧链的甲苯磺酸酯,其在常规条件下30应该导致更慢的反应。相反地,考虑到可以获得甲基化剂,由于有效碰撞更可能发生,甲基化相当快。因此,如果甲苯磺酸甲氧基烷基酯倾向于重排,如同在meobuots和meopenots中,缓慢的甲氧基烷基化给予进行侧链重新组装的时间并给予累积原位产生的甲基化剂达到足以利于甲基化的水平(以甲氧基烷基化为代价)的时间。此类反应倾向导致在图3和4中给出的甲基化特征。值得注意的是图片整体表明n-吡啶基卟啉充当稍微独特的(somewhatexotic)捕获试剂和昂贵的传感器,用于在这些甲苯磺酸甲氧基烷基酯系统中原位形成甲基化剂。
mntnbuoe-2-pyp5+。甲苯磺酸甲氧基烷基酯系统的研究为成功地合成带有丁氧基乙基侧链的mn(iii)2-n-吡啶基卟啉衍生物—mntnbuoe-2-pyp5+(bmx-001)做准备(图1)。这种化合物目前在美国处于i/ii期临床试验。这种化合物的设计探索如下事实:在甲苯磺酸烷氧基乙酯中氧原子的位置更接近磺酸根合基团(由于与甲苯磺酸甲氧基乙酯系统类似)不利于甲苯磺酸酯的重排并因此有利于烷氧基乙基化对烷基化。确切地,在没有竞争性丁基化反应的迹象的情况下完成mntnbuoe-2-pyp5+的合成44。针对甲苯磺酸丁氧基乙酯系统,对竞争性路径a、b和c的dft计算产生明显地与meoetots系统类似的能量特征,除了相比于基于meoetots的甲基化,基于nbuoetots的正丁基化甚至是稍微不利的(图7)。通过保持氧原子离磺酸根合基团2个碳原子远,在路径b和c中形成3-元环作为中间体是高度不利的,并且期望的丁氧基乙基化反应(路径a)是导致mntnbuoe-2-pyp5+的主要途径。因此,meoetots和nbuoetots的整体特征与实验反应性趋势高度一致。
值得注意的是尽管meopenots和nbuoetots为具有相同链长的异构体,但链内氧原子的相对位置将这两个化合物置于反应趋势非常相反的两侧:meopenots极度倾向于重排并有利于相应的甲基化路径(通过路径b和/或c),而nbuoetots在其自身的右侧反应,有利于丁氧基乙基化产物(路径a)。
除了对于甲苯磺酸酯的反应模式的影响,氧原子的相对位置在控制和限定所得mnp络合物的亲脂性中也是最重要的。相比于深埋在链内的那些,其中(在侧链末端)暴露氧原子的系统的溶剂化程度大大不同。尽管甲氧基己基衍生物相对亲水,丁氧基乙基类似物mntnbuoe-2-pyp5+不仅是亲脂的而且还展现出低表面活性特征和低毒性。在4个阳离子氮的情况下,证实了预期的高mn(iii)/mn(ii)还原电位(e½)和高sod-样活性。
mntmoe-2-pyp5+和mntteg-2-pyp5+制剂的纯度/特性的重新评估。理解采用带有氧的对甲苯磺酸酯进行季铵化的机理使我们不仅设计和优化sod模拟物的结构,还重新访问和准确识别由我们报告的其它sod模拟物和过氧亚硝酸盐清除剂的制备中的主产物和副产物,即mntmoe-2-pyp5+和mnpeg-基化卟啉(mntteg-2-pyp5+),并考虑其它人制备的fepeg-基化类似物—fp-15的组成。尽管我们尚未在体内测试mntmoe-2-pyp5+和mntteg-2-pyp5+的功效(除了在大肠杆菌的研究中之外),但fp-15已经用于不同的动物模型中。在我们初始报告我们的mntmoe-2-pyp5+和mntteg-2-pyp5+制剂的特性和纯度时,我们还尚未建立防止分析物破碎的esi-ms条件。因此,我们然后指定25,26质谱中的多个峰为碎片和在esi-ms电离室的损耗,其阻碍识别分离的物质中的mnp污染物。在使用七氟丁酸作为esi-ms添加剂以允许离子配对并防止mnp破碎的情况下,关于先前称为mntmoe-2-pyp5+的样品的情况在本文中澄清:图6表明分离的制剂实际上为完全季铵化的mnps的混合物,其中目标mntmoe-2-pyp5+化合物占~70%并且其余~30%涉及mnp5+种类(其中一个或两个甲氧基乙基基团被甲基基团替代)(图6)。
mnpeg-基化的化合物的重新访问的esi-ms分析显示相当数量的副产物;fp-15,其不同于mntteg-2-pyp5+(仅在于fe替代mn作为金属中心),应该同样地含有类似的基于卟啉的杂质/副产物。由于在季铵化期间形成不同长度的环,mntteg-2-pyp5+制剂不仅含有感兴趣的化合物,还含有具有不同的烷基和烷氧基烷基吡啶基取代基的种类(表1)。尽管所有副产物必须为sod活性的(鉴于为阳离子卟啉设计的构效关系),但它们可能具有明显不同的亲脂性和因此,不同的生物利用度,其应该显著影响它们的体内功效。
表1.mntteg-2-pyp5+的电喷雾离子化质谱数据。
~1µmmntteg-2-pyp5+在1:1v/v乙腈:h2o(含0.01%v/v七氟丁酸(hfba))混合物中的溶液,20v锥孔电压。
进行这些邻位、间位、对位mn(iii)n-吡啶基卟啉与甲苯磺酸烷氧基烷基酯的系统评估,并且该研究表明哪种类型的带有氧的类似物能够以与生物需求相容的纯度合成。mntnbuoe-2-pyp5+出现且目前作为辐射防护剂进入临床试验。
本文中报告的研究证实n-甲氧基烷基吡啶基卟啉中的n-甲基化吡啶基种类源自未预期的重排机理而非源自对甲苯磺酸酯、溶剂或起始非烷基化卟啉中的杂质。制备相当纯(>95%)的采用4-甲氧基丁基和5-甲氧基戊基取代基完全季铵化的间位n-吡啶基卟啉的可能性被放弃,也放弃了邻位和对位n-甲氧基烷基吡啶基卟啉的合成。对卟啉吡啶基类的n-烷氧基烷基衍生化的机理的研究导致mntnbuoe-2-pyp5+的合成,并证明与形成小的3-元环相关联的不稳定性最小化了甲苯磺酸丁氧基乙酯侧链重排和随后形成不期望的副产物的可能性。所述化合物保留类似的邻位mnp5+的强大的氧化还原性质,并且如预期地,由于氧原子破坏类似烷基链的胶束性质,毒性小4-5倍。在合成己氧基乙基类似物mntnhexoe-2-pyp5+的先前的成功还由在季铵化期间不利的三元环形成来解释,导致分离出与mntnbuoe-2-pyp5+具有同样高的纯度的化合物。本文中获得的知识对于合成具有与吡啶基尽可能接近的氧原子的n-烷氧基烷基吡啶基卟啉至关重要,以最小化竞争性甲苯磺酸酯重排以及可能导致产生不期望的烷基化产物的不期望种类的形成。因此,本文中所述的内容导致mntnbuoe-2-pyp5+的设计和理解为什么这种化合物实际上遵循于以高产率/纯度制备而其它相关化合物产生作为氧化还原活性治疗剂的非前瞻性的混合物。
实施例10
h2tnhexoe-2-pyp4+和mntnhexoe-2-pyp5+的合成
h2tnhexoe-2-pypcl4,内消旋-四(n-(2’-正己氧基乙基)吡啶鎓-2-基)卟啉四氯化物:将h2t-2-pyp(70mg,0.113mmol)溶解于4mldmf中,在115℃预热~5min,并加入8.5g对甲苯磺酸2-正己氧基乙酯(0.028mol)。通过在硅胶板上使用乙腈:kno3(饱和):水=8:1:1作为流动相进行薄层层析(tlc)来跟踪n-季铵化进程。此外,将甲醇/氯仿(1/4)溶剂系统用于监控反应进展。该反应在48小时内完成。通过乙醚从反应混合物中沉淀出卟啉,过滤并用乙醚(5×30ml)洗涤。然后,将甲苯磺酸卟啉溶解于100ml热水中并采用nh4pf6饱和水溶液作为pf6–盐沉淀出来。用乙醚充分洗涤沉淀物。然后将经干燥的沉淀物溶解于丙酮中,过滤溶液,并采用甲基-三正辛基氯化铵的饱和丙酮溶液将卟啉作为氯化物盐从溶液中沉淀出来。用丙酮洗涤沉淀物并溶解于水中。再一次重复两步沉淀以确保最高纯度的制剂。在真空烘箱中干燥卟啉,为cl-盐形式。元素分析:h2tnhexoe-2-pypcl4·8h2o:c72h110cl4n8o12的分析计算值:h,7.8;c,60.84;n,7.88%。实测值:h,7.72;c,60.56;n,7.92%。264.4(4.38),419.4(5.35),513.5(4.27),545.5(3.64),586.4(3.86),640(3.43)。电喷雾离子化质谱(esi-ms)数据,种类[m/z,实测值(计算值)]:[h2p4++hfba-]3+/3[449.4(449.2)],[h2p4++2hfba-]2+/2[780.2(780.4)],[h2p]4+/4283.6(283.7)[h2p4+-h+]3+/3378.1(377.9)[h2p4+-h++hfba-]2+/2673.3(673.4),[h2p4++h++3hfba-]2+/2887.0(887.3)。tlc保留因子rf(硅胶板,使用乙腈:kno3(饱和):水=8:1:1作为流动相)0.53。
mntnhexoe-2-pypcl5,mn(iii)内消旋-四(n-(2’-正己氧基乙基)吡啶鎓-2-基)卟啉五氯化物:将80mlh2tnhexoe-2-pypcl4水溶液(100mg,0.078mmol)的ph调节至10.9并将20-倍过量的mncl2(310mg,1.55mmol)加入该溶液中,同时在25ºc下搅拌2.5小时直到完成金属化。在硅胶tlc板上使用乙腈:kno3(饱和):水=8:1:1作为流动相跟踪金属化进程。将溶液的ph定期调节至7.2。另外,随着在~350nm的uv光下卟啉配体荧光消失,监控金属化进程。首先通过粗滤纸,然后通过细滤纸过滤卟啉溶液。采用nh4pf6的饱和水溶液以pf6–盐沉淀出mn卟啉。采用乙醚充分地洗涤沉淀物。然后,将经干燥的沉淀物溶解于丙酮中,过滤并采用甲基-三正辛基氯化铵的饱和丙酮溶液以氯化物盐沉淀出来。采用丙酮洗涤沉淀物并溶解于水中。再一次重复两步沉淀以确保最高纯度的卟啉并完全除去游离锰种类。元素分析:mntnhexoe-2-pypcl5·8.5h2o:c64h94cl5mnn8o9的分析计算值:h,7.23;c,56.93;n,7.38;cl,11.67%。实测值:h,7.05;c,56.58;n,7.68;cl,11.28%。uv-可见光,λmaxnm(logε):212.5(4.72),261.7(4.56),365.4(4.74),411.4(4.39),455.5(5.26),561.1(4.16),786.5(3.38)。电喷雾离子化质谱(esi-ms)数据,种类[m/z,实测值(计算值)]:[mnp5++hfba-]4+/4[350.2(350.2)],[mnp5++2hfba-]3+/3[537.7(537.9)],[mnp4++3hfba-]2+/2[913.0(913.3)]。tlc保留因子rf(硅胶板,使用乙腈:kno3(饱和):水=8:1:1作为流动相)0.50。
对比实施例
bmx-001的现有技术合成
z.rajic等人,freeradicalbiology&medecine53,1828—1834(2012)在其中的第1830页第一栏记载了mntnbuoe-2-pyp5+的现有技术合成。
本发明的发明人已经发现z.rajic等人文章中报告的方法没有提供本文中记载的式i化合物的组合物,在其中基本上限制或控制了污染物(例如游离锰和/或吡啶基卟啉的替代形式)的量。例如,如上所述,已经发现应该严格控制在金属化期间的ph范围以避免产生吡啶基卟啉的替代形式。此外,z.rajic等人文章中所述的方法没有意识到需要优化溶剂(dmf)体积、bmx-001-1当量和oct3n当量以最大化h2t-2-pyp至bmx-001-2的转化率和最小化在105℃持续加热期间杂质的形成。此外,现有技术的方法没有意识到需要包括通过沉淀分离bmx-001-2-ots中的絮凝剂、采用水从絮凝剂中提取出期望产物和直接转化成bmx-001-2-pf6,这有助于避免有问题的水性后处理,其中产物分配至水相和有机相两相中,特别是在其较大量被产出时。此外,z.rajic等人文章中所述的方法没有意识到初始物质中(即2-丁氧基乙醇中)以及中间产物中(即bmx-001-1中)的杂质特征的重要性,这可能导致形成极高反应性的试剂,该试剂增加随后步骤中的杂质水平。
前文是本发明的说明,并不可理解成对其进行限制。本发明由下文的权利要求进行限定,权利要求的等价物包括在其中。
- 还没有人留言评论。精彩留言会获得点赞!