一种构建高效分泌表达人源肝素水解酶重组菌的方法与流程
本发明涉及一种构建高效分泌表达人源肝素水解酶重组菌的方法,属于酶工程技术领域。
背景技术
多糖作为一种高分子碳水化合物,广泛存在于动植物和微生物,具有抗肿瘤、抗病毒、抗氧化、免疫调节等多种生物学活性。多糖主要有二糖单位组成,分为硫酸乙酰肝素、肝素、透明质酸、硫酸软骨素、硫酸皮肤素。多糖裂解酶主要以β消除的方式裂解肝素或硫酸乙酰肝素,主要来源于肝素黄杆菌,目前从中分离纯化出三种肝素水解酶:肝素水解酶i、ii、iii,在低分子肝素制备及肝素类多糖分子结构解析领域具有十分重要的应用前景。对于包括肝素水解酶在内的几乎所有多糖裂解酶,催化方式的单一性很大程度限制了其相应的应用。然而,对于这种催化底物的单一性,目前的理解仅限于推测,尚无直接的实验证据,更无法实现不同结构多糖裂解酶间底物谱的转化。
肝素水解酶是内切-β-葡萄糖醛酸酶属于糖苷水解酶家族79,这种酶水解硫酸肝素,水解葡糖醛酸和氨基葡萄糖间的β1,4-糖苷键。肝素水解酶在癌细胞中过表达是众所周知的,与血管生成、炎症和增加的转移潜能有关,因此,肝素水解酶是一种重要的潜在药物目标。在35年前,hook和他的同事们首先描述了一种硫酸乙酰肝素(hs)内切-β-d-葡糖醛酸糖苷酶,此后,陆续报道了这种活性存在各种细胞类型和组织。肝素水解酶在几乎所有分析的人类肿瘤中都过表达,并且在肿瘤细胞的过表达与转移潜能之间观察到相关性。它似乎也是小鼠β细胞存活和自身免疫性糖尿病的关键。因此,肝素水解酶被认为对肿瘤细胞的侵袭和转移具有重要意义,成为抗癌药物发现的理想靶标。
目前生产肝素水解酶的方法为e.colibl21,产量未报导,存在的问题为胞内表达未实现高效分泌表达等。
技术实现要素:
为了解决上述问题,本发明重组表达了来源于人的肝素水解酶,实现了人源肝素水解酶的高效分泌表达,酶活可达585u/ml。
本发明的第一个目的是提供一种高效分泌表达人源肝素水解酶重组菌,所述重组菌是以毕赤酵母pichiapastorisgs115为宿主,表达人源的肝素水解酶。
在本发明的一种实施方式中,所述肝素水解酶的核苷酸序列如seqidno.1所示。
在本发明的一种实施方式中,所述肝素水解酶的氨基酸序列如seqidno.2所示。
本发明的第二个目的是提供一种所述重组菌的构建方法,包括:将核苷酸序列为seqidno.1的肝素水解酶基因连接到表达载体ppic9k上,然后转化到毕赤酵母pichiapastorisgs115中,筛选正确的转化子,即得重组毕赤酵母pichiapastorisgs115/ppic9k-hse。
在本发明的一种实施方式中,所述方法,还包括在肝素水解酶基因上添加组氨酸标签。
本发明的第三个目的是提供一种发酵生产肝素水解酶的方法,包括利用所述重组菌进行发酵生产。
在本发明的一种实施方式中,所述方法在发酵罐中,采用甲醇诱导策略发酵生产肝素水解酶。
在本发明的一种实施方式中,所述发酵包括:将pichiapastorisgs115/ppic9k-hse的种子液按照8%-12%的接种量接种到发酵罐中,温度控制在25-30℃、ph为5-6、500-1000r·min-1,通气量为2-4l·min-1,溶氧维持在30%-35%以上进行培养;培养至甘油耗尽,指数流加含有ptm1的30-50%(w·v-1)甘油溶液,控制转速在500-1000r·min-1补料8-16h,停止补料待甘油再次耗尽,控制转速在600-1000r·min-1并流加甲醇进行诱导培养。
在本发明的一种实施方式中,所述方法还包括对所述肝素水解酶分离纯化;具体步骤如下:离心发酵液,收集上清液,上样;使用ni柱,用磷酸盐缓冲液平衡柱子8-12柱体积;采用咪唑梯度洗脱。
在本发明的一种实施方式中,咪唑用磷酸缓冲液配制,按照10mmol·l-1,30mmol·l-1,200mmol·l-1梯度洗脱。
在本发明的一种实施方式中,所述发酵的具体步骤为:
将摇瓶培养的ypd种子液以10%的接种量接种于3l全自动发酵罐(liflusgmbiotron,korea)中,温度控制在25-30℃,使用25%氨水调节ph为5-6,初始搅拌转速为500-1000r·min-1,通气量为2-4l·min-1,溶氧维持在30%-35%以上。培养大约20-40h,od600约70-80待甘油耗尽,指数流加30-50%(w·v-1)甘油溶液(含12ml·l-1ptm1),搅拌转速与溶氧相关联,控制转速在500-1000r·min-1补料12h,停止补料待甘油再次耗尽,od600约250(干重约60.0g·l-1),转速在600-1000r·min-1并流加100%甲醇(含12ml·l-1ptm1),甲醇浓度控制在18.0g·l-1,诱导温度分别采用30℃,25℃,22℃及阶段控制温度诱导策略。本发明的第四个目的是提供一种所述肝素水解酶分离纯化的方法,具体步骤如下:离心发酵液,收集上清液,上样;使用ni柱,用磷酸盐缓冲液平衡柱子10柱体积;采用咪唑梯度洗脱,咪唑用上述磷酸缓冲液配制,按照10mmol·l-1,30mmol·l-1,200mmol·l-1梯度洗脱。
本发明的有益效果:
(1)采用本发明的方法构建的基因工程菌在毕赤酵母中进行表达,是一种快速生产肝素水解酶的方法,采用镍柱进行纯化,方法简便。
(2)毕赤酵母具有强有力的启动子aox,表达水平高,重组菌株稳定性较高,异源蛋白基因与表达质粒通过同源重组整合到p.pastoris基因组上,随染色体复制遗传且不容易丢失。具有糖基化、蛋白磷酸化、脂肪酞化等翻译后修饰加工功能。适应性强,营养要求低。分泌到胞外的蛋白种类比较少,且培养基中不含蛋白质,易于下游产物的分离与纯化。高密度发酵工艺较成熟,易进行放大培养。
(3)毕赤酵母分泌表达的肝素水解酶表达量高、酶学性质稳定,耐ph、温度范围广。
附图说明
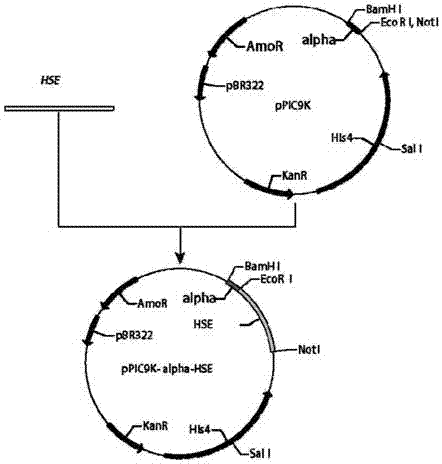
图1为毕赤酵母中构建肝素水解酶的质粒图谱;
图2为毕赤酵母中检测肝素水解酶的酶活;
图3为毕赤酵母中构建肝素水解酶的sds-page电泳结果。
具体实施方式
bmgy培养基:酵母粉10gl–1,蛋白胨20gl–1,丙三醇10mll–1,100mm磷酸钾盐缓冲液,0.34%(质量百分数)无氨基酵母氮源(ynb),1%(nh4)2so4,4x10–5%生物素,ph=6.0。
肝素水解酶酶活测定方法:800μl底物肝素、硫酸软骨素a、c(2mg·ml-1)+5-10μl发酵液,剩余用50mmol·l-1ph5.5柠檬酸缓冲液(柠檬酸+磷酸氢二钠)补足1ml。加入2mldns混匀,水浴煮沸反应10min。冷去至室温,补加超纯水至10ml体系,在540nm下测定各编号管的a540值。
实施例1:产肝素水解酶的毕赤酵母重组菌的构建
一种产肝素水解酶的重组菌的构建:
以ppic9k为载体,如图1所示,克隆所述肝素水解酶基因,基因atg后添加6-his标签。上游引物引入ecori限制性酶切位点;下游引物引入noti限制性酶切位点;基因hepa、质粒ppic9k经限制性内切酶ecori、noti酶切纯化后,16℃过夜连接转入escherichiacolijm109进行扩增,挑选测序正确的质粒转入毕赤酵母pichiapastorisgs115中进行表达。
所述上、下游引物为:
f:gaattcatgaagaagtttaagaactc(seqidno:3)
r:gcggccgctcagatgcaagcagcaa(seqidno:4)
实施例2:摇瓶水平发酵生产肝素水解酶
以含有肝素水解酶基因的重组毕赤酵母pichiapastorisgs115/ppic9k-hse为生产菌株,单菌落接种于ypd培养基中,28℃,200rmp条件下培养过夜,得到种子培养液;将种子培养液按质量百分比2%的接种量接种到25ml的bmgy培养基,在培养基中加入1%的甲醇进行诱导,诱导温度28℃,诱导表达96h。发酵结束后,如图2所示,测定肝素(hp)酶活117u/ml、硫酸软骨素a(csa)酶活147u/ml、硫酸软骨素c(csc)酶活180u/ml。
实施例3:发酵罐水平发酵生产肝素水解酶
将摇瓶培养的ypd种子液以10%的接种量接种于3l全自动发酵罐(liflusgmbiotron,korea)中,温度控制在30℃,使用25%氨水调节ph为5.5,初始搅拌转速为500r·min-1,通气量为2.5l·min-1,溶氧维持在30%以上。培养大约28h,od600约70-80待甘油耗尽,指数流加50%(w·v-1)甘油溶液(含12ml·l-1ptm1),搅拌转速与溶氧相关联,控制转速在500-1000r·min-1补料12h,停止补料待甘油再次耗尽,od600约250(干重约60.0g·l-1),转速在1000r·min-1并流加100%甲醇(含12ml·l-1ptm1),甲醇浓度控制在18.0g·l-1,诱导温度分别采用30℃,25℃,22℃及阶段控制温度诱导策略,96h酶活达到最高,肝素酶活585u/ml,较摇瓶水平提高5倍。
实施例4:重组肝素水解酶的纯化制备
纯化重组肝素水解酶,具体步骤:使用5ml的镍柱,用磷酸盐缓冲液(50mmol·l-1ph7.0)平衡柱子10柱体积。4℃离心收集发酵上清液,上样20ml。采用咪唑梯度洗脱,咪唑用上述磷酸缓冲液配制,按照10mmol·l-1,30mmol·l-1,200mmol·l-1梯度洗脱,最后洗脱下来的是目的蛋白。洗脱下来的目的蛋白进行脱盐脱咪唑,4℃保存。经纯化后的酶活:205u/ml。如图3所示,sds-page所示,泳道1表示发酵液上清中肝素水解酶、泳道2表示纯化后肝素水解酶的条带。
实施例5:酶性质测定
一系列ph值(4.0-11.0)的溶液用来测定肝素水解酶的最适反应ph,分别是醋酸钠缓冲液(20mm,ph4.0-5.0)、磷酸缓冲液(20mm,ph5.0-7.0)、tris–hcl缓冲液(20mm,ph7.0-9.0)和gly-naoh缓冲液(20mm,ph9.0-11.0),测得最适ph5.0。而不同温度对肝素水解酶活性的影响测定主要是采用温度范围20℃–70℃,测得最适温度为37℃。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
sequencelisting
<110>江南大学
<120>一种构建高效分泌表达人源肝素水解酶重组菌的方法
<130>1
<160>4
<170>patentinversion3.3
<210>1
<211>1164
<212>dna
<213>人工序列
<400>1
atgaaaaagttcaagaacagcacctactcaagaagctctgtagatgtgctatacactttt60
gcaaactgctcaggactggacttgatctttggcctaaatgcgttattaagaacagcagat120
ttgcagtggaacagttctaatgctcagttgctcctggactactgctcttccaaggggtat180
aacatttcttgggaactaggcaatgaacctaacagtttccttaagaaggctgatattttc240
atcaatgggtcgcagttaggagaagattttattcaattgcataaacttctaagaaagtcc300
accttcaaaaatgcaaaactctatggtcctgatgttggtcagcctcgaagaaagacggct360
aagatgctgaagagcttcctgaaggctggtggagaagtgattgattcagttacatggcat420
cactactatttgaatggacggactgctaccagggaagattttctaaaccctgatgtattg480
gacatttttatttcatctgtgcaaaaagttttccaggtggttgagagcaccaggcctggc540
aagaaggtctggttaggagaaacaagctctgcatatggaggcggagcgcccttgctatcc600
gacacctttgcagctggctttatgtggctggataaattgggcctgtcagcccgaatggga660
atagaagtggtgatgaggcaagtattctttggagcaggaaactaccatttagtggatgaa720
aacttcgatcctttacctgattattggctatctcttctgttcaagaaattggtgggcacc780
aaggtgttaatggcaagcgtgcaaggttcaaagagaaggaagcttcgagtataccttcat840
tgcacaaacactgacaatccaaggtataaagaaggagatttaactctgtatgccataaac900
ctccataatgtcaccaagtacttgcggttaccctatcctttttctaacaagcaagtggat960
aaataccttctaagacctttgggacctcatggattactttccaaatctgtccaactcaat1020
ggtctaactctaaagatggtggatgatcaaaccttgccacctttaatggaaaaacctctc1080
cggccaggaagttcactgggcttgccagctttctcatatagtttttttgtgataagaaat1140
gccaaagttgctgcttgcatctga1164
<210>2
<211>387
<212>prt
<213>人工序列
<400>2
metlyslysphelysasnserthrtyrserargserservalaspval
151015
leutyrthrphealaasncysserglyleuaspleuilepheglyleu
202530
asnalaleuleuargthralaaspleuglntrpasnserserasnala
354045
glnleuleuleuasptyrcysserserlysglytyrasnilesertrp
505560
gluleuglyasngluproasnserpheleulyslysalaaspilephe
65707580
ileasnglyserglnleuglygluasppheileglnleuhislysleu
859095
leuarglysserthrphelysasnalalysleutyrglyproaspval
100105110
glyglnproargarglysthralalysmetleulysserpheleulys
115120125
alaglyglygluvalileaspservalthrtrphishistyrtyrleu
130135140
asnglyargthralathrarggluasppheleuasnproaspvalleu
145150155160
aspilepheileserservalglnlysvalpheglnvalvalgluser
165170175
thrargproglylyslysvaltrpleuglygluthrserseralatyr
180185190
glyglyglyalaproleuleuseraspthrphealaalaglyphemet
195200205
trpleuasplysleuglyleuseralaargmetglyilegluvalval
210215220
metargglnvalphepheglyalaglyasntyrhisleuvalaspglu
225230235240
asnpheaspproleuproasptyrtrpleuserleuleuphelyslys
245250255
leuvalglythrlysvalleumetalaservalglnglyserlysarg
260265270
arglysleuargvaltyrleuhiscysthrasnthraspasnproarg
275280285
tyrlysgluglyaspleuthrleutyralaileasnleuhisasnval
290295300
thrlystyrleuargleuprotyrpropheserasnlysglnvalasp
305310315320
lystyrleuleuargproleuglyprohisglyleuleuserlysser
325330335
valglnleuasnglyleuthrleulysmetvalaspaspglnthrleu
340345350
proproleumetglulysproleuargproglyserserleuglyleu
355360365
proalaphesertyrserphephevalileargasnalalysvalala
370375380
alacysile
385
<210>3
<211>26
<212>dna
<213>人工序列
<400>3
gaattcatgaagaagtttaagaactc26
<210>4
<211>25
<212>dna
<213>人工序列
<400>4
gcggccgctcagatgcaagcagcaa25
- 还没有人留言评论。精彩留言会获得点赞!