一种杨梅CAPS标记在检测杨梅花青苷相关MrMYB1等位基因中的应用的制作方法
本发明属于植物分子生物技术和基因工程领域,涉及一个用于检测杨梅花青苷合成相关mrmyb1等位基因的caps标记。
背景技术:
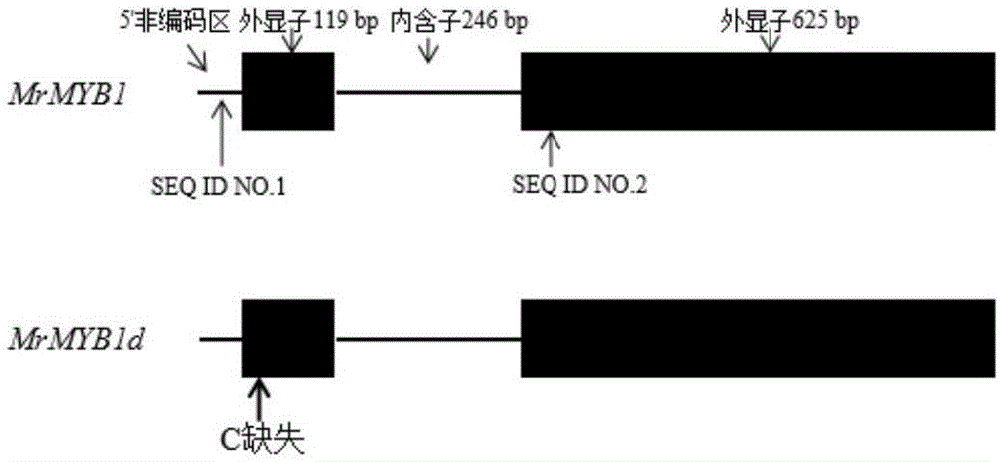
:杨梅(morellarubra)是我国南方特色水果,其果实色泽鲜艳、风味独特,富含生物活性物质,深受消费者喜爱。花青苷是杨梅果实特征色素,不同品种因花青苷含量不同而果实呈现不同色泽,如大量积累花青苷的‘荸荠’果实呈紫黑色,中量积累花青苷的‘东魁’果实呈红色,少量积累花青苷的‘粉红’果实呈粉红色,不积累花青苷的‘水晶’果实呈白色。研究表明转录因子mrmyb1可正向调控杨梅花青苷生物合成。对不同杨梅品种dna中mrmyb1等位基因存在情况的分析表明,杨梅中存在两个mrmyb1等位基因,即mrmyb1和mrmyb1d,其中后者在atg起始密码子后第30位上缺失了一个胞嘧啶,导致移码突变,不能合成正常的mrmyb1蛋白。应用克隆测序分析发现,在‘荸荠’杨梅(成熟果实为紫黑色,大量积累花青苷)基因组和转录组中均只含有mrmyb1;在‘东魁’与‘粉红’杨梅(成熟果实为红色或粉红色,中量或少量积累花青苷)的基因组和转录组中同时含有mrmyb1和mrmyb1d;在‘水晶’杨梅(成熟果实为白色,不积累花青苷)基因组中同时含有mrmyb1和mrmyb1d,转录组中只含有mrmyb1d。因此,鉴定杨梅品种中mrmyb1等位基因基因型,则可预测其花青苷生物合成的能力。此技术应用于杨梅育种工作中,在苗期即可筛选出花青苷合成能力不同的品种,提高育种效率。目前常用的鉴定杨梅mrmyb1等位基因的方法为克隆测序,但是该方法费时费力、效率较低。因此,开发一种简便、高效的鉴定杨梅mrmyb1等位基因mrmyb1和mrmyb1d的分子标记并应用于杨梅不同品种mrmyb1基因型鉴别的方法十分必要。技术实现要素:本发明的目的是克服目前尚未有用于mrmyb1等位基因型鉴别的分子标记这一技术不足,提供一种杨梅caps标记在检测杨梅花青苷相关mrmyb1等位基因中的应用,是一个简便、准确、高效的用于检测杨梅花青苷相关mrmyb1等位基因的酶切扩增多态性序列(caps)标记。本发明提供的caps标记是一组引物对与一种限制性内切酶,引物对序列如seqidno:1-2所示(seqidno:1为5’-atcgatgtctcaacgttcggg-3’;seqidno:2为5’-gatcattagatccacttcgtccgct-3’),限制性内切酶为hhai。所述杨梅caps标记通过对杨梅调控花青苷生物合成的转录因子mrmyb1基因的mrmyb1和mrmyb1d等位基因型的检测可以在杨梅品种果实着色能力预测以及分子辅助选育中的应用。杨梅调控花青苷生物合成的转录因子mrmyb1基因的等位基因mrmyb1和mrmyb1d,本发明的caps标记是通过以下方法得到的:(1)pcr引物设计。根据研究探明的杨梅mrmyb1基因组dna序列设计pcr引物,其序列如seqidno:1-2(seqidno:1为5’-atcgatgtctcaacgttcggg-3’;seqidno:2为5’-gatcattagatccacttcgtccgct-3’)所示。(2)模板dna制备。用ctab(十六烷基三乙基溴化铵,hexadecyltrimethylammoniumbromide)法提取杨梅品种基因组dna和果实cdna。(3)运行pcr。pcr反应体系为:25μlbuffer,2μl10μmseqidno.1和2μl10μmseqidno.2,1μldntp,1μl模板dna,1μlmaxsuper-fidelitydnapolymerase,18μldepc水。pcr程序为:95℃3min,35个热循环(95℃15s,58℃15s,72℃30s),72℃10min,4℃保温。(4)进行酶切。酶切反应体系为:10μlpcr产物,1μlhhai内切酶,5μl10×cutsmartbuffer,34μl灭菌水。反应条件为37℃过夜。(5)琼脂糖凝胶电泳。将酶切产物进行琼脂糖凝胶电泳检测,凝胶浓度为2%,电泳条件为110v,400a,30min,以dl2000dnamarker为参照。(6)等位基因型分析。根据琼脂糖凝胶电泳结果分析mrmyb1等位基因型(表1)。表1pcr产物酶切条带与mrmyb1等位基因型的对应表模板dnapcr产物经酶切后的条带*基因型基因组dna54bp,393bpmrmyb1/mrmyb1基因组dna54bp,393bp,446bpmrmyb1/mrmyb1d基因组dna446bpmrmyb1d/mrmyb1dcdna54bp,147bpmrmyb1/mrmyb1cdna54bp,147bp,200bpmrmyb1/mrmyb1dcdna200bpmrmyb1d/mrmyb1d*:54bp条带在琼脂糖凝胶电泳胶上通常看不到本发明基于研究探明的mrmyb1基因序列设计了pcr引物,基于mrmyb1与mrmyb1d等位基因的序列差异选择了限制性内切酶hhai,通过pcr产物酶切和电泳分离,根据条带情况判断mrmyb1基因型,从而实现基于caps标记的基因型判断。caps标记的准确性以及普适性在12个不同色泽的杨梅品种上得到了验证(实施例5、实施例6,附图3、附图4、附图5、附图6)。本发明可简便、准确、高效地鉴定杨梅调控花青苷生物合成的转录因子mrmyb1基因的等位基因mrmyb1和mrmyb1d,以及杨梅的不同基因型。该分子标记可用于杨梅果实着色能力预测以及分子辅助选育等领域。附图说明图1为mrmyb1和mrmyb1d等位基因序列及pcr引物设计示意图。图2为4个杨梅品种成熟果实的色泽信息。图3为4个杨梅品种基因组中mrmyb1等位基因目的片段酶切电泳图。图4为4个杨梅品种转录组中mrmyb1等位基因目的片段酶切电泳图。图5为12个杨梅品种成熟果实的色泽信息。图6为12个杨梅品种转录组中mrmyb1等位基因目的片段酶切电泳图以及基因型分析结果。具体实施方式本发明结合附图和实施例作进一步的说明。实施例1:caps标记开发思路研究探明了mrmyb1基因序列含有2个外显子,分别为119bp和625bp,1个内含子为246bp。等位基因mrmyb1d为起始密码子(atg)后第30位上缺失了一个c(附图1),导致移码突变,不能合成正常的mrmyb1蛋白。发现这一缺失突变使得序列的一个hhai识别位点(5’-gcgc-3’)丧失,因而使得caps标记开发成为可能。为使得等位基因mrmyb1的pcr产物经hhai酶切后产生分离良好的条带并同时适用于基因组dna和cdna,选择的上下游引物离酶切位点应有不同的距离,而且上下游引物间不能存在额外的hhai酶切位点。综合考虑上述两方面要求,最终在mrmyb15’非编码序列中设计了上游引物,在第二个外显子中设计了下游引物。引物的位置如附图1所示。序列如seqidno:1-2(seqidno:1为5’-atcgatgtctcaacgttcggg-3’;seqidno:2为5’-gatcattagatccacttcgtccgct-3’)所示。实施例2:ctab法提取杨梅基因组dna(1)配制ctab基因组dna提取液,配方为:2%ctab(十六烷基三乙基溴化铵,hexadecyltrimethylammoniumbromide),0.1mtris,20mmedta,1.4mnacl,ph值8.0。(2)采集杨梅幼嫩叶片。(3)放入液氮中充分研磨至粉末状,称取0.7g左右转入盛有4mlctab溶液与80μlβ-巯基乙醇(65℃预热)的10ml离心管中,65℃水浴1h;加入4ml氯仿/异戊醇(24:1,v/v),混匀,12000rpm离心10min,15℃,取上清液并再次加入4ml氯仿/异戊醇(24:1,v/v),混匀,12000rpm离心10min。吸取上清,加入2ml5mnacl,4ml异丙醇(-20℃预冷),混匀,放入-20℃2h。12000rpm离心15min,弃上清,沉淀用75%乙醇漂洗2次,晾干。加入100μl含10μg/mlrnasea的te缓冲液溶解沉淀,37℃水浴1h以降解rna。用分光光度计法检测dna浓度,用电泳法检测质量,保存于-20℃。实施例3:杨梅果实rna提取以及cdna合成(1)配制ctabrna提取液,配方为:2%ctab,2%pvp-k30(乙烯毗咯烷酮碘,polyvinylpyrrolidone),100ml1mtris,50ml0.5medta,2mnacl,0.5%亚精胺,ph值8.0。(2)采集杨梅成熟果实。(3)提取rna。杨梅果实放入液氮中充分研磨至粉末状,称取1.0g左右转入盛有4mlctab溶液与80μlβ-巯基乙醇(65℃预热)的10ml离心管中,65℃水浴5min;加入4ml氯仿/异戊醇(24:1,v/v),混匀,10000rpm离心10min,取上清液并再次加入4ml氯仿/异戊醇(24:1,v/v),混匀,12000rpm离心10min。吸取上清液,加入2mlicl,混匀,放入4℃过夜。4℃下10000rpm离心20min,弃上清,沉淀用65℃的sste溶解后,加入400μl的24:1氯仿/异戊醇,涡旋混匀,15℃、10000rpm离心10min。将上清液转入新的离心管中,加入两倍体积的-20℃预冷的无水乙醇,混匀后-80℃放置30min。10000rpm离心20min,收集沉淀,用depc水溶解即可得总rna。用分光光度计法检测rna浓度,用电泳法检测质量,保存于-80℃或用于cdna合成。(4)cdna合成。在离心管中加入10μldepc水,然后加入1μl(约1μg)提取所得的rna和1μloligo(dt)23vn(50μm),于65℃加热5min,迅速置于冰上2min进行rna模板变性。向上述混合液中加入4μl4×gdnawipermix混匀后于42℃保温2min进行基因组dna去除。再向上述混合液中各加入2μl10×rtmix、2μlhiscriptⅱenzymemix混匀,运行程序25℃5min,50℃45min,85℃2min以进行cdna合成。实施例4:pcr参照superfidelitydnapolymerase(任一公司均可,本发明选用vazyme,中国)说明书,按照以下体系克隆杨梅mrmyb1基因目的片段:25μlbuffer,2μl10μmseqidno.1和2μl10μmseqidno.2,1μldntp,1μl模板dna,1μlmaxsuper-fidelitydnapolymerase,18μldepc水。pcr程序为:95℃3min,35个热循环(95℃15s,58℃15s,72℃30s),72℃10min,4℃保温。实施例5:酶切分析将实施例4的pcr产物用限制性内切酶hhai酶切,体系参照hhai(neb,北京)说明书,具体为10μlpcr产物,1μlhhai内切酶,5μl10×cutsmartbuffer,34μl灭菌水。反应条件为37℃过夜。将酶切产物进行琼脂糖凝胶电泳检测,凝胶浓度为2%,电泳条件为110v,400a,30min,以dl2000dnamarker为参照。分别以成熟果实具不同色泽的4个杨梅品种(‘水晶’,‘粉红’,‘东魁’和‘荸荠’)(附图2)的基因组dna和成熟果实cdna为模板扩增所得的pcr产物经hhai酶切后的片段情况如附图3和附图4所示。实施例6:等位基因型分析根据琼脂糖凝胶电泳结果(附图3、附图4),按表1所示分析mrmyb1等位基因型。判断‘荸荠’杨梅基因组和转录组中均只含有mrmyb1,‘东魁’与‘粉红’杨梅基因组和转录组中同时含有mrmyb1和mrmyb1d,‘水晶’杨梅基因组中同时含有mrmyb1和mrmyb1d,转录组中只含有mrmyb1d。这一基因型分析结果与应用克隆测序分析所得结果一致,表明这一caps标记准确可靠。为验证这一caps标记的普适性,将杨梅品种增加至12个品种(附图5),对转录组中的基因型进行了分析。酶切结果与基因型判断结果如附图6所示。这一结果也与克隆测序分析所得结果一致,表明这一caps标记具有普适性。同时,从基因型分析结果可以发现:白色果实杨梅品种转录组中只有mrmyb1d,红色果实杨梅品种转录组中同时含有mrmyb1和mrmyb1d,紫黑色果实杨梅品种转录组中只有mrmyb1。表明基于这一caps标记的基因型分析结果与果实色泽密切相关。综上所述,本发明公布的检测杨梅花青苷相关mrmyb1等位基因的caps标记具有简便、高效的优势,可用于杨梅果实色泽相关的育种研究工作,提高育种效率。序列表<120>一种杨梅caps标记在检测杨梅花青苷相关mrmyb1等位基因中的应用<160>2<170>siposequencelisting1.0<210>1<211>21<212>dna<213>人工序列(unknown)<400>1atcgatgtctcaacgttcggg21<210>2<211>25<212>dna<213>人工序列(unknown)<400>2gatcattagatccacttcgtccgct25当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1