分离装置的制作方法
本实用新型涉及生物
技术领域:
,具体地,涉及一种用于分离液体样本中目标颗粒的分离装置。
背景技术:
:液体活检(liquidbiopsy或fluidbiopsy),是一种能够全面、实时地反映肿瘤细胞或组织生物信息的采样和分析方法。液体活检具有非侵入性的优点,通过分离、分析血液或其他体液(尿液、唾液、胸腔积液、脑脊液等)中特定的研究对象对肿瘤进行动态观察,可以指导医护人员对肿瘤进行筛查、诊断、判断预后、选择治疗方案和监测复发等。液体活检中的特定研究对象包括循环肿瘤dna(circulatingtumordna,ctdna)、循环肿瘤细胞(circulatingtumorcell,ctc)、微泡(又称外泌体,exosome)等。现有技术中一般采用离心、免疫捕获或过滤等方法分离、纯化血液或体液中的循环肿瘤细胞和/或外泌体。离心的分离方法对循环肿瘤细胞(或外泌体)的膜结构会造成一定程度的机械损伤,影响后续的分析研究,且离心造作繁琐对液体活检的通量造成限制。免疫捕获的分离方法需要利用抗体,大幅度提高样本处理成本,且免疫捕获后的洗脱条件可能会对循环肿瘤细胞(或外泌体)的活性产生影响。利用过滤膜过滤的分离方法可以有效地分离体液中不同尺寸的组分,具有低成本、高通量的特点,过滤后得到的目标组分能保持很高的生物活性。但是,在实际操作过程中,过滤膜上易于富集生物样本中的部分组分,其中大于膜孔尺寸的组分会堵塞膜孔。膜孔堵塞会使小于膜孔尺寸的组分不能有效地透过过滤膜,影响分离后目标组分的纯度。膜孔堵塞也会造成局部压力过大,甚至导致过滤膜破裂。技术实现要素:鉴于以上内容,有必要提供一种可以降低过滤分离过程中发生过滤膜堵孔现象的分离装置。本实用新型实施例提供一种分离装置,用于从液体样本中分离提纯出目标颗粒,所述分离装置包括:分离芯片,所述分离芯片包括样本池、第一过滤膜、第二过滤膜、第一腔室以及第二腔室,所述第一过滤膜的孔径与所述第二过滤膜的孔径均小于目标颗粒的粒径,所述第一腔室与所述样本池通过所述第一过滤膜相连通,所述第一腔室设置有第一开口,所述第二腔室与所述样本池通过所述第二过滤膜相连通,所述第二腔室设置有第二开口,其中,所述第一腔室与所述第二腔室分别位于该样本池相对的两侧;真空系统,所述真空系统与所述分离芯片的所述第一开口和所述第二开口分别相连接;以及变频模块,所述变频模块通过所述真空系统分别与所述第一开口和所述第二开口连接。相较于现有技术,本实用新型通过真空系统为分离芯片的第一腔室和第二腔室交替提供负压,并且通过变频模块控制真空系统实现可控、自动化的分离操作,在液体活检过程中可以对循环肿瘤细胞、外泌体等进行快速、高通量的分离提取,减轻实验人员的工作量,降低液体活检的检测成本。附图说明图1是本实用新型实施例所提供的分离芯片的结构示意图。图2是图1所示的分离芯片的结构拆解示意图。图3是本实用新型实施例所提供的分离装置的功能模块示意图。图4是图3所示的分离装置的液路示意图。图5是图3所示的分离装置的分离控制系统的程序模块图。图6是使用图1所示的分离芯片进行分离提纯时样本池内的液体流向示意图。图7a是本实用新型一实施例中施加于分离芯片的负压的示意图。图7b是本实用新型另一实施例中施加于分离芯片的负压的示意图。图7c是本实用新型另一实施例中施加于分离芯片的负压的示意图。图8a是图3所示的分离装置一实施例的芯片底座的结构示意图。图8b是在图8a所示的芯片底座中固定分离芯片以及气体导管后的结构示意图。图9a是原始尿液样本中的组分的粒度测试图。图9b是使用本实用新型实施例的分离芯片对原始尿液样本进行分离提纯后的外泌体的粒度测试图。图9c是使用qev分离柱对原始尿液样本进行分离提纯后的外泌体的粒度测试图。图9d是使用exoquick-tc外泌体试剂盒对原始尿液样本进行分离提纯后的外泌体的粒度测试图。图9e是使用magcapture外泌体提取试剂盒对原始尿液样本进行分离提纯后的外泌体的粒度测试图。图9f是使用exo-spin外泌体纯化管柱对原始尿液样本进行分离提纯后的外泌体的粒度测试图。图10a是使用本实用新型实施例的分离芯片对原始尿液样本进行分离提纯后的外泌体的扫描电镜图。图10b是使用本实用新型实施例的分离芯片对原始尿液样本进行分离提纯后的外泌体的透射电镜图。图11是对分别使用本实用新型实施例的分离芯片、qev分离柱、exoquick-tc外泌体试剂盒、magcapture外泌体提取试剂盒以及exo-spin外泌体纯化管柱对原始尿液样本进行分离提纯后得到的外泌体进行蛋白凝胶电泳以及银染色得到的条带图谱。图12是对使用本实用新型实施例的分离芯片对11份癌症病人的尿液样本进行分离提纯后得到的外泌体进行蛋白质印迹分析得到的图谱。主要元件符号说明如下具体实施方式将结合上述附图进一步说明本实用新型。具体实施方式下面将结合本实用新型的优选实施方式及实施例对本实用新型的技术方案进行描述。需要说明的是,当一个单元被描述为“连接”于另一个单元,它可以是直接连接到另一个单元或者可能同时存在居中单元。当一个单元被被描述为“设置于”另一个单元,它可以是直接设置在另一个单元上或者可能同时存在居中单元。除非另有定义,本文所使用的所有的技术和科学术语与属于本实用新型的
技术领域:
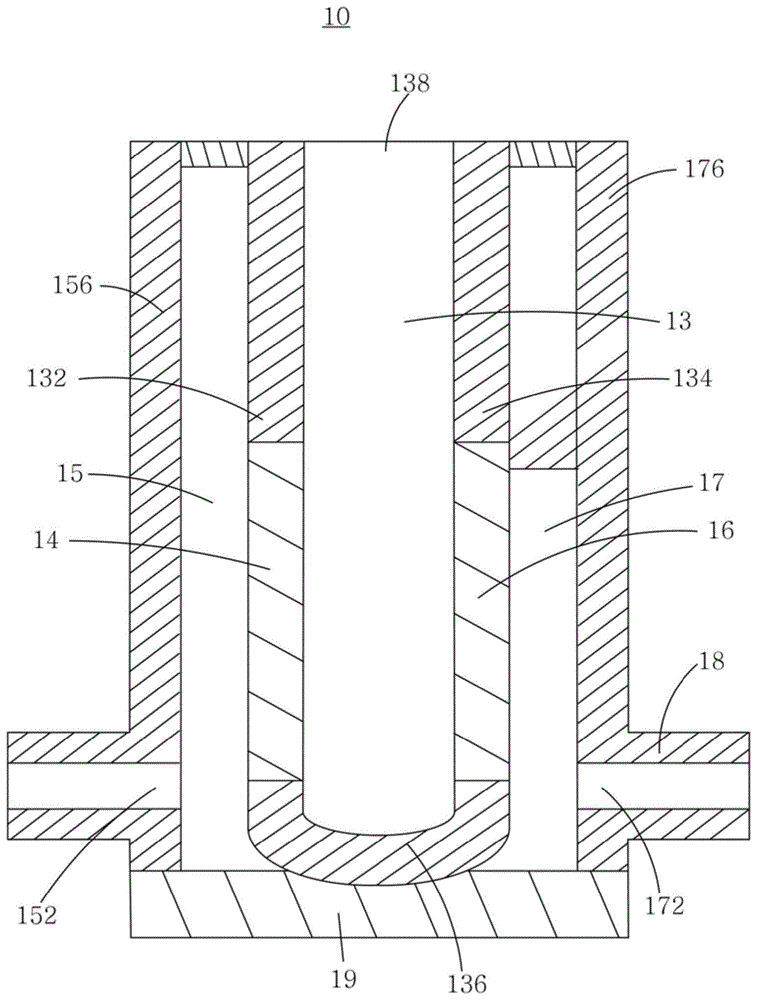
的技术人员通常理解的含义相同。在本实用新型的说明书中所使用的元件或设备的名称只是为了描述具体的实施例的目的,不是旨在于限制本实用新型。本实用新型实施例提供一种分离芯片,该分离芯片用于对液体样本中不同尺寸的颗粒进行分离提纯,以得到特定尺寸的目标颗粒。该液体样本可为人体血浆、血清、脑髓液、唾液、尿液以及胃液等。图1是本实用新型一实施例所提供的分离芯片10的结构示意图。如图1所示,分离芯片10包括样本池13、第一腔室15和第二腔室17。该第一腔室15以及该第二腔室17分别位于该样本池13相对的两侧。该样本池13包括样本池基片136、第一内盖片132和第二内盖片134,该第一内盖片132与该第二内盖片134盖设于该样本池基片136相对的两侧,从而使该样本池基片136、该第一内盖片132以及该第二内盖片134共同围设出用于收容液体样本的收容腔(图未标)。该第一内盖片132上设置有第一过滤膜14,该第二内盖片134设置有第二过滤膜16。该第一腔室15与该样本池13通过该第一过滤膜14相连通。该第一腔室15设置有第一开口152,该第一开口152用于使该第一腔室15与外界连通。该第二腔室17与该样本池13通过该第二过滤膜16相连通,该第二腔室17设置有第二开口172,该第二开口172用于使该第二腔室17与外界连通。使用该分离芯片10时,将液体样本加入样本池13,将该第一开口152和该第二开口172分别与真空系统30(参图3)相连接。当真空系统30通过该第一开口152使该第一腔室15受到抽吸时,该第一腔室15中产生负压。在该第一腔室15的负压作用下,样本池13中的液体样本中尺寸小于第一过滤膜14的过滤孔径的组分经由第一过滤膜14流入该第一腔室15。当真空系统30通过该第二开口172使该第二腔室17受到抽吸时,该第二腔室17中产生负压。在该第二腔室17的负压作用下,样本池13中的液体样本中尺寸小于第二过滤膜16的过滤孔径的组分经由第二过滤膜16流入该第二腔室17。反复交替使该第一腔室15和该第二腔室17内产生负压,可以有效地使液体样本反复交替地流过第一过滤膜14和第二过滤膜16,使液体样本中尺寸大于第一过滤膜14和第二过滤膜16孔径的组分留在样本池13中。该分离芯片10的结构设计使吸附于第一过滤膜14和第二过滤膜16表面的组分在反复交替的负压变化中易于从滤膜表面脱落,可以有效地防止滤膜的膜孔被堵塞。该分离芯片10的样本池13、第一腔室15、第二腔室17的主体部分可以由塑料、玻璃、金属或复合材料制成。在一实施例中,该分离芯片10的样本池13、第一腔室15、第二腔室17的主体部分由聚乙烯亚胺(pei)或聚甲基丙烯酸甲酯(pmma)等透明材料制成。该第一过滤膜14和该第二过滤膜16可以由相同的膜材料制成,也可以由不同的膜材料制成。该第一过滤膜14和该第二过滤膜16可以具有相同的平均过滤膜孔径和/或孔径分布,也可以具有不同的平均过滤膜孔径和/或孔径分布。该第一过滤膜14(或该第二过滤膜16)可以是由一种膜材料制成的,也可以是由多种膜材料复合而成的。该第一过滤膜14和该第二过滤膜16可以是多孔材料,包括但不仅限于多孔陶瓷材料、多孔塑料材料和多孔金属材料。具体地,该第一过滤膜14和该第二过滤膜16可以分别选自阳极氧化铝膜(aao)、聚碳酸酯膜、醋酸纤维膜、聚乙烯膜、聚丙烯膜和聚苯乙烯膜中的一种或几种。更具体地,鉴于阳极氧化铝膜具有较高的孔隙率和较均匀的孔径,该第一过滤膜14和该第二过滤膜16采用阳极氧化铝膜。该第一过滤膜14和该第二过滤膜16的孔径可根据该液体样本以及目标颗粒的类型进行设计。在一实施方式中,该第一过滤膜14和该第二过滤膜16的孔径在2-20微米之间;较佳地,在5-10微米之间。更具体地,该第一过滤膜14和该第二过滤膜16的孔径为8微米,可以用于分离提纯血浆样本中的循环肿瘤细胞。在另一实施方式中,该第一过滤膜14和该第二过滤膜16的孔径在5-200纳米之间;较佳地,在10-100纳米之间。在一实施例中,该第一过滤膜14和该第二过滤膜16的孔径为20纳米,可以用于分离提纯已通过200纳米过滤膜的血浆样本中的外泌体。其中,当该第一过滤膜14和该第二过滤膜16表面未被进一步修饰时,该分离芯片10仅根据滤膜的孔径筛选液体样本中的各种组分,分离提纯后所得的样本中主要包括目标颗粒(如循环肿瘤细胞、外泌体等),也可能含有其他具有相近或较大尺寸的颗粒(如,高密度脂蛋白(hdls),低密度脂蛋白(ldls),中密度脂蛋白(idls),极低密度脂蛋白(vldl),以及乳糜微粒(chylomicrons)等常见的粒度与外泌体相近的非外泌体蛋白)。为降低多孔材料对液体样本中的蛋白或基因的吸附,该第一过滤膜14和该第二过滤膜16的表面可以是被化学修饰的;为特异性地分离提纯目标微粒,该第一过滤膜14和该第二过滤膜16的表面可以是被特异性生物大分子修饰的,该特异性生物大分子可以是特定的一种或几种抗体、抗原、多肽或碱基序列。需要指出的是,本文中所述的目标颗粒可以是具有生物学意义的细胞或组分,也可以是其他类型的微粒,如合成的脂质体、纳米微球、纳米微粒等。可以理解的是,该样本池13的体积可以根据实际应用场景设计。对于生物活检的应用场景,该样本池13的体积可以在0.1-10毫升之间,可选地,在0.5-2毫升之间。在一实施例中,该样本池13的体积为1毫升。该样本池13的顶端可以包括样本池开口138,用于加入和/或取出液体样本。在图1所示的实施方式中,该第一腔室15包括与该第一过滤膜14相对的第一侧盖片156,该第一侧盖片156以及具有该第一过滤膜14的该第一内盖片132共同围设形成该第一腔室15,该第一开口152设置于该第一侧盖片156上;该第二腔室17包括与所述第二过滤膜16相对的第二侧盖片176,该第二侧盖片176以及具有该第二过滤膜16的该第二内盖片134共同围设形成该第二腔室17,该第二开口172设置于该第二侧盖片176上。在本实施方式中,该分离芯片10的第一侧盖片156以及第二侧盖片176上分别固定有一开口连接块18,该开口连接块18中开设有一通道(图未标),该通道分别与第一开口152以及第二开口172对齐且连通。更进一步地,该分离芯片10还可包括一芯片基底19,该芯片基底19用于封闭该第一腔室15以及该第二腔室17,且用于支撑该分离芯片10的其它元件。所述分离芯片10具有对称结构。需要说明的是,分离芯片10也可以是不对称结构或其他任何能够实现本实用新型构思的结构。图2示出了本实用新型所提供的分离芯片10的一实施例的分解示意图。如图2所示,该第一内盖片132上开设有通孔(图未标),该第一过滤膜14固定于该第一内盖片132的通孔中;该第二内盖片134上开设有通孔(图未标),该第二过滤膜16固定于该第二内盖片134的通孔中。该样本池基片136为具有一定厚度的u型基片,该第一内盖片132与该第二内盖片134沿该样本池基片136的厚度方向盖设于该样本池基片136相对的两侧。本实用新型实施例还提供一种上述分离芯片10的制作方法,其包括如下步骤:步骤一,提供上述样本池基片136、第一内盖片132、第二内盖片134、第一侧盖片156、第二侧盖片176、第一过滤膜14以及第二过滤膜16。步骤二,将该第一侧盖片156组装至该第一内盖片132以形成第一腔室15。步骤三,将该第一过滤膜14组装至该第一内盖片132。步骤四,在带有该第一过滤膜14的第一内盖片132远离该第一侧盖片156的一侧依次组装该样本池基片136以及该第二内盖片134。步骤五,将该第二过滤膜16组装至该第二内盖片134。步骤六,将该第二侧盖片176组装至带有该第二过滤膜16的第二内盖片134远离该样本池基片136的一侧以形成第二腔室17。在一实施例中,该样本池基片136、第一内盖片132、第二内盖片134、第一侧盖片156、第二侧盖片176、第一过滤膜14以及第二过滤膜16均通过粘合剂固定。所述粘合剂可以为紫外光固化胶或透明的硅酮防水密封胶。基于以上方法,可以以较低的成本制得符合本实用新型精神的分离芯片10。本实用新型实施例进一步提供了一种分离装置。图3示出了该分离装置100的程序模块示意图。该分离装置100包括主体模块101、辅助模块102以及人机交互模块103。该主体模块101用于对液体样本进行分离提纯。该主体模块101包括如上文所述的分离芯片10、液体供应单元20、真空系统30以及变频模块40。该液体供应单元20用于向分离芯片10、10’的样本池13中注入液体样本以及清洗液。如图3所示,该液体供应单元20包括待测样本室210、清洗液室230和第一控制阀220。该第一控制阀220可分别与该待测样本室210以及该清洗液室230中的其中一个连通。该第一控制阀220可以是液路转换器,包括但不仅限于电磁阀、旋转阀。将第一控制阀220连通待测样本室210,可以将待测样本室210中的液体样本提供至分离芯片10、10’的样本池13用于分离目标颗粒;将该第一控制阀220切换至与该清洗液室230连通,可以将清洗液室230中的清洗液提供至分离芯片10、10’的样本池13用于清洗分离芯片10。该清洗液中可以包括上述的表面活性剂,用于清除分离芯片10、10’各个表面上吸附的蛋白分子。该液体供应单元20还可以包括一动力部件,如动力泵或抽气泵,为液流提供动力。在其它实施方式中,所述液体供应单元20也可以为移液枪或注射器,操作者可手动通过移液枪或注射器将液体样本加入样本池13。该真空系统30用于分别使该分离芯片10、10’的第一腔室15和第二腔室17产生负压。该真空系统30可以是两个独立的真空系统,也可以是经过设计的一个真空系统。该真空系统30也可以包括微型真空泵或微型抽气泵等设备。可以理解的是,该真空系统30与该分离芯片10之间可以通过气密性较佳的管道连接。在一实施方式中,该真空系统30包括第一真空泵310和第二真空泵320,该第一真空泵310与该分离芯片10、10’的第一开口152相连接,该第二真空泵320与该分离芯片10、10’的第二开口172相连接。该变频模块40与该真空系统30电连接,该变频模块40可以控制提供给该真空系统30的电源电压,从而使第一腔室15和第二腔室17内交替产生负压。在一实施方式中,该变频模块40包括变频器410以及与该变频器410连接的第二控制阀420。该第二控制阀420可以是液路转换器,包括但不仅限于电磁阀、旋转阀。该第二控制阀420分别与该第一真空泵310以及该第二真空泵320中的其中一个连通,从而使第一真空泵310和第二真空泵320反复交替工作。例如,将该第二控制阀420连通该第一真空泵310,使得该变频器410控制该第一真空泵310运行,通过第一开口152抽气使第一腔室15(如图6所示的左侧腔室)内产生负压,如图6箭头所示方向,样本池13中的液体样本中的液体和尺寸小于第一过滤膜14孔径的组分在负压作用下通过第一过滤膜14,进入第一腔室15,与此同时,样本池13中的液体样本在第二过滤膜16处会产生回流(backflow)现象,从而减少或移除粘附于第二过滤膜16的组分,避免过滤分离过程中过滤膜被堵塞的情况发生;然后,该变频器410控制该第一真空泵310停止运行;之后,将该第二控制阀420切换至与该第二真空泵320连通,使得该变频器410控制该第二真空泵320运行,通过第二开口172抽气使第二腔室17(如图6所示的右侧腔室)内产生负压,如图6箭头所示方向,使得样本池13中的液体样本中的液体和尺寸小于第二过滤膜16孔径的组分在负压作用下通过第二过滤膜16,进入第二腔室17,与此同时,样本池13中的液体样本在第一过滤膜14处会产生回流现象,从而减少或移除粘附于第一过滤膜14的组分,避免过滤分离过程中过滤膜被堵塞的情况发生;再之后,该变频器410控制该第二真空泵320停止运行;反复上述步骤多次。请参阅图7a,在一实施例中,该真空系统30交替地在该第一腔室15以及该第二腔室17内产生的负压形成周期的矩形脉冲信号。所述矩形脉冲信号的强度为-70kpa,周期为1min,负压在该第一腔室15以及该第二腔室17之间的交替时间为0.5min。如图7b和7c所示,在另一实施例中,为防止负压方向突然改变对第一过滤膜14以及第二过滤膜16造成损坏,该矩形脉冲信号还可以替换为周期性的正弦信号或梯形信号。在其它实施例中,鉴于血浆样本中蛋白含量较多,为了进一步避免过滤膜堵塞现象,可以在其中一腔室内产生负压的同时在另一腔室内产生正压,加强过滤膜处的回流现象。工作中,可根据液体样本的类型相应调整该交替变化的负压的强度、交替时间、周期以及总操作时间等,以使得过滤膜处回流效果最佳。请参阅图8a和图8b,在一实施例中,该主体模块101还可包括一芯片底座50,该芯片底座50用于收容并固定该分离芯片10。该芯片底座50包括一底板51以及固定于该底板51上的芯片座体52以及两个固定板53。该芯片座体52中开设有与该分离芯片10、10’形状匹配的收容槽520,该收容槽520用于将该分离芯片10、10’收容于其中。该芯片座体52还包括相对设置的两个侧壁521,每一侧壁521自远离该底板51的顶端向该底板51的方向开设有一插口522。因此,当操作者将该分离芯片10、10’插入该收容槽520内时,使得该分离芯片10、10’的开口连接块18能够插入该插口522中。如图8b所示,该开口连接块18的厚度大于该侧壁521的厚度,从而,当该开口连接块18插入该插口522中时,每一开口连接块18远离该分离芯片10、10’的端部凸伸出该插口522。该两个固定板53分别位于该芯片座体52相对的两侧。该第一真空泵310以及该第二真空泵320各包括一气体导管330以及套设于该气体导管330远离该第一真空泵310或该第二真空泵320的一端的一导管接块340。该气体导管330在该导管接块340上形成一第三开口341。每一气体导管330穿过其中一固定板53,使该气体导管330上的导管接块340位于该固定板53以及该芯片座体52之间。该气体导管330在位于该固定板53以及该导管接块340之间的部分套设有一螺旋弹簧331。当该分离芯片10、10’插入该收容槽520中时,该第一开口152以及该第二开口172均与该导管接块340上的第三开口341对齐且连通。此时,由于该分离芯片10、10’的每一开口连接块18远离该分离芯片10、10’的端部凸伸出该插口522,该开口连接块18推动该导管接块340朝向该固定板53运动,从而压缩该螺旋弹簧331。该螺旋弹簧331的弹性回复力使得该分离芯片10、10’与该导管接块340紧密接触,从而防止抽吸过程中发生气体泄露。在一实施例中,该导管接块340在围绕该第三开口341的位置设有一环形密封圈342,该环形密封圈342能够进一步提高该分离芯片10、10’与该导管接块340之间的气密性。如图3和图4所示,在一实施例中,该主体模块101还可以包括一液体收集单元60,该液体收集单元60用于当液体样本已经完成分离提纯后,从分离芯片10、10’的样本池13收集分离后的液体样本。该液体收集单元60可包括采样针,该采用针可伸入该样本池13中吸取分离后的液体样本。进一步地,如图4所示,该主体模块101还可以包括第一液体存储室350和第二液体存储室360。该第一液体存储室350设置于该第一真空泵310与分离芯片10、10’的第一开口152之间,且该第一液体存储室350分别与第一真空泵310和分离芯片10、10’的第一腔室15相连通。该第二液体存储室360设置于该第二真空泵320与分离芯片10、10’的第二开口172之间,且该第二液体存储室360分别与第二真空泵320和分离芯片10、10’的第二腔室17相连通。第一液体存储室350和第二液体存储室360可以作为安全瓶,避免分离芯片10、10’中的液体进入真空泵,也可以作为废液瓶收集每次分离后残余在分离芯片10、10’中的液体或清洗液。该辅助模块102用于确保该分离装置100稳定运行且提高分离提纯效果。该辅助模块102包括一检测器70以及一控制器80。该检测器70用于检测该分离芯片10、10’的样本池13中的液面高度。该控制器80与该检测器70以及该变频模块40电连接。该控制器80用于获取该检测器70检测到的液面高度,并结合该液面高度以及液体样本的预设加入量判断液体样本是否已经完成分离提纯。当判断液体样本已经完成分离提纯时,该控制器80控制该变频模块40停止作业,从而停止在该分离芯片10、10’的第一腔室15和第二腔室17内产生负压。其中,该控制器80可以是内嵌在硬件或固件(firmware)上的逻辑关系集合,也可以是用编程语言所编写的一系列存储在存储器或其他固件中的程序。在一实施例中,该控制器80还用于根据预设的负压参数控制该变频模块40在该第一腔室15以及第二腔室17内交替产生相应的负压。该控制器80还用于根据液体样本的预设加入量控制该第一控制阀220与待测样本室210的连通时间,从而使符合该预设加入量的液体样本流入该样本池13。该控制器80还根据清洗液的预设加入量控制该第一控制阀220与清洗液室230的连通时间,从而使符合该预设加入量的清洗液流入该样本池13。该人机交互模块103用于满足实际分离提纯过程中的使用需求,使该分离装置100具有可操作性。该人机交互模块103包括一人机交互界面90。该人机交互界面90用于供操作者通过该分离装置100的输入单元(如:触摸屏、键盘、鼠标等)输入分离提纯参数,即,操作者可通过该人机交互界面90预先设置分离提纯过程中所需的分离提纯参数。在一实施例中,该分离提纯参数包括液体样本的预设加入量、清洗液的预设加入量以及负压参数。该负压参数包括该负压的强度、交替时间、周期以及总操作时间等中的至少一种。该控制器80还与该人机交互界面90电连接。从而,该控制器80可获取经该人机交互界面90输入的分离提纯参数,并根据该分离提纯参数控制该变频模块40或该液体供应单元20相应作业。在一实施例中,该人机交互模块103还可以包括一传输接口92,该传输接口92用于连接一外部设备(如,操作者的u盘、手机等),从而向该外部设备传输该分离提纯参数,使操作者可在每一液体样本分离提纯完成后回顾相关的分离提纯数据。其中,该传输接口可以是usb接口或无线接口。使用本实用新型所提供的分离装置可以自动化地对液体样本中的目标颗粒进行分离,将样本池中无法通过过滤膜的组分分离出来,同时通过样本池两侧空腔内的负压变化改变样本池中的气液流动方向,减少粘附在过滤膜表面的组分,避免过滤分离过程中过滤膜被堵塞的情况发生。该分离装置成本较低、使用方便,极大地降低了实验人员的工作量。本实用新型实施例进一步提供一种分离控制系统200,其应用于该分离装置100中。该分离装置100的辅助模块102还可包括一存储器82,该分离控制系统200存储于该存储器82中。该分离控制系统200包括一个或多个由程序代码组成的程序模块。该控制器80用于加载并执行该分离控制系统200的各个程序模块,从而实现该分离装置100的分离提纯功能。其中,如图3和5所示,该分离控制系统200包括液路与机械模块202以及主控模块203。该液路与机械模块202用于控制该液体供应单元20向分离芯片10、10’的样本池13中注入液体样本以及清洗液。在一实施方式中,该液体供应单元20包括待测样本室210、清洗液室230和第一控制阀220。该液路与机械模块202用于控制该第一控制阀220与该待测样本室210连通,从而将待测样本室210中的液体样本提供至该样本池13。该主控模块203用于通过该变频模块40控制该真空系统30分别在该分离芯片10、10’的第一腔室15和第二腔室17内交替产生负压。在一实施方式中,该真空系统30包括第一真空泵310和第二真空泵320,该第一真空泵310与该分离芯片10、10’的第一开口152相连接,该第二真空泵320与该分离芯片10、10’的第二开口172相连接。该变频模块40包括变频器410以及与该变频器410连接的第二控制阀420。该主控模块203用于控制该第二控制阀420连通该第一真空泵310,使得该变频器410控制该第一真空泵310运行,通过第一开口152抽气使第一腔室15内产生负压。该主控模块203还用于控制该第二控制阀420切换至与该第二真空泵320连通,使得该变频器410控制该第二真空泵320运行,通过第二开口172抽气使第二腔室17内产生负压。在一实施例中,该分离装置100还包括液体收集单元60。该液路与机械模块202还用于当液体样本已经完成分离提纯后,控制该液体收集单元60从分离芯片10、10’的样本池13收集分离后的液体样本。在一实施例中,该分离装置100还包括检测器70。该检测器70用于检测该分离芯片10、10’的样本池13中的液面高度。该分离控制系统200还包括一驱动控制模块201,该驱动控制模块201用于获取该检测器70检测到的液面高度,并结合该液面高度以及液体样本的预设加入量判断液体样本是否已经完成分离提纯。当判断液体样本已经完成分离提纯时,该驱动控制模块201向该主控模块203发送一停止指令。该主控模块203响应该停止指令,并控制该变频模块40停止作业,从而停止在该分离芯片10、10’的第一腔室15和第二腔室17内产生负压。在一实施例中,该驱动控制模块201还用于获取预设的负压参数,并向该主控模块203发送包括所述预设的负压参数在内的一第一控制指令。该主控模块203用于响应该第一控制指令,并根据所述预设的负压参数控制该变频模块40在该第一腔室15以及第二腔室17内交替产生相应的负压。该驱动控制模块201还用于获取液体样本的预设加入量,并向该液路与机械模块202发送一第二控制指令。该液路与机械模块202用于响应该第二控制指令,并根据该液体样本的预设加入量控制该第一控制阀220与待测样本室210的连通时间,从而使符合该预设加入量的液体样本流入该样本池13。该驱动控制模块201还用于获取清洗液的预设加入量,并向该液路与机械模块202发送一第三控制指令。该液路与机械模块202还用于响应该第三控制指令,并根据该清洗液的预设加入量控制该第一控制阀220与清洗液室230的连通时间,从而使符合该预设加入量的清洗液流入该样本池13。本实用新型实施例进一步提供一种分离液体样本中目标颗粒的方法,其包括如下步骤:步骤一,提供本实用新型所述的分离芯片10、10’。步骤二,向该分离芯片10、10’的样本池13中提供液体样本。在一实施例中,可使用分离装置100的液体供应单元20向该样本池13加入液体样本,液体样本可通过该样本池开口138加入该样本池13。为了防止分离提纯过程中蛋白分子吸附于该分离芯片10、10’的第一过滤膜14以及第二过滤膜16处,可进一步向该样本池13中加入表面活性剂以及pbs缓冲液。该表面活性剂可为聚乙氧基月桂酸清凉茶醇(别名:吐温20)或聚氧乙烯聚氧丙烯(pluronicf68),该表面活性剂的质量浓度可为5%。步骤三,通过该分离芯片10、10’的第一开口152抽吸第一腔室15,使第一腔室15内产生负压。其中,在进行抽吸之前,将分离芯片10、10’的第一开口152、第二开口172分别与分离装置100的真空系统30相连。如此,真空系统30通过第一开口152抽吸第一腔室15,使第一腔室15内产生负压。样本池13中的液体样本中的液体和尺寸小于第一过滤膜14孔径的组分在负压作用下通过第一过滤膜14,进入第一腔室15。在某些情况下,如第一腔室15的体积相对较小,亦或是,第一腔室15内的负压变化过快,液体和尺寸小于第一过滤膜14孔径的组分也可能进一步通过第一开口152流出,进入第一液体存储室350。更具体地,在进行抽吸之前,若液体样本通过该样本池开口138加入该样本池13,可进一步将该样本池开口138封闭。当该样本池开口138被封闭时,在抽吸过程中,样本池13中位于该第一过滤膜14以及该第二过滤膜16之间的液体流动速度增强,从而增强该第一过滤膜14或该第二过滤膜16的回流现象,减少粘附在过滤膜表面的组分,避免过滤分离过程中过滤膜被堵塞的情况发生。在其它实施例中,鉴于血浆样本中蛋白含量较多,为了进一步避免过滤膜堵塞现象,步骤三可进一步包括在第二腔室17内产生正压,加强过滤膜处的回流现象。步骤四,停止抽吸第一腔室15。步骤五,通过该分离芯片10、10’的第二开口172抽吸第二腔室17使第二腔室17内产生负压。其中,真空系统30通过第二开口172抽吸第二腔室17,使第二腔室17内产生负压。粘附在第一过滤膜14表面的组分可以随着气流和/或液流样本池13中,样本池13中的液体样本中的液体和尺寸小于第二过滤膜16孔径的组分在负压作用下通过第二过滤膜16,进入第二腔室17。在某些情况下,如第二腔室17的体积相对较小,亦或是,第二腔室17内的负压变化过快,液体和尺寸小于第二过滤膜16孔径的组分也可能进一步通过第二开口172流出,进入第二液体存储室360。可以理解地,步骤四和步骤五可以依次先后执行,也可以同时执行。在其它实施例中,鉴于血浆样本中蛋白含量较多,为了进一步避免过滤膜堵塞现象,步骤五可进一步包括在第一腔室15内产生正压,加强过滤膜处的回流现象。步骤六,停止抽吸第二腔室17。然后,步骤三至步骤六可循环多次,使液体样本中小于过滤膜孔径的组分被去除,大于过滤膜孔径的组分被截留在样本池13中,以实现更好的分离提纯效果。通过第一腔室15、第二腔室17内负压的交替变化可以改善过滤过程中过滤膜的通透性,降低过滤膜堵孔,提高过滤效果。在一实施例中,在该步骤六之后,该方法可进一步包括如下步骤:步骤七:向该分离芯片10、10’的样本池13中提供清洗液。然后,通过反复执行步骤三至步骤六对分离芯片10、10’进行清洗。该表面活性剂的质量浓度可为0.1%。使用本实用新型实施例提供的分离芯片10对10ml的尿液样本进行分离提纯,30min内便可分离出较高产量的外泌体。此外,还使用市售的qev分离柱(izonscience公司)、exoquick-tc外泌体试剂盒(sbi公司)、magcapture外泌体提取试剂盒(wako公司)以及exo-spin外泌体纯化管柱分别从同样的尿液样本中分离外泌体,并使用粒度分析仪(malvern公司)对原始尿液样本以及各分离提纯手段得到的外泌体的粒度进行测试,测试结果如图9a至9f所示。其中,包括使用该分离芯片10、10’在内的各种分离提纯手段得到的外泌体的粒度范围均为30-150nm,符合外泌体的理论粒度范围。对使用该分离芯片10、10’得到的外泌体进行扫描电镜和透射电镜测试,测试结果如图10a以及10b所示。其中,分离得到的外泌体具有较高的完整性以及纯度。进一步地,由于高密度脂蛋白(hdls),低密度脂蛋白(ldls),中密度脂蛋白(idls),极低密度脂蛋白(vldl),以及乳糜微粒(chylomicrons)具有与外泌体相近的粒度和密度,为测试经各种分离提纯手段得到的外泌体的纯度,对原始尿液样本以及经各种分离提纯方法得到的外泌体进行蛋白凝胶电泳,电泳染色后,采用银染色法对蛋白进行染色,得到的条带图谱如图11所示。其中,原始尿液样本对应的条带信号较强,表明原始尿液样本中含有较高含量的蛋白。经过qev分离柱或exo-spin外泌体纯化管柱分离提纯后,得到的外泌体对应的条带仍然具有较强的信号,表明经这两种分离手段分离提纯后的外泌体中吸附有大量蛋白。经magcapture外泌体提取试剂盒或exoquick-tc外泌体试剂盒分离提纯后,得到的外泌体对应的条带强度减弱,表明外泌体中大量蛋白已被移除,提纯精度较高。而使用本实用新型实施例所提供的分离芯片10进行分离提纯后,得到的分泌体对应的条带的信号强度相较于经过qev分离柱以及exo-spin外泌体纯化管柱分离提纯后得到的外泌体对应的条带信号强度大幅降低,而相较于经magcapture外泌体提取试剂盒以及exoquick-tc外泌体试剂盒分离提纯后得到的外泌体对应的条带信号强度仅有少许提高。因此,使用本实用新型实施例所提供的分离芯片10分离得到的分泌体中未吸附有大量的蛋白,提纯精度较高,进一步表明该分离芯片10相较于市售的各种外泌体分离手段具有较强的竞争力。由于癌症病人的液体样本相较于常人通常存在差异,为证明本实施例的分离芯片10可同样用于癌症病人的液体样本的分离提纯,收集11位前列腺癌病人的尿液样本各10ml,并使用本实用新型实施例的分离芯片10分别对每一份尿液样本进行分离提纯,并采用微量紫外-可见光分光光度计对分离后的外泌体进行蛋白含量进行测试,测试结果如表1所示。表1尿液样本蛋白含量(mg/ml)10.27520.73133.09940.82650.32160.16570.99881.11292.21100.624110.944从表1可知,8个尿液样本的外泌体中蛋白含量均小于1mg/ml,表明使用该分离芯片10对癌症病人的液体样本进行分离提纯后,得到的分泌体同样未吸附有大量的蛋白,提纯精度较高。进一步地,使用蛋白质印迹法对该11份尿液样本分离提纯后得到的外泌体中的cd81,cd9蛋白标志物进行测试,测试结果如图12所示。其中,至少7份尿液样本分离提纯后得到的外泌体中能够同时检测到两种蛋白标志物,2份尿液样本分离提纯后得到的外泌体中能够检测到一种蛋白标志物。由此可见,本实用新型实施例的分离芯片10能够用于癌症病人的液体样本的分离提纯。更进一步地,使用同一个分离芯片10并以相同的方法重复对该11份尿液样本进行分离提纯,并采用微量紫外-可见光分光光度计对每次分离得到的外泌体进行蛋白含量测试,发现测试结果相较于表1的差异系数小于5%,表明本实用新型实施例的分离芯片10具有较高的结构稳定性,且使用该分离芯片10进行分离提纯具有较高的可重复性。再者,使用多个该分离芯片10并以相同的方法重复对该11份尿液样本进行分离提纯,失败率小于5%,进一步表明使用该分离芯片10进行分离提纯具有较高的可重复性。上述实施例为本实用新型较佳的实施方式,但本实用新型的实施方式并不受上述实施例的限制,以上实施方式仅是用于解释权利要求书。然本实用新型的保护范围并不局限于说明书。任何熟悉本
技术领域:
的技术人员在本实用新型披露的技术范围内,可轻易想到的变化或者替换,都包含在本实用新型的保护范围之内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1