CARM1小分子抑制剂及其应用的制作方法
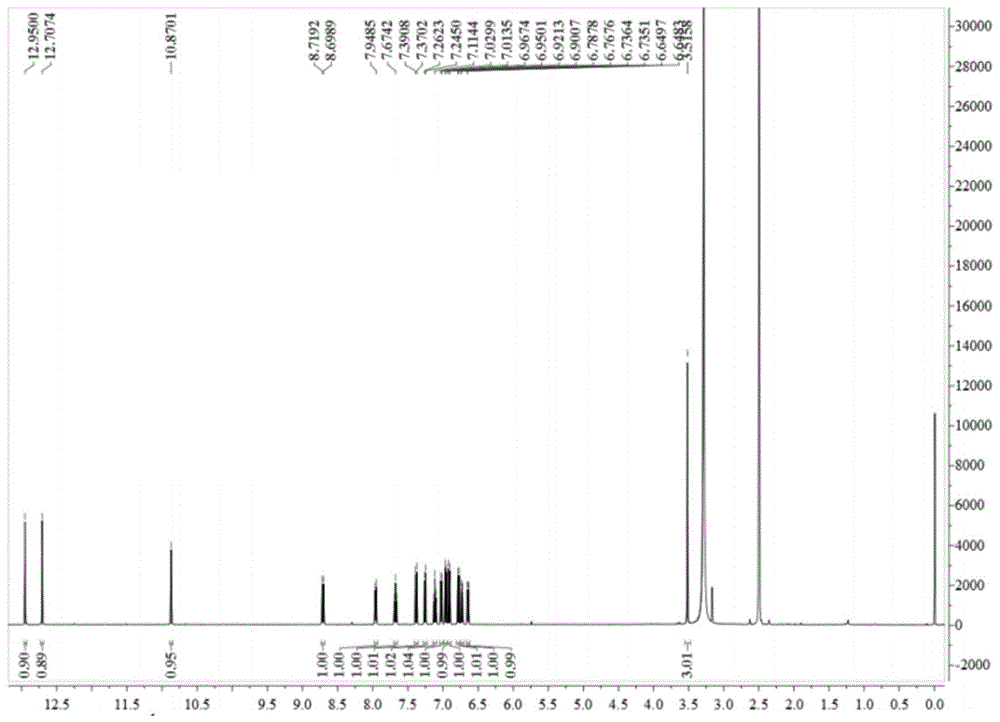
本发明属于药物化学领域,涉及carm1抑制剂,具体涉及一种carm1小分子抑制剂及其应用。技术背景根据2018年全球癌症统计结果显示每年有超过1800万新增癌症病例,其中前列腺癌在所有男性癌症中发病率排名第二位,严重危害男性健康和生命。前列腺癌的早期治疗手段包括手术切除、放射疗法和内分泌疗法等,但是大多数患者最终会出现复发,发展为去势抵抗性前列腺癌。因此,开发低毒、高效和高特异性的新型抗肿瘤药物成为当前科学家们的重点研究方向。共激活因子相关精氨酸甲基转移酶1(coactivator-associatedargininemethyltransferase1,carm1)也叫精氨酸甲基转移酶4(proteinargininemethyltransferase4,prmt4)是精氨酸甲基转移酶家族的重要成员之一。carm1在细胞核与细胞质中均有分布,可以催化组蛋白h3第2、17和26位精氨酸发生非对称性双甲基化修饰,此外还有多种非组蛋白底物。carm1参与了转录调控、rna加工、自噬和细胞凋亡等多种生物学过程。多项研究表明carm1的失调是多种癌症发生的原因之一,其高表达与预后不良和低生存率相关。因此,carm1已被成为重要的癌症治疗靶点。在过去十年中,研究报道了一些carm1的小分子抑制剂,然而较低的细胞活性以及较差的特异性使得这些小分子杀伤癌细胞的效果不甚理想。因此研究开发一种全新结构的,具有良好特异性的天然产物小分子化合物,通过抑制carm1的活性达到杀伤癌细胞的效果,从而开发出新的抗癌药物具有重要的现实意义和经济价值。技术实现要素:本发明的目的在于提供两种互为对映体的carm1小分子抑制剂(1a,1b),其中小分子抑制剂1b具有能够抑制前列腺癌细胞增殖的功能。本发明的另一目的在于提供上述carm1小分子抑制剂在制备抗肿瘤药物中的应用。本发明的又一目的在于提供一种抗肿瘤药物组合物。为达到上述发明目的,本发明采用的技术方案是:两种carm1小分子抑制剂(1a,1b),所述抑制剂为具有下述化学结构的化合物:本发明同时要求保护上述的carm1小分子抑制剂在制备抗肿瘤药物中的应用。优选的,所述的肿瘤为前列腺癌、非小细胞肺癌、乳腺癌、急慢性白血病、肝癌、胃癌、结直肠癌、卵巢癌、宫颈癌中的任意一种。本发明开发的全新结构的carm1小分子抑制剂主要通过抑制carm1甲基转移酶活性,降低整体组蛋白h3r17甲基化修饰水平,抑制prostate-specificantigen(psa)基因的表达,从而能有效地抑制肿瘤细胞增殖的效果。因此,本发明能够在制备抗肿瘤的药物中应用。本发明同时要求保护一种抗肿瘤药物组合物,该抗肿瘤药物组合物的活性成分包含上述的carm1小分子抑制剂。优选的,该抗肿瘤药物组合物还包括药学上能接受的载体或辅料。本发明所述carm1小分子抑制剂可以单独或与一种以上可接受的载体组合剂制成制剂给药。例如,溶剂、稀释剂等。可以口服剂型给药,如片剂、胶囊、可分散粉末、颗粒剂等;也可以注射型给药,如冻干粉针剂。本发明的药物组合物的各种剂型可以按照药学领域中熟知的方法制备。由于上述技术方案的运用,本发明与现有技术相比具有以下列优点:1、本发明制备的carm1小分子抑制剂,从植物的天然产物分离得到,可以利用生物合成或微生物发酵的方法制备,反应简单易操作,产物易提纯、得率高、易保存。2、本发明所鉴定的carm1小分子抑制剂对正常细胞毒性低,并对carm1底物组蛋白h3r17甲基化化介导的下游基因psa的表达具有显著的抑制作用,因此能够有效地抑制前列腺癌的增殖,从而有望将其开发成新的抗肿瘤药物。附图说明图11a和1b的1h核磁共振光谱分析(500mhz,dmso-d6)结果图21a和1b的13c核磁共振光谱分析(125mhz,dmso-d6)结果图31a和1b的1h-1h关联性磁振频谱分析(dmso-d6)结果图4手性高效液相色谱分离1a和1b图5体外甲基化实验分析小分子抑制剂1a和1b体外抑制carm1酶活的效果图6mst技术检测1b小分子与carm1蛋白的解离常数图7蛋白免疫印迹研究1a和1b对carm1底物h3r17me2a水平的影响图8蛋白免疫印迹研究1a和1b对carm1表达水平的影响图9实时定量pcr和蛋白免疫印迹验证lncap细胞中carm1干扰表达的效果图10实时定量pcr和蛋白免疫印迹验证lncap细胞中carm1干扰表达后psa的表达变化图11实时定量pcr和蛋白免疫印迹验证1a和1b分别处理lncap细胞后psa的表达变化图121a和1b对lncap细胞周期的影响图131a和1b对lncap细胞总蛋白的影响图14蛋白免疫印迹验证野生型carm1和失活突变carm1过表达lncap稳定细胞株中carm1的表达水平图15cck-8实验检测1a和1b对野生型carm1和失活突变carm1过表达lncap稳定细胞株增殖的影响具体实施方案结合实验对本发明作进一步描述:实施例11a,1b制备方法:天然产物1a,1b来源于螳螂(tenoderaaridifolia)的肠道菌ifb-tl01(保藏于中国典型培养物保藏中心,保藏编号cctccm207198),将ifb-tl01从螳螂肠道中分离后,体外大量培养,将细菌超声破碎后通过基于生物活性的分馏方法(kruzselyidetal.journalofchromatographicscience,2016,54(7):1084-1089.)分离得到一种具有全新骨架的生物活性聚酮化合物,高分辨率电喷雾电离质谱分析显示该化合物[m+na]+荷质比为541.0897。我们进一步通过1h和13cnmr,1h-1hcosy分析来确定其结构(图1-3),单晶x射线晶体衍射分析表明该化合物是由一对对映体形成的外消旋混合物。进一步我们通过高效液相色谱对两种手性对映体进行了分离(图4),我们将他们命名为1a和1b。实施例2细胞外实验检测1a和1b对carm1催化活性的影响为了验证1a和1b能否抑制carm1的甲基转移酶活性,我们首先原核表达了带有gst标签的carm1蛋白,进行了体外甲基化实验,图5所示,gst-carm1蛋白具有甲基转移酶活性,可以甲基化组蛋白h3。此外,与对照相比较,1a和1b能够显著地抑制carm1甲基转移酶活性,并且1b效果更好。随后我们利用微量热泳动仪(mst)检测1b与carm1蛋白的结合情况。mst是利用粒子在微观的温度梯度中的定向运动,通过测量水化层(通常是由生物分子结构/构象的变化引起的)导致的微量热泳动的变化来确定亲和力。图6所示,体外结合实验表明1b与carm1蛋白直接结合,结合常数为40.75μm±3.05μm。具体步骤如下:a.gst-carm1原核蛋白表达1)重组质粒构建:我们选用pgex-6p-1载体构建pgex-6p-1-carm1原核表达载体。使用ecori和sali酶切位点,pcr引物如下:以人293t细胞cdna为模板,lataq酶扩增carm1cds序列,双酶切扩增片段、pgex-6p-1载体,进行重组质粒连接,连接产物转化dh5α感受态菌,涂抹含氨苄抗性的lb平板,挑取阳性克隆进行测序鉴定,测序正确的质粒即是pgex-6p-1-carm1组质粒。2)原核蛋白表达:将阳性重组质粒pgex-6p-1-carm1转化bl21感受态表达菌种,接取100μl原核表达菌至3mllb培养基中培养。第二天按1:100体积比扩大培养,3小时后取1ml菌液测od600吸光值,od600值达到0.4-0.6后,按照1:10000比例加入iptg(1m)诱导carm1原核蛋白表达,继续培养4小时后,10000rpm离心收集菌体,-80℃保存。3)gst-carm1蛋白纯化:以1l菌/50mlpbs比例重悬菌体,置于冰上冷却,放置超声破碎仪中,以如下程序破碎菌体:功率600w,超声2s,间歇2s,共30min。超声结束后12000rpm,4℃离心15min去除沉淀,收集上清至新50ml管中,加入300mlgstbeads,4℃旋转结合1小时,3000rpm,4℃离心3min,去除上清,使用2mlnetn500溶液洗涤3次,取适量gstbeads进行sds-page电泳鉴定纯化结果。4)gst-carm1原核重组蛋白洗脱:按如下配方配制还原型谷胱甘肽洗脱溶液:1mtris-cl(ph=8.0)500μlddh2o至10mll-glutathione0.03g加入1ml洗脱液至含gstbeads的ep管中,4℃旋转30min,3000rpm离心3min,吸取上清液保留,如此反复洗脱2次,保留的上清液即是gst-carm1溶液,-80℃保存。取适量上清液进行sds-page电泳鉴定洗脱效果、蛋白纯度及蛋白定量。b.体外甲基化反应按如下体系进行体外甲基化反应:按上述体系混合好各成分后,置于30℃反应2h,反应结束后进行放射自显影实验。c.微尺度热泳实验(mst实验)我们通过mst实验验证1b与carm1蛋白直接相互作用,使用monotemper公司的仪器与试剂盒(货号:mo-c030),具体实验步骤如下:a)缓冲液交换根据mst仪器对测试样品的要求,标记操作需要蛋白溶解在中性ph(ph6-8)的标记缓冲液中,溶解蛋白的缓冲液中不能含有伯胺类化合物(例如铵离子,tris,甘氨酸,乙醇胺,三乙胺,谷胱甘肽)或者咪唑,这类化合物会明显降低蛋白标记效率。蛋白纯度较低或者蛋白样品中含有的载体蛋白如bsa都会影响蛋白的标记,因此我们首先按照试剂盒中的步骤对carm1蛋白进行缓冲液交换,具体操作如下:1)加3ml双蒸水溶解试剂盒中的缓冲盐。2)倒置混匀柱a,扭掉柱a底部的小盖子,并拧开柱盖。3)将柱子放在1.5-2ml的ep管中,3000rpm离心1min除去柱a中过量的液体,加入300μl的1)中溶解好的缓冲液,3000rpm离心1min,洗涤3次。4)将40-100μl的蛋白溶液加入柱a,将柱a放入新的ep管中,3000rpm,4℃离心2min,即得交换缓冲液的蛋白。b)蛋白的标记1)用标记缓冲液将蛋白的浓度调节到2-20μm。2)加入50μl的dmso溶解固体染料(此时染料的浓度大约为650μm)。3)混匀,使得染料充分溶解,用标记缓冲液稀释染料的浓度为蛋白浓度的2-3倍。4)1:1体积混合染料和蛋白,室温避光孵育30min。c)蛋白的纯化为了优化mst的实验结果,未反应的过量游离染料需要过柱除去,标记蛋白的纯度可以通过测量蛋白和染料的比值得到(例如可以通过测量蛋白在280nm以及染料在650nm处的吸光度值来测量两者的比例,摩尔吸光度250m-1cm-1)。1)倒掉柱b中的储存液,用mst测试液平衡柱b(总共需8ml,依靠重力下缓冲液从柱b中流出来平衡柱子)。2)加入200μl体积的标记反应液至柱b中间位置,让反应液完全浸入柱b中,弃去流出的液体。3)再加入300μl体积的冲洗液(试剂盒提供)至柱b,重复操作2。4)加入600μl体积的冲洗液,收集洗脱下来的液体(前两滴流出的液体可以弃去)。5)用光谱法测量蛋白与染料的比率,并分装蛋白。d)mst反应取1b小分子母液,以2倍依次稀释,共稀释16个pcr管,每管以1:1体积加入c中标记的蛋白,混匀,使用毛细管吸取至毛细管顶部即可,避免毛细管内部含气泡。将毛细管放入nanotempermst仪器读取荧光值,利用仪器软件程序计算出解离常数kd值。实施例3细胞内检测1a和1b对carm1催化活性的影响为了在细胞内验证1a和1b对carm1催化活性的影响,我们使用1a和1b处理lncap细胞,48h后收集细胞,提取蛋白进行蛋白免疫印记实验,使用不同的组蛋白标记抗体检测相关组蛋白修饰的变化,图7结果显示1a和1b处理lncap细胞显著地降低h3r17me2a修饰水平,但是不影响h4r3me2a和h4r3me2s修饰水平。图8结果表明1a和1b不影响carm1的蛋白水平。因此,上述实验结果证实1a和1b可以抑制lncap细胞内h3r17me2a修饰水平,并且1b表现出更强的抑制效果。实施例4构建carm1干扰表达的lncap稳定细胞株,检测相关蛋白变化为了探明carm1在前列腺癌中的功能,我们使用shrna慢病毒系统构建了carm1干扰表达的lncap稳定细胞株。实时定量pcr和蛋白印记检测了carm1表达水平(图9),结果表明carm1mrna和蛋白表达水平都下降,同时实时定量pcr蛋白印记实验也证实carm1干扰表达后,前列腺癌特异性抗原psa的表达水平显著降低(图10)。上述结果表明carm1可以调控前列腺癌中psa的表达。具体是实施实例及步骤如下:1)carm1干扰表达的前列腺癌lncap稳定细胞株的构建和检测我们使用pll3.7shrna慢病毒系统构建carm1干扰表达的lncap稳定细胞株。lncap细胞从上海细胞生物所购得,在含10%fcs的dmem培养基(v/v,thermofisher)中培养。carm1的shrna靶点序列遵照生产厂家的说明书插入pll3.7慢病毒质粒的xhoi/hpai位点。shrna靶点:2)利用实时定量pcr技术检测carm1基因在对照scr细胞和carm1干扰表达细胞株(carm1-kd)中的mrna表达水平,具体实施步骤如下:a.细胞总rna提取1)计数板法查看细胞密度(取四周和中间格子计数,算平均值,要求细胞密度为5×106个/ml)。2)在生物安全柜内,取5ml细胞溶液加入无菌的15ml离心管内,1000rpm离心10min。3)去上清,加1mlpbs,吹匀细胞,将这些细胞溶液全部转移至一个ep管内(以下所用的ep管、枪头均须经过0.1%depc水处理,湿热灭菌后使用)。4)去上清,加1mlpbs,吹匀细胞,3000rpm5min.5)吸尽上清,弃去,各加1mltrizol,每加一管,须吹打均匀,以不见丝状物为准(即透明),室温静置5min。6)补加200μl氯仿,剧烈摇动15s,室温静置2-3min。7)12000g,4℃,离心15min。8)吸取上层水相(约600μl),转移至一个新ep管内,加500μl异丙醇,室温静置10min。9)12000g,4℃,离心10min。10)去上清,加1ml75%的预冷乙醇(0.1%的depc水配制),涡旋片刻。11)7500g,4℃,离心5min。12)去上清,干燥,溶于20μl的0.1%depc水中,55℃放置10min促溶,利用分光光度计测定浓度和纯化,rna可立即用于逆转录cdna或-80℃保存备用。b.cdna合成1)hiscriptrversetranscriptase逆转录系统在无rnase的ep管中配制如下混合液:用移液器轻轻吹打混匀,42℃2min。之后加入5×qrtsupermixii,用移液器轻轻吹打混匀,按如下程序合成cdna:25℃10min50℃30min85℃5min产物可立即用于pcr反应,或在-20℃保存备用。q-rt-pcr使用的是gene公司corbettresearch的rotor-gene6000定量pcr仪,试剂是rochefaststartuniversalsybrgreenmastermix,反应体系如下:q-rt-pcr反应条件如下:2)carm1、psa引物列表如下:实施例51a和1b对lncap细胞中psa表达水平、细胞周期和总蛋白的影响我们使用1a和1b分别处理lncap细胞,提取细胞总rna和细胞总蛋白,检测psa基因的表达。实时定量pcr结果显示,相对于对照细胞,psa基因表达水平也显著降低,蛋白免疫印迹结果也证实psa蛋白水平降低(图11),这一结果与carm1干扰表达效果相同。为了进一步分析1a和1b对lncap细胞的影响,我们使用了细胞周期检测试剂盒。流式细胞仪分析结果表明,1b处理lncap细胞后,细胞周期阻滞在了g1期(图12)。通过对细胞总蛋白进行sds-page电泳染色分析,结果表明1a和1b处理lncap细胞对细胞总蛋白水平没有显著影响(图13)。实施例61a和1b抑制肿瘤细胞增殖能力检测将癌细胞lncap,a549,mcf7和正常细胞293t传代至96孔板中,待细胞贴壁生长至对数生长期后,将不同浓度的1a和1b(0μm,0.1μm,0.5μm,1μm,2μm,4μm,8μm,16μm,32μm)加入到96孔板里的细胞中,37℃培养48h,用cck-8方法分析细胞生长情况,计算1a和1b对不同细胞的半数抑制浓度ic50。表1显示1b对前列腺癌lncap细胞增殖具有较好的抑制作用。表11a和1b处理不同细胞的半数抑制浓度ic50celllineslncapa549293tmcf71a>14μm>14μm>14μm>14μm1b9μm>14μm12.81μm12.74μm实施例7野生型carm1和失活突变carm1过表达lncap稳定细胞株的构建和鉴定为了在细胞水平验证1a和1b是通过抑制carm1催化活性来抑制lncap细胞增殖。我们首先构建了带有ha标签的mscv-carm1过表达载体(具体操作步骤参考文献niemetal.journalofbiologicalchemistry,2018,293(45):17454-17463.),随后通过点突变试剂盒(赛百盛,货号sdm-15)在mscv-carm1过表达载体基础上突变得到了mscv-carm1s229e失活突变过表达载体。与包装质粒共同转染293t细胞包装过表达mscv-carm1和mscv-carm1s229e的逆转录病毒,感染lncap细胞,构建carm1和carm1s229e过表达的lncap稳定细胞株(具体操作步骤参考文献niemetal.journalofbiologicalchemistry,2018,293(45):17454-17463.)。使用ha抗体进行蛋白免疫印迹实验证明细胞株构建成功(图14)。随后我们使用1a和1b分别处理野生型(wt)和失活突变(s229e)carm1过表达的lncap细胞,通过cck-8实验检测细胞增殖能力变化,图15结果表明1a和1b对于野生型carm1过表达的lncap细胞增殖能力的抑制效果显著,而对失活突变carm1过表达的lncap细胞增殖能力的抑制效果较差。这一结果表明1a和1b是通过抑制carm1的催化活性来发挥作用的。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1