制备AMH抗体的质粒、抗体、其制备方法及筛选方法,试剂盒及检测方法与流程
本发明涉及生物技术领域,特别是涉及制备amh抗体的质粒、抗体、其制备方法及筛选方法,试剂盒及检测方法。
背景技术:
抗缪勒氏管激素(amh)是一种140kda的二聚体糖蛋白,通常用作评估卵巢储备和女性生育能力的生化标记物。即使使用激素避孕药或处于自发性月经周期,血清和血浆amh水平也相对稳定。
amh检测方法从最早的免疫细胞化学分析(ica)和放射免疫分析(ria)到目前的酶联免疫吸附试验(elisa)。ica和ria专注于amh在动物组织中的定位和功能研究,并未达到临床诊断所需的标准。尽管elisa可用于amh的临床分析,但由于样品储存时间和反复冻融等因素,结果不稳定,并且在大多数情况下,样品线性稀释后获得的实验结果较差。在免疫测定中,amh抗体是amh检测的关键试剂。全长amh分子的结构复杂,由于半胱氨酸内二硫化物的存在,成熟区域不处于暴露状态。因此,针对具有复杂结构的amh蛋白的高质量单克隆抗体的开发在技术上仍具有挑战性,从而影响amh的检测。
技术实现要素:
基于此,有必要针对现有amh单克隆抗体的制备质量不高的问题,提供一种制备amh抗体的质粒、抗体、其制备方法及筛选方法,试剂盒及检测方法。
一种用于制备amh单克隆抗体的质粒,包括:
质粒载体;
amh基因,所述amh基因用于编码amh;以及
促抗体形成基因,所述促抗体形成基因的表达产物能够促进amh免疫形成amh单克隆抗体,所述促抗体形成基因包括β2-微球蛋白基因和细胞因子基因中的一种或多种;
所述amh基因、所述β2-微球蛋白基因和所述细胞因子基因插入到同一个或不同的所述质粒载体中。
在其中一个实施例中,所述细胞因子选自flt3l、gm-csf和ccl20中的一种或多种。
在其中一个实施例中,所述amh基因和所述β2-微球蛋白基因插入到同一个所述质粒载体中。
在其中一个实施例中,所述促抗体形成基因包括所述β2-微球蛋白基因和所述细胞因子基因,所述细胞因子基因包括flt3l基因、gm-csf基因和ccl20基因,所述amh基因和所述β2-微球蛋白基因插入到第一所述质粒载体中,所述amh基因单独插入到第二所述质粒载体中,所述flt3l基因插入到第三所述质粒载体中,所述gm-csf基因插入到第四所述质粒载体中,所述ccl20基因插入到第五所述质粒载体中。
一种amh单克隆抗体,所述amh单克隆抗体采用所述的用于制备amh单克隆抗体的质粒经动物免疫形成。
一种所述的amh单克隆抗体的制备方法,包括:
将所述用于制备amh单克隆抗体的质粒注射入小鼠尾静脉得到免疫小鼠;
将骨髓瘤细胞与所述免疫小鼠的脾脏细胞进行融合得到杂交瘤细胞;
筛选能够产生amh单克隆抗体的阳性杂交瘤细胞;
将所述阳性杂交瘤细胞注射入其它小鼠腹腔进行培养,在所述培养后的小鼠的腹水中得到所述amh单克隆抗体。
一种所述的amh单克隆抗体的配对组合的筛选方法,包括:
提供分子互作检测装置,所述分子互作检测装置包括生物传感器,所述生物传感器包括生物膜层,所述amh单克隆抗体能够固定在所述生物膜层上,当所述生物膜层上结合分子时所述生物膜层的光学厚度增大,所述生物膜层的光学厚度变化能够通过所述生物传感器以信号输出;
将第一amh单克隆抗体固定在所述生物膜层上;
将amh负载在所述固定有所述第一amh单克隆抗体的生物膜层上,形成抗体-抗原结合生物膜层;
将第二amh单克隆抗体负载在所述抗体-抗原结合生物膜层上;以及
通过检测所述生物膜层的光学厚度变化筛选与所述amh形成三明治夹心结构的所述第一amh单克隆抗体和所述第二amh单克隆抗体的组合,所述光学厚度变化越大,所述第一amh单克隆抗体和所述第二amh单克隆抗体的组合与amh越容易形成所述三明治夹心结构,所述变化越小,所述第一amh单克隆抗体和所述第二amh单克隆抗体的组合与amh越不容易形成所述三明治夹心结构。
一种amh检测试剂盒,包括:
第一抗体;
第二抗体;
所述第一抗体和所述第二抗体选自权利要求5所述的amh单克隆抗体,且所述第一抗体和amh的结合位点与所述第二抗体和amh的结合位点不同;
还包括:固相载体和化学检测分子,所述第一抗体能够包被在所述固相载体上,所述化学检测分子能够标记在所述第二抗体上,所述化学检测分子能够催化底物发光。
在其中一个实施例中,所述第一抗体和所述第二抗体的组合通过所述的amh单克隆抗体的配对组合的筛选方法筛选获得。
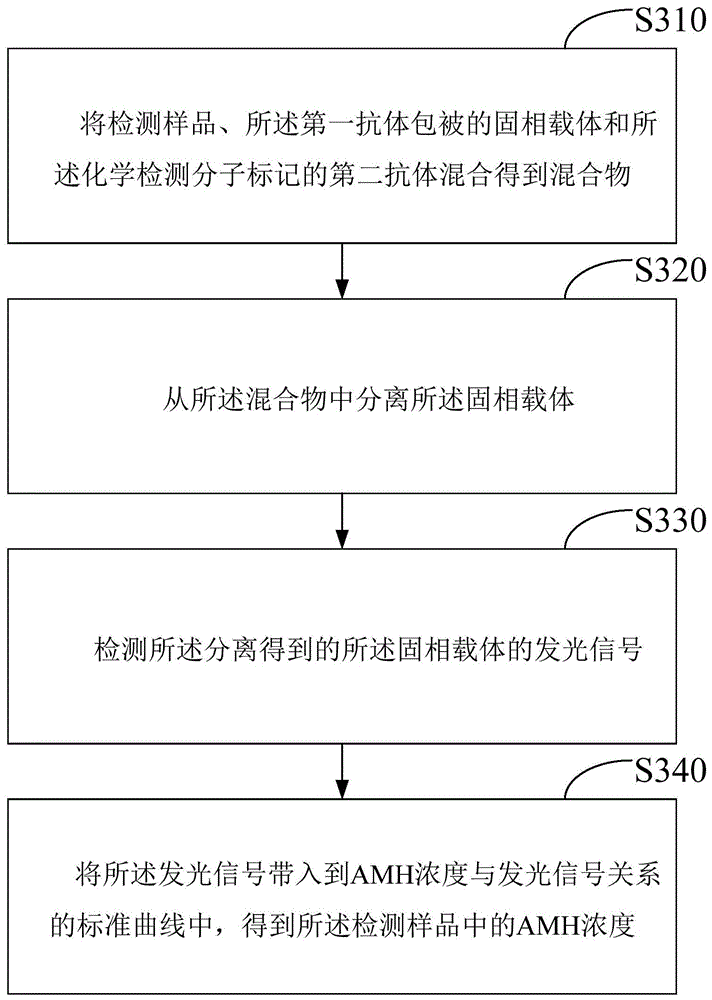
一种amh的检测方法,采用所述的amh检测试剂盒,并包括以下步骤:
将检测样品、所述第一抗体包被的固相载体和所述化学检测分子标记的第二抗体混合得到混合物;
从所述混合物中分离所述固相载体;
检测所述分离得到的所述固相载体催化底物的发光信号强度;以及
将所述发光信号带入到amh浓度与发光信号关系的标准曲线中,得到所述检测样品中的amh浓度。
本发明的所述用于制备amh单克隆抗体的质粒包括amh基因,amh基因能够表达形成作为抗原的amh,amh抗原经免疫系统能够产生amh抗体,本发明通过在制备amh单克隆抗体的质粒中加入促抗体形成基因,提高抗原amh免疫应答形成抗体的能力,发明人经过研究发现,amh和β2-微球蛋白同时存在能够有效地产生细胞毒性t淋巴细胞(ctl)靶结构,提高通过amh体内免疫诱导特异性ctl应答而形成分泌抗amh抗体淋巴细胞的能力;细胞因子具有调节和促进免疫强度的能力,能够提高机体免疫应答,促进分泌抗amh单克隆抗体免疫细胞的增殖和分化。本发明可以通过将包括amh基因和促抗体形成基因的质粒通过尾静脉免疫小鼠,代替传统的直接用amh重组蛋白皮下免疫制备amh抗体的方法,制备的抗体可更好的识别体内天然形成的amh抗原,采用本发明实施例的质粒免疫形成的amh抗体与amh的亲和力更强,采用本发明制备的抗体检测amh具有较高的检测精确性和准确性。
将本发明得到的amh单克隆抗体分别包被固相载体和标记化学检测分子,可以采用夹心法检测样品中的所述amh浓度,第一抗体包被固相载体,第二抗体标记化学检测分子,第一抗体和第二抗体分别与目标amh结合,增加了目标amh检测的特异性和精准性。所述固相载体作为结合的场所,有利于结合后产物的转移和清洗等,目标amh结合固相载体上的第一抗体的同时和标记有化学检测分子的第二抗体结合,化学检测分子作为检测标志物,通过化学检测分子催化底物的发光量表征目标amh的浓度,发光量与目标amh的浓度成正比。
本发明通过分子互作技术筛选作为第一抗体和第二抗体的配对组合,利用第一抗体和第二抗体与amh结合后的生物膜层的光学厚度变化表征第一抗体和第二抗体与amh形成三明治夹心结构的免疫复合物的效果,所述筛选方法操作简便、选择性高、灵敏度强。
附图说明
图1为本发明一实施例的amh的检测方法的流程示意图;
图2为本发明一实施例的不同质粒免疫得到的抗体滴度结果照片;
图3为本发明一实施例的amh单克隆抗体的纯化后电泳结果照片;
图4为本发明一实施例amh单克隆抗体效价结果照片;
图5a为本发明一实施例的一批次的amh单克隆抗体的亲和力结果照片;
图5b为本发明一实施例的另一批次的amh单克隆抗体的亲和力结果照片;
图6为本发明一实施例的amh单克隆抗体配对筛选结果照片;
图7为本发明一实施例的amh单克隆抗体配对包被固相载体和标记化学检测分子筛选结果照片;
图8为本发明一实施例的amh浓度与发光值的关系标准曲线照片;
图9a为本发明一实施例的amh检测试剂盒与elisa试剂盒的检测结果的相关性结果曲线;
图9b为本发明一实施例的amh检测试剂盒与elisa试剂盒的检测结果的相对偏差结果曲线。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下通过实施例,并结合附图,对本发明的制备amh抗体的质粒、抗体、其制备方法及筛选方法,试剂盒及检测方法进行进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
本发明实施例提供一种用于制备amh单克隆抗体的质粒,包括:
质粒载体;
amh基因,所述amh基因用于编码amh;以及
促抗体形成基因,所述促抗体形成基因的表达产物能够促进amh免疫形成amh单克隆抗体,所述促抗体形成基因包括β2-微球蛋白基因和细胞因子基因中的一种或多种;
所述amh基因、所述β2-微球蛋白基因和所述细胞因子基因插入到同一个或不同的所述质粒载体中。
本发明实施例的所述用于制备amh单克隆抗体的质粒包括amh基因,amh基因能够表达形成作为抗原的amh,amh抗原经免疫系统能够产生amh抗体,本发明通过在制备amh单克隆抗体的质粒中加入促抗体形成基因,提高抗原amh免疫应答形成抗体的能力,发明人经过研究发现,amh和β2-微球蛋白同时存在能够有效地产生细胞毒性t淋巴细胞(ctl)靶结构,提高通过amh体内免疫诱导特异性ctl应答而形成分泌抗amh抗体淋巴细胞的能力;细胞因子具有调节和促进免疫强度的能力,能够提高机体免疫应答,促进分泌抗amh单克隆抗体免疫细胞的增殖和分化。本发明实施例可以通过将包括amh基因和促抗体形成基因的质粒通过尾静脉免疫小鼠,代替传统的直接用amh重组蛋白皮下免疫制备amh抗体的方法,制备的抗体可更好的识别体内天然形成的amh抗原,采用本发明实施例的质粒免疫形成的amh抗体与amh的亲和力更强,采用本发明实施例制备的抗体检测amh具有较高的检测精确性和准确性。
所述amh基因和所述促抗体形成基因可以通过人工合成或者购买得到。所述amh基因和所述促抗体形成基因可以通过对所述质粒载体进行酶切和连接而插入所述质粒载体中。所述质粒载体的种类可以选自但不限于pcaggs载体。
在一实施例中,所述细胞因子可以选自鼠酪氨酸激酶受体3配体(fms-liketyrosinekinase3ligand,flt3l)、鼠粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophagecolony-stimulatingfactor,gm-csf)和cc亚型趋化因子20(ccsubtypechemokineligand20,ccl20)中的一种或多种。flt3l可以作为amh抗原诱导免疫形成抗体的引发剂。gm-csf可以作为免疫调节剂改善免疫反应,并诱导免疫细胞形成能够识别天然amh的抗体。ccl20趋化因子能够招募未成熟的免疫细胞,如树突状细胞(dendriticcells,dc)、效应或记忆t细胞和b细胞,从而增加免疫细胞捕获和呈递amh抗原的能力。所述细胞因子通过促进免疫过程,提高amh抗体的形成能力。
在一实施例中,所述amh基因和所述β2-微球蛋白基因插入到同一个所述质粒载体中。所述amh和β2-微球蛋白在同一个质粒中共表达,可以更有效地产生ctl靶结构,提高amh基因的体内免疫诱导特异性ctl应答形成抗体的性能。
优选的,所述促抗体形成基因包括所述β2-微球蛋白基因和所述细胞因子基因,所述细胞因子基因包括所述flt3l基因、gm-csf基因和ccl20基因。β2-微球蛋白和多种细胞因子配合dna免疫可以有效激发动物免疫反应,β2-微球蛋白和多细胞因子协同,提高机体内抗原amh的有效递呈,促进amh抗体的有效成熟,进而得到高质量的amh抗体。在一实施例中,所述amh基因和所述β2-微球蛋白基因插入到第一所述质粒载体中,所述amh基因单独插入到第二所述质粒载体中,所述flt3l基因插入到第三所述质粒载体中,所述gm-csf基因插入到第四所述质粒载体中,所述ccl20基因插入到第五所述质粒载体中。各细胞因子基因分别单独在不同的质粒中设置,有利于降低构建质粒的难度。
本发明实施例还提供一种amh单克隆抗体所述amh单克隆抗体采用所述的用于制备amh单克隆抗体的质粒经动物免疫形成。
所述用于制备amh单克隆抗体的质粒在动物体内表达形成amh,amh在动物体内具有抗原性和免疫原性,可以诱导动物免疫产生能够与amh的特异性结合的抗体。所述β2-微球蛋白基因和所述细胞因子基因在在动物体内表达分别形成β2-微球蛋白和细胞因子,所述β2-微球蛋白和细胞因子促进所述amh的免疫性能,提高amh抗体形成能力。
本发明实施例还提供一种所述的amh单克隆抗体的制备方法,包括:
s110,将所述用于制备amh单克隆抗体的质粒注射入小鼠尾静脉得到免疫小鼠;
s120,将骨髓瘤细胞与所述免疫小鼠的脾脏细胞进行融合得到杂交瘤细胞;
s130,筛选能够产生amh单克隆抗体的阳性杂交瘤细胞;
s140,将所述阳性杂交瘤细胞注射入其它小鼠腹腔进行培养,在所述培养后的小鼠的腹水中得到所述amh单克隆抗体。
本发明实施例还提供一种amh检测试剂盒,包括:
第一抗体;
第二抗体;
所述第一抗体和所述第二抗体选自所述的amh单克隆抗体,且所述第一抗体和amh的结合位点与所述第二抗体和amh的结合位点不同。
amh可以通过夹心法测定,通过检测检测样品中的amh与所述第一抗体和所述第二抗体的结合后催化底物发光的强度表征所述检测样品中的amh浓度。
在一实施例中,所述amh检测试剂盒还包括:固相载体和化学检测分子,所述第一抗体能够包被在所述固相载体上,所述化学检测分子能够标记在所述第二抗体上,所述化学检测分子能够催化底物发光。
将本发明实施例得到的amh单克隆抗体分别包被固相载体和标记化学检测分子,可以采用夹心法检测样品中的所述amh浓度,第一抗体包被固相载体,第二抗体标记化学检测分子,第一抗体和第二抗体分别与目标amh结合,增加了目标amh检测的特异性和精准性。所述固相载体作为结合的场所,有利于结合后产物的转移和清洗等,目标amh结合固相载体上的第一抗体的同时和标记有化学检测分子的第二抗体结合,化学检测分子作为检测标志物,通过化学检测分子催化底物的发光量表征目标amh的浓度,发光量与目标amh的浓度成正比。
在一实施例中,所述化学检测分子可以选自但不限于吖啶酯、吖啶酰胺、辣根过氧化物酶(hrp)和碱性磷酸酶(ap)中的一种或多种。
在一实施例中,所述化学检测分子可以选自碱性磷酸酶(ap),所述检测试剂盒还包括检测底物,所述碱性磷酸酶能够催化所述检测底物发生反应而发光。所述检测底物可以包括3-(2-螺旋金刚烷)-4-甲氧基-4-(3-磷氧酰)-苯基-1,2-二氧环乙烷二钠盐(amppd)。ap能够催化amppd脱去一个磷酸根基团,形成不稳定的中间体,该中间体随即自行分解,同时发射光子。通过检测发光值表征碱性磷酸酶浓度,即与碱性磷酸酶关联的检测样品中的amh的浓度。
在一实施例中,所述检测试剂盒还包括校准品及清洗剂。所述校准品为特定浓度梯度的天然amh溶液,所述amh溶液中的溶剂可以包括tris-hcl缓冲液和牛血清白蛋白溶液中的一种或多种。
所述清洗液用于清洗未结合到所述固定载体上的试剂。所述清洗剂可以包括吐温和的tris-hcl缓冲液中的一种或多种。
所述固相载体和所述第一抗体的包被方式可以为通过所述固相载体表面的活性基团与所述第一抗体结合或者通过对所述固相载体和所述第一抗体分别进行分子标记,通过标记分子进行结合。所述活性基团可以包括氨基、羧基和羟基中的一种或多种。在一实施例中,所述固相载体的表面具有羧基,所述固相载体能够通过所述羧基与所述第一抗体的氨基结合。所述分子标记可以为生物素和亲和素标记,所述生物素和所述亲和素可以特异性结合。在另一实施例中,所述第一抗体标记有生物素,所述固相载体标记有亲和素。所述亲和素可以选自链霉亲和素。每个链霉亲和素可以结合4个生物素,从而扩大固相载体结合所述第一抗体的容量。
在一实施例中,所述固相载体为所述amh检测的结合反应的载体,目标amh与第一抗体、第二抗体的结合集成在所述固相载体上,有利于转移、清洗和分离结合后的产物,使得操作更便利。所述固相载体可以为粒子状,粒子状的固相载体的表面积大,提供更多的结合位点从而提高反应容量,并且粒子状的固相载体更适用于液相反应,为检测的实施提供便利。所述固相载体颗粒选自聚苯乙烯粒子和磁性粒子(mps)中的一种或多种。优选的,所述固相载体选自磁性颗粒。磁性颗粒作为固相载体具有易于分离的特点,能够适用于自动化生产的需求。并且磁性颗粒的良好的环境抗性使得它可以适应从酸到碱的苛刻反应环境,从而使得反应体系具有更大的包容性。
优选的,由于不同批次制备的或者不同方式获得的所述amh单克隆抗体与amh的结合位点或结合亲和力不同,所述第一抗体和所述第二抗体的组合可以通过对不同批次制备的或者不同方式获得的所述amh单克隆抗体进行配对组合的筛选获得能够同时与amh结合并且第一抗体和第二抗体的组合与amh的亲和力更强的组合。
本发明实施例还提供一种所述的amh单克隆抗体的配对组合的筛选方法,包括:
s210,提供分子互作检测装置,所述分子互作检测装置包括生物传感器,所述生物传感器包括生物膜层,amh单克隆抗体能够固定在所述生物膜层上,当所述生物膜层上结合分子时所述生物膜层的光学厚度增大,所述生物膜层的光学厚度变化能够通过所述生物传感器以信号输出;
s220,将第一amh单克隆抗体固定在所述生物膜层上;
s230,将amh负载在所述固定有所述第一amh单克隆抗体的生物膜层上,形成抗体-抗原结合生物膜层;
s240,将第二amh单克隆抗体负载在所述抗体-抗原结合生物膜层上;以及
s250,通过检测所述生物膜层的光学厚度变化筛选与所述amh形成三明治夹心结构的所述第一amh单克隆抗体和所述第二amh单克隆抗体的组合,所述光学厚度变化越大,所述第一amh单克隆抗体和所述第二amh单克隆抗体的组合与amh越容易形成所述三明治夹心结构,所述变化越小,所述第一amh单克隆抗体和所述第二amh单克隆抗体的组合与amh越不容易形成所述三明治夹心结构。
所述第一amh单克隆抗体和所述第二amh单克隆抗体为不同批次制备的或者不同方式获得的amh单克隆抗体。本发明实施例通过分子互作技术筛选作为第一抗体和第二抗体的最优配对组合,利用第一抗体和第二抗体与amh结合后的生物膜层的光学厚度变化表征第一抗体和第二抗体与amh结合的亲和力强弱,本发明实施例的筛选方法操作简便、选择性高、灵敏度强。
优选的,所述配对组合的筛选方法还包括:将所述s250筛选得到的第一amh单克隆抗体和第二amh单克隆抗体组合中的所述第一amh单克隆抗体分别包被所述固相载体和标记所述化学检测分子,所述第二amh单克隆抗体分别标记所述固相载体和标记所述化学检测分子;
将所述包被所述固相载体的所述第一amh单克隆抗体和所述标记所述化学检测分子的所述第二amh单克隆抗体作为第一检测组合,所述包被所述固相载体的所述第二amh单克隆抗体和所述标记所述化学检测分子的所述第一amh单克隆抗体作为第二检测组合,通过夹心法检测所述第一检测组合所述第二检测组合的检测效果,从而所述第一amh单克隆抗体和所述第二amh单克隆抗体中包被所述固相载体的抗体和标记所述化学检测分子的抗体的选择。
请参阅图1,本发明实施例还提供一种amh的检测方法,采用所述的amh检测试剂盒,并包括以下步骤:
s310,将检测样品、所述第一抗体包被的固相载体和所述化学检测分子标记的第二抗体混合得到混合物;
s320,从所述混合物中分离所述固相载体;
s330,检测所述分离得到的所述固相载体催化底物的发光信号强度;以及
s340,将所述发光信号带入到amh浓度与发光信号关系的标准曲线中,得到所述检测样品中的amh浓度。
优选的,所述将检测样品、所述第一抗体包被的固相载体和所述化学发光分子标记的第二抗体混合得到混合物的步骤可以包括:
s311,将所述检测样品与所述第一抗体包被的固相载体混合孵育预定时间得到第一混合物;
s312,用清洗液清洗所述第一混合物;
s313,从所述清洗后的所述第一混合物中分离所述固相载体;以及
s314,将从所述第一混合物中分离的所述固相载体与所述化学发光分子标记的第二抗体混合孵育得到第二混合物。
通过先将所述第一抗体包被的固相载体和待测样品混合,清洗后再与化学发光分子标记的第二抗体集合,步骤s211使得待测样品中的amh与第一抗体结合而固定在所述固相载体上,然后经过步骤s312和步骤s313将未结合到固相载体上的试剂清洗,避免未结合的化学检测分子的干扰。
实施例
(1)用于制备amh单克隆抗体的质粒的构建
使用pcaggs载体作为质粒载体,构建可在真核哺乳细胞表达amh蛋白、β2-微球蛋白及细胞因子的质粒。细胞因子包括flt3l、gm-csf和ccl20。质粒分别为:①具有amh基因的质粒pcaggs-hamh;②具有amh基因和β2-微球蛋白基因的质粒pcaggs-hamh-mβ2m;③具有flt3l基因的质粒pcaggs-mflt3l;④具有gm-csf基因的质粒pcaggs-mgm-csf;⑤具有ccl20基因的质粒pcaggs-mccl20。质粒由普健生物(武汉)生物科技有限公司协助构建。
自动化学发光免疫测定仪(limiray1200)由深圳雷度提供。抗体的亲和力和最佳抗体对的筛选有fortebio公司的blitz系统评估。对照试剂盒使用beckman的商业酶联免疫吸附测定(elisa)试剂盒。
(2)amh单克隆抗体的制备和表征
将6~8周龄雌性balb/c小鼠随机分成5组。第1组,第2组和第3组分别用空白pcaggs质粒,pcaggs-hamh和pcaggs-hamh-mβ2m质粒免疫,不使用③④⑤三种质粒。第4组和第5组分别注射pcaggs-hamh和pcaggs-amh-mβ2m,并同步使用③④⑤三种质粒辅助免疫。动物免疫步骤为:将质粒在生理盐水中稀释,并通过尾静脉注射入小鼠得到免疫小鼠。每两周进行一次免疫,一共进行三次。在第2次和第3次免疫后7天,检测免疫小鼠血清amh抗体滴度。选择最高血清amh滴度的小鼠在进一步的细胞融合前三天用50μgamh重组蛋白(基因工程制备得到的amh蛋白)进行腹腔冲击。通过电融合将小鼠的脾脏细胞与sp2/0骨髓瘤细胞融合。在hat培养基中筛选杂交瘤细胞。使用有限稀释法筛选阳性杂交瘤细胞克隆株。最后将阳性杂交瘤细胞注射入小鼠腹腔。培养10天后从小鼠腹腔中获取富含amh单克隆抗体的腹水,腹水经protein-g亲和层析纯化。通过sds-page分析amh单克隆抗体的纯度,并通过间接elisa测定抗体滴度,使用分子互作仪评估抗体亲和力。
请参阅图2所示,在第2次和第3次免疫后,第4组和第5组的血清滴度高于其他组。人amh和鼠β2m共表达质粒免疫组(第5组)的滴度具有明显优势,可能是因为具有共价连接的amh抗原和β2m可以有效地产生ctl靶结构,为通过amh基因免疫诱导ctl应答提供了新的可能性。在细胞因子存在下,balb/c小鼠的免疫应答显著增强。
经筛选得到四株杂交瘤细胞系(标记为3b3,6d2,3c10,5b9),可稳定分泌amh单克隆抗体。请参阅图3,经sds-page分析,四株杂交瘤细胞系得到的amh单克隆抗体具有较高的纯度。
请参阅图4所示,四株杂交瘤细胞系得到的amh单克隆抗体的效价高达1:106。
请参阅图5a和图5b所示,经检测配对多组单克隆抗体的亲和力浓度小于5nm,属于高亲和力抗体,亲和力浓度越低,结合性越强。其中,kd=koff/kon,kd代表常规解离常数,koff代表解离常数,kon代表结合常数。
(3)amh单抗包被磁性颗粒和ap酶标记的amh单抗的制备
高亲和力amh单克隆抗体通过末端氨基与磁性颗粒(mps)共价偶联。首先,将20mg/ml的mps置于2.0mlep管中。用结合缓冲液洗涤mps五次。在洗涤过程中,将ep管置于磁力浓缩器上并除去上清液。然后,将mps重悬于2ml结合缓冲液中得到mps悬浮液。在37℃下振荡培养过夜,将amh单克隆抗体溶液加入到上述mps悬浮液中。孵育后,将ep管置于磁力浓缩器中以将amh单抗包被磁性颗粒与上清液分离。用3%牛血清白蛋白(bsa)封闭mps上的残留结合位点,在37℃温育并轻微摇动2小时。洗涤5次后,将包被amh单抗的磁性颗粒(mab-mps)分散在2ml缓冲液中并在4℃下保存,备用。
识别另一个位点的amh单克隆抗体标记ap并与戊二醛偶联。首先,将ap和amh单克隆抗体悬浮在超纯水中并分别稀释至4mg/ml和8mg/ml。将250μl等份的4mg/mlap溶液转移至1.5mlep管中并与250μl8mg/mlamh抗体溶液混合得到混合液。然后,向混合液中加入0.5ml含1%戊二醛的0.1mol/l磷酸盐缓冲液(ph7.4)。将所得混合物在37℃下在黑暗中轻微振荡温育4小时。第三步,向混合物中加入0.1ml1mol/l单乙醇胺溶液,随后在室温下振荡温育2小时。将温育后的产物在4℃下用pbs溶液透析过夜得到ap酶标记的amh抗体。透析后,将ap酶标记的amh抗体转移至ep管中,并与等体积的甘油和1%bsa混合。最后,将ap酶标记的amh抗体(ap-mabs)储存在-20℃,备用。
(4)分子互作仪筛选最佳抗体配对
为了选择最佳抗体配对来检测amh,使用生物膜层光学干涉(bli)传感器系统blitz(fortebio仪器)检测双抗夹心法检测抗原的效果。将第一amh单克隆抗体分散在磷酸盐缓冲盐水(pbs,0.02%吐温20,0.1%牛血清白蛋白)中得到第一amh单克隆抗体溶液。将第一amh单克隆抗体溶液中的第一amh单克隆抗体固定在抗小鼠iggfc(amc)生物传感器的生物膜层的表面上,在25℃下保持180秒(抗体固化),将未结合残留表面在含有0.5%鼠igg的pbs中封闭。洗涤30秒后,将固定有第一amh单克隆抗体的生物传感器的生物膜层浸入amh蛋白质溶液中180秒(第一amh单克隆抗体-amh抗原结合),然后在pbs中平衡30秒。接下来,将生物传感器的生物膜层移浸入第二amh单克隆抗体溶液180秒(第一amh单克隆抗体-amh抗原-第二amh单克隆抗体结合)。动力学曲线显示每个抗体对的夹心效应。在每种抗体和抗原浓度相同的条件下,我们通过比较第二抗体与生物传感器生物膜层结合时的光学厚度变化(δh)来选择最佳抗体对。随后,通过比较检测最佳抗体对(1ng/ml)的信号强度来确定包被固相载体和标记化学检测分子的抗体种类的最佳选择。
具体实验操作如下:采用上述分子互作方法,将步骤(2)筛选得到的四株抗体随机分组并在
(5)基于mps的全自动化学发光法检测amh
应用磁性颗粒包被抗体(mab-mps)和ap酶标抗体(ap-mabs)夹心反应模式在全自动化学发光仪上进行amh检测。首先,将50μl不同浓度的mab-mps和30μlamh样品或者校准品分别移到与仪器匹配的试剂管中,并在37℃轻轻摇动孵育20分钟(捕获)。然后试剂管通过清洗站用清洗液(含有0.05%吐温的0.01mol/lpbs)洗涤3次,去除非特异性的结合的试剂。然后加入ap-mabs,37℃轻轻摇动孵育10分钟。此时,免疫夹心复合物mps-cpp-ap形成。将形成的免疫夹心复合物磁分离,并通过洗涤除去过量的ap-mabs。随后,将含有200μl发光底物3-(2-螺旋金刚烷)-4-甲氧基-4-(3-磷氧酰)-苯基-1,2-二氧环乙烷二钠盐(amppd)的溶液加入夹心复合物。将所得混合物在免疫测定仪器中温育,并测量相对发光单位(rlu)的值。
请参阅图8所示,制备并测定amh重组蛋白溶液(s0~s10,0~50ng/ml)的系列稀释液作为校准品。绘制amh的标准曲线。线性范围为0.125~20ng/ml(y=4.1149x+6.0497,r2=0.9999)。
(6)检测方法和检测试剂的优化
一系列稀释的ap-mabs(1:100,1:200,1:300,1:400,1:500)和mab-mps(1:20,1:50,1:100,1:200,and1:400)与amh的标准阳性校准品(s8,10ng/ml)和阴性样品(s0,0ng/ml)反应。以两者的最大rlu比(rlus8/rlus0)确定最佳稀释度。同时还优化了其他实验参数,例如底物体积,ph值,孵育时间。最后经过准确度、精密度、稳定性和真实性评价。并且为了本发明实施例的检测方法的可行性,与标准的elisa试剂盒对比分析了69例临床血清样品。
请参阅图9a和图9b,69例临床血清样本(amh浓度为0.19~19.2ng/ml)使用本发明实施例的检测试剂盒进行检测,并与标准elisa试剂盒(型号为amhgenii,beckmancoulter))进行比较。本发明实施例的检测试剂盒孵育可在30分钟内完成,而elisa方法需约3小时。本发明实施例的检测试剂盒与市售的elisa试剂盒之间存在很好的相关性(r2=0.9831),且本发明实施例的检测试剂盒和elisa检测试剂盒之间没有显着的偏差,从标准偏差图计算的平均相对差异(95%的一致性限度)是4.35%。
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!