一种中性粒细胞明胶酶相关脂质运载蛋白检测试剂盒及其临床应用的制作方法
1.本发明属于医学免疫体外诊断领域,尤其是一种重组中性粒细胞明胶酶相关脂质运载蛋白及其在检测血液样本中中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinaseassociated lipocalin,ngal)含量的检测试剂盒中的应用。
背景技术:
2.中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinaseassociated lipocalin,ngal),又称人脂质运载蛋白2(lipocalin 2),其蛋白有三种形式,分子量为25kd的单体、自身聚合46kd同源二聚体、与mmp-9聚合体形成135kd异源二聚体。近年来,ngal已经作为一种新的急性肾损伤的标志物,早期诊断急性肾功能损伤(aki)时,血、尿中的ngal浓度通常会迅速升高,2h最为明显,而传统的指标血清肌酐、尿酶等需要在24~72h后才能明显升高。此外ngal也是反映肾脏慢性损害的一种有潜力的新标记物,在慢性肾脏病(ckd)患者中,ngal能确切反映肾脏损害的程度,是ckd进展的一个强力和独立的风险指标。综上所述,ngal的定量检测产品将具有重要的临床意义和较强的市场需求。
3.目前对ngal的检测方法有酶联免疫吸附测定法、化学发光法、免疫比浊法等。其中,胶乳免疫比浊法的基本原理是:临床样本中的ngal蛋白与包被到胶乳微球的特异性抗人ngal抗体发生反应,形成抗原抗体的免疫复合物,使得胶乳微球形成网状聚合物,增加检测体系的浊度,在一定范围内,ngal蛋白浓度与浊度高低成正相关。随着临床检测需求的增大以及全自动生化分析仪的普及,生化胶乳比浊法凭借反应时间短,精密度好,易于自动化等优点,成为临床上主流检测方法。
技术实现要素:
4.本发明提供了一种重组中性粒细胞明胶酶相关脂质运载蛋白(以下简称ngal),其氨基酸序列如seq id no:1,优化后的密码子序列如seq id no:2所示。
5.本发明还提供了4种鼠抗人ngal单克隆抗体,第一种抗人ngal单克隆抗体(ng08),其重链可变区含有以下的互补决定区:氨基酸序列如序列seq id no:3所示的hcdr1、如序列seq id no:4所示的hcdr2和/或如序列seq id no:5所示的hcdr3;
6.以及其轻链可变区序列含有以下的互补决定区:氨基酸序列如序列seq id no:6所示的lcdr1、如序列seq id no:7所示的lcdr2和/或如序列seq id no:8所示的lcdr3。
7.优选的是本发明中ng08抗体重链可变区的氨基酸序列如seq id no:9所示,轻链可变区的氨基酸序列如seq id no:10所示。
8.优选的ng08单克隆抗体氨基酸序列分别如seq id no:11所示;编码上述单克隆抗体的核苷酸序列分别如seq id no:12所示。
9.第二种抗人ngal单克隆抗体(ng19),其重链可变区含有以下的互补决定区:氨基酸序列如序列seq id no:13所示的hcdr1、如序列seq id no:14所示的hcdr2和/或如序列
seq id no:15所示的hcdr3;
10.以及其轻链可变区序列含有以下的互补决定区:氨基酸序列如序列seq id no:16所示的lcdr1、如序列seq id no:17所示的lcdr2和/或如序列seq id no:18所示的lcdr3。
11.优选的是本发明中ng19抗体重链可变区的氨基酸序列如seq id no:19所示,轻链可变区的氨基酸序列如seq id no:20所示。
12.优选的ng19单克隆抗体氨基酸序列分别如seq id no:21所示;编码上述单克隆抗体的核苷酸序列分别如seq id no:22所示。
13.第三种抗人ngal单克隆抗体(ng20),其重链可变区含有以下的互补决定区:氨基酸序列如序列seq id no:23所示的hcdr1、如序列seq id no:24所示的hcdr2和/或如序列seq id no:25所示的hcdr3;
14.以及其轻链可变区序列含有以下的互补决定区:氨基酸序列如序列seq id no:26所示的lcdr1、如序列seq id no:27所示的lcdr2和/或如序列seq id no:28所示的lcdr3。
15.优选的是本发明中ng20抗体重链可变区的氨基酸序列如seq id no:29所示,轻链可变区的氨基酸序列如seq id no:30所示。
16.优选的ng20单克隆抗体氨基酸序列分别如seq id no:31所示;编码上述单克隆抗体的核苷酸序列分别如seq id no:32所示。
17.第四种抗人ngal单克隆抗体(ng37),其重链可变区含有以下的互补决定区:氨基酸序列如序列seq id no:33所示的hcdr1、如序列seq id no:34所示的hcdr2和/或如序列seq id no:35所示的hcdr3;
18.以及其轻链可变区序列含有以下的互补决定区:氨基酸序列如序列seq id no:36所示的lcdr1、如序列seq id no:37所示的lcdr2和/或如序列seq id no:38所示的lcdr3。
19.优选的是本发明中ng37抗体重链可变区的氨基酸序列如seq id no:39所示,轻链可变区的氨基酸序列如seq id no:40所示。
20.优选的ng37单克隆抗体氨基酸序列分别如seq id no:41所示;编码上述单克隆抗体的核苷酸序列分别如seq id no:42所示。
21.本发明还提供了由上述重组抗人ngal单克隆抗体混合物制备的胶乳增强免疫比浊检测试剂盒。本发明的一种ngal蛋白免疫胶乳增强比浊检测试剂盒,包含r1试剂、r2试剂和标准品,所述r1试剂包括:缓冲液1、稳定剂、增凝剂、保护剂、防腐剂、表面活性剂;所述r2试剂包括:缓冲液2、防腐剂、稳定剂、保护剂;所述标准品包括:缓冲液3、保护剂、稳定剂。
22.优选的,所述r1试剂中:缓冲液1为的磷酸盐缓冲液(0.01m-0.05m、ph7.0-7.4);稳定剂为40g/l-80g/l的nacl;增凝剂为5-10g/l的peg6000~20000,保护剂为0g/l-10g/l的bsa,防腐剂为0.05-0.1g/l的proclin300,表面活性剂为0.1%~0.2%的tween 80或者tritonx 100。
23.优选的,所述r2试剂中:缓冲液2为0.01m-0.05m、ph5.9-7.4的磷酸盐缓冲液或者乙磺酸缓冲液;防腐剂为0.1-0.2g/l的proclin300;稳定剂为10g/l-20g/l的nacl、50g/l~100g/l的葡萄糖或者蔗糖,保护剂为10g/l-20g/l的bsa,0~0.1%的tween 20;另外有标记有四种重组鼠抗人ngal单克隆抗体的胶乳微球(质量浓度为0.125%-0.33%)。
24.优选的,所述标准品包括5支不同浓度的重组人ngal的溶液,其中:缓冲液3为0.01m-0.05m、ph7.0-7.4的磷酸盐缓冲液;保护剂为0g/l-10g/l的bsa及0~2g/l的peg8000
或0~20g/l的山梨醇,稳定剂0-13g/l的nacl。
25.优选的,标记有ngal蛋白抗体的胶乳微球制备方法包括如下步骤:
26.用磷酸盐缓冲液将4种重组鼠抗人ngal单克隆抗体等质量混合物稀释至0.5-4mg/ml,制备成抗体稀释液;用mes缓冲液将胶乳微球(聚苯乙烯胶乳,购自日本jsr公司,粒径100-400nm)稀释至1%(质量浓度),再加入0.02~0.08(edc/胶乳微球的质量比)的edc,在30℃下搅拌反应30min,反应结束后通过离心去除未反应的edc,然后加入兔抗人ngal多克隆抗体稀释液,在25~37℃下搅拌反应30-120min,反应结束后通过离心去除未反应的抗体,再加入终止反应液终止反应即得。
27.本发明采用大肠杆菌作为表达系统制备重组人ngal,该方法具有周期短、表达量大、成本低的特点。制备的ngal蛋白不仅可以作为检测试剂盒中的校准品和质控品原料,而且作为有效的免疫原,可用于鼠单克隆抗体的制备,在获得鼠抗序列的基础上进行重组表达,制备的单链抗体包被于胶乳微球表面,作为ngal定量检测试剂盒中r2试剂的重要原料。
28.本发明制备了多种抗体,并进行配对筛选,获得灵敏度及特异性均能满足需求的抗体组合;抗体方便大量生产,可满足日后大规模临床应用的需求;同时单克隆抗体来源的抗体组合便于试剂盒原料质量控制,可满足试剂盒性能稳定的要求。对上述抗体组合进行检测体系的调试优化工作,获得操作简便,灵敏度,特异性及相关检测性能均可满足人临床样本检测的胶乳免疫比浊定量检测试剂。
附图说明
29.图1试剂盒的标准曲线绘制图,图中横坐标为ngal校准品浓度,纵坐标为吸光度
△
a。
具体实施方式
30.下面通过实施例进一步详细描述本发明,但本发明不局限于这些实施例。
31.实施例1鼠单抗的制备
32.1.动物免疫
33.以ngal蛋白(氨基酸序列如seq id no:1,优化后的密码子序列如seq id no:2所示)按照一般免疫程序免疫balb/c雌性小鼠(购自常州卡文斯实验动物有限公司)。具体免疫情况参见《抗体制备与使用实验指南》。采用间接elisa法跟踪免疫小鼠血清滴度,选取血清效价最高的免疫小鼠,进行小鼠脾细胞和小鼠骨髓瘤细胞进行融合实验。
34.2.细胞融合
35.(1).脾脏细胞的制备
36.将免疫小鼠,摘眼球取血,经断颈椎处死后置于75%(v/v)的酒精中浸泡10分钟,于无菌操作台中取出其脾脏,置于细胞筛网中,充分研磨细胞,过筛网,用无菌1640培养基(购自gibco公司)离心洗涤数次后,重悬细胞以制成单细胞悬液,并计数,备用。
37.(2).饲养细胞的制备
38.取8~10周龄的雌性balb/c小鼠一只,摘眼球获取阴性血清,经断颈椎处死后置75%(v/v)酒精中浸泡10分钟;无菌揭开腹部皮肤,暴露腹膜,用注射器将约10ml 1640ht培养基(购自sigma公司)注入小鼠腹腔,轻轻按摩腹部并吹打数次。吸取含有巨噬细胞的培养
基注入20%1640hat培养基中备用;
39.取2~3周龄的雌性balb/c小鼠一只,经断颈椎处死后置于75%(v/v)酒精中浸泡10分钟;无菌取胸腺于细胞筛网中,研磨,过筛网,获得胸腺细胞置于上述含有巨噬细胞的20%1640hat培养基中,备用。
40.(3).细胞融合
41.选择处于对数生长期的小鼠骨髓瘤细胞株sp2/0,收集并计数。取约108个上述脾细胞与2
×
107个上述sp2/0细胞株加入融合管中混合,1000rpm离心10分钟后弃上清(尽量弃净),将融合管置手掌上来回轻轻摩擦以使沉淀松散。60秒内先慢后快地加入1ml预热的peg1450(聚乙二醇1450,购自sigma公司),加入1640ht培养基30ml终止,1000rpm离心10分钟,去上清,轻轻摩擦使沉淀松散,加入步骤2所获得的20%的1640hat培养基中。
42.将上述hat培养基充分混匀后,以200μl/孔分装至96孔细胞培养板中,置37℃,5%co2的细胞培养箱中培养。一周后用10%1640ht培养基替换20%1640hat培养基,3天后取上清进行检测。
43.3.抗人ngal特异性杂交瘤株筛选
44.(1).检测板的准备:用cb包被液稀释重组人ngal蛋白至1μg/ml,包被96孔elisa酶标板,100μl/孔,2~8℃包被过夜,洗涤一次拍干;含2%牛血清白蛋白的pbst缓冲液封闭(200ul/孔),37℃封闭2小时;拍干,备用。
45.(2).阳性克隆的筛选:将待检细胞培养上清100μl/孔加入上述检测板中,于37℃作用30分钟后洗涤并拍干,加入100μl/孔的hrp标记的羊抗鼠igg,于37℃作用30分钟后洗涤并拍干,加入100μl/孔的tmb显色液,于37℃避光显色15分钟,每孔加入50μl的2m h2so4终止反应,并于od450处读取数值。阳性孔确定原则:od450值/阴性对照值≥2.1。选取阳性克隆株进行细胞克隆化筛选。经过三至四轮的克隆化筛选后,单克隆细胞株阳性率100%即确定为稳定细胞株,对细胞株进行定株。杂交瘤细胞株ngal08、ngal19、ngal20及ngal37均具有较高的效价,遂后续进一步对上述杂交瘤细胞株进行抗体可变区序列测序分析。
46.实施例3.单链抗体重组表达及纯化
47.根据实施例2中测序结果,将杂交瘤细胞株ng08、ng19、ng20及ng37的抗体重链及轻链可变区之间加入连接肽(ggggs)3,引入六个组氨酸,并将其全基因直接融合并用毕赤酵母表达系统进行单链抗体的重组表达。所表达得到的单链抗体分别命名为ng08、ng19、ng20及ng37。上述单链抗体的重组表达具体如下:
48.a)单链抗体基因表达载体构建
49.单链抗体ng08的基因序列如seq id no:12所示、氨基酸序列如seq id no:11所示;单链抗体ng19的基因序列如seq id no:22所示、氨基酸序列如seq id no:21所示;单链抗体ng20的基因序列如seq id no:32所示、氨基酸序列如seq id no:31所示;单链抗体ng37的基因序列如seq id no:42所示、氨基酸序列如seq id no:41所示。将单链抗体ng08、ng19、ng20及ng37基因片段上游引入xhoi酶切位点以及ppiczαa载体中xhoi序列,下游引入组氨酸标签和xbai酶切位点,进行全基因合成并构建到puc57质粒(购自南京金斯瑞生物科技有限公司)中,得到一种长期保存质粒,质粒记为puc57-ng08-scfv、puc57-ng19-scfv、puc57-ng20-scfv、puc57-ng37-scfv。进行pcr扩增,其中
50.上游引物p1为tgt aaa acg acg gcc agt;
51.下游引物p2为:cag gaa aca gct atg ac。
52.常规pcr程序后,琼脂糖凝胶电泳分析,显示产物大小与预期大小一致。
53.分别将pcr获得基因产物回收纯化后,采用xhoi(#r0146s,购自new england biolabs公司)和xbai(#r0145v,购自new england biolabs公司)双酶切,用t4连接酶连接到ppiczαa(v19520,购自invitrogen)质粒中,转化到dh5α感受态细胞中,在含有zeocin(r250-01,购自invitrogen公司)的lb平板中37℃培养过夜。第二天筛选阳性克隆菌测序,比对,与预期序列完全一致,即得到单链抗体表达载体,记为ppiczα-ng08-scfv、ppiczα-ng19-scfv、ppiczα-ng20-scfv、ppiczα-ng37-scfv。
54.b)单链抗体基因在毕赤酵母宿主工程菌株的构建、筛选及表达
55.ypds固体培养基配制:参照invitrogen公司easyselect pichia expression kit说明书;毕赤酵母感受态细胞:参照easyselect pichia expression kit说明书;bmgy培养基配制:参照invitrogen公司multi-copy pichia expression kit说明书;bmmy培养基配制:参照invitrogen公司multi-copy pichia expression kit说明书。
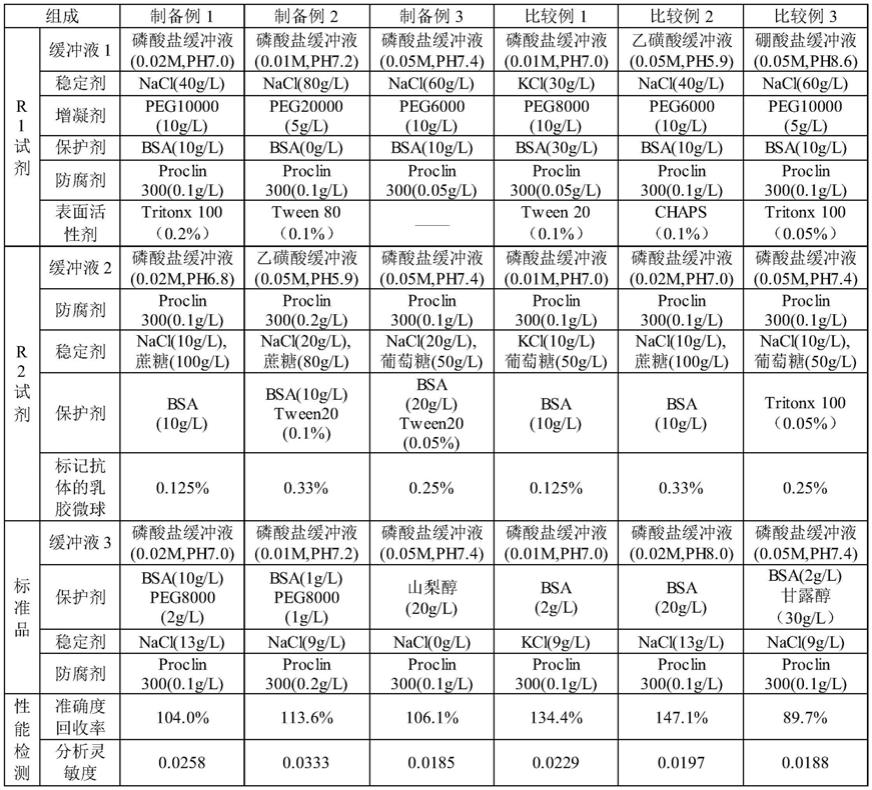
56.分别将ppiczα-ng08-scfv、ppiczα-ng19-scfv、ppiczα-ng20-scfv、ppiczα-ng37-scfv质粒,用saci限制性内切酶酶切线性化。乙醇沉淀后将线性化载体,电转化进入到x-33感受态酵母细胞,涂布到含有zeocin的ypds固体培养基,30℃培养3-5天,就有阳性克隆产生。
57.将上述获得的重组单链抗体基因工程菌株接种于bmgy培养基中,30℃,220rpm培养至菌体密度到od
600
=2.0~6.0,每隔24小时补加甲醇至终浓度为1.0%(v/v)。一周后,收集发酵培养液。
58.c)单链抗体纯化
59.采用组氨酸标签亲和柱纯化单链抗体ng08、ng19、ng20及ng37,预装柱子选择为histrap hp,具体步骤如下:
60.(1)发酵液的除杂预处理:将上述表达得到单链抗体ng08、ng19、ng20及ng37发酵液上清,离心收集上清,并加入结合缓冲液,使得上清终浓度为300mm nacl,20mm nah2po4,10mm imidazole,调ph7.5,0.45μm滤膜过滤。
61.(2)histrap hp亲和柱纯化:运用全自动智能蛋白纯化系统(akta avant150,购自ge healcare公司)对预处理获得的单链抗体ng08、ng19、ng20及ng37发酵液进行亲和纯化,柱子为histrap hp(17-5248-02,购自ge healcare公司)。结合缓冲液为300mm nacl,20mm nah2po4,10mm imidazole,ph7.5,洗脱缓冲液为300mm nacl,20mm nah2po4,500mm imidazole,ph7.5。洗脱时进行线性洗脱,并收集各个洗脱峰。纯化后的蛋白纯度均达到95%以上;合并符合要求的收集管,更换缓冲液为pbs溶液并超滤浓缩(1mg/ml),过滤除菌于-20℃保存备用。
62.实施例3检测试剂盒的制备及使用方法
63.本发明的检测试剂盒是液体双试剂,其中包括r1试剂、r2试剂和校准品,具体见下:
64.1、r1试剂:在缓冲液1中加入稳定剂(例如:nacl)、增凝剂(例如:peg10000)、保护剂(例如:bsa)、防腐剂(例如:proclin 300)、表面活性剂(例如:tritonx100),搅拌混匀,即为r1试剂。
65.2、r2试剂:将4种重组抗人ngal单克隆抗体等质量混合物用磷酸盐缓冲液将抗体稀释至1.0mg/ml,制备成抗体稀释液;用乙磺酸缓冲液将胶乳微球(聚苯乙烯胶乳,购自日本jsr公司,粒径220nm)稀释至1%(质量浓度),再加入0.04(edc/胶乳微球的质量比)的活化剂edc,在30℃下搅拌反应30min,反应结束后通过离心去除未反应的edc,然后加入0.05抗体/胶乳微球的质量比)重组抗人ngal单克隆抗体混合物稀释液,在37℃下搅拌反应60min,反应结束后通过离心去除未反应的抗体,再加入终止反应液终止反应,离心,最后加入由缓冲液2、防腐剂(例如:proclin300)、稳定剂(例如:nacl,蔗糖)、保护剂(例如:bsa、tween20)组成的缓冲液搅拌混匀,即为r2试剂(其中标记有ngal抗体的胶乳微球质量浓度为0.125~0.33%)。
66.3、校准品:将ngal标准品分别加入由缓冲液3、保护剂(例如:bsa)稳定剂(例如:nacl)、防腐剂(例如:proclin 300)组成的缓冲液中,制备得到终浓度为4524、2162、1075、237、0ng/ml的一组校准品。
67.优选地,为了提高试剂盒的准确度,制备了不同的r1、r2、校准品试剂进行准确度(回收率)、分析灵敏度的性能检测和比对,具体评价结果见下表1。选择本发明的各种缓冲液、稳定剂、保护剂、防腐剂、螯合剂等制备的试剂盒有更好的检测性能。
68.分析灵敏度:以已知中性粒细胞明胶酶相关脂质运载蛋白(或简称ngal)含量为(100~300)ng/ml的样本作为检测样本,重复测定3次,记录试剂盒在规定参数下的吸光度差值。换算为200ng/ml ngal所引起的吸光度差值。
69.准确度(添加回收):选择合适浓度的人血清样本(简称:常规样本)中加入一定体积的校准品(ngal理论浓度为c
理论
)制作成回收样本,在常规样本中加入相同体积的去离子水制作成基础样本,其中加入的校准品量不超过总体积的1/10,每个回收样本和基础样本检测3次,测定平均浓度对应为c1和c0。根据计算公式:回收率=(c
1-c0)/c
理论
*100%计算出各自的回收率。
70.表1试剂盒的制备比对结果
[0071][0072]
实施例4检测试剂盒的性能测试
[0073]
对照试剂盒:试剂r2中所使用的重组抗体替换为a厂家商品化兔抗人ngal多克隆抗体,其他试剂及实验方案均同实施例3制备例;
[0074]
本发明试剂盒:具体见实施例3制备例制备的ngal检测试剂盒;
[0075]
商品化试剂盒:购买于知名c公司的临床用ngal胶乳增强比浊试剂盒;
[0076]
对上述试剂盒关键性能进行比较。
[0077]
1、线性范围
[0078]
采用贝克曼全自动生化分析仪au480测定4个不同浓度的ngal标准品在540~600nm处的吸光度,绘制校准品的工作曲线(见图1)。结果可以看出,本发明试剂盒的检测范围较对照试剂盒具有更宽的线性范围,更加有利于高浓度的病理样本直接检测,而不需要进行样本的稀释,操作简易化。此外,线性关系也比商品化试剂盒的更好。
[0079]
因对照试剂盒的线性范围均无法满足临床应用需求,遂未对其进行进一步研究。下述性能评价仅针对本发明试剂盒及商品化试剂盒展开。
[0080]
2、精密度
[0081]
重复性:用本发明试剂盒检测ngal浓度为100~200ng/ml、400~600ng/ml的临床血清样本,重复测试10次,分别计算变异系数(cv)。检测结果可见,本发明试剂盒和商品化试剂盒的重复性完全达到cv≤10%,但本发明试剂盒cv值更低,表明均一性优于商品化试
剂盒(见表2)。
[0082]
批间差:分别用四个不同批号的本发明的检测试剂,ngal浓度为100~200ng/ml、400~600ng/ml的临床血清样本,每个批号至少重复测试3次,计算试剂(盒)批间差r。商品化试剂盒标注的10%,检测结果表明本发明试剂盒批间差异较小,工艺稳定。
[0083]
3、准确度
[0084]
添加回收:选择合适浓度的人血清样本(简称:常规样本)中加入一定体积的校准品(ngal理论浓度为c
理论
)制作成回收样本,在常规样本中加入相同体积的去离子水制作成基础样本,其中加入的校准品量不超过总体积的1/10,每个回收样本和基础样本检测3次,测定平均浓度对应为c1和c0。根据计算公式:回收率=(c
1-c0)/c
理论
*100%计算出各自的回收率。结果表明本发明试剂盒的回收率均能满足90%-110%的要求,而商品化试剂盒的准确度(高浓度样本)超过110%,显示本发明试剂盒具有更好的的特异性和准确度(见表2)。
[0085]
表2准确度和精密度性能评价结果
[0086][0087]
实施例5检测试剂盒的适用性
[0088]
本发明的检测试剂盒应用于全自动生化仪,但不局限于此,其中主要参数设置及检测方法如下(举例贝克曼全自动生化分析仪au5800):
[0089]
检测波长:主波长540~600nm,副波长无;检测温度:37℃;
[0090]
检测方法:取180μl试剂r1与1.5μl样本混匀,孵育5min后,加入45μl试剂r2,立即读取吸光度a1,孵育5min后读取吸光度a2,计算吸光度变化
△
a=a2-a1。使用多点非线性校准,绘制校准品的工作曲线,样品中ngal含量可根据
△
a变化值在工作曲线上计算获得。
[0091]
本发明试剂盒在贝克曼au5800生化分析仪上进行精密度、准确度等性能评价(具体见实施例4,其中准确度采用相对偏差法),结果见表3。结果显示本发明试剂盒精密度和准确度满足要求,表明本发明试剂盒也可以应用于贝克曼生化分析仪其他机型,具有较广的适用性。
[0092]
表3本发明试剂盒在au5800上的性能
[0093]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1