一种抗PD1的制作方法
一种抗pd1
×
pdl1的双特异性抗体
技术领域
1.本发明涉及抗体领域,更具体地,本发明公开了一种抗pd1
×
pdl1的双特异性抗体。
背景技术:
2.人程序性细胞死亡受体-1(pd-1)是一种有288个氨基酸的i型膜蛋白,是已知的主要免疫检查点(immune checkpoint)之一(blank et al,2005,cancer immunotherapy,54:307-314)。pd-1表达在已经激活的t淋巴细胞,它与配体pd-l1(程序性细胞死亡受体-配体1,programmed cell death-ligand 1)和pd-l2(程序性细胞死亡受体-配体2,programmed cell death-ligand 2)结合可以抑制t淋巴细胞的活性及相关的体内细胞免疫反应。pd-l2主要表达在巨噬细胞和树突状细胞,而pd-l1则广泛表达于b、t淋巴细胞及外周细胞如微血管上皮细胞,肺、肝、心等组织细胞中。大量研究表明,pd-1和pd-l1的相互作用不但是维持体内免疫系统平衡所必须,也是导致pd-l1表达阳性肿瘤细胞规避免疫监视的主要机制和原因。通过阻断癌细胞对pd-1/pd-l1信号通路的负调控,激活免疫系统,能够促进t细胞相关的肿瘤特异性细胞免疫反应,从而打开了一扇新的肿瘤治疗方法的大门
--
肿瘤免疫疗法。
3.pd-1(由基因pdcd1编码)为与cd28和ctla-4有关的免疫球蛋白超家族成员。研究成果显示,当pd-1与其配体(pd-l1和/或pd-l2)结合时会负调节抗原受体信号转导。目前已弄清鼠pd-1结构以及小鼠pd-1与人pd-l1的共结晶结构(zhang,x.等,immunity 20:337-347(2004);lin等,proc.natl.acad.sci.usa105:3011-6(2008))。pd-1及类似的家族成员为i型跨膜糖蛋白,其含有负责配体结合的ig可变型(v-型)结构域和负责结合信号转导分子的胞质尾区。pd-1胞质尾区含有两个基于酪氨酸的信号转导模体itim(免疫受体酪氨酸抑制作用模体)和itsm(免疫受体酪氨酸转换作用模体)。
4.pd-1在肿瘤的免疫逃避机制中起到了重要的作用。肿瘤免疫疗法,即利用人体自身的免疫系统抵御癌症,是一种突破性的肿瘤治疗方法,但是肿瘤微环境可保护肿瘤细胞免受有效的免疫破坏,因此如何打破肿瘤微环境成为抗肿瘤研究的重点。现有研究成果已确定了pd-1在肿瘤微环境中的作用:pd-l1在许多小鼠和人肿瘤中表达(并在大多数pd-l1阴性肿瘤细胞系中可由ifn-γ诱导),并被推定为介导肿瘤免疫逃避的重要靶点(iwai y.等,proc.natl.acad.sci.u.s.a.99:12293-12297(2002);strome s.e.等,cancer res.,63:6501-6505(2003))。通过免疫组织化学评估活组织检查,已经在人的很多原发性肿瘤中发现pd-1(在肿瘤浸润淋巴细胞上)和/或pd-l1在肿瘤细胞上的表达。这样的组织包括肺癌、肝癌、卵巢癌、宫颈癌、皮肤癌、结肠癌、神经胶质瘤、膀胱癌、乳腺癌、肾癌、食道癌、胃癌、口腔鳞状细胞癌、尿道上皮细胞癌和胰腺癌以及头颈肿瘤等。由此可见,阻断pd-1/pd-l1的相互作用可以提高肿瘤特异性t细胞的免疫活性,有助于免疫系统清除肿瘤细胞,因此pd-1和pd-l1成为开发肿瘤免疫治疗药物的热门靶点。
5.双特异性抗体是指能同时特异性结合两种抗原或两种表位的抗体分子。根据对称
性,双特异性抗体可以分为结构对称的和不对称的分子。根据结合位点的多少,双特异性抗体可以分为二价、三价、四价和多价分子。双特异性抗体正在逐步成为一类新的治疗性抗体,可以用于治疗各种炎性疾病、癌症和其它疾病。
技术实现要素:
6.本发明提供了一种抗pd1
×
pdl1的双特异性抗体。
7.因此,本发明的第一个目的在于提供一种抗pd1
×
pdl1的双特异性抗体。
8.本发明的第二个目的在于提供一种编码所述的双特异性抗体的分离的核苷酸。
9.本发明的第三个目的在于提供一种包含所述的核苷酸的表达载体。
10.本发明的第四个目的在于提供一种包含所述的表达载体的宿主细胞。
11.本发明的第五个目的在于提供所述的双特异性抗体的制备方法。
12.本发明的第六个目的在于提供包含所述的双特异性抗体的药物组合物。
13.本发明的第七个目的在于提供所述的双特异性抗体或所述的药物组合物在制备治疗癌症的药物中的用途。
14.本发明的第八个目的在于提供所述的双特异性抗体或所述的药物组合物用于治疗癌症的方法。
15.为了达到上述目的,本发明提供了以下技术方案:
16.本发明的第一个方面提供了一种抗pd1
×
pdl1的双特异性抗体,包含:
17.(a)两条多肽链,所述的多肽链从n末端至c末端包含vh-pdl1-ch1-ch2-ch3-linker2-vl-pd1-linker1-vh-pd1,其中,所述的vh-pdl1为结合pd-l1的重链可变区,所述的ch1-ch2-ch3为重链恒定区,所述的linker2为3个ggggs,所述的vl-pd1为结合pd-1的轻链可变区,所述的linker1为4个ggggs,所述的vh-pd1为结合pd-1的重链可变区,和
18.(b)两条轻链,所述的轻链从n末端至c末端包含vl-pdl1-cl,其中,所述的vl-pdl1为结合pd-l1的轻链可变区,所述的cl为轻链恒定区,
19.其中,所述的vh-pdl1与所述的vl-pdl1形成特异性结合pd-l1的抗原结合位点,所述的vl-pd1与所述的vh-pd1形成特异性结合pd-1的抗原结合位点。
20.根据本发明的优选实施例,所述的vh-pdl1包含氨基酸序列如seq id no:1-3所示的重链cdr,所述的vl-pdl1包含氨基酸序列如seq id no:4-6所示的轻链cdr,所述的vh-pd1包含氨基酸序列如seq id no:7-9所示的重链cdr,所述的vl-pd1包含氨基酸序列如seq id no:10-12所示的轻链cdr。
21.根据本发明的优选实施例,所述的vh-pdl1具有如seq id no:13所示的氨基酸序列,所述的vl-pdl1具有如seq id no:14所示的氨基酸序列,所述的vh-pd1具有如seq id no:15所示的氨基酸序列,所述的vl-pd1具有如seq id no:16所示的氨基酸序列。
22.根据本发明的优选实施例,所述的多肽链具有如seq id no:17所示的氨基酸序列,所述的轻链具有如seq id no:18所示的氨基酸序列。
23.根据本发明,所述的重链恒定区包括igg1、igg2、igg3或igg4重链恒定区,所述的轻链恒定区包括κ或λ轻链恒定区。
24.本发明的第二个方面提供了一种分离的核苷酸,所述的核苷酸编码所述的双特异性抗体。
25.本发明的第三个方面提供了一种表达载体,所述的表达载体含有如上所述的核苷酸。
26.本发明的第四个方面提供了一种宿主细胞,所述的宿主细胞含有如上所述的表达载体。
27.本发明的第五个方面提供了所述的双特异性抗体的制备方法,所述方法包含以下步骤:
28.(a)在表达条件下,培养如上所述的宿主细胞,从而表达所述的双特异性抗体;
29.(b)分离并纯化(a)所述的双特异性抗体。
30.本发明的第六个方面提供了一种药物组合物,所述药物组合物含有如上所述的双特异性抗体和药学上可接受的载体。
31.本发明的第七个方面提供了如上所述的双特异性抗体或如上所述的药物组合物在制备治疗癌症的药物中的用途。
32.根据本发明,所述癌症选自由以下组成的组:黑色素瘤、肾癌、肺癌、肝癌、胃癌、淋巴癌、乳腺癌、结直肠癌、白血病、前列腺癌、骨髓癌及其它赘生性恶性疾病等。
33.发明的第八个方面提供了一种治疗癌症的方法,包括向有需要的受试者施用如上所述的双特异性抗体或如上所述的药物组合物。
34.根据本发明,所述癌症选自由以下组成的组:黑色素瘤、肾癌、肺癌、肝癌、胃癌、淋巴癌、乳腺癌、结直肠癌、白血病、前列腺癌、骨髓癌及其它赘生性恶性疾病等。
35.有益效果:本发明提供了一种抗pd1
×
pdl1的双特异性抗体,实验结果显示该双抗能够较好的保持各自单抗的活性,并且能够同时特异性结合pd-1和pd-l1两个靶点,具有良好的理化性质。
附图说明
36.图1为本发明的抗pd1
×
pdl1双抗分子的结构示意图。
37.图2为抗pd1
×
pdl1双抗的hplc检测图谱和sds-page检测结果,其中,图2a为hplc检测图谱,图2b为sds-page检测结果。
38.图3为elisa检测抗pd1
×
pdl1双抗分别与pd-1和pd-l1的结合结果,其中,图3a为与pd-1的结合结果,图3b为与pd-l1的结合结果。
39.图4为双特异elisa检测抗pd1
×
pdl1双抗同时与pd-1和pd-l1的结合结果。
40.图5为facs检测抗pd1
×
pdl1双抗分别与pd-1/cho和n87-pdl1细胞的结合结果,其中,图5a为与pd-1/cho细胞的结合结果,图5b为与n87-pdl1细胞的结合结果。
41.图6为抗pd1
×
pdl1双抗阻断细胞上pd1/pd-l1的活性结果。
具体实施方式
42.本发明中,术语“抗体(antibody,缩写ab)”和“免疫球蛋白g(immunoglobulin g,缩写igg)”是有相同结构特征的约150000道尔顿的异四聚糖蛋白,其由两条相同的轻链(l)和两条相同的重链(h)组成。每条轻链通过一个共价二硫键与重链相连,而不同免疫球蛋白同种型(isotype)的重链间的二硫键数目不同。每条重链和轻链也有规则间隔的链内二硫键。每条重链的一端有可变区(vh),其后是恒定区,重链恒定区由三个结构域ch1、ch2、以及
ch3构成。每条轻链的一端有可变区(vl),另一端有恒定区,轻链恒定区包括一个结构域cl;轻链的恒定区与重链恒定区的ch1结构域配对,轻链的可变区与重链的可变区配对。恒定区不直接参与抗体与抗原的结合,但是它们表现出不同的效应功能,例如参与抗体依赖的细胞介导的细胞毒性作用(adcc,antibody-dependent cell-mediated cytotoxicity)等。重链恒定区包括igg1、igg2、igg3、igg4亚型;轻链恒定区包括κ(kappa)或λ(lambda)。抗体的重链和轻链通过重链的ch1结构域和轻链的cl结构域之间的二硫键共价连接在一起,抗体的两条重链通过铰链区之间形成的多肽间二硫键共价连接在一起。
43.本发明中,术语“双特异性抗体(双抗)”是指能同时特异性结合两种抗原(靶点)或两种表位的抗体分子。
44.本发明中,术语“单克隆抗体(单抗)”指从一类基本均一的群体获得的抗体,即该群体中包含的单个抗体是相同的,除少数可能存在的天然发生的突变外。单克隆抗体高特异性地针对单个抗原位点。而且,与常规多克隆抗体制剂(通常是具有针对不同抗原决定簇的不同抗体的混合物)不同,各单克隆抗体是针对抗原上的单个决定簇。除了它们的特异性外,单克隆抗体的好处还在于它们可以通过杂交瘤培养来合成,不会被其它免疫球蛋白污染。修饰语“单克隆”表示了抗体的特性,是从基本均一的抗体群中获得的,这不应被解释成需要用任何特殊方法来生产抗体。
45.本发明中,术语“fab”和“fc”是指木瓜蛋白酶可将抗体裂解为两个完全相同的fab段和一个fc段。fab段由抗体的重链的vh和ch1以及轻链的vl和cl结构域组成。fc段即可结晶片段(fragment crystallizable,fc),由抗体的ch2和ch3结构域组成。fc段无抗原结合活性,是抗体与效应分子或细胞相互作用的部位。
46.本发明中,术语“scfv”为单链抗体(single chain antibody fragment,scfv),由抗体重链可变区和轻链可变区通过15~25个氨基酸的短肽(linker)连接而成。
47.本发明中,术语“可变”表示抗体中可变区的某些部分在序列上有所不同,它形成各种特定抗体对其特定抗原的结合和特异性。然而,可变性并不均匀地分布在整个抗体可变区中。它集中于重链可变区和轻链可变区中称为互补决定区(complementarity-determining region,cdr)或超变区中的三个片段中。可变区中较保守的部分称为框架区(frame region,fr)。天然重链和轻链的可变区中各自包含四个fr区,它们大致上呈β-折叠构型,由形成连接环的三个cdr相连,在某些情况下可形成部分β折叠结构。每条链中的cdr通过fr区紧密地靠在一起并与另一链的cdr一起形成了抗体的抗原结合部位(参见kabat等,nih publ.no.91-3242,卷i,647-669页(1991))。
48.本发明中,术语“抗”、“结合”、“特异性结合”是指两分子间的非随机的结合反应,如抗体和其所针对的抗原之间的反应。通常,抗体以小于大约10-7
m,例如小于大约10-8
m、10-9
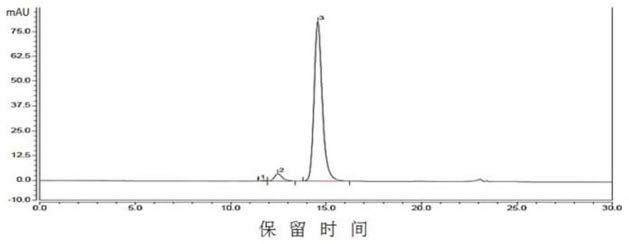
m、10-10
m、10-11
m或更小的平衡解离常数(kd)结合该抗原。本发明中,术语“kd”是指特定抗体-抗原相互作用的平衡解离常数,其用于描述抗体与抗原之间的结合亲和力。平衡解离常数越小,抗体-抗原结合越紧密,抗体与抗原之间的亲和力越高。例如,使用表面等离子体共振术(surface plasmon resonance,缩写spr)在biacore仪中测定抗体与抗原的结合亲和力或使用elisa测定抗体与抗原结合的相对亲和力。
49.本发明中,术语“表位”是指与抗体特异性结合的多肽决定簇。本发明的表位是抗原中被抗体结合的区域。
50.本发明中,术语“表达载体”可以为ptt5,psectag系列,pcgs3系列,pcdna系列载体等,以及其它用于哺乳动物表达系统的载体等,表达载体中包括连接有合适的转录和翻译调节序列的融合dna序列。
51.本发明中,术语“宿主细胞”是指适用于表达上述表达载体的细胞,可以是真核细胞,如哺乳动物或昆虫宿主细胞培养系统均可用于本发明的融合蛋白的表达,cho(中国仓鼠卵巢,chinese hamster ovary),hek293,cos,bhk以及上述细胞的衍生细胞均可适用于本发明。
52.本发明中,术语“药物组合物”是指本发明的双特异性抗体可以和药学上可以接受的载体一起组成药物制剂组合物从而更稳定地发挥疗效,这些制剂可以保证本发明公开的双特异性抗体的氨基酸核心序列的构象完整性,同时还保护蛋白质的多官能团防止其降解(包括但不限于凝聚、脱氨或氧化)。
53.以下实施例中使用的实验材料说明如下:
54.pcdna
tm
3.4vector:购自thermo fisher公司,货号a14697;
55.cho细胞:购自thermo fisher公司,货号a29133;
56.293e细胞:来自nrc biotechnology research institute;
57.pd-1/pd-l1 blockade bioassay,propagation model:购自promega公司,货号j1252;
58.人胃癌细胞株nci-n87:购自美国典型培养物保藏中心(atcc);
59.sd大鼠:购自上海灵畅生物科技有限公司。
60.以下实施例中使用的实验试剂说明如下:
61.抗pd-l1单抗:根据pct/cn2020/090442中的序列制备;
62.抗pd-1单抗:根据wo2018/137576中的序列制备;
63.hrp标记的鼠抗人fab抗体:购自sigma,货号a0293;
64.hrp标记的anti-6
×
his抗体:购自abcam,货号ab178563;
65.羊抗人igg-fitc:购自sigma,货号f4143;
66.pbs:购自生工生物工程(上海)股份有限公司,货号b548117;
67.pbst:pbs+0.05%tween 20;
68.bsa:购自生工生物工程(上海)股份有限公司,货号a60332;
69.fbs:购自gibco,货号10099;
70.tmb:购自bd公司,货号555214;
71.bio-glo luciferase assay system:购自promega,货号g7940。
72.以下实施例中使用的实验仪器说明如下:
73.pcr仪:购自biorad,货号c1000 touch thermal cycler;
74.hitrap mabselectsure柱:购自ge公司,货号11-0034-95;
75.beckman coulter cytoflex流式细胞仪:购自beckman公司;
76.spectramax i3x酶标仪:购自molecular devices公司。
77.以下实施例、实验例是对本发明进行进一步的说明,不应理解为对本发明的限制。实施例不包括对传统方法的详细描述,如那些用于构建载体和质粒的方法,将编码蛋白的基因插入到这样的载体和质粒的方法或将质粒引入宿主细胞的方法。这样的方法对于本领
域中具有普通技术的人员是众所周知的,并且在许多出版物中都有所描述,包括sambrook,j.,fritsch,e.f.and maniais,t.(1989)molecular cloning:a laboratory manual,2nd edition,cold spring harbor laboratory press。
78.实施例1抗pd1
×
pdl1双抗分子的构建
79.本发明采用了将抗人pd-1单抗mab1-25-hu(序列来源于wo2018/137576)的scfv(vl-linker1-vh,linker1为4个ggggs),通过linker2(为3个ggggs),串联在抗人pd-l1单抗m8(序列来源于pct/cn2020/090442)的重链c-末端的方式,构建了抗pd1
×
pdl1双特异性抗体,命名为anti-pd1
×
pdl1 bsab。结构如图1所示。
80.通过基因合成及常规的分子克隆方法获得双特异性抗体及其对应的单克隆抗体的重链和轻链表达载体,其对应的氨基酸序列如表1所示,其中cdr根据kabat规则编码。
81.表1、本发明的抗体的序列信息
82.seq id no:序列名称1抗pd-l1单抗的重链互补决定区h-cdr1的氨基酸序列2抗pd-l1单抗的重链互补决定区h-cdr2的氨基酸序列3抗pd-l1单抗的重链互补决定区h-cdr3的氨基酸序列4抗pd-l1单抗的轻链互补决定区l-cdr1的氨基酸序列5抗pd-l1单抗的轻链互补决定区l-cdr2的氨基酸序列6抗pd-l1单抗的轻链互补决定区l-cdr3的氨基酸序列7抗pd-1单抗的重链互补决定区h-cdr1的氨基酸序列8抗pd-1单抗的重链互补决定区h-cdr2的氨基酸序列9抗pd-1单抗的重链互补决定区h-cdr3的氨基酸序列10抗pd-1单抗的轻链互补决定区l-cdr1的氨基酸序列11抗pd-1单抗的轻链互补决定区l-cdr2的氨基酸序列12抗pd-1单抗的轻链互补决定区l-cdr3的氨基酸序列13抗pd-l1单抗的重链可变区的氨基酸序列14抗pd-l1单抗的轻链可变区的氨基酸序列15抗pd-1单抗的重链可变区的氨基酸序列16抗pd-1单抗的轻链可变区的氨基酸序列17anti-pd1
×
pdl1 bsab的多肽链的氨基酸序列18抗pd-l1单抗的轻链的氨基酸序列19抗pd-l1单抗的重链的氨基酸序列20抗pd-1单抗的重链的氨基酸序列21抗pd-1单抗的轻链的氨基酸序列
83.实施例2抗pd1
×
pdl1双抗的表达与纯化
84.将抗pd1
×
pdl1双抗的重链和轻链的dna片段分别亚克隆到pcdn3.4载体中,抽提重组质粒共转染cho细胞和/或293e细胞,细胞培养5-7天后,将培养液通过高速离心、微孔滤膜过滤后,上样至hitrap mabselectsure柱,用含有100mm柠檬酸,ph3.5的洗脱液洗脱蛋白,并透析至ph7.4的pbs。
85.将纯化后的蛋白用hplc检测,抗pd1
×
pdl1双抗的hplc-sec检测图谱如图2a所示,
双抗单体纯度达到96%以上。sds-page检测结果如图2b所示,泳道1与2为抗pd1
×
pdl1双抗的还原与非还原sds-page,泳道3与4为抗pd-l1单抗的还原与非还原sds-page。双抗理论分子量为197kd。
86.实施例3酶联免疫吸附法(elisa)检测抗pd1
×
pdl1双抗对抗原的亲和力
87.实施例3.1与pd-1抗原的亲和力检测
88.为了检测抗pd1
×
pdl1双抗与pd-1抗原的亲和力,用ph7.4的pbs缓冲液将pd1-ecd-hfc蛋白(根据uniprot提供的序列(序列号q15116)合成胞外域基因并在其n端加上信号肽序列,c末端加上hfc,通过ecori和hindiii两个酶切位点分别构建到表达载体中,转染hek-293e细胞表达并纯化获得)稀释至200ng/ml,然后100μl/孔加入elisa板中;4℃孵育过夜;次日用pbst洗板两次;每孔加入pbst+1%bsa进行封闭,37℃封闭1h;用pbst洗板两次;然后加入用pbs+1%bsa梯度稀释的待检测抗体,抗pd-1单抗作为阳性对照,起始浓度为100nm,逐级3倍稀释12个梯度。37℃孵育1h;pbst洗板两次,加入二抗hrp标记的鼠抗人fab,37℃再孵育40min;pbst洗板三次并拍干,每孔加入100μl tmb,室温(20
±
5℃)避光放置5分钟;每孔加入50μl的2m h2so4终止液终止底物反应,酶标仪450nm处读取od值,graphpad prism进行数据分析,作图并计算ec
50
。
89.实验结果如图3a所示,抗pd-1单抗和抗pd1
×
pdl1双抗与pd-1抗原结合的ec
50
分别为0.29nm和0.30nm,两者亲和力相当。
90.实施例3.2与pd-l1抗原的亲和力检测
91.为了检测抗pd1
×
pdl1双抗与pd-l1抗原的亲和力,用ph7.4的pbs缓冲液将pdl1-ecd-his蛋白(根据ncbi提供的序列(ncbi登记号为np_054862.1)合成pd-l1胞外域基因并在其n端加上信号肽序列,c末端加上6
×
his标签,通过ecori和hindiii两个酶切位点分别构建到表达载体中,转染hek-293e细胞表达并纯化获得)稀释至1000ng/ml,然后100μl/孔加入elisa板中;4℃孵育过夜;次日用pbst洗板两次;每孔加入pbst+1%bsa进行封闭,37℃封闭1h;用pbst洗板两次;然后加入用pbs+1%bsa梯度稀释的待检测抗体,抗pd-l1单抗作为阳性对照,起始浓度为100nm,逐级3倍稀释12个梯度。37℃孵育1h;pbst洗板两次,加入二抗hrp标记的鼠抗人fab,37℃再孵育40min;pbst洗板三次并拍干,每孔加入100μl tmb,室温(20
±
5℃)避光放置5分钟;每孔加入50μl 2m h2so4终止液终止底物反应,酶标仪450nm处读取od值,graphpad prism进行数据分析,作图并计算ec
50
。
92.实验结果如图3b所示,抗pd-l1单抗及抗pd1
×
pdl1双抗与pd-l1抗原结合的ec
50
为0.27nm和0.29nm,两者亲和力相当。
93.实施例4双特异elisa检测抗pd1
×
pdl1双抗同时结合两个抗原的能力
94.为了检测抗pd1
×
pdl1双抗同时结合pd-1抗原和pd-l1抗原的能力,用ph7.4的pbs缓冲液将pd1-ecd-hfc蛋白稀释至200ng/ml,然后100μl/孔加入elisa板中;4℃孵育过夜;次日用pbst洗板两次;每孔加入pbst+1%bsa进行封闭,37℃封闭1h;用pbst洗板两次;然后加入用pbs+1%bsa梯度稀释的待检测抗体,起始浓度为100nm,逐级3倍稀释12个梯度。37℃孵育1h;pbst洗板两次,再加入ph7.4的pbs稀释的1000ng/ml的pdl1-ecd-his,100μl/孔加入elisa板中。37℃孵育1h;pbst洗板两次,加入二抗hrp-anti-his,37℃再孵育40min;pbst洗板三次并拍干,每孔加入100μl tmb,室温(20
±
5℃)避光放置5分钟;每孔加入50μl 2m h2so4终止液终止底物反应,酶标仪450nm处读取od值,graphpad prism进行数据分析,作图
并计算ec
50
。
95.实验结果如图4所示,抗pd1
×
pdl1双抗的ec
50
为0.36nm,而抗pd-1单抗和抗pd-l1单抗没有同时结合这两种抗原的能力。
96.实施例5检测抗pd1
×
pdl1双抗对靶细胞的结合亲和力
97.细胞表面表达pd-1的cho稳转细胞作为靶细胞,通过流式细胞仪测定抗pd1
×
pdl1双抗对该细胞的结合亲和力。用含有0.5%bsa的pbs洗涤三次细胞,每次300g离心5分钟,弃上清。0.5%bsa的pbs重悬细胞,细胞密度为1
×
106细胞/ml,100μl/孔加入96孔板。将抗pd1
×
pdl1双抗及阳性对照抗pd-1单抗200nm起始,逐级稀释11个梯度,100μl/孔加入96孔板,4℃孵育1h。pbs洗涤细胞两次以去除未结合的待检抗体。再加入100μl的羊抗人igg-fitc,于4℃孵育30分钟。300g离心5分钟,pbs洗涤细胞两次以去除未结合的二抗。最后将细胞重悬在200μl pbs中,通过beckman coulter cytoflex流式细胞仪测定双抗对该细胞的结合亲和力。所得数据通过graphpad prism软件拟合分析。实验结果如图5a所示,抗pd-1单抗和抗pd1
×
pdl1双抗的ec
50
分别为0.64nm和1.43nm,两者亲和力相当。
98.n87-pdl1为本实验室采用慢病毒转染法,给nci-n87转染了pd-l1构建的稳转细胞株。取对数生长期的n87-pdl1用胰酶消化后,用含有0.5%bsa的pbs洗涤三次,每次300g离心5分钟,弃上清。0.5%bsa的pbs重悬细胞,细胞密度为1
×
106细胞/ml,100μl/孔加入96孔板。将抗pd1
×
pdl1双抗及阳性对照抗pd-l1单抗稀释为120nm,逐级稀释11个梯度,100μl/孔加入96孔板,与n87-pdl1细胞混合均匀。其余方法同上。实验结果如图5b所示,抗pd-l1单抗的ec
50
为0.11nm,抗pd1
×
pdl1双抗的ec
50
为0.15nm,两者亲和力相当。
99.实施例6抗pd1
×
pdl1双抗阻断pd1/pd-l1的细胞水平的活性
100.本实验采用promega的pd-1/pd-l1 blockade bioassay,propagation model及方法。
101.取对数期生长的pd-l1 aapc/cho-k1,胰酶消化成单个细胞后转移到白色底透96孔板,100μl/孔,40000细胞/孔,置于37℃,5%co2,孵育过夜。取抗pd1
×
pdl1双抗、抗pd-l1单抗、抗pd-1单抗稀释成2
×
工作液浓度,起始浓度为100nm,逐级3倍梯度。取密度在1.4-2
×
106细胞/ml,细胞活率在95%以上的pd1效应细胞,胰酶消化成1.25
×
106细胞/ml的单细胞悬液。取前一天铺好的pd-l1 aapc/cho-k1细胞,弃掉上清,加入40μl梯度稀释的待检抗体工作液;再加入等体积的pd1效应细胞。置于37℃,5%co2,孵育6小时。每孔加入80μl检测试剂bio-glo。室温孵育10分钟后,用spectramax i3读取luminescence。用graphpad prism进行数据分析,作图并计算ic
50
。
102.实验结果如图6所示,anti-pd1
×
pdl1 bsab、抗pd-l1单抗、抗pd-1单抗的ic
50
分别为0.24nm、0.42nm、1.60nm,双抗与抗pd-l1单抗的ic
50
接近,抗pd-1单抗的ic
50
偏大,但其高平台稍高。
103.实施例7抗pd1
×
pdl1双抗的药代动力学研究
104.取每组4只sd大鼠,体重200g左右,每只大鼠通过尾静脉注射剂量为2mg的抗体。给药后取血时间点为:0h,3h,24h,48h,96h,168h,336h,504h。眼眶取血,血液自然凝固后8000rpm/min离心取血清。
105.抗pd1
×
pdl1双抗的血清中药物浓度采用以下方法检测:
106.1)protein a包被elisa板,检测抗体fab段。用protein a包被,包被量为100ng/
孔,4℃过夜;次日pbst洗板两次,然后用pbs+2%bsa于37℃封闭2小时。pbst洗板两次。抗pd1
×
pdl1双抗的标准品从1000ng/ml起始,逐级两倍稀释12个梯度。大鼠血清样品1000-4000倍稀释。以上两组样品加入封闭后的elisa板,孵育1小时;pbst洗板两次后加入hrp标记的鼠抗人fab抗体,37℃放置30分钟;pbst洗板3次后,在吸水纸上尽量拍干残留液滴,每孔加入100μl的tmb,室温(20
±
5℃)避光放置5分钟;每孔加入50μl 2m的h2so4终止液终止底物反应,酶标仪450nm处读取od值。计算所得的半衰期为275.6小时。
107.2)pd1-ecd-hfc包被elisa板,20ng/孔。其余方法同上。计算所得的半衰期为303.5小时。
108.3)pdl1-ecd-hfc包被elisa板,100ng/孔。其余方法同上。计算所得的半衰期为307小时。
109.如表2-4所示,由以上三组elisa结果,计算的半衰期结果相近,均为300小时左右,说明分析数据可靠。
110.表2、protein a包板elisa结果
111.实验组半衰期(小时)最高浓度(μg/ml)1247.504331702316.484821663273.295921504265.20196164
112.表3、pd1-ecd-hfc包板elisa结果
113.实验组半衰期(小时)最高浓度(μg/ml)1299.467771962348.737962023295.38371704270.42874174
114.表4、pdl1-ecd-hfc包板elisa结果
115.实验组半衰期(小时)最高浓度(μg/ml)1280.1546316623361523320.979121464291.3996166
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1