一种促进大鼠放射状胶质细胞向神经元分化的方法与流程
本发明属于细胞培养技术领域,具体涉及一种促进大鼠放射状胶质细胞向神经元分化的方法。
背景技术:
神经退行性疾病的重要病理学基础是神经元在局部区域变性坏死,造成神经环路破坏或神经递质丢失。目前,临床上治疗这类疾病的主要方法是补充缺少的神经递质,但这并不能从根本上解决神经元变性坏死的问题。利用具有多向分化潜能的神经干细胞(neuralstemcells,nscs)进行替代治疗被认为是较为理想的方法,可是在体内、外的自然分化条件下,nscs分化成神经元的数量极少,这就需要引导nscs分化成足够量的神经元,以满足治疗的需要。研究表明,在胚胎时期大脑皮质中大量分布的放射状胶质细胞(radialglialcells,rgcs)属于初级nscs,是神经元和神经胶质细胞共同的前体细胞,可以作为研究nscs分化的理想细胞模型。
技术实现要素:
本部分的目的在于概述本发明的实施例的一些方面以及简要介绍一些较佳实施例。在本部分以及本申请的说明书摘要和发明名称中可能会做些简化或省略以避免使本部分、说明书摘要和发明名称的目的模糊,而这种简化或省略不能用于限制本发明的范围。
鉴于上述的技术缺陷,提出了本发明。本发明提供了将大鼠胚胎大脑皮质来源的放射状胶质细胞分化为成熟神经元的方法。
因此,作为本发明其中一个方面,本发明克服现有技术中存在的不足,提供一种促进大鼠放射状胶质细胞向神经元分化的方法。
为解决上述技术问题,本发明提供了如下技术方案:一种促进大鼠胚胎放射状胶质细胞向神经元分化的方法,其特征在于:包括,
获取胎鼠大脑皮质的细胞悬液,制备rgcs单细胞;
将所述rgcs单细胞接种于培养板,用rgcs培养液培养过夜,用rgcs诱导分化液继续培养即可。
作为本发明所述的促进大鼠胚胎放射状胶质细胞向神经元分化的方法的优选方案,其中:所述制备rgcs单细胞,其为用rgcs培养液重悬细胞,形成肉眼可见的悬浮的细胞球后更换rgcs培养液,继续培养5~7d,得到细胞球;用accutase酶处理所述细胞球,消化成单个细胞,继续悬浮培养,传代即可。
作为本发明所述的促进大鼠胚胎放射状胶质细胞向神经元分化的方法的优选方案,其中:所述培养,其按1×105个/ml的密度接种于10mlrgcs培养液中。
作为本发明所述的促进大鼠胚胎放射状胶质细胞向神经元分化的方法的优选方案,其中:所述传代,其为传代3代以上。
作为本发明所述的促进大鼠胚胎放射状胶质细胞向神经元分化的方法的优选方案,其中:所述rgcs培养液,其每100ml为dmem/f12基础培养液97ml,egf2ug,bfgf2ug,b272ml,100×ps1ml。
作为本发明所述的促进大鼠胚胎放射状胶质细胞向神经元分化的方法的优选方案,其中:所述rgcs诱导分化液,其每100ml为dmem/f12基础培养液97ml,fbs2ml,bdnf2ug,gdnf2ug,100×ps1ml。
作为本发明所述的促进大鼠胚胎放射状胶质细胞向神经元分化的方法的优选方案,其中:所述将所述rgcs单细胞接种于培养板,其接种密度为按2×104个/孔的密度进行。
作为本发明所述的促进大鼠胚胎放射状胶质细胞向神经元分化的方法的优选方案,其中:所述获取胎鼠大脑皮质的细胞悬液,其为取孕14dsd大鼠1只,用复合麻醉剂chlorpent0.4ml/100g经腹腔麻醉后,无菌条件下打开腹腔,置于含有预冷dmem/f12基础培养液的培养皿中;取出胎鼠全脑组织,将皮质剪碎成1mm3大小的组织块;将皮质组织块移至盛有适量基础培养液的离心管内,机械轻轻吹打至无明显组织块,用无菌200目尼龙网过滤,收集过滤后的细胞悬液。
作为本发明所述的促进大鼠胚胎放射状胶质细胞向神经元分化的方法的优选方案,其中:相比于自然分化,所述方法可提高大鼠胚胎大脑皮质来源的放射状胶质细胞向神经元分化率的3倍以上。
本发明的有益效果:
本方法可明显提高大鼠胚胎大脑皮质来源的放射状胶质细胞向神经元分化的比例,可达自然分化率的3倍左右甚至更高。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其它的附图。其中:
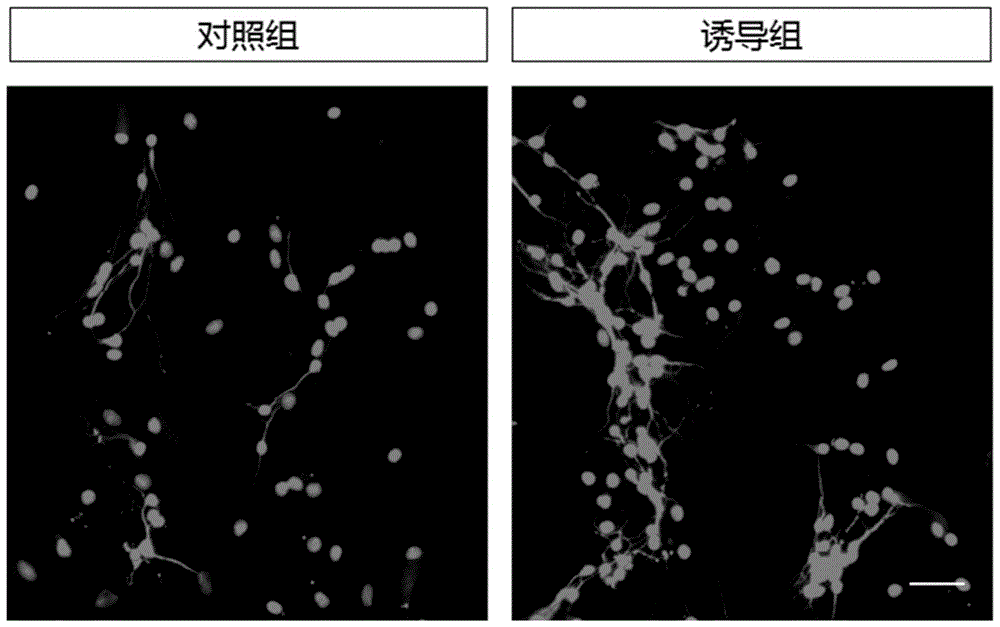
图1为rgcs诱导分化后map2的表达,其中红色示map2,蓝色示hoechst,bar=50um;
图2.为各组map2阳性细胞比例统计图。各组结果分别为:对照组:20.17±1.233%,诱导组:56.53±3.230%。与对照组相比,诱导组map2阳性细胞比例显著增多(*p<0.01),说明本诱导方法可有效促进rgcs向神经元分化。
具体实施方式
为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合具体实施例对本发明的具体实施方式做详细的说明。
在下面的描述中阐述了很多具体细节以便于充分理解本发明,但是本发明还可以采用其他不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似推广,因此本发明不受下面公开的具体实施例的限制。
其次,此处所称的“一个实施例”或“实施例”是指可包含于本发明至少一个实现方式中的特定特征、结构或特性。在本说明书中不同地方出现的“在一个实施例中”并非均指同一个实施例,也不是单独的或选择性的与其他实施例互相排斥的实施例。
本方法所使用的材料包括:
1.实验动物:
清洁级孕14dspraguedawley(sd)大鼠6只,由南通大学实验动物中心提供。
2.细胞培养试剂及配方:
(1)dulbecco'smodifiedeaglemedia(dmem)/f12基础培养液(thermo公司);
(2)b27无血清培养基添加剂(b27serum-freesupplements50×,b27,gibco公司);
(3)胎牛血清(fetalbovineserum,fbs,gibco公司);
(4)表皮生长因子(epidermalgrowthfactor,egf,sigma公司);
(5)碱性成纤维细胞生长因子(basicfibroblastgrowthfactor,bfgf,sigma公司);
(6)脑源性神经营养因子(brain-derivedneurotrophicfactor,bdnf,invitrogen公司);
(7)胶质细胞源性神经营养因子(glialcell-derivedneurotrophicfactor,gdnf,invitrogen公司);
(8)accutase细胞消化酶(sigma公司);
(9)100×青霉素链霉素混合液(penicillinandstreptomycin,ps,beyotime公司);
(10)多聚-l-赖氨酸(poly-l-lysine,pll,sigma公司):ddh2o配成终浓度为0.01%的稀释液,过滤后分装保存;
(11)rgcs培养液:dmem/f12基础培养液97ml,egf2ug,bfgf2ug,b272ml,100×ps1ml;
(12)rgcs诱导分化液:dmem/f12基础培养液97ml,fbs2ml,bdnf2ug,gdnf2ug,100×ps1ml。
3.细胞免疫荧光实验试剂:
(1)甲醇(上海振兴化工一厂);
(2)4%多聚甲醛(sangon公司);
(3)20×磷酸盐缓冲液(phosphatebufferedsalinepbs,pbs)(sangon公司):使用时加ddh2o稀释为1×pbs即可;
(4)山羊血清(sigma公司);
(5)tritonx-100(sangon公司);
(6)hoechst33342活细胞染色液(sigma公司):使用时用1×pbs按1:1000比例稀释即可;
(7)封闭液:山羊血清2ml,tritonx-1000.06ml,加1×pbs至20ml;
(8)抗体稀释液:同封闭液。
4.抗体:
(1)兔抗map2多克隆抗体(abcam公司);
(2)alexa
5.其他溶液配制:
chlorpent复合麻醉剂:水合氯醛4.25g,mgso42.12g,戊巴比妥钠0.886g,无水乙醇14.25ml,丙二醇33.8ml,加ddh2o至100ml。
本发明所述放射状胶质细胞可用以下方法制备:
1.取孕14dsd大鼠1只,用复合麻醉剂chlorpent0.4ml/100g经腹腔麻醉后,无菌条件下打开腹腔,取出胎鼠,置于含有预冷dmem/f12基础培养液的培养皿中;
2.在超净台上用眼科剪取出胎鼠全脑组织,分离大脑皮质,经基础培养液洗涤后,将皮质剪碎成1mm3大小的组织块;
3.将皮质组织块浸至基础培养液内,机械轻轻吹打,用无菌200目尼龙网过滤,收集过滤后的细胞悬液;
4.用rgcs培养液重悬细胞,按1×105个/ml的密度接种于含有10mlrgcs培养液的细胞培养瓶中,置于37℃、5%co2培养箱培养;
5.约5-7d后,培养瓶内形成肉眼可见的悬浮的细胞球,此时换一次rgcs培养液;
6.再过5-7d,用accutase酶将细胞球消化成单个细胞,继续予以悬浮培养,如此传3代后,方可用于后续实验。
本发明诱导rgcs向神经元分化的具体步骤为:
1.rgcs单细胞按2×104个/孔的密度接种于24孔培养板,按孔将细胞分为对照组和诱导组,每组设3个复孔,用rgcs培养液培养过夜;
2.用rgcs诱导分化液继续培养14d,期间每隔3d换液一次;
3.用细胞免疫荧光实验检测各组中成熟神经元的标记物map2。
细胞免疫荧光实验:
1.各孔细胞去除培养液,用100%甲醇-20℃孵育7m;
2.pbs漂洗3次,4%多聚甲醛室温下孵育10m;
3.pbs漂洗3次,封闭液室温下封闭1h;
4.pbs漂洗3次,一抗4℃孵育过夜;
5.pbs漂洗3次,二抗室温下孵育2h;
6.弃去二抗,pbs漂洗3次后,hoechst33342活细胞染色液室温下孵育10m,并用evosflauto全自动荧光显微成像系统检测map2的表达情况。
实施例1:
1.分离与培养大鼠放射状胶质细胞:
(1)取孕14dsd大鼠1只,用复合麻醉剂chlorpent0.4ml/100g经腹腔麻醉后,无菌条件下打开腹腔,置于含有预冷dmem/f12基础培养液的培养皿中;
(2)在超净台上取出胎鼠全脑组织,将皮质剪碎成1mm3大小的组织块;
(3)将皮质组织块移至盛有适量基础培养液的离心管内,机械轻轻吹打至无明显组织块,用无菌200目尼龙网过滤,收集过滤后的细胞悬液;
(4)用rgcs培养液重悬细胞,用台盼蓝染色计数后,按1×105个/ml的密度接种于含有10mlrgcs培养液的细胞培养瓶中,置于37℃、5%co2培养箱培养;
(5)约5-7d后,培养瓶内形成肉眼可见的悬浮的细胞球,此时换一次rgcs培养液;
(6)再过5-7d,用accutase酶将细胞球消化成单个细胞(消化温度控制在37℃,可置于恒温培养箱内进行,时间不超过20min),继续予以悬浮培养,如此传3代。
2.诱导放射状胶质细胞向神经元分化:
(1)rgcs单细胞按2×104个/孔的密度接种于24孔培养板,按孔将细胞分为对照组和诱导组,每组设3个复孔,用rgcs培养液培养过夜;
(2)用rgcs诱导分化液继续培养14d,期间每隔3d换液一次;
(3)用细胞免疫荧光实验检测各组中的map2。
3.细胞免疫荧光实验:
(1)各孔细胞去除培养液,经1×pbs漂洗3次后,用100%甲醇-20℃孵育7m;
(2)pbs漂洗3次,4%多聚甲醛室温下孵育10m;
(3)pbs漂洗3次,封闭液室温下封闭1h;
(4)pbs漂洗3次,map2抗体用抗体稀释液按1:200的比例稀释后,孵育细胞,4℃过夜;
(5)pbs漂洗3次,alexa
(6)弃去二抗,hoechst33342活细胞染色液室温下孵育10m,pbs漂洗3次后,用evosflauto全自动荧光显微成像系统检测map2的表达情况并拍照。
以上实验方法已重复实施三次。
作者在研究中体外培养14d大鼠胚胎大脑皮质来源的rgcs,通过改良培养环境,诱导rgcs分化为成熟的神经元,为利用nscs替代治疗神经系统疾病提供一定的实验依据及方法。
应说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,其均应涵盖在本发明的权利要求范围当中。
- 还没有人留言评论。精彩留言会获得点赞!