蛋白质生物工艺的制作方法
蛋白质生物工艺
背景技术:
技术领域
1.本公开涉及在蛋白质的纯化和/或浓缩期间,特别是在超滤和/或渗滤程序期间使水溶液中的该蛋白质稳定的方法。
2.相关技术的说明
3.生物制剂(衍生自蛋白质或其他生物衍生大分子的药物)已迅速成为一类重要的药物。由于蛋白质材料相对易碎的性质,开发具有治疗益处且足够稳定以经受住加工、分配和施用的生物活性物质仍然是一项重大挑战。蛋白质生物药物生产者和配制者采用各种工艺技术来纯化和制备生物制剂以获得其最终剂型。这些包括经常用于纯化和浓缩蛋白质或交换缓冲溶液的超滤(uf)和渗滤(df)程序。然而,超滤和渗滤也可能由于剪切应力、蛋白质与界面之间的接触或在超滤或渗滤操作期间滤膜表面更高的蛋白质浓度而导致蛋白质变性、聚集或沉淀。
4.表面活性剂通常用于基于蛋白质的生物制剂的最终配制品中,以保护生物制剂免受各种不稳定力(如界面和剪切力)的影响。虽然这样的力也存在于生物配制品开发的早期(如在上游和下游加工期间),但由于表面活性剂与加工设备的相互作用(例如,膜污染)以及难以可靠地去除蛋白质过滤、缓冲液交换和浓缩期间的表面活性剂,表面活性剂的使用受到限制。
5.聚山梨醇酯80是生物配制品中最常用的表面活性剂。callahan,stanley和li,journal of pharmaceutical sciences[药物科学杂志]103:862-869,2014证明了聚山梨醇酯80在超滤和渗滤工艺期间稳定蛋白质的能力,但也表明聚山梨醇酯80是经浓缩的并且不能有效地穿过超滤和渗滤过滤器。
[0006]
网站(https://www.researchgate.net/post/how_to_add_tween
[0007]
_80_after_protein_ultrafiltration_diafiltration)上表明吐温80(聚山梨醇酯80)被吸附到膜上,并且因此应在渗滤后添加。
[0008]
us 20130195888 a1教导并举例说明在渗滤工艺中以0.1mg/ml的浓度使用聚山梨醇酯80。虽然保护蛋白质免于聚集,但没有评估超滤浓缩步骤期间聚山梨醇酯80含量的变化。
[0009]
lei等人,biotechnol.prog.[生物技术进展],2013,第29卷,第6期表明当使用30kda(分子量截止值)超滤膜时,聚山梨醇酯20的组成和浓度发生变化。无论浓度是否高于或低于聚山梨醇酯20的临界胶束浓度,膜都会保留聚山梨醇酯20。
[0010]
经常在上游生物加工中将泊洛沙姆188用作产生生物制剂的细胞的稳定剂。然而,泊洛沙姆在蛋白a色谱法期间在超滤和渗滤工艺的上游被去除,并且因此不存在通过下游加工(如超滤和渗滤)来稳定生物制剂。这在xu等人,bioprocess biosyst eng[生物工艺与生物系统工程](2017)40:1317-1326中的实例中示出。
技术实现要素:
[0011]
本公开提供了在蛋白质的纯化和/或浓缩期间使水溶液中的该蛋白质稳定的方法。该方法包括以下步骤:(a)提供包含蛋白质和具有通式i的聚烷氧基脂肪酰基表面活性剂的水溶液
[0012][0013]
其中r
1-c(=o)是脂肪酰基基团,r2是h或者取代的或未取代的烃基基团,x1是s、o或nh,x2是s、o或nh,n是0或1-5的整数,r3是包含具有通式ii和iii的聚合单元的聚合基团
[0014][0015]
(b)使该水溶液与分离膜接触,以及(c)使该水溶液经受渗滤步骤以降低可溶性低分子量组分的浓度或向其中引入一种或多种可溶性低分子量组分和/或使该水溶液经受超滤步骤以浓缩该蛋白质以产生渗余物产物,该渗余物产物为包含该蛋白质的水溶液,从而具有式i的化合物减少了方法步骤(a)-(c)中该蛋白质的聚集并且从而该具有式i的化合物在步骤(c)中穿过该分离膜。
具体实施方式
[0016]
前面的一般性描述和以下详细描述仅是示例性的和解释性的,并且不限制如所附权利要求所限定的本发明。从以下详细说明并且从权利要求书中,任何一个或多个实施例的其他特征和益处将是明显的。
[0017]
如本文所用,术语“包含/包括(comprises/comprising)”、“包括(includes/including)”、“具有(has/having)”或其任何其他变体旨在覆盖非排他性的包含内容。例如,包括要素列表的工艺、方法、制品或设备不一定仅限于那些要素,而是可包括未明确列出的或此类工艺、方法、制品或设备所固有的其他要素。此外,除非有相反的明确说明,否则“或”是指包含性的或,而不是指排他性的或。例如,条件a或者b通过以下中的任一个满足:a为真(或存在)且b为假(或不存在),a为假(或不存在)且b为真(或存在),以及a和b均为真(或存在)。
[0018]
而且,使用“一个/种(a/an)”来描述本文所述的要素和组分。这样做只是为了方便并给出本发明范围的一般意义。此描述应当被解读为包括一个/种或至少一个/种,并且单数形式也包括复数形式,除非很明显其另有所指。
[0019]
除非另有定义,否则本文所用的所有技术和科学术语均具有与本发明所属领域普通技术人员所通常理解的相同含义。在冲突的情况下,则以本说明书,包括定义为准。尽管
与本文所述的那些类似或等同的方法和材料可用于本发明实施例的实践或测试中,但在下面描述了合适的方法和材料。此外,材料、方法和实例仅为说明性的并且不旨在是限制性的。
[0020]
当量、浓度、或者其他值或参数以范围、优选范围、或一系列上限优选值和/或下限优选值给出时,这应当被理解为特别公开了由任何范围上限或优选值与任何范围下限或优选值的任何配对所形成的所有范围,而不论该范围是否被单独公开。当在此列举数值范围时,除非另行说明,否则该范围旨在包含其端点、以及范围中的所有整数和分数。例如,当列举“1至10”的范围时,所列举的范围应解释为包括“1至8”、“3至10”、“2至7”、“1.5至6”、“3.4至7.8”、“1至2和7-10”、“2至4和6至9”、“1至3.6和7.2至8.9”、“1-5和10”、“2和8至10”、“1.5-4和8”等范围。
[0021]
虽然组合物和方法在本文中描述为“包含”各种组分或步骤,但除非另有说明,否则组合物和方法也可以“基本上由各种组分或步骤组成”或“由各种组分或步骤组成”。
[0022]
在提出下述实施例的详情之前,定义或阐明一些术语。
[0023]
如本文所用,术语“水溶液”意指一种溶液,其中溶剂包含基于该溶剂总重量的至少90wt%的水。在一些实施例中,溶剂进一步包含有机溶剂,例如丙酮、乙醇、dmso(二甲基亚砜)、2-丁酮、辛酸乙酯和月桂酸乙酯。在一些实施例中,溶剂包含水和有机溶剂、基本上由其组成或由其组成。在一些实施例中,溶剂包含基于该溶剂总重量的至少92wt%、或至少94wt%、或至少96wt%、或至少98wt%、或至少99wt%的水。在一些实施例中,溶剂基本上由水组成或由水组成。在一些实施例中,溶剂是水。在一些实施例中,水溶液基本上不含有机溶剂。在一些实施例中,水溶液的液体介质基本上由水组成或由水组成。
[0024]
如本文所用,术语“超滤”意指一种工艺,其中蛋白质的溶液穿过半透膜(即分离膜),该半透膜保留蛋白质(渗余物)同时允许溶剂和溶解的低分子量组分如盐和糖(滤液)穿过。以这种方式,蛋白质溶液变得更加浓缩。
[0025]
如本文所用,术语“渗滤”意指过滤和溶剂交换工艺,其中通过使用半透膜(即分离膜)过滤蛋白质的溶液,该半透膜保留蛋白质(渗余物)同时允许一部分溶剂和溶解的低分子量组分如盐和糖(滤液)穿过。损失的溶剂(即穿过分离膜的溶剂)被新溶剂替代,该新溶剂任选地含有溶解在其中的一种或多种新的低分子量组分,并且通过使用半透膜(即分离膜)使得到的新溶液再次进行过滤,该半透膜保留蛋白质(渗余物)同时允许一部分溶剂和溶解的低分子量组分如盐和糖(滤液)穿过。
[0026]
渗滤可以连续或分批进行。在一些实施例中,渗滤以连续模式进行,并且以与产生滤液相同的速率将新溶剂连续添加到渗余物中。在此类实施例中,可降低蛋白质的溶液中溶解的低分子量组分如盐或糖的浓度,而基本上不改变溶液中蛋白质的浓度。在一些实施例中,新溶剂包含溶解在其中的低分子量组分,如盐和糖,这些低分子量组分与蛋白质的原始溶液中含有的低分子量组分不同。在此类实施例中,渗滤可用于将一种或多种低分子量组分引入蛋白质溶液中。
[0027]
如本文所用,术语“分离膜”意指在超滤(uf)或渗滤(df)中用于基于水溶液中的组分的分子量或尺寸分离这些组分的多孔膜或过滤器。保留大于膜中的孔的分子(如蛋白质),并且小于这些孔的低分子量化合物穿过。
[0028]
如本文所用,术语“表面活性剂/蛋白质浓度比”意指水溶液中具有式i的聚烷氧基
脂肪酰基表面活性剂的浓度与蛋白质的浓度的比率。在本公开中,将具有式i的聚烷氧基脂肪酰基表面活性剂的浓度和蛋白质的浓度表示为重量体积比(例如,mg/ml)。
[0029]
聚烷氧基化合物是含有一个或多个具有结构-(-a-o)
m-的基团的化合物,其中m是3或更大,并且a是未取代的烷基基团。基团a可以是直链、支链、环状或其组合。各种-(-a-o)-基团中的各种a基团可以彼此相同或不同。
[0030]
脂肪族化合物是含有一个或多个脂肪族基团的化合物。脂肪族基团是含有8个或更多个碳原子的基团,每个碳原子与该基团中的一个或多个其他碳原子键合。聚烷氧基脂肪族化合物是既是聚烷氧基化合物又是脂肪族化合物的化合物。
[0031]
数均分子量定义为样品的总重量除以样品中分子的数量。
[0032]
烃基基团是含有氢原子和碳原子的基团。未取代的烃基基团仅含有氢原子和碳原子。取代的烃基基团含有一个或多个取代基基团,该取代基基团含有一个或多个除氢和碳以外的原子。
[0033]
蛋白质是其中聚合单元是氨基酸的聚合物。氨基酸通过肽键键合在一起。蛋白质含有一种或多种氨基酸残基的20个或更多个聚合单元。术语蛋白质包括线性多肽链以及含有多肽链的更复杂的结构。
[0034]
如果蛋白质的分子以溶解的单个分子的形式分布在整个连续的液体介质中,则认为该蛋白质是呈液体介质中的溶液(或同义地,溶解在液体介质中)。如果连续液体介质含有的水量基于该连续液体介质的重量为60重量%或更多,则认为蛋白质溶解在水中。
[0035]
如果ph值为4.5至8.5,使得当化学基团在该ph值下与水接触时,存在的那些化学基团的50摩尔%或更多为离子形式,则该化学基团是离子基团。
[0036]
缓冲液为(i)一种化合物,该化合物具有接受质子以形成该化合物的共轭酸的能力并且该化合物的共轭酸具有小于10的pka,或(ii)一种化合物,该化合物具有释放质子的能力并且该化合物具有大于4的pka。
[0037]
现已令人惊讶地发现,当先前发现的使水性配制品中的蛋白质稳定的某类表面活性剂化合物经受超滤和/或渗滤工艺时,可将其从蛋白质溶液中有效且高效地去除,这些表面活性剂化合物如wo2017/044367中所公开的,出于所有目的,将该专利通过引用以其全文并入本文。这允许在蛋白质生产的上游阶段(而不仅仅是在配制阶段)使用此类表面活性剂,在这些上游阶段,此类表面活性剂可以减轻蛋白质溶液的纯化和/或浓缩期间发生的蛋白质聚集和颗粒形成,从而提高蛋白质产量。与聚山梨醇酯不同,在仍保护蛋白质的浓度下的此类表面活性剂很容易地通过分离膜过滤,因此可以减轻过滤期间蛋白质变性和聚集的问题。
[0038]
因此,本公开提供了在蛋白质的纯化和/或浓缩期间使水溶液中的该蛋白质稳定的方法。该方法包括以下步骤:(a)提供包含蛋白质和具有通式i的聚烷氧基脂肪酰基表面活性剂的水溶液
[0039][0040]
其中r
1-c(=o)是脂肪酰基基团,r2是h或者取代的或未取代的烃基基团,x1是s、o或nh,x2是s、o或nh,n是0或1-5的整数,r3是包含具有通式ii和iii的聚合单元的聚合基团
[0041][0042]
(b)使该水溶液与分离膜接触,以及(c)使该水溶液经受渗滤步骤以降低可溶性低分子量组分的浓度或向其中引入一种或多种可溶性低分子量组分和/或使该水溶液经受超滤步骤以浓缩该蛋白质以产生渗余物产物,该渗余物产物为包含该蛋白质的水溶液,从而具有式i的化合物减少了方法步骤(a)-(c)中该蛋白质的聚集并且从而该具有式i的化合物在步骤(c)中穿过该分离膜。
[0043]
已经发现具有式i的聚烷氧基脂肪酰基表面活性剂表现出的临界胶束浓度(高于其表面活性剂自发聚集成胶束的浓度)低于常规表面活性剂如聚山梨酯或泊洛沙姆188的临界胶束浓度,参见j.s.katz等人,mol.pharmaceutics[分子药剂学]2019,16,第282-291页。较低的临界胶束浓度表明更强的聚集驱动力,这可能转化为界面的更快稳定。不希望受特定理论约束,较低的临界胶束浓度可以解释以下发现:具有式i的聚烷氧基脂肪酰基表面活性剂比常规表面活性剂1至2个数量级更快地达到表面平衡,并且在界面处超过蛋白质,因此降低了蛋白质聚集的可能性。
[0044]
步骤(a)中提供的水溶液包含溶解在其中(例如溶解在水中)的蛋白质和具有通式i的聚烷氧基脂肪酰基表面活性剂。任选地,水溶液进一步包含低分子量组分,如糖、糖醇、盐、缓冲液、氨基酸、氨基酸盐及其混合物。低分子量组分也溶解在水溶液中。当存在低分子量组分时,优选所有低分子量组分的总量不超过300mg/ml。
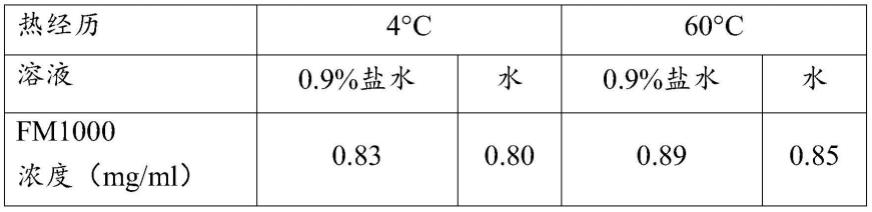
[0045]
优选的糖选自由以下组成的组:蔗糖、葡萄糖、甘露糖、海藻糖、麦芽糖、右旋糖、右旋糖酐及其混合物。优选的糖醇选自由以下组成的组:山梨糖醇、甘露糖醇、木糖醇及其混合物。优选的盐具有选自由以下组成的组的阳离子:氢、钠、钾、镁、钙、铵及其混合物。优选的盐具有选自由以下组成的组的阴离子:氟离子、氯离子、溴离子、碘离子、磷酸根、碳酸根、乙酸根、柠檬酸根、硫酸根及其混合物。优选的缓冲液具有选自由以下组成的组的阳离子:氢、钠、钾、镁、钙、铵及其混合物。优选的氨基酸选自由以下组成的组:赖氨酸、甘氨酸、脯氨酸、精氨酸、组氨酸及其混合物。
[0046]
在步骤(c)中,对步骤(a)中提供的水溶液进行渗滤步骤和/或超滤步骤。在渗滤步骤中,至少一部分溶剂和具有式i的聚烷氧基脂肪酰基表面活性剂穿过分离膜。因此,产生
的渗余物(包含蛋白质的水溶液)包含降低量或降低浓度的具有式i的化合物。在渗滤步骤中,至少一部分溶解在水溶液中的低分子量组分也可以穿过分离膜。因此,产生的渗余物包含降低量或降低浓度的初始存在于步骤(a)中提供的水溶液中的低分子量组分。在渗滤步骤中,通过从水溶液中除去至少一部分具有式i的化合物和不希望的低分子量组分来纯化包含蛋白质的水溶液(例如,在步骤(a)中提供的水溶液)。
[0047]
在渗滤期间,用新溶剂补充从蛋白质水溶液(渗余物)中除去的溶剂和低分子量组分(滤液)。在一些实施例中,新溶剂包含溶解在其中的一种或多种新低分子量组分,并将这样的一种或多种新低分子量组分引入蛋白质水溶液中。新溶剂和溶解在其中的一种或多种新低分子量组分可以独立地与步骤(a)中提供的水溶液中初始存在的溶剂和低分子量组分相同或不同。在一些实施例中,在渗滤结束时,所产生的渗余物产物包含降低浓度的具有式i的聚烷氧基脂肪酰基表面活性剂。在一些实施例中,在渗滤结束时,所产生的渗余物产物中的蛋白质浓度基本与步骤(a)中提供的水溶液的蛋白质浓度相同。在一些实施例中,在渗滤结束时,所产生的渗余物产物中的蛋白质浓度在步骤(a)中提供的水溶液的蛋白质浓度的
±
5%、或
±
10%、或
±
15%的范围内。
[0048]
在超滤步骤中,一部分溶剂和具有式i的聚烷氧基脂肪酰基表面活性剂穿过分离膜。因此,所产生的渗余物产物(包含蛋白质的水溶液)中的蛋白质浓度高于步骤(a)中提供的水溶液的蛋白质浓度,即,水溶液中的蛋白质被浓缩。在一些实施例中,所产生的渗余物产物中具有式i的聚烷氧基脂肪酰基表面活性剂的浓度与其在步骤(a)中提供的水溶液中浓度相比保持基本相同。
[0049]
在一些实施例中,步骤(c)包括依次进行的渗滤步骤和超滤步骤两者、基本上由其组成或由其组成。在一些实施例中,步骤(c)包括渗滤步骤随后是超滤步骤,即,使通过渗滤产生的渗余物进行超滤,基本上由其组成或由其组成。在一些实施例中,步骤(c)包括超滤步骤、基本上由其组成或由其组成,并且步骤(c)中没有渗滤。在一些实施例中,步骤(c)包括渗滤步骤、基本上由其组成或由其组成,并且步骤(c)中没有单独的超滤步骤。
[0050]
步骤(c)结束时产生的渗余物产物是一种水溶液,该水溶液包含溶解在其中的蛋白质。在一些实施例中,渗余物产物的水溶液中的蛋白质的浓度为0.01mg/ml至700mg/ml,优选5mg/ml至300mg/ml。在一些实施例中,渗余物产物的水溶液基本上不含具有式i的聚烷氧基脂肪酰基表面活性剂。在一些实施例中,渗余物产物的水溶液进一步包含溶解在其中的具有式i的聚烷氧基脂肪酰基表面活性剂。在一些实施例中,渗余物产物的水溶液中的具有式i的聚烷氧基脂肪酰基表面活性剂的浓度不超过1mg/ml、或不超过0.1mg/ml、或不超过0.05mg/ml、或不超过0.01mg/ml、或不超过0.005mg/ml、或不超过0.001mg/ml。
[0051]
在一些实施例中,步骤(c)结束时产生的渗余物产物的水溶液包含基于渗余物产物的水溶液中蛋白质总重量的至少80wt%的单体蛋白、或至少85wt%的单体蛋白、或至少90wt%的单体蛋白、或至少92wt%的单体蛋白、或至少94wt%的单体蛋白、或至少96wt%的单体蛋白、或至少98wt%的单体蛋白、或至少99wt%的单体蛋白。
[0052]
在一些实施例中,与步骤(a)中提供的水溶液中的表面活性剂/蛋白质浓度比相比,步骤(c)结束时产生的渗余物产物的水溶液中的表面活性剂/蛋白质浓度比降低至少50%、或至少60%、或至少70%、或至少80%、或至少85%、或至少90%、或至少95%、或至少97%、或至少99%。
[0053]
在一些实施例中,步骤(a)中提供的水溶液中具有式i的化合物的浓度为约0.001mg/ml至约5mg/ml、优选约0.005mg/ml至约1mg/ml、优选约0.01mg/ml至约0.5mg/ml、更优选约0.01mg/ml至约0.1mg/ml、更优选约0.01mg/ml至约0.05mg/ml。
[0054]
在一些实施例中,分离膜具有约30kda至约50kda的分子量截止值,步骤a)中提供的水溶液中具有式i的化合物的浓度为约0.01mg/ml至约0.1mg/ml或约0.01mg/ml至约0.05mg/ml,渗余物产物的水溶液包含基于渗余物产物的水溶液中蛋白质总重量的至少80wt%、或至少85wt%、或至少90wt%、或至少95wt%的单体蛋白,并且与步骤(a)中提供的水溶液中的表面活性剂/蛋白质浓度比相比,步骤(c)结束时产生的渗余物产物的水溶液中的表面活性剂/蛋白质浓度比降低至少50%、或至少60%、或至少70%、或至少80%、或至少85%、或至少90%、或至少95%、或至少97%、或至少99%。
[0055]
在一些实施例中,步骤(a)的水溶液中的蛋白质的浓度为0.0001mg/ml至150mg/ml、优选0.1mg/ml至50mg/ml、更优选1mg/ml至20mg/ml。
[0056]
在一些实施例中,步骤(c)包括超滤步骤,并且步骤c)中超滤后水溶液中的蛋白质的浓度为0.01mg/ml至700mg/ml,优选5mg/ml至300mg/ml。
[0057]
在一些实施例中,分离膜具有约10kda至约100kda的分子量截止值,即,大于分子量截止值的蛋白质可以被保留(在渗余物中),而较小的蛋白质和其他分子可穿过分离膜以形成滤液。优选的是最小化通过分离膜的蛋白质损失。因此,应选择具有不超过待保留蛋白质分子量的三分之一的分子量截止值的分离膜。约30kda至约50kda范围内的分子量截止值可用于保留大多数大蛋白质,如用作生物制剂的抗体。在一些实施例中,分离膜具有约30kda至约50kda的分子量截止值。
[0058]
在一些实施例中,分离膜具有约100kda的分子量截止值并且步骤(a)的水溶液中具有式i的化合物的浓度为约0.005mg/ml至约1mg/ml、或约0.05mg/ml至约1mg/ml、或约0.01mg/ml至约0.5mg/ml、或约0.01mg/ml至约0.1mg/ml、或约0.01mg/ml至约0.05mg/ml。
[0059]
在一些实施例中,分离膜具有约100kda的分子量截止值,步骤(a)的水溶液中具有式i的化合物的浓度为约0.05mg/ml至约1mg/ml,渗余物产物的水溶液包含基于渗余物产物的水溶液中蛋白质总重量的至少80wt%、或至少85wt%、或至少90wt%、或至少95wt%的单体蛋白,并且与步骤(a)中提供的水溶液中的表面活性剂/蛋白质浓度比相比,步骤(c)结束时产生的渗余物产物的水溶液中的表面活性剂/蛋白质浓度比降低至少50%、或至少60%、或至少70%、或至少80%、或至少85%、或至少90%、或至少95%、或至少97%、或至少99%。
[0060]
在一些实施例中,分离膜具有约30kda至约50kda的分子量截止值,并且步骤(a)的水溶液中具有式i的化合物的浓度为约0.01mg/ml至约0.1mg/ml、或约0.01mg/ml至约0.05mg/ml、或约0.001mg/ml至约0.025mg/ml、或约0.001mg/ml至约0.01mg/ml。
[0061]
在一些实施例中,步骤(c)包括超滤步骤、基本上由其组成或由其组成,并且在步骤(c)中的超滤之前或之后没有渗滤,分离膜具有约30kda至约50kda的分子量截止值,并且步骤(a)的水溶液中具有式i的化合物的浓度为约0.001mg/ml至约0.025mg/ml,优选约0.001mg/ml至约0.01mg/ml。
[0062]
在一些实施例中,步骤(c)包括超滤步骤、基本上由其组成或由其组成,并且在步骤(c)中的超滤之前或之后没有渗滤,分离膜具有约30kda至约50kda的分子量截止值,步骤(a)的水溶液中具有式i的化合物的浓度为约0.001mg/ml至约0.025mg/ml或约0.001mg/ml
至约0.01mg/ml,渗余物产物的水溶液包含基于渗余物产物的水溶液中蛋白质总重量的至少80wt%、或至少85wt%、或至少90wt%、或至少95wt%的单体蛋白,并且与步骤(a)中提供的水溶液中的表面活性剂/蛋白质浓度比相比,步骤(c)结束时产生的渗余物产物的水溶液中的表面活性剂/蛋白质浓度比降低至少50%、或至少60%、或至少70%、或至少80%、或至少85%、或至少90%、或至少95%、或至少97%、或至少99%。
[0063]
在一些实施例中,步骤(c)包括渗滤步骤随后是超滤步骤、基本上由其组成或由其组成,分离膜具有约30kda至约50kda的分子量截止值,步骤(a)的水溶液中具有式i的化合物的浓度为约0.01mg/ml至约0.1mg/ml或约0.01mg/ml至约0.05mg/ml,渗余物产物的水溶液包含基于渗余物产物的水溶液中蛋白质总重量的至少80wt%、或至少85wt%、或至少90wt%、或至少95wt%的单体蛋白,并且与步骤(a)中提供的水溶液中的表面活性剂/蛋白质浓度比相比,步骤(c)结束时产生的渗余物产物的水溶液中的表面活性剂/蛋白质浓度比降低至少50%、或至少60%、或至少70%、或至少80%、或至少85%、或至少90%、或至少95%、或至少97%、或至少99%。
[0064]
在一些实施例中,步骤(c)包括渗滤步骤、基本上由其组成或由其组成,并且步骤(c)中的渗滤之前或之后没有超滤,分离膜具有约30kda至约50kda的分子量截止值,并且步骤(a)的水溶液中具有式i的化合物的浓度为约0.01mg/ml至约0.1mg/ml。
[0065]
在一些实施例中,步骤(c)包括渗滤步骤、基本上由其组成或由其组成,并且步骤(c)中的渗滤之前或之后没有超滤,分离膜具有约30kda至约50kda的分子量截止值,步骤(a)的水溶液中具有式i的化合物的浓度为约0.01mg/ml至约0.1mg/ml,渗余物产物的水溶液包含基于渗余物产物的水溶液中蛋白质总重量的至少80wt%、或至少85wt%、或至少90wt%、或至少95wt%的单体蛋白,并且与步骤(a)中提供的水溶液中的表面活性剂/蛋白质浓度比相比,步骤(c)结束时产生的渗余物产物的水溶液中的表面活性剂/蛋白质浓度比降低至少50%、或至少60%、或至少70%、或至少80%、或至少85%、或至少90%、或至少95%、或至少97%、或至少99%。
[0066]
在具有式i的聚烷氧基脂肪酰基化合物中,r1优选为取代的或未取代的脂族基团。在取代的脂族基团中,优选的取代基是羟基。更优选地,r1是未取代的脂族基团;更优选地,r1是未取代的烷基基团。在一些实施例中,在具有式i的化合物中,r1是c
9-22
直链烷基,即r1是具有9至22个碳原子的直链烷基基团。在一些实施例中,在具有式i的化合物中,r1是c
10-18
直链烷基。在一些实施例中,在具有式i的化合物中,r1是c
10-16
直链烷基。在一些实施例中,在具有式i的化合物中,r1是c
11-15
直链烷基。
[0067]
优选地(当n不是0时),x1是o或nh。更优选地,x1是nh。优选地,x2是o或nh。更优选地,x2是nh。
[0068]
n是0或1、2、3、4或5。优选地,n是0或1。更优选地,n是1。
[0069]
优选地,r2具有20个或更少的原子;更优选15个或更少的原子。优选地,如果r2不是氢,则r2含有一个或多个碳原子。优选地,r2是氢或未取代的烃基基团;更优选地,r2是氢、未取代的烷基基团或烷基基团(其唯一取代基是未取代的芳烃基团)。在未取代的烷基基团中,优选的是甲基。在烷基基团(其唯一取代基是未取代的芳烃基团)中,优选的是-ch
2-(c6h5),其中-(c6h5)是苯环。优选地,r2表示天然存在的氨基酸的侧链。在一些实施例中,n是1并且在具有式i的化合物中的r2表示天然存在的氨基酸的侧链。在一些实施例中,在具有
式i的化合物中,r2是h、未取代的c
1-4
烷基或-ch
2-(c6h5)。
[0070]
在一些实施例中,在具有式i的化合物中,r3具有为600-5000道尔顿,优选800-3000道尔顿的数均分子量。在一些实施例中,基团r3是结构(ii)和结构(iii)的单元的统计共聚物或结构(ii)和结构(iii)的单元的嵌段共聚物。优选地,基团r3是结构(ii)和结构(iii)的单元的统计共聚物。优选地,-r3具有结构-r
4-ch3,其中r4是包含结构(ii)和结构(iii)的聚合单元、基本上由其组成或由其组成的聚合基团。优选地,除了结构(ii)和结构(iii)外,r4没有其他聚合单元。
[0071]
在一些实施例中,r1为具有10至16个碳原子的直链未取代的烷基基团,r2选自由氢、甲基和-ch
2-(c6h5)组成的组,其中-(c6h5)是苯环,并且r3具有800至3000的数均分子量。
[0072]
表征结构(ii)的单元与结构(iii)的单元的摩尔比(在本文中为“po/eo比”)是有用的。po是结构(ii)并且eo是结构(iii)。在一些实施例中,po/eo比在0.01:1至2:1、或0.05:1至1:1、或0.1:1至0.5:1的范围内。
[0073]
在具有式(i)的化合物的特别优选的实施例中,r1是ch
3-(ch2)
11-ch
2-,n是1,x1和x2均为nh,r2是-ch2(c6h5),并且r3是被ch3封端的po和eo单元的共聚物,具有大约1000道尔顿的数均分子量以及约3:19的po与eo比率。这种具有式(i)化合物在本文的实例中表示为fm1000。
[0074]
在具有式(i)的化合物的另一个优选的实施例中,r1是ch
3-(ch2)
11-ch
2-,n是0,x2是nh,并且r3是被ch3封端的po和eo单元的共聚物,具有大约1000道尔顿的数均分子量以及约3:19的po与eo比率。
[0075]
优选地,具有式(i)的化合物不具有离子基团。
[0076]
具有式(i)化合物可以通过wo 2017/044366中公开的方法制造,出于所有目的,将该专利通过引用以其全文并入本文。
[0077]
本公开的方法中使用的优选的蛋白质可以选自由以下组成的组:单克隆抗体、多克隆抗体、抗体药物缀合物、双特异性抗体、三特异性抗体、生长因子、胰岛素、免疫球蛋白、肽激素、酶、多肽、融合蛋白质、糖基化蛋白质、抗原、抗原亚单位及其组合。
[0078]
优选的蛋白质具有治疗疾病或医学病症或充当疫苗的治疗功效。治疗性蛋白质的实例是免疫球蛋白-g、阿达木单抗、干扰素α、贝伐单抗、人生长激素、利妥昔单抗、人血清白蛋白、胰岛素、促红细胞生成素α、派姆单抗、依那西普、非格司亭、纳武单抗、曲妥单抗、度伐利尤单抗(durvalumab)、白介素-2、英利昔单抗、绒毛膜促性腺激素、阿维单抗(avelumab)、狄诺塞麦、兰尼单抗、阿柏西普、替西木单抗(tremelimumab)、因子viii、干扰素β、易普利姆玛、阿特朱单抗、阿巴西普、托珠单抗、优特克单抗、培非格司亭、苏金单抗、链激酶、西妥昔单抗、奥马珠单抗、雷莫芦单抗、尿激酶、妥珠单抗、度匹鲁单抗(dupilumab)、杰诺单抗(genolimzumab)、阿地白介素、莫拉司亭、聚乙二醇干扰素α-2b、替雷利珠单抗(tislelizumab)、促滤泡素α、格伐克单抗(gevokizumab)、戈利木单抗、斯巴达珠单抗(spartalizumab)、康纳单抗、福雷芦单抗(foralumab)、伐立鲁单抗、尼妥珠单抗、红细胞生成素β、依伏库单抗、培精氨酸酶(pegargiminase)、贝迈奇单抗(bermekimab)、卡罗妥昔单抗(carotuximab)、达雷木单抗、依库丽单抗、昂妥昔珠单抗(ontuxizumab)、阿达木单抗、卡瑞利珠单抗、恩波妥珠单抗(enoblituzumab)、白介素-12、利瑞鲁单抗(lirilumab)、帕尼单抗、伽妥珠单抗(gatipotuzumab)、瑞莱单抗(relatlimab)、安德利昔单抗
(andecaliximab)、贝利木单抗、卡比拉单抗(cabiralizumab)、isactuzumab govitecan、莫那利珠单抗(monalizumab)、胰液素、帕妥珠单抗、特瑞普利单抗、英比利珠单抗、奥法木单抗、派比耐单抗、信迪利单抗、阿利库单抗、米拉组单抗、尼达利单抗、索特西普(sotatercept)、维多珠单抗、维妥珠单抗、贝伐单抗β、伊沙昔单抗(isatuximab)、奥洛他单抗(orlotamab)、蒂索瘤抑菌素(tisotumab vedotin)、贝那利珠单抗、柯希利单抗、艾马珠单抗、加尼妥单抗、纳索利单抗、匹地利珠单抗、沙利鲁单抗、曲妥珠单抗-厄塔毒素偶联物、雷星-阿奈妥单抗、柏替木单抗、博纳吐单抗、古塞尔库姆单抗(guselkumab)、衣克珠单抗、美泊利单抗、奥匹妥珠单抗(obinutuzumab)、乌布妥昔单抗(ublituximab)、阿仑单抗、依米妥珠单抗(emibetuzumab)、非卡妥珠单抗(ficlatuzumab)、伊波妥组单抗(ifabotuzumab)、米吉珠单抗(mirikizumab)、那他珠单抗、雷妥莫单抗、司妥昔单抗、替米妥珠单抗、曲妥珠单抗-deruxtecan、比美吉珠单抗、布罗达单抗、西利单抗(cetrelimab)、法妥组单抗(farletuzumab)、opinercept、利纳西普、托木妥昔单抗(tomuzotuximab)、乌瑞芦单抗、阿伐苏单抗、溴珠单抗、克拉扎珠单抗、古妥珠单抗(cusatuzumab)、达洛珠单抗、伊利尤单抗、伊曲珠单抗(itolizumab)、以及马吉妥昔单抗(margetuximab)。还考虑了可用作医学诊断剂或对食品组合物具有有益效果,或可以掺入清洁组合物或涂料配制品中的蛋白质。
[0079]
许多方面和实施例已在上文中描述并且仅是示例性的且非限制性的。在阅读本说明书后,技术人员应理解,在不背离本发明的范围的情况下,其他方面和实施例是可能的。
[0080]
实例
[0081]
本文所述的概念将在以下实例中进一步描述,这些实例不限制权利要求中所述的本发明的范围。
[0082]
材料
[0083]
除非另有说明,否则所有材料均来自西格玛-奥德里奇公司(sigma-aldrich)或飞世尔公司(fisher),并无需进一步纯化即可使用。jeffamine m-1000由亨斯迈公司(huntsman)提供。聚山梨醇酯80(ps80)是“根据ph.eur.测试的”等级,西格玛-奥德里奇公司产品编号59924。将它储存在氮气顶部空间下以使氧化最小化。工业级牛igg(免疫球蛋白g)购自mp生物医疗公司(mp biomedicals)(加利福尼亚州圣安娜)。
[0084]
fm1000是具有式(i)的表面活性剂化合物,其中r1是ch
3-(ch2)
11-ch
2-,n是1,x1和x2均为nh,r2是-ch
2-(c6h5),其中-(c6h5)是苯环,并且r3是被ch3封端的po和eo单元的共聚物,具有大约1000道尔顿的分子量以及约3:19的po/eo比。如wo2017/044366中报道的制备fm1000。简言之,在氢氧化钠和三乙胺的存在下,将肉豆蔻酰氯用苯丙氨酸在水中酰胺化。用浓hcl将得到的悬浮液酸化至ph 2,并过滤。然后将过滤的粉末从己烷中重结晶。通过与jeffamine m-1000熔融缩合而使肉豆蔻酰基苯丙氨酸酰胺化。将粗fm1000产物溶解在甲醇中,并在dupont amberlite
tm irn 77和irn78离子交换树脂上搅拌,以除去起始材料。将最终产物在真空下干燥。
[0085]
实例1:在离心过滤期间保留fm1000。
[0086]
制备去离子水或0.9%盐水中的1mg/ml的fm1000溶液。将一半样品直接从冰箱中取出,而将另一半在离心前短暂加热至60℃。将2ml的每种溶液置于amicon ultra-4离心管中,并以3000rpm的离心2min。过滤器(分离膜)的分子量截止值(mwco)为30、50或100kda。通过hplc(高效液相色谱法)分析测量滤液的fm1000浓度。结果示于表1中。
[0087]
表1:滤液中fm1000浓度,100kda mwco过滤器
[0088][0089]
在任何测试条件下,穿过30或50kda mwco过滤器的滤液中没有可检测的fm1000。这些数据显示,浓度为1mg/ml的fm1000可以有效地穿过100kda mwco的分离膜,但不能有效地穿过30或50kda mwco的分离膜。
[0090]
实例2-5
[0091]
对于实例2-5,在标准超滤(uf)装置的贮液器(reservoir)中制备包含浓度为1mg/ml的igg和fm1000的200ml水溶液。对于渗滤(df),主贮液器含有与超滤贮液器中的水溶液相同的水溶液(包含浓度为1mg/ml的igg和fm1000)。第二贮液器含有与主贮液器中的水溶液相同的替代水溶液,不同的是替代水溶液中不具有fm1000和igg。将替代水溶液以与将水溶液滤出为废物相同的速度吸入主贮液器,即将替代水溶液以与形成滤液相同的速度吸入主贮液器。以这种方式,水溶液中蛋白质的浓度在渗滤期间基本保持恒定。从超滤贮液器或渗滤主贮液器收集所有用于分析的等分试样。过滤器(分离膜)是具有30kda mwco的pall minimate膜包(capsules),并且流速设置为120ml/min。
[0092]
实例2(对比):包含0.05mg/ml fm1000和1mg/ml igg的水溶液的uf。
[0093]
对包含浓度为1mg/ml的igg和浓度为0.05mg/ml的fm1000的200ml水溶液(0.9%盐水)仅进行uf并浓缩至约5ml(渗余物体积)。分离膜mwco为30kda。将样品在各个浓度点(即渗余物体积的各个点)处收集,并通过uv/vis(a280 nm,10x稀释)分析igg浓度以及通过hplc(a210 nm)分析fm1000浓度。结果示于表2中。
[0094]
表2
[0095]
渗余物体积hplcuv/vis200ml(初始,t=0)162.30.066150ml136.90.082100ml176.70.10450ml262.10.17025ml657.00.3975ml758.10.506
[0096]
这些数据显示,在超滤工艺中,浓度为0.05mg/ml的fm1000不能有效地穿过30kda mwco的分离膜。
[0097]
实例3:包含0.05mg/ml fm1000和1mg/ml igg的水溶液的df/uf。
[0098]
在实例3中,对包含浓度为1mg/ml的igg和浓度为0.05mg/ml的fm1000的200ml水溶液进行df然后uf,即对在df结束时产生的渗余物产物的水溶液进行uf。200ml水溶液(进行df)是0.9%盐水溶液或25mm(毫摩尔)、ph 6.5的组氨酸缓冲溶液。当200ml水溶液(进行df)为0.9%盐水溶液(包含igg和fm1000)时,第二贮液器中的替代水溶液为不含igg和fm1000
的纯0.9%盐水溶液。当200ml水溶液(进行df)是25mm、ph 6.5的组氨酸缓冲溶液(包含igg和fm1000)时,第二贮液器中的替代水溶液是不含igg和fm1000的纯25mm、ph 6.5的组氨酸缓冲溶液。
[0099]
在df期间,将主贮液器中的200ml 0.9%盐水溶液(包含igg和fm1000)与1.6升纯0.9%盐水溶液(不含igg和fm1000)进行渗滤交换,并且将200ml的25mm、ph 6.5的组氨酸缓冲溶液(包含igg和fm1000)与1.0升纯25mm、ph 6.5的组氨酸缓冲溶液(不含igg和fm1000)进行渗滤交换。使在df结束时产生的渗余物产物的各自的水溶液进一步进行uf以将渗余物的体积减少到约25ml,从而浓缩其中含有的蛋白质igg。
[0100]
实例3中用于df和uf的分离膜具有30kda的mwco。将样品在df和uf工艺的各个点处收集,并通过uv/vis(a280 nm,10x稀释)分析igg浓度以及通过hplc(a210 nm)分析fm1000浓度。结果示于表3中,其中“盐水hplc”栏显示0.9%盐水溶液的df和uf的各个点处hplc的信号强度(指示fm1000的浓度),“盐水uv/vis”栏显示0.9%盐水溶液的df和uf的各个点处uv/vis的信号强度(指示igg的浓度),“组氨酸hplc”栏显示25mm组氨酸缓冲溶液的df和uf的各个点处hplc的信号强度,并且“组氨酸uv/vis”栏显示25mm组氨酸缓冲溶液的df和uf的各个点处uv/vis的信号强度(指示igg的浓度)。
[0101]
表3
[0102][0103]
这些数据显示,浓度为0.05mg/ml的fm1000可以在包含渗滤步骤随后是超滤步骤的工艺期间被有效地去除,其中30kda mwco分离膜用于df和uf两者。这些数据还表明,在渗滤工艺中,浓度为0.05mg/ml的fm1000可以有效地穿过30kda mwco分离膜。
[0104]
实例4:包含0.1mg/ml fm1000和1mg/ml igg的水溶液的df/uf。
[0105]
在实例4中,使包含浓度为1mg/ml的igg和浓度为0.1mg/ml的fm1000的200ml 0.9%盐水溶液进行df,然后进行uf。以与实例3中相同的方式进行df/uf工艺,不同的是初始200ml水溶液中的fm1000的浓度为0.1mg/ml,仅0.9%盐水溶液在该工艺中被使用/测试并在df中与1.5升的纯0.9%盐水溶液(不含igg和fm1000)进行渗滤交换,并且uf将渗余物的体积减少到约50ml。实例4中用于df和uf的分离膜具有30kda的mwco。结果示于表4中。
[0106]
表4
[0107]
df/uf进程hplcuv/vis初始溶液(t=0)352.30.06811升df交换129.50.0718
sec柱,并且运行缓冲液是磷酸盐缓冲液。uv吸收是在molecular devices m3板读取器上测量的。在wyatt dynapro ii上测量动态光散射(dsc)。
[0118]
表6
[0119][0120]
在表6中,samp意指样品,ctx意指西妥昔单抗,conc意指浓度,并且surf意指表面活性剂。这些数据显示,在0.01mg/ml表面活性剂的水平下,fm1000能够比聚山梨醇酯80更显着地减少蛋白质西妥昔单抗的聚集。
[0121]
应注意的是,并不是所有的以上在一般性描述或实例中所描述的活动都是必需的,一部分特定活动可能不是必需的,并且除了所描述的那些以外,还可进行一个或多个其他活动。此外,所列举的活动的顺序不必是它们实施的顺序。
[0122]
在前述说明书中,已参考具体实施例描述了概念。然而,本领域的普通技术人员理解,在不脱离以下权利要求中所规定的本发明范围的情况下可作出各种修改和改变。因此,本说明书应被认为是说明性的而非限制性的,并且所有此类修改均旨在包括于本发明的范围内。
[0123]
上面已经关于具体实施例描述了益处、其他优点和问题的解决方案。然而,益处、优点、问题的解决方案、以及可能引起任何益处、优点、或解决方案出现或使其变得更明显的一个或多个任何特征不会被解释为任何或所有权利要求的关键的、必要的或基本的特征。
[0124]
要理解的是,为清楚起见,本文在单独实施例的上下文中所述的某些特征还可以以组合形式在单个实施例中提供。相反地,为了简洁起见,在单个实施例的背景下所述的各个特征也可以单独地或以任何子组合提供。
[0125]
实施例
[0126]
为了进一步说明,以下阐述了本公开的附加的非限制性实施例。
[0127]
例如,实施例1是在蛋白质的纯化和/或浓缩期间使水溶液中的该蛋白质稳定的方
法。该方法包括以下步骤:(a)提供包含蛋白质和具有通式i的聚烷氧基脂肪酰基表面活性剂的水溶液
[0128][0129]
其中r
1-c(=o)是脂肪酰基基团,r2是h或者取代的或未取代的烃基基团,x1是s、o或nh,x2是s、o或nh,n是0或1-5的整数,r3是包含具有通式ii和iii的聚合单元的聚合基团
[0130][0131]
(b)使该水溶液与分离膜接触,以及(c)使该水溶液经受渗滤步骤以降低可溶性低分子量组分的浓度或向其中引入一种或多种可溶性低分子量组分和/或使该水溶液经受超滤步骤以浓缩该蛋白质以产生渗余物产物,该渗余物产物为包含该蛋白质的水溶液,从而具有式i的化合物减少了方法步骤(a)-(c)中该蛋白质的聚集并且从而该具有式i的化合物在步骤(c)中穿过该分离膜。
[0132]
实施例2是如实施例1所示的方法,其中该渗余物产物的水溶液包含基于该渗余物产物的水溶液中蛋白质总重量的至少80wt%、或至少85wt%、或至少90wt%、或至少95wt%的单体蛋白,并且与步骤(a)中提供的该水溶液中的表面活性剂/蛋白质浓度比相比,步骤(c)结束时产生的该渗余物产物的水溶液中的表面活性剂/蛋白质浓度比降低至少50%、或至少60%、或至少70%、或至少80%、或至少85%、或至少90%、或至少95%、或至少97%、或至少99%。
[0133]
实施例3是如前述实施例中任一项所示的方法,其中步骤(c)包括依次进行的渗滤步骤和超滤步骤两者。
[0134]
实施例4是如前述实施例中任一项所示的方法,其中步骤(a)中提供的该水溶液中该具有式i的化合物的浓度为约0.001mg/ml至约5mg/ml、优选约0.005mg/ml至约1mg/ml、优选约0.01mg/ml至约0.5mg/ml、更优选约0.01mg/ml至约0.1mg/ml、更优选约0.01mg/ml至约0.05mg/ml。
[0135]
实施例5是如前述实施例中任一项所示的方法,其中该分离膜具有约30kda至约50kda的分子量截止值,步骤a)中提供的该水溶液中该具有式i的化合物的浓度为约0.01mg/ml至约0.1mg/ml或约0.01mg/ml至约0.05mg/ml,该渗余物产物的水溶液包含基于渗余物产物的水溶液中蛋白质总重量的至少80wt%、或至少85wt%、或至少90wt%、或至少95wt%的单体蛋白,并且与步骤(a)中提供的该水溶液中的表面活性剂/蛋白质浓度比相比,步骤(c)结束时产生的该渗余物产物的水溶液中的表面活性剂/蛋白质浓度比降低至少
50%、或至少60%、或至少70%、或至少80%、或至少85%、或至少90%、或至少95%、或至少97%、或至少99%。
[0136]
实施例6是如前述实施例中任一项所示的方法,其中步骤(a)的水溶液中该蛋白质的浓度为0.0001mg/ml至150mg/ml、优选0.1mg/ml至50mg/ml、更优选1mg/ml至20mg/ml。
[0137]
实施例7是如前述实施例中任一项所示的方法,其中步骤(c)包括超滤步骤,并且步骤c)中的超滤后水溶液中蛋白质的浓度为0.01mg/ml至700mg/ml,优选5mg/ml至300mg/ml。
[0138]
实施例8是如实施例1-4和6-7中任一项所示的方法,其中该分离膜具有约10kda至约100kda,优选约30kda至约50kda的分子量截止值。
[0139]
实施例9是如实施例1-4和6-8中任一项所示的方法,其中该分离膜具有约100kda的分子量截止值并且其中该步骤(a)的水溶液中该具有式i的化合物的浓度为约0.005mg/ml至约1mg/ml、或约0.05mg/ml至约1mg/ml、或约0.01mg/ml至约0.5mg/ml、或约0.01mg/ml至约0.1mg/ml、或约0.01mg/ml至约0.05mg/ml。
[0140]
实施例10是如实施例9所示的方法,其中该渗余物产物的水溶液包含基于该渗余物产物的水溶液中蛋白质总重量的至少80wt%、或至少85wt%、或至少90wt%、或至少95wt%的单体蛋白,并且与步骤(a)中提供的该水溶液中的表面活性剂/蛋白质浓度比相比,步骤(c)结束时产生的该渗余物产物的水溶液中的表面活性剂/蛋白质浓度比降低至少50%、或至少60%、或至少70%、或至少80%、或至少85%、或至少90%、或至少95%、或至少97%、或至少99%。
[0141]
实施例11是如实施例1-3和6-7中任一项所示的方法,其中该分离膜具有约30kda至约50kda的分子量截止值,并且其中该步骤(a)的水溶液中该具有式i的化合物的浓度为约0.01mg/ml至约0.1mg/ml。
[0142]
实施例12是如实施例1-2和6中任一项所示的方法,其中步骤(c)包括超滤步骤、基本上由其组成或由其组成,并且在步骤(c)中的超滤之前或之后没有渗滤,该分离膜具有约30kda至约50kda的分子量截止值,并且该步骤(a)的水溶液中该具有式i的化合物的浓度为约0.001mg/ml至约0.025mg/ml,优选约0.001mg/ml至约0.01mg/ml。
[0143]
实施例13是如实施例12所示的方法,其中该渗余物产物的水溶液包含基于该渗余物产物的水溶液中蛋白质总重量的至少80wt%、或至少85wt%、或至少90wt%、或至少95wt%的单体蛋白,并且与步骤(a)中提供的该水溶液中的表面活性剂/蛋白质浓度比相比,步骤(c)结束时产生的该渗余物产物的水溶液中的表面活性剂/蛋白质浓度比降低至少50%、或至少60%、或至少70%、或至少80%、或至少85%、或至少90%、或至少95%、或至少97%、或至少99%。
[0144]
实施例14是如实施例1-2和6中任一项所示的方法,其中步骤(c)包括渗滤步骤随后是超滤步骤、基本上由其组成或由其组成,该分离膜具有约30kda至约50kda的分子量截止值,并且该步骤(a)的水溶液中该具有式i的化合物的浓度为约0.01mg/ml至约0.1mg/ml或约0.01mg/ml至约0.05mg/ml。
[0145]
实施例15是如实施例14所示的方法,其中该渗余物产物的水溶液包含基于该渗余物产物的水溶液中蛋白质总重量的至少80wt%、或至少85wt%、或至少90wt%、或至少95wt%的单体蛋白,并且与步骤(a)中提供的该水溶液中的表面活性剂/蛋白质浓度比相
是ch
3-(ch2)
11-ch
2-,n是0,x2是nh,并且r3是被ch3封端的po和eo单元的共聚物,具有约1000道尔顿的数均分子量以及约3:19的po与eo比率。
[0160]
实施例30是如前述实施例中任一项所示的方法,其中该蛋白质选自由以下组成的组:单克隆抗体、多克隆抗体、抗体药物缀合物、双特异性抗体、三特异性抗体、生长因子、胰岛素、免疫球蛋白、肽激素、酶、多肽、融合蛋白质、糖基化蛋白质、抗原、抗原亚单位及其组合。
[0161]
实施例31是如前述实施例中任一项所示的方法,其中该步骤(a)的水溶液进一步包含选自由以下组成的组的糖:蔗糖、葡萄糖、甘露糖、海藻糖、麦芽糖、右旋糖、右旋糖酐及其混合物。
[0162]
实施例32是如实施例1-30中任一项所示的方法,其中该步骤(a)的水溶液进一步包含选自由以下组成的组的糖醇:山梨糖醇、甘露糖醇、木糖醇及其混合物。
[0163]
实施例33是如前述实施例中任一项所示的方法,其中该步骤(a)的水溶液进一步包含盐,该盐具有选自由以下组成的组的阳离子:氢、钠、钾、镁、钙、铵及其混合物,并且该盐具有选自由以下组成的组的阴离子:氟离子、氯离子、溴离子、碘离子、磷酸根、碳酸根、乙酸根、柠檬酸根、硫酸根及其混合物。
[0164]
实施例34是如前述实施例中任一项所示的方法,其中该步骤(a)的水溶液进一步包含天然存在的氨基酸。
[0165]
实施例35是如实施例34所示的方法,其中该氨基酸选自由以下组成的组:赖氨酸、甘氨酸、脯氨酸、精氨酸、组氨酸及其混合物。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1