一种检测IRES活性的环RNA荧光素酶报告质粒构建方法
本发明属于生物医药领域,涉及一种检测ires活性的环rna荧光素酶报告质粒构建方法。
背景技术:
中心法则提出dna转录成rna,rna进一步可以翻译成蛋白,rna分子作为基因信息传递的中间分子,往往具有重要的生物学功能,作为信使rna(mrna)主要通过翻译蛋白质发挥作用。信使mrna翻译蛋白质的方式主要有两种,一类是依赖rna5’端的帽子结构的蛋白翻译模式,另外一类是借助于rna内部的核糖体插入位点ires序列进行蛋白质的合成。近年来,随着研究的深入,在生物体内验证发现了许多具有起始蛋白质翻译的ires的核酸片段,并且尚有大量的具有ires活性的基因片段尚未被识别鉴定,那么对于ires活性片段的鉴定及活性定量将有助于对蛋白的翻译进行深入的研究。
目前报道的传统验证ires活性的检测报告系统是基于将两个报告基因(海肾荧光素酶蛋白和萤火虫荧光素酶蛋白)同时串联构建到一个启动子后面,通过中间插入ires核酸片段,将报告质粒转染细胞,检测计算两个肾荧光素酶的活性,从而实现ires活性的定量;此类ires检测系统能够检测目标ires活性,但是在研究过程中发现此类报告系统存在缺陷,报告出来的ires活性具有潜在的假阳性,不能真实客观的反应所研究的ires大的活性。
技术实现要素:
一些实施方式中,本发明提供了一种检测ires活性的rna报告质粒。
一些实施方式中,所述检测ires活性的环状rna报告质粒的制备方法,包括,设计一种环状rna报告基因表达框架序列:将报告基因的核酸片段序列拆分成两段序列(不限于具体的拆分位置),将靠近3’端的那一段序列放到靠近5’端的那段序列之前进行位置倒置;倒置之后的两段序列之间连接酶切位点识别序列,用于连接要目的ires序列。
一些实施方式中,本发明提供了一种rna重组报告质粒的制备方法,包括,将初始报告基因的核酸片段序列拆分成两段序列(具体拆分位置不限定,只要是进行了拆分即可),分别为5’端起始的一段序列、及报告基因3’端截止的一段序列,将两段序列的位置倒置;所述倒置是指,报告基因5’端起始的一段序列,倒置后的位置位于所述报告基因3’端截止的一段序列的下游;所述报告基因5’端起始的一段序列,始于报告基因5’端,截止于报告基因3’端之前,并且,该截止位点后的下一位即为报告基因3’端截止的一段序列的起始位点。
一些实施方案中,所述被倒置之后的两段序列之间连接酶切位点识别序列。
一些实施方案中,所述酶切位点识别序列用于连接目的ires序列。
一些实施方式中,所述环状rna报告基因表达框架的设计还包括:在倒置连接后的报告基因序列的两端连接促进环化rna成环的框架序列,以及ag和gt剪接信号序列。
一些实施方式中,所述方法还包括合成所述环状rna报告基因表达框架序列。
一些实施方式中,所述方法还包括将上述合成后的环状rna荧光素酶报告表达框架构建到具有报告基因的骨架质粒中,骨架质粒中的报告基因作为内参基因,获得环状的rna报告质粒。
一些实施方式中,所述报告基因包括海肾荧光素酶基因和萤火虫荧光素酶基因。
一些实施方式中,所述环状rna报告基因表达框架序列中的报告基因为海肾荧光素酶基因。
一些实施方式中,所述内参基因为萤火虫荧光素酶基因。
一些实施方式中,所述酶切位点识别序列包括sgfi、xhoi和pmei。
一些实施方式中,所述环状rna报告质粒为用于检测ires活性的环状rna报告质粒。
一些实施方式中,本发明提供了一种rna重组报告基因的表达框架,所述报告基因表达框架与初始报告基因相比,含有被倒置的两段序列,两段序列为初始报告基因拆分得到的,分别为5’端起始的一段序列、及报告基因3’端截止的一段序列;所述被倒置是指,报告基因5’端起始的一段序列,倒置后的位置位于所述报告基因3’端截止的一段序列的下游;所述报告基因5’端起始的一段序列,始于报告基因5’端,截止于报告基因3’端之前,并且,该截止位点后的下一位即为报告基因3’端截止的一段序列的起始位点。
发明人通过上述方式设计的序列,能够产生一种环状的rna,按照本发明的设计,只有成功成环,截成两半的报告基因才能重新组合成正确的顺序,这样才能够恢复所述报告基因的表达,且因为在这种环状rna中没有5'帽子、启动子、增强子这些了,要使得报告基因表达,就需要有ires活性,因此,可以根据环状rna中报告基因的表达,可以同时直接判断rna成功成环了,并且是具有ires活性的。
经典的双荧光素酶ires报告系统,包括启动子(sv40promoter),海肾荧光素酶基因(renillaluciferase),多克隆位点(可插入待验证ires序列),萤火虫荧光素酶基因(fireflyluciferase),增强子(sv40enhancer)。其中海肾荧光素酶基因被前面启动子序列所驱动表达;当插入的ires具有活性时,萤火虫荧光素酶基因才能通过5’帽非依赖方式进行表达,否则不表达。也就是说,当检测到萤火虫荧光素酶活性,代表插入的待验证ires具有活性。
但是上述经典的报告系统被广泛报道具有隐藏启动子(crypticpromoter)假阳性:(1)当待验证序列本身不具有ires活性,但包含了启动子序列时,也能导致下游萤火虫荧光素酶表达;(2)当待验证序列本身不具有ires活性,也没有启动子序列,但包含了某段能被增强子(例如sv40enhancer)所激活的启动序列,也能导致下游萤火虫荧光素酶表达。例如bertag等公开的,将vegfr-1和egr-15’utr序列插入到经典的双荧光素酶ires报告系统中进行验证(分别命名为r-vegfr1-fe和r-egr-f),都能检测到萤火虫荧光素酶活性(prom+enh组)。当删除启动子和增强子时(-prom,-enh),萤火虫荧光素酶活性随之消失,说明插入的待验证序列不包含有自身内在启动子序列(情况(1)排除)。当只删除启动子(-prom)但是保留增强子时,萤火虫荧光素酶活性仍存在,说明插入的待验证序列包含了某段能被增强子所激活的启动序列,驱动了萤火虫荧光素酶表达(属于情况(2))(bertag,grepinr,vadasma,goodallgj:assessingiresactivityinthehif-1alphaandothercellular5'utrs.rna2006,12:1074-1083.)。也就是说,这时萤火虫荧光素酶表达,不是因为ires活性,而是因为包含了某段能被增强子所激活的启动序列,是假阳性。
在本发明的一些实施方案中,所采用的ires验证系统,因为代表ires活性的海肾荧光素酶,需要在rna环化背景下、ires具有活性时才能顺利表达。在环化后的表达系统中:假阳性情况(1)中,环化的序列即使有启动子,在环状rna的背景下,因为没有5’帽子结构,同样是不能表达的。也就是说,海肾荧光素酶基因表达只能来源于ires活性驱动。假阳性情况(2)中,环化的序列即使包含了某段能被增强子所激活的启动序列,因为环化的rna中本身就无增强子,也没有5’帽子结构,因此不能表达。同样地,海肾荧光素酶基因表达只能来源于ires活性驱动。
因此,本发明中所采用的ires验证系统,不会出现经典ires验证系统中的假阳性情况。一般来说,在现有的经典的报告系统中,用对照来排除假阳性,删除启动子、删除启动子加增强子。而本发明设计的这种报告质粒无需设置额外的对照即可排除,提供一种全新的检测ires活性的思路。
一些实施方式中,本发明提供了一种检测ires活性的环状rna荧光素酶报告质粒。
一些实施方式中,本发明提供了一种构建环状rna荧光素酶报告质粒的方法。
一些实施方式中,本发明提供了一种核酸片段序列,所述核酸片段序列如seqidno:1所示。
一些实施方式中,所述的序列为rna荧光素酶表达框架序列。
一些实施方式中,所述的序列为环状rna荧光素酶表达框架序列。
一些实施方式中,
一些实施方式中,本发明提供了一种rna荧光素酶表达框架,包含如seqidno:1所述的核酸片段序列。
一些实施方式中,所述rna重组报告基因表达框架包括海肾荧光素酶蛋白的基因片段序列的阅读框、促进rna环化的序列、ag剪接信号序列、gt剪接信号序列、sgfi限制性内切酶识别序列、xhoi限制性内切酶识别序列、pmei限制性内切酶识别序列。
一些实施方式中,所述rna荧光素酶表达框架的结构包括所述的报告基因的基因片段序列的阅读框是由所述报告基因的核酸片段序列拆分成两段序列,将靠近3’端的那一段序列放到靠近5’端的那段序列之前进行位置倒置获得的,倒置之后的两段序列之间连接酶切位点识别序列,用于连接要目的ires序列。
一些实施方式中,所述rna荧光素酶表达框架的结构包括所述的海肾海肾荧光素酶蛋白基因片段序列的阅读框倒置,在其两侧添加有促进所述rna成环的序列以及ag和gt剪接信号序列,中间添加有sgfi、xhoi、pmei三个限制性内切酶识别序列。
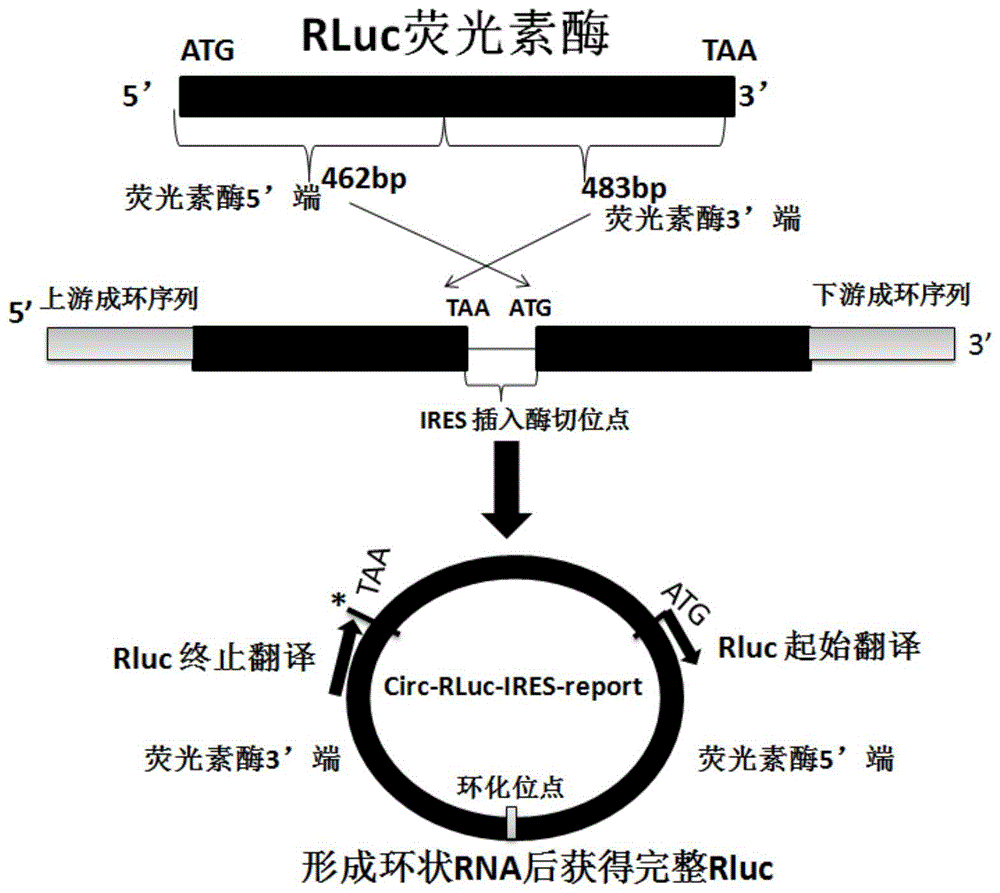
一些实施方式中,所述阅读框倒置为将海肾荧光素酶的5’端462bp转置到海肾荧光素酶的3’端483bp后面。
一些实施方式中,所述的sgfi、xhoi和pmei三个限制性内切酶识别序列用于连接要测试的ires序列。
一些实施方式中,所述sgfi的序列如seqidno:2所示。
一些实施方式中,所述xhoi的序列如seqidno:3所示。
一些实施方式中,所述pmei的序列如seqidno:4所示。
一些实施方式中,所述rna荧光素酶表达框架为环状rna荧光素酶表达框架。
一些实施方式中,本发明提供了一种表达载体,含有所述的rna荧光素酶表达框架;
一些实施方式中,所述载体选自质粒。
一些实施方式中,所述载体为环状rna荧光素酶报告质粒。
一些实施方式中,本发明提供了一种ires荧光素酶报告质粒的构建方法:将海肾荧光素酶蛋白(rluc)的核酸序列进行拆分,分成两段进行序列倒置,海肾荧光素酶蛋白3’端序列放到5’端序列之前,两者中间设计合适的酶切位点序列,用于连接要研究的ires序列,在序列的两端添加能够促使环状rna形成的成环序列,将此框架序列构建到t7启动子后面;将上述环状rna荧光素酶报告表达框架构建到具有萤火虫荧光素酶蛋白(luc)骨架质粒中,有萤火虫荧光素酶作为内参基因。所获得的荧光素酶报告质粒只有在海肾荧光素酶蛋白基因转录形成环状的rna后,才能形成完整的海肾荧光素酶蛋白,这样就能避免由于ires潜在的启动子活性带来的假阳性,从而实现更客观的ires活性的定量检测。
一些实施方式中,本发明提供了所述载体的构建方法,包括以下步骤:(1)构建权利要求3所述的rna荧光素酶表达框架;(2)用nhei和xhoi内切酶将步骤(1)中的rna荧光素酶表达框架置换掉骨架载体中含有的海肾荧光素酶蛋白基因片段序列,即得。
一些实施方式中,所述载体的构建方法,包括以下步骤:(1)构建所述的rna荧光素酶表达框架;(2)设计扩增引物对,以步骤(1)的rna荧光素酶表达框架的片段序列为模板进行pcr扩增,得pcr产物;(3)将所述pcr产物用nhei、xhoi进行酶切,同时载体也用同样的内切酶切割,从而将所述的rna荧光素酶表达框架构建到空白载体中,即得。
一些实施方式中,所述的扩增引物包括nhei和xhoi酶切位点序列。
一些实施方式中,所述引物对的序列分别如seqidno:5和seqidno:6所示。
一些实施方式中,所述空白载体为psicheck2载体。
一些实施方式中,所述表达载体为环状rna荧光素酶报告质粒。
一些实施方式中,本发明所获得的荧光素酶报告质粒能够实现ires片段的活性检测,且能够避免假阳性,从而实现更客观的ires活性的定量检测。
一些实施方式中,所述的核酸片段序列或所述的rna荧光素酶表达框架或所述的表达载体或所述的制备方法在ires的鉴定或分析中的应用。
一些实施方式中,所述分析包括定量分析。
一些实施方式中,所述的ires为心肌炎病毒的ires。
附图说明
图1为环状rna荧光素酶表达框架序列circ-rluc-ires-report示意图。
图2脑心肌炎病毒ecmv-ires活性环状rna荧光素酶报告检测。
具体实施方式
以下通过具体的实施例进一步说明本发明的技术方案,具体实施例不代表对本发明保护范围的限制。其他人根据本发明理念所做出的一些非本质的修改和调整仍属于本发明的保护范围。
除非另有定义,本文中所使用的所有技术与科学术语的定义与本领域技术人员所熟悉的定义相同。此外,任何与所记载内容相似或均等的方法和材料皆可应用于本发明方法中,具体实施方式中描述了优选的方法和材料。
文中所用的“一”和“一种”指语法上不定冠词的释义,表示“一个”、“一种”或“多个”、“多种"(即“至少一个”、“至少一种”)。例如“一要素”指一种或种要素。
“/”指的是可以选择其一,例如“鉴定/检测/分析”指的是可以为鉴定,可以为检测,还可以为分析。
术语“片段”将被理解为指长度比参考核酸短并且在共同部分包含与参考核酸相同的核苷酸序列的核苷酸序列。如果合适的话,根据本发明的这样的核酸片段可以被包含在更大的多核苷酸中,该片段是该更大的多核苷酸的组成成分。这样的片段包括长度在本发明的核酸的至少6、8、9、10、12、15、18、20、21、22、23、24、25、30、39、40、42、45、48、50、51、54、57、60、63、66、70、75、78、80、90、100、105、120、135、150、200、300、500、720、900、1000或1500个连续核苷酸范围内的寡核苷酸,或可选地由这样的寡核苷酸组成。
在本说明中,除非上下文另有要求,词语"包含"、"包括"将被理解为是指包括所述的步骤或要素或步骤和要素的集合,但并不排除任何其它的步骤或要素或步骤和要素的集合;即开放式限定。
术语“下游”是指位于参考核苷酸序列3’端的核苷酸序列。特别地,下游核苷酸序列通常涉及转录起始点之后的序列。例如,基因的翻译起始密码子位于转录起始位点的下游。
术语“上游”是指位于参考核苷酸序列5’端的核苷酸序列。特别地,上游核苷酸通常涉及位于编码序列或转录起始点的5’侧的序列。例如,大部分的启动子位于转录起始位点的上游。
“启动子”是指能够控制编码序列或功能性rna的表达的dna序列。一般而言,编码序列位于启动子序列的3’端。启动子可以整体源自天然基因,或由源自天然发现的不同启动子的不同元件组成,或甚至包括合成的dna片段。本领域技术人员应该理解的是,不同的启动子可以指导基因在不同的组织或细胞类型中,或在发育的不同阶段,或应答于不同的环境或生理条件进行表达。导致基因在大多数细胞类型中在大多数的时间被表达的启动子通常称为“组成型启动子”。导致基因在特定的细胞类型中被表达的启动子通常称为“细胞特异性启动子”或“组织特异性启动子”。导致基因在特定的发育或细胞分化阶段被表达的启动子通常称为“发育特异性启动子”或“细胞分化特异性启动子”。在将细胞暴露于诱导启动子的药剂、生物分子、化学品、配体、光或类似物,或用这些物质对细胞进行处理之后,被诱导并导致基因被表达的启动子通常被称为“诱导型启动子”或“调控型启动子”。还应该认识的是,因为在大多数情况下,调控序列的准确界限还没有完全限定,所以不同长度的dna片段可能具有相同的启动子活性。
术语“载体”意指核酸分子,其能转移它已连接的核酸分子。一种载体类型是“质粒”,其指环状双链dna环,其他dna区段可连接进去。另一类载体是病毒载体,其中其他dna区段可连接到病毒基因组内。某些载体能在引入了这些载体的宿主细胞中自我复制(如具有细菌的复制起始点的细菌载体以及游离型哺乳动物载体)。其他载体(如非游离型哺乳动物载体)在引入到宿主细胞中后能够整合到宿主细胞的基因组中,因此随宿主基因组复制。此外,某些载体能够指导表达它们操作地连接的基因。
一些载体称为“重组表达载体”(或简称为“表达载体”)是指被设计成使得插入的核酸序列在转化入宿主后能够表达的载体、质粒或媒介。总的来说,重组dna技术所使用的表达载体经常是质粒形式。本说明书的“质粒”和“载体”交换使用,因为质粒是载体最普遍使用的形式。但是,本发明意包括这种表达载体的其他形式,如病毒载体(如复制缺陷型反转录病毒、腺病毒和腺伴随病毒),其充当同等作用。
术语“质粒”是指染色体外元件,它们常常携带不是作为细胞的中心代谢的一部分的基因,并且常常是环状双链dna分子的形式。这样的元件可以是来自任何来源的自主复制序列、基因组整合序列、噬菌体或核苷酸序列,线性、环状或超螺旋的,单链或双链dna或rna,其中许多核苷酸序列已经被连接入或重组入独特的结构中,该结构能够将针对所选的基因产物的启动子片段和dna序列以及合适的3’端非翻译序列导入细胞。
载体可以通过本领域已知的方法导入期望的宿主细胞,例如转染、电穿孔、微注射、转导、细胞融合、deae葡聚糖、磷酸钙沉淀、脂转染(溶酶体融合)、使用基因枪或dna载体转运蛋白(参见例如wuetal.,1992,j.biol.chem.267:963-967;wu和wu,1988,j.biol.chem.263:14621-14624;和hartmutetal.,1990年3月15日提交的加拿大专利申请2,012,311)。
术语“转染”是指细胞摄取外源或异源rna或dna。当外源或异源rna或dna已被引入细胞内时,该细胞便被这样的rna或dna“转染”。当转染的rna或dna影响表型变化时,该细胞便被外源或异源rna或dna“转化”。转化rna或dna可以被整合入(共价连接入)构成细胞基因组的染色体dna。
本发明中使用的术语“初始报告基因”是指实施本发明倒置手段之前的基因,例如是现有技术中的报告基因,例如海肾荧光素酶蛋白(renillaluciferase,rluc)基因。
本发明中使用的术语“重组报告质粒”或“重组报告基因”在本发明是指使用初始报告质粒或基因,将其中的基因序列进行位置倒置,改变后的称为重组报告质粒或基因。
实施例1环状rna荧光素酶表达框架序列(下文称“circ-rluc-ires-report”)的设计
将海肾荧光素酶蛋白(renillaluciferase,rluc)基因片段序列的阅读框倒置,海肾荧光素酶rluc的5’端462bp(seqidno:1序列划单实线)转置到海肾荧光素酶rluc的3’端483bp(seqidno:1序列划单虚线线)后面,两侧添加促进环化rna成环框架序列以及ag和gt剪接信号序列,中间添加sgfigcgatcgc(seqidno:2)、xhoictcgag(seqidno:3)、pmeigtttaaac(seqidno:4)三个限制性内切酶识别序列用于连接要测试的ires序列(参考图1环状rna荧光素酶表达框架序列circ-rluc-ires-report示意图);通过全基因化学合成的方法获得整个环状rna荧光素酶表达框架序列,框架序列命名为circ-rluc-ires-report。
所述的环状rna荧光素酶表达框架序列(circ-rluc-ires-report)如seqidno:1所示:
实施例2环状rna荧光素酶表达框架序列(circ-rluc-ires-report)的获得及报告质粒的构建
构建环状rna荧光素酶表达框架序列的示意图如图1所示。
根据实施例1所述的circ-rluc-ires-report表达框架的设计方案,通过全基因化学合成的策略获得目标核苷酸序列,用nhei和noti内切酶位点将circ-rluc-ires-report框架序列置换掉psicheck2(promega,usa)骨架载体本身含有的rluc片段序列获得鉴定ires活性的环状rna荧光素酶报告质粒。psicheck2载体中本身含有的萤火虫荧光素酶蛋白luciferase(luc)作为内参矫正。
具体的实施方案如下:
按照实施例1的方案在上海捷瑞生物公司合成所述的环状rna荧光素酶表达框架序列后,获得组装的框架序列,设计pcr扩增引物,采用pcr扩增的方法以获得的片段序列(即环状rna荧光素酶表达框架序列)为模板进行扩增。
在设计扩增引物的时候引入nhei和xhoi酶切位点序列,设计的引物的序列为:
circ-rluc-ires-report-f:5'tatgctagcctttttttttgagacagag3'(seqidno:5);circ-rluc-ires-report-r:5'tagcggccgcttttgttttgtttttttgag3'(seqidno:6),划线为酶切位点序列,两侧为保护碱基。
pcr扩增的反应体系如下:pcr设计为30μl总体系:具体是2×高保真pcr混合液15μl(南京诺唯赞生物公司),10mm上下游引物各1.5μl,pcr模板1μl,用灭菌去离子水补足30μl体系;反应条件为:95℃3min预变性,循环内95℃30s变性,62℃30s退火,72℃延伸2min,共30个循环,pcr反应循环后72℃继续延伸5min,然后4℃保存。pcr产物通过使用胶回收试剂盒回收纯化,然后pcr产物用nhei、xhoi酶切后,同时psicheck2载体也用同样的内切酶切割,然后将此框架构建到真核表达载体psicheck2中,获得环状rna荧光素酶报告质粒,构建好的载体命名为circ-rluc-ires-report。
实施例3检测ires活性的环状rna荧光素酶报告质粒的应用
1、ires阳性环状rna荧光素酶报告质粒构建
本实施例以公知的脑心肌炎病毒(encephalomyocarditisvirus,emcv)的ires为阳性对照,具体实施方案如下:据ncbi数据库
(https://www.ncbi.nlm.nih.gov/nuccore/nc_001479.1?from=834&to=7712&report=genbank)得到emcv的ires序列。
然后通过常规的全基因合成的手段合成所述的emcv的ires片段(下文以“emcv-ires片段”表示),设计引物,采用pcr的方法扩增此片段。设计引物的时候引入xhoi、pmei酶切位点序列,然后将emcv-ires片段构建到环状rna荧光素酶报告质粒circ-rluc-ires-report(实施例2构建得到的)中,设计的引物序列如下:
seqidno:7:emcv-ires-f:5'atctcgaggcccctctccctccccccccccta3';
seqidno:8:emcv-ires-r:5'tagtttaaactttttcaaaggaaaaccacgtccccg3'。
pcr设计为30μl总体系:具体是2×高保真pcr混合液(南京诺唯赞生物公司)15μl,10mm上下游引物各1.5μl,pcr模板(emcv-ires片段)1μl,用灭菌去离子水补足30μl体系;反应条件为:95℃3min预变性,循环内95℃30s变性,60℃30s退火,72℃延伸1min,共35个循环,pcr反应循环后72℃继续延伸5min,然后4℃保存。pcr产物通过使用胶回收试剂盒回收纯化,然后pcr产物用xhoi、pmei酶切后,同时circ-rluc-ires-report载体也用同样的内切酶切割,然后将此emcv-ires片段构建到环状rna荧光素酶报告质粒circ-rluc-ires-report中,获得ires阳性环状rna荧光素酶报告质粒,构建好的载体命名circ-rluc-emcv-ires。
2、ires阳性环状rna荧光素酶报告质粒细胞转染及荧光素酶活性检测
取对数生长期的hek293细胞,以每孔1×103细胞接种于96孔板中,每孔总体积100μl,于37℃、5%co2培养箱中培养24h。
将上述circ-rluc-emcv-ires载体用lipo3000转染试剂转染到hek293细胞中(以circ-rluc-ires-report(即空白报告质粒)为阴性对照),每组设3个复孔,独立进行5次实验验;载体转染浓度1μg/ml,转染后培养48小时,准备检测荧光素酶活性。
按照promega公司的dual-luciferasereporterassaysystem说明书进行双荧光素酶的检测:吸弃孔中培养液,用pbs洗3次,每孔加入被动裂解液plb24μl,室温下裂解20min;在透明管中加入100μllarⅱbuffer,在荧光检测仪中测定背景值;移取孔中的20μl裂解液至上述管中,迅速吹吸3次混匀,将荧光检测仪设定为延迟时间3秒,检测时间12秒,测定萤火虫荧光素酶荧光值;再加入100μlstop&
所述的脑心肌炎病毒ires活性环状rna荧光素酶报告检测结果如图2,结果显示插入脑心肌炎病毒ecmvires序列后海肾荧光素酶活性明显升高,说明本发明的环状rna荧光素酶报告质粒能够有效检测ires的活性。
序列表
<110>中山大学附属第一医院
<120>一种检测ires活性的环rna荧光素酶报告质粒构建方法
<160>8
<170>siposequencelisting1.0
<210>1
<211>1704
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>环状rna荧光素酶表达框架序列(circ-rluc-ires-report)
<400>1
gctagcctttttttttgagacagagtcttgctctgtctcacaggctgaagtgcagtggtg60
caatctcggctcactgcaacctccacctcccaggttcaagcgattctcctccctcagcct120
cccgagtagctgggaccacaggcatgcaccaccatccccagctaatttttgcattattag180
tagagttgggatttcttcaccgtgttggccaggctggtcttggactcctgacctcaagtg240
atccaactgcctcagcctctcaaagtgctaggattacaggagtgctgagattacaggcgt300
gagccaccacccccggcccactttttgtaaaggtacgtactaatgactttttttttatac360
ttcagtgggacgagtggcctgacatcgaggaggatatcgccctgatcaagagcgaagagg420
gcgagaaaatggtgcttgagaataacttcttcgtcgagaccatgctcccaagcaagatca480
tgcggaaactggagcctgaggagttcgctgcctacctggagccattcaaggagaagggcg540
aggttagacggcctaccctctcctggcctcgcgagatccctctcgttaagggaggcaagc600
ccgacgtcgtccagattgtccgcaactacaacgcctaccttcgggccagcgacgatctgc660
ctaagatgttcatcgagtccgaccctgggttcttttccaacgctattgtcgagggagcta720
agaagttccctaacaccgagttcgtgaaggtgaagggcctccacttcagccaggaggacg780
ctccagatgaaatgggtaagtacatcaagagcttcgtggagcgcgtgctgaagaacgagc840
agtaataagcgatcgcacctcgagtggtttaaacgccaccatggcttccaaggtgtacga900
ccccgagcaacgcaaacgcatgatcactgggcctcagtggtgggctcgctgcaagcaaat960
gaacgtgctggactccttcatcaactactatgattccgagaagcacgccgagaacgccgt1020
gatttttctgcatggtaacgctgcctccagctacctgtggaggcacgtcgtgcctcacat1080
cgagcccgtggctagatgcatcatccctgatctgatcggaatgggtaagtccggcaagag1140
cgggaatggctcatatcgcctcctggatcactacaagtacctcaccgcttggttcgagct1200
gctgaaccttccaaagaaaatcatctttgtgggccacgactggggggcttgtctggcctt1260
tcactactcctacgagcaccaagacaagatcaaggccatcgtccatgctgagagtgtcgt1320
ggacgtgatcgagtccgtaagaagcaaggaaaagaattaggctcggcacggtagctcaca1380
cctgtaatcccagcagccgggtgcagtggctcatgcctgtaatccctgcacttagggagg1440
ctgaggcgggtggatgacctgaggttaggagttcaagaccagcctggccaacatggcgaa1500
acccccatctctactaaaaataacaaaaattagctgggtgtggtggtgggtgtctataat1560
cccagcaacttgggaggctgaggcaggagaatcacttgaacccaggagatggaggttgca1620
gtgagccgagatcatgccattgcactccagcctgggccacaagagcaaaactctgtctca1680
aaaaaacaaaacaaaagcggccgc1704
<210>2
<211>8
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>sgfi序列
<400>2
gcgatcgc8
<210>3
<211>6
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>xhoi序列
<400>3
ctcgag6
<210>4
<211>8
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>pmei
<400>4
gtttaaac8
<210>5
<211>28
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>circ-rluc-ires-report-f
<400>5
tatgctagcctttttttttgagacagag28
<210>6
<211>30
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>circ-rluc-ires-report-r
<400>6
tagcggccgcttttgttttgtttttttgag30
<210>7
<211>32
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>emcv-ires-f
<400>7
atctcgaggcccctctccctccccccccccta32
<210>8
<211>36
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>emcv-ires-r
<400>8
tagtttaaactttttcaaaggaaaaccacgtccccg36
- 还没有人留言评论。精彩留言会获得点赞!