一种高纯度熊去氧胆酸的制备方法与流程
1.本发明涉及生物技术领域,尤其是一种高纯度熊去氧胆酸的制备方法,还涉及制备高纯度熊去氧胆酸的耐碱性酶。
背景技术:
2.熊去氧胆酸(udca)的化学名称为:3α,7β-二羟基-5β-胆甾烷-24酸,分子式为c
24h40
o4,分子量392.58,白色结晶粉末,熔点200-203℃,无臭,易溶于乙醇、冰醋酸、氢氧化钠试液,在三氯甲烷中不溶。
3.udca是一种无毒性亲水胆汁酸,可以竞争性抑制毒性内源性胆汁酸在回肠中的吸收。通过激活ca
2+
、蛋白激酶c组成的信号网络,来激活分裂活性蛋白激酶,从而增强胆汁澉积肝细胞的分泌能力,使血液及肝细胞中的内源性疏水胆汁酸浓度下降,可用治疗胆汁淤积行疾病。在临床上,熊去氧胆酸主要用于溶解胆固醇型胆结石,原发性胆汁肝硬化pbc,慢性丙型肝炎,同时还用于酒精性肝病,非酒精性脂肪肝、良性复发性肝内胆汁淤积症、先天性内胆管囊性扩张症,是治疗肝硬化的一线药物,临床上疗效好,副作用小,应用广泛,市场缺口大。
4.目前,国内外主要使用化学法以鹅去氧胆酸为原料经过氧化、还原两步化学反应制备熊去氧胆酸,反应过程中使用氧化、还原剂和大量的溶剂,且鹅去氧胆酸转化率较低,只有80%左右的鹅去氧胆酸转化为熊去氧胆酸,后处理需要进行拆分,精制等过程,且产物中含有鹅去氧胆酸及其他双氧化物杂质很难除掉,对产品质量影响很大,目前市售的熊去氧胆酸纯度不高。
5.绿色酶催化工艺这几年蓬勃发展,但是受制于原料7k-lca在弱碱性水溶液中的溶解度有限,生物酶对有机溶剂的耐受度差,稳定性差及工作ph与反应体系不相容等共同缺陷,使生物法合成udca转化效率低,产品杂质多无法满足药典要求,难以实现产业化生产。
6.并且,原料3α-羟基-7-氧代-5β-胆烷酸即7k-lca,在中性溶剂中的溶解度低,较低的溶解度直接导致反应效率难以提升。而7k-lca在偏碱性溶液中的溶解度高,但是在利用酶转化方法制备时,碱性越强,酶的活力越差,反应效率仍难以提升。
7.现有技术中提供了一些利用酶转化7k-lca制备熊去氧胆酸的方法,例如cn107980064a、cn105861613a、cn106520888a和cn108251491a等。然而,包括上述专利的现有技术均未能关注熊去氧胆酸相关酶的耐碱性,因此熊去氧胆酸的提取效率和纯度均难以进一步提高。
技术实现要素:
8.为了解决上述问题,本发明旨在提供一种用于制备高纯度熊去氧胆酸的耐碱性酶,以及利用耐碱性酶高效转化7k-lca制备熊去氧胆酸的方法,使得制备出的熊去氧胆酸产品纯度达到99.5%以上,ee值》95%,单杂含量小于0.5%,符合药典的要求。
9.一方面,本技术提供了一种耐碱性7β-hsdh酶,所述耐碱性7β-hsdh酶的氨基酸序
列与seq id no.1所示氨基酸序列相比,在seq id no.1所述序列的第228位丝氨酸存在突变,所述第228位丝氨酸突变为苯丙氨酸或缬氨酸。
10.另一方面,本技术还提供了编码上述耐碱性7β-hsdh酶的核酸。
11.优选的,所述核酸的碱基序列与序列表中seq id no.2所示碱基序列相比,将编码第228位丝氨酸的碱基agt替换为编码苯丙氨酸的碱基ttt或编码缬氨酸的碱基gtt。
12.另一方面,本技术还公开了一种重组表达载体,所述重组表达载体包含上述核酸;优选的,所述重组表达载体的骨架载体包括pet-22b。
13.另一方面,本技术还公开了一种宿主细胞,包含上述的核酸或上述重组表达载体;优选的,所述宿主细胞是大肠杆菌,更优选,大肠杆菌bl21(de3)。
14.另一方面,本技术还提供了一种制备高纯度熊去氧胆酸的方法,所述方法包括利用上述耐碱性7β-hsdh酶制备熊去氧胆酸的步骤。
15.进一步地,所述方法包括:
16.步骤一:利用所述的耐碱性7β-hsdh酶以及葡萄糖脱氢酶gdh和辅酶nadph将7k-lca转化为熊去氧胆酸,获得转化液;
17.步骤二:将所述转化液升温并加入絮凝剂使蛋白质絮凝沉降,浓缩后调至酸性,获得熊去氧胆酸粗品;
18.步骤三:将所述熊去氧胆酸粗品溶解并进行硅烷化纯化,经过滤、洗涤、干燥后,即获得所述高纯度熊去氧胆酸;
19.优选的,所述葡萄糖脱氢酶gdh的氨基酸序列如seq id no.3所示;
20.优选的,所述葡萄糖脱氢酶gdh通过以下方法获得:
21.将筛选获得的来源于枯草芽孢杆菌的gdh酶基因序列在大肠杆菌中进行重组表达,以获得具有氨苄抗性的重组菌株,将所述重组菌株进行发酵培养后破碎,获得具有耐碱性的gdh酶。
22.进一步地,所述步骤一还包括将7k-lca与醇溶剂、缓冲液、葡萄糖混合的步骤。
23.优选的,所述醇溶剂选自甲醇、乙醇、叔丁醇、异丙醇中的一种或多种。
24.优选的,所述缓冲液为tris-hcl缓冲溶液。
25.优选的,醇溶剂和缓冲液的体积比为1:3。
26.优选的,混合后控制7k-lca终浓度为10~30mm,7β-hsdh酶的酶活反应终浓度为8~30uml-1
,gdh酶的酶活反应终浓度为3~10uml-1
,辅酶nadph的终浓度为0.1~1mm,葡萄糖终浓度为10~30mm。
27.优选的,混合后控制7k-lca终浓度为15~25mm,7β-hsdh酶的酶活反应终浓度为10~20uml-1
,gdh酶的酶活反应终浓度为5~8uml-1
,辅酶nadph的终浓度为0.3~0.6mm,葡萄糖终浓度为15~25mm。
28.优选的,7k-lca浓度为20mm,7β-hsdh酶的活性为15uml-1
,gdh酶的用量为5uml-1
,辅酶nadph的浓度为0.5mm,葡萄糖浓度为20mm。
29.优选的,所述转化的条件为:温度35-38℃,ph为8-10,转化时间2-5小时,更优选,转化条件中ph为8.5~9.0。
30.优选的,上述方法中使用的7β-hsdh酶,gdh酶以及辅酶nadph的变性温度为65-85℃。
31.进一步地,所述步骤二中,将转化液升温至65-75℃,优选70℃;
32.所述絮凝剂包括壳聚糖;
33.所述调至酸性为调至ph为1-3。
34.进一步地,所述步骤三中,采用dmf溶解所述熊去氧胆酸粗品,并加入六甲基二硅氮烷于30-40℃反应1-3h进行硅烷化纯化。
35.优选的,本技术采用的原料7k-lca采用精制过的7k-lca原料。更优选,可以采用参考专利文献cn 110003302 b提供的方法精制过的7k-lca原料。
36.另一方面,本技术还提供了采用上述制备方法制备获得的熊去氧胆酸。
37.另一方面,本技术还提供了上述耐碱性7β-hsdh酶、核酸、重组表达载体或宿主细胞在制备熊去氧胆酸中的应用。
38.本技术提供的技术方案具有如下有益效果:
39.1、本技术提供的用于制备高纯度熊去氧胆酸的耐碱性酶,即7β-hsdh酶,是酶法催化制备udca的关键瓶颈,其活性、稳定性、耐碱性及溶剂耐受性均能显著影响酶促路线的经济性,而本技术将筛选获得的7β-hsdh基因,经密码子优化后,构建重组质粒pet-22b-7β-hsdh,以e.coli bl21(de3)为宿主构建重组菌,通过诱变筛选,获得耐碱性菌株,同时对序列进行进一步分析发现,其最适ph从6.5提升至8.5~9.0,显示出了优异的耐碱性,可以用于高转化率地制备熊去氧胆酸;
40.2、本发明提供的利用绿色酶催化制备高纯度熊去氧胆酸的方法,采用精制过的7k-lca为原料,从原料7k-lca进行质量控制,并采用自制的耐碱性酶进行催化,将7k-lca一步转化为熊去氧胆酸,转化率99.2%,精制后,产品纯度达到99.5%以上,ee值》95%,单杂含量小于0.5%,符合药典的要求,能够低污染、可持续、易工业化的获得高质量的熊去氧胆酸。
41.3、本技术提供的高纯度的熊去氧胆酸的制备方法中,还采用了耐碱性的gdh酶,该酶从假单胞菌中筛选得到,通过基因重组技术在大肠杆菌中进行表达,镍亲和层析柱纯化后得到gdh酶液,该gdh酶具有耐碱特性,最适反应ph为9.0,在ph9-11范围内具有较高酶催化活力;
42.4、本技术提供的高纯度的熊去氧胆酸的制备方法,还采用多元醇与缓冲液的双向反应体系,ph控制在8-10之间,以增加7k-lca的溶解度,实现了熊去氧胆酸的中试放大生产,目前已经放大至200l反应体系,产品质量达标,可以实现合格产品的生产。
附图说明
43.此处所说明的附图用来提供对本技术的进一步理解,构成本技术的一部分,本技术的示意性实施例及其说明用于解释本技术,并不构成对本技术的不当限定。在附图中:
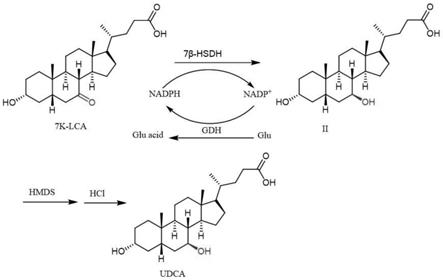
44.图1是本技术提供的高纯度熊去氧胆酸制备方法的合成路线图;
45.图2是采用本技术制备方法获得的熊去氧胆酸的高效液相色谱图。
具体实施方式
46.为了更清楚的阐释本技术的整体构思,下面以实施例的方式进行详细说明。在下文的描述中,给出了大量具体的细节以便提供对本技术更为彻底的理解。然而,对于本领域
技术人员来说显而易见的是,本技术可以无需一个或多个这些细节而得以实施。在其他的例子中,为了避免与本技术发生混淆,对于本领域公知的一些技术特征未进行描述。
47.下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
48.下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
49.在下述实施例提供的熊去氧胆酸的制备方法中,原料7k-lca参考专利cn10003302b提供的方法制备,即采用精制过的7k-lca原料。
50.实施例1耐碱性7β-hsdh酶的制备
51.从基因库中筛选获得7β-hsdh酶氨基酸序列,如序列表中seq id no.1所示,该序列经过优化后的碱基序列如序列表中seq id no.2所示。
52.利用上述核酸基因序列构建重组质粒pet-22b-7β-hsdh,以e.coli bl21(de3)为宿主构建重组菌,通过诱变筛选,获得耐碱性菌株2株,经鉴定后分别命名为s228f(第228位丝氨酸替换为苯丙氨酸)和s228v(第228位丝氨酸替换为缬氨酸),并利用该耐碱性菌株制备耐碱性7β-hsdh酶,获得的7β-hsdh酶是形成的新氨基酸序列的衍生蛋白质。
53.对s228f和s228v的最适ph进行分析,结果显示,与野生型7β-hsdh酶相比,s228f最适ph从6.5提高到9.0,s228v最适ph从6.5提高到8.5。
54.其中,利用耐碱性菌株制备耐碱性7β-hsdh酶的具体方法如下(以s228f为例):
55.步骤s1、s228f大肠杆菌突变株为pet-22b重组菌体突变株,具有氨苄抗性;
56.步骤s2、将s228f突变株大肠杆菌在摇瓶中对发酵,培养基为tb培养基,培养温度37℃,转速220r/min,培养至od600为0.4~0.6时,加入iptg进行诱导,诱导温度16℃,转速220r/min,培养16小时;
57.步骤s4、发酵结束后收集菌体,超声破碎后得到7β-hsdh酶的粗酶液,经镍柱亲和层析纯化,得到高纯度酶蛋白,经测定酶活约为180u/ml,sds-page电泳检测酶液纯度大于95%。并且经测试得知,该酶的变性温度为65-85℃。
58.利用s228v菌株制备耐碱性7β-hsdh酶的具体方法与上述方法完全相同,经测定酶活约为172u/ml,sds-page电泳检测酶液纯度大于95%,该酶的变性温度为65-85℃。
59.实施例2耐碱性gdh酶的制备
60.从基因库中筛选获得耐碱性的gdh酶基因序列,并利用生物技术制备耐碱性的gdh酶,其氨基酸序列如seq id no.3所示,其基因序列如seq id no.4所示。具体步骤如下:
61.步骤s1、将筛选得到的来源于枯草芽孢杆菌的gdh酶基因序列在大肠杆菌中进行重组表达,重组菌株具有氨苄抗性;
62.步骤s2、将重组菌株在摇瓶中对发酵,培养基为tb培养基,培养温度37℃,转速220r/min,培养至od600为0.4~0.6时,加入iptg进行诱导,诱导温度16℃,转速220r/min,培养16小时;
63.步骤s4、发酵结束后收集菌体,按照1:25(w/v)比例进行超声破碎后得到gdh酶的粗酶液,经测定该酶最适反应ph值为9.0,最适反应温度为40℃。并且经测试得知,该酶的变性温度为65-85℃。
64.实施例3高纯度熊去氧胆酸的制备方法
65.利用实施例1的耐碱性7β-hsdh酶s228f和实施例2提供的耐碱性gdh酶制备高纯度的熊去氧胆酸,具体步骤如下:
66.步骤一、向搪瓷反应釜中加入25l乙醇和1.1kg7-klca,搅拌溶解;加入100mm tris-hcl缓冲溶液(ph=9.0)100l,葡萄糖360.32g,nadph
·
4na 83g,实施例2获得的gdh酶液9.7l(酶活6.5u/ml),实施例1获得的7β-hsdh酶液15l(酶活14u/ml),反应体系补水至200l,投料完毕后,保持35-38℃反应3小时,获得转化液;
67.步骤二、tlc监测,直至原料的基本消失后,将转化液升温至70℃,并加入壳聚糖使蛋白变性絮凝后沉降;
68.步骤三、抽取上清液直接进行浓缩,底部溶液过板框后,减压回收乙醇,降至室温,浓缩液中滴加盐酸调ph至2左右,过滤,滤饼水洗至中性,70-80℃干燥,得到熊去氧胆酸粗品;
69.步骤四、纯化精制:将制备得到的熊去氧胆酸粗品,加入到反应容釜中,加入dmf,搅拌溶解后加入hmds,30-40℃反应2h,降至室温过滤,滤饼水洗至中性后,干燥,得到高纯度的熊去氧胆酸。
70.采用上述方法制备获得的熊去氧胆酸终产品936g,反应后收率高达85.1%,纯度99.5%,总杂0.5%。其高效液相色谱图如图2所示。
71.利用实施例1的耐碱性7β-hsdh酶s228v和实施例2提供的耐碱性gdh酶制备高纯度的熊去氧胆酸,制备方法与上述方法大致相同,区别仅在于,步骤一中反应体系的ph调至8.5。最终制备获得熊去氧胆酸终产品872g,反应后收率高达79.2%,纯度99.5%,总杂0.5%。
72.对比例1:
73.该对比例采用野生型非耐碱性的7β-hsdh酶和gdh酶进行制备,其余步骤与实施例3的制备方法大致相同。
74.该对比例最终获得熊去氧胆酸795g,反应后收率为72.3%,纯度99.5%,总杂0.5%,效果远不如实施例3。
75.综合上述可知,上述实施例提供的耐碱性酶以及利用该耐碱性酶制备熊去氧胆酸的方法,能够显著提高从原料7k-lca转化为熊去氧胆酸的转化率,并且产品纯度高,符合药典的要求,即该方法能够低污染、可持续、易工业化的获得高质量的熊去氧胆酸。
76.以上所述仅为本技术的实施例而已,并不用于限制本技术。对于本领域技术人员来说,本技术可以有各种更改和变化。凡在本技术的精神和原理之内所作的任何修改、等同替换、改进等,均应包含在本技术的权利要求范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1