一种抗肿瘤活性的吡咯烷基螺氧化吲哚类化合物及其合成方法
1.本发明属于生物医药领域,具体涉及一种抗肿瘤活性的吡咯烷基螺氧化吲哚类化合物及其合成方法。
背景技术:
2.全球人口中癌症的高患病率和致死率促使人们更加努力地寻找新的治疗方案,化疗是最常见的策略之一。开发癌症化疗药物的主要挑战因素是提高选择性并减少对正常细胞和组织的副作用。由于药物的功效和毒性与其亚细胞分布密切相关,因此靶向亚细胞细胞器的治疗诊断学逐渐引起科研界以及学术界的广泛关注。
3.在细胞器中,线粒体作为细胞能量代谢、物质合成和死亡的调节中心,通常呈现出不同的形态和亚细胞分布,以动态网络的形式发挥作用,受到了广泛关注。大量研究表明,许多人类疾病都与功能性线粒体密切相关,例如神经退行性疾病、心血管疾病、代谢紊乱和癌症。最近的研究表明,在细胞凋亡的早期阶段,线粒体形态发生了巨大的变化,即网络分裂和嵴的重塑,表明线粒体与细胞凋亡通路密切相关。此外,越来越多的证据表明,肿瘤的发生、发展和转移与线粒体功能障碍有关,尤其是线粒体的形态变化会产生很大的影响。
4.因此,靶向线粒体的抗癌药物设计是肿瘤药物开发的新方向。
技术实现要素:
5.一种抗肿瘤活性的吡咯烷基螺氧化吲哚类化合物及其合成方法,该类螺环化合物能够高效的诱导肿瘤细胞线粒体形态发生改变,启动线粒体自噬途径,诱导癌细胞死亡;并且,本发明还提供一种该类螺环化合物的高效合成方法。
6.一种抗肿瘤活性的吡咯烷基螺氧化吲哚类化合物,结构式为:
[0007][0008]
其中r1选自-h,-me,-cl,-br,-ocf3;r2选自-f,-cl,-br,-och3;r3选自对甲苯磺酰基、对甲氧苯磺酰基、苯磺酰基。
[0009]
一种抗肿瘤活性的吡咯烷基螺氧化吲哚类化合物,结构式选自:
[0010]
一种抗肿瘤活性的吡咯烷基螺氧化吲哚类化合物,结构式选自:
[0011][0012]
一种上述抗肿瘤活性的吡咯烷基螺氧化吲哚类化合物的应用,用于制备抗肿瘤药物。
[0013]
一种上述抗肿瘤活性的吡咯烷基螺氧化吲哚类化合物的应用,用于制备适应症包括急性髓性白血病的抗肿瘤药物。
[0014]
进一步,上述抗肿瘤活性的吡咯烷基螺氧化吲哚类化合物有效在体浓度为10μm~10mm。
[0015]
一种上述抗肿瘤活性的吡咯烷基螺氧化吲哚类化合物的制备方法,步骤包括:
[0016][0017]
进一步,溶剂为mtbe,反应温度为35~45℃;
[0018]
进一步,化合物i、化合物ii、碳酸氢铵的摩尔比为0.4:0.3~0.6:0.8~2.0;
391.1112。
[0036]
实施例2:
[0037]
向一只10毫升的反应管中依次加入底物1b(0.4mmol,100.4mg),2a(0.4mmol,118mg)、碳酸氢铵(1.2mmol,94.9mg)以及4毫升甲基叔丁基醚。将反应混合液在40℃条件下搅拌17小时后停止反应,向反应体系中加入水淬灭,随后以二氯甲烷萃取(15ml*3),合并有机相,饱和氯化钠洗、无水硫酸钠干燥,过滤后真空浓缩得粗产品。所得粗产品通过柱层析法进行纯化分离,得到白色产物3b,分离产率为75%。
[0038]
mp:98-102℃.1h nmr(600mhz,dmso-d6)δ10.96(s,1h),7.69(d,j=8.4hz,2h),7.34(d,j=8.4hz,2h),7.30(d,j=8.4hz,1h),7.27(d,j=7.8hz,1h),7.24-7.20(m,2h),7.05-7.02(m,2h),6.74(s,1h),3.54(d,j=16.2hz,1h),3.33(d,j=15.6hz,1h),2.36(s,3h)ppm;
13
c nmr(150mhz,dmso-d6)δ177.1,145.0,143.6,143.5 141.5,140.9,136.4,132.1,130.2(2c),128.5,127.7(2c),125.9,123.6,116.8,112.4,111.8,71.7,41.8,21.4ppm;hrms(esi):m/z[m+h]
+
calcd for c
23h18
f3n2o4s
+
475.0939;found 475.0935.。
[0039]
实施例3:
[0040]
向一只10毫升的反应管中依次加入底物1c(0.4mmol,80.8mg),2a(0.4mmol,118mg)、碳酸氢铵(1.2mmol,94.9mg)以及4毫升甲基叔丁基醚。将反应混合液在40℃条件下搅拌17小时后停止反应,向反应体系中加入水淬灭,随后以二氯甲烷萃取(15ml*3),合并有机相,饱和氯化钠洗、无水硫酸钠干燥,过滤后真空浓缩得粗产品。所得粗产品通过柱层析法进行纯化分离,得到白色产物3c,分离产率为82%。
[0041]
mp:253-255℃.1h nmr(400mhz,dmso-d6)δ10.91(s,1h),7.59(d,j=8.0hz,2h),7.36-7.23(m,6h),7.05(t,j=7.2hz,1h),6.95(d,j=8.4hz,1h),6.50(s,1h),3.51(d,j=16.4hz,1h),3.30(d,j=16.4hz,1h),2.36(s,3h)ppm;
13
c nmr(100mhz,dmso-d6)δ176.8,145.0,141.5,140.6,136.3,131.7,130.1(2c),130.0,128.6,127.8,127.6,126.3,126.0,123.6(2c),123.3,112.5,112.4,71.4,41.7,21.5ppm;hrms(esi):m/z[m+h]
+
calcd for c
22h18
cln2o3s
+
425.0727;found 425.0718。
[0042]
实施例4:
[0043]
向一只10毫升的反应管中依次加入底物1a(0.4mmol,66.8mg),2b(0.4mmol,132mg)、碳酸氢铵(1.2mmol,94.9mg)以及4毫升甲基叔丁基醚。将反应混合液在40℃条件下搅拌17小时后停止反应,向反应体系中加入水淬灭,随后以二氯甲烷萃取(15ml*3),合并有机相,饱和氯化钠洗、无水硫酸钠干燥,过滤后真空浓缩得粗产品。所得粗产品通过柱层析法进行纯化分离,得到红色产物3d,分离产率为85%。
[0044]
mp:174-177℃.1h nmr(400mhz,dmso-d6)δ10.79(s,1h),7.69(d,j=8.0hz,2h),7.37(d,j=8.0hz,2h),7.28(d,j=7.6hz,2h),7.10(d,j=10.4hz,2h),6.94(d,j=8.0hz,1h),6.86-6.82(m,2h),3.51(d,j=16.4hz,1h),3.25(d,j=16.4hz,1h),2.38(s,3h)ppm;
13
c nmr(100mhz,dmso-d6)δ176.7,145.2,143.0,141.6,136.1,132.6,130.4,130.3(2c),127.9(2c),127.3,127.2 123.2,122.6,112.0,110.9,72.6,67.5,41.4,25.6,21.5ppm;hrms(esi):m/z[m+h]
+
calcd for c
22h18
cln2o3s
+
425.0727;found 425.0725。
[0045]
实施例5:
[0046]
向一只10毫升的反应管中依次加入底物1a(0.4mmol,66.8mg),2c(0.4mmol,
119.6mg)、碳酸氢铵(1.2mmol,94.9mg)以及4毫升甲基叔丁基醚。将反应混合液在40℃条件下搅拌17小时后停止反应,向反应体系中加入水淬灭,随后以二氯甲烷萃取(15ml*3),合并有机相,饱和氯化钠洗、无水硫酸钠干燥,过滤后真空浓缩得粗产品。所得粗产品通过柱层析法进行纯化分离,得到红色产物3e,分离产率为90%。
[0047]
mp:207-210℃.1h nmr(400mhz,dmso-d6)δ10.80(s,1h),7.88-7.85(m,2h),7.38(t,j=13.2hz,2h)7.29-7.25(m,4h),7.07-7.03(m,1h),6.95(d,j=7.6hz,1h),6.81(t,j=7.6hz,1h),6.73(d,j=7.2hz,1h)3.55(d,j=16.4hz,1h),3.25(d,j=16.4hz,1h)ppm;
13
c nmr(125mhz,cdcl3)δ177.7,141.4,139.7,136.4,130.8,130.8,130.5,130.0,128.2,127.3,125.4,123.3,123.0,122.8,116.2,116.1,112.5,110.9,71.8,42.2,29.7ppm;hrms(esi):m/z[m+h]
+
calcd for c
21h16
fn2o3s
+
395.0866;found 395.0863。
[0048]
实施例6:
[0049]
向一只10毫升的反应管中依次加入底物1f(0.4mmol,66.8mg),2d(0.4mmol,132mg)、碳酸氢铵(1.2mmol,94.9mg)以及4毫升甲基叔丁基醚。将反应混合液在40℃条件下搅拌17小时后停止反应,向反应体系中加入水淬灭,随后以二氯甲烷萃取(15ml*3),合并有机相,饱和氯化钠洗、无水硫酸钠干燥,过滤后真空浓缩得粗产品。所得粗产品通过柱层析法进行纯化分离,得到红色产物3f,分离产率为78%
[0050]
mp:222-226℃.1h nmr(600mhz,cdcl3)δ8.07(s,1h),7.76(d,j=7.6hz,2h),7.26(t,j=9.6hz,1h),7.22-7.18(m,3h),7.14(t,j=8.4hz,1h),6.98(d,j=7.8hz,1h),6.94(t,j=7.8hz,2h),6.88(t,j=7.8hz,1h)3.72(d,j=16.8hz,1h),3.30(d,j=16.2hz,1h),2.38(s,3h)ppm;
13
c nmr(150mhz,cdcl3)δ177.1,144.5,142.9,139.6,136.2,131.0,130.6,123.0,129.7,129.6(2c),128.0(2c),125.7,123.1,123.2,123.0,110.7,110.6,71.4,41.5,21.6ppm;hrms(esi):m/z[m+h]
+
calcd for c
22h18
cln2o3s
+
425.0727;found 425.0718。
[0051]
实施例7:
[0052]
向一只10毫升的反应管中依次加入底物1a(0.4mmol,66.8mg),2e(0.4mmol,112.4mg)、碳酸氢铵(1.2mmol,94.9mg)以及4毫升甲基叔丁基醚。将反应混合液在40℃条件下搅拌17小时后停止反应,向反应体系中加入水淬灭,随后以二氯甲烷萃取(15ml*3),合并有机相,饱和氯化钠洗、无水硫酸钠干燥,过滤后真空浓缩得粗产品。所得粗产品通过柱层析法进行纯化分离,得到红色产物3g,分离产率为88%mp:138-140℃.1h nmr(400mhz,dmso-d6)δ10.77(s,1h),7.81(d,j=7.6hz,2h),7.67(t,j=7.2hz,1h),7.53(t,j=7.6hz,2h),7.29-7.23(m,4h),7.06-7.02(m,1h),6.95(d,j=8.0hz,1h),6.80(t,j=7.2hz,1h),6.73(t,j=7.2hz,1h),3.55(d,j=16.2.4hz,1h),3.25(d,j=16.4hz,1h)ppm;
13
c nmr(100mhz,dmso-d6)δ177.1,141.6,141.5,139.34,134.2,130.8,130.2,129.7(2c),128.4,128.0,127.8(2c),125.9,123.5,123.0,122.5,112.3,110.8,71.8,42.1ppm;hrms(esi):m/z[m+h]
+
calcd for c
21h17
n2o3s
+
377.096;found 377.0955。
[0053]
实施例8:
[0054]
向一只10毫升的反应管中依次加入底物1a(0.4mmol,66.8mg),2f(0.4mmol,112.4mg)、碳酸氢铵(1.2mmol,94.9mg)以及4毫升甲基叔丁基醚。将反应混合液在40℃条件下搅拌17小时后停止反应,向反应体系中加入水淬灭,随后以二氯甲烷萃取(15ml*3),合并有机相,饱和氯化钠洗、无水硫酸钠干燥,过滤后真空浓缩得粗产品。所得粗产品通过柱层
析法进行纯化分离,得到红色产物3g,分离产率为88%mp:138-140℃.1h nmr(400mhz,dmso-d6)δ10.77(s,1h),7.81(d,j=7.6hz,2h),7.67(t,j=7.2hz,1h),7.53(t,j=7.6hz,2h),7.29-7.23(m,4h),7.06-7.02(m,1h),6.95(d,j=8.0hz,1h),6.80(t,j=7.2hz,1h),6.73(t,j=7.2hz,1h),3.55(d,j=16.2.4hz,1h),3.25(d,j=16.4hz,1h)ppm;
13
c nmr(100mhz,dmso-d6)δ177.1,141.6,141.5,139.34,134.2,130.8,130.2,129.7(2c),128.4,128.0,127.8(2c),125.9,123.5,123.0,122.5,112.3,110.8,71.8,42.1ppm;hrms(esi):m/z[m+h]
+
calcd for c
21h17
n2o3s
+
377.096;found 377.0955。
[0055]
实施例9:
[0056]
向一只10毫升的反应管中依次加入底物1a(0.4mmol,66.8mg),2g(0.4mmol,124mg)、碳酸氢铵(1.2mmol,94.9mg)以及4毫升甲基叔丁基醚。将反应混合液在40℃条件下搅拌17小时后停止反应,向反应体系中加入水淬灭,随后以二氯甲烷萃取(15ml*3),合并有机相,饱和氯化钠洗、无水硫酸钠干燥,过滤后真空浓缩得粗产品。所得粗产品通过柱层析法进行纯化分离,得到白色产物3h,分离产率为70%mp:245-248℃.1h nmr(600mhz,cdcl3)δ7.87(d,j=9.0hz,2h),7.71(s,1h),7.25-7.23(m,2h),7.19-7.15(m,2h),6.99(t,j=7.2hz,1h),6.95(d,j=7.2hz,1h),6.92(d,j=7.8hz,1h),6.89-6.86(m,3h),3.83(s,3h),3.74(d,j=15.6hz,1h),3.22(d,j=16.2hz,1h)ppm;
13
c nmr(150mhz,cdcl3)δ177.4,163.3,141.7,139.4,131.0,130.9,130.3(2c),129.7,128.1,127.2,125.2,123.1,122.9,122.9,114.1(2c),112.4,110.5,71.7,55.6,42.2ppm;hrms(esi):m/z[m+h]
+
calcd for c
22h19
n2o4s
+
407.1065;found 407.1062。
[0057]
实施例10:
[0058]
向一只10毫升的反应管中依次加入底物1d(0.4mmol,97.6mg),2a(0.4mmol,118mg)、碳酸氢铵(1.2mmol,94.9mg)以及4毫升甲基叔丁基醚。将反应混合液在40℃条件下搅拌17小时后停止反应,向反应体系中加入水淬灭,随后以二氯甲烷萃取(15ml*3),合并有机相,饱和氯化钠洗、无水硫酸钠干燥,过滤后真空浓缩得粗产品。所得粗产品通过柱层析法进行纯化分离,得到黄色产物3i,分离产率为72%mp:270-274℃.1h nmr(400mhz,cdcl3)δ7.88(d,j=8.4hz,2h),7.74(s,1h),7.40(d,j=8.0hz,1h),7.25(d,j=9.6hz,2h),7.21-7.15(m,3h),7.01-6.93(m,2h),6.80(t,j=7.6hz,1h),3.73(d,j=15.6hz,1h),3.21(d,j=15.6hz,1h),2.39(s,3h)ppm;
13
c nmr(150mhz,cdcl3)δ176.2,144.4,141.4,138.7,136.2,132.5,132.4,129.6(2c),128.2,128.1(2c),126.8,125.2,124.4,123.1,121.5,112.4,103.6,72.9,42.3,21.6ppm;hrms(esi):m/z[m+h]
+
calcd for c
22h18
brn2o3s
+
469.0222;found 469.0222。
[0059]
实施例11:
[0060]
向一只10毫升的反应管中依次加入底物1e(0.4mmol,118mg),2a(0.4mmol,66.8mg)、碳酸氢铵(1.2mmol,94.9mg)以及4毫升甲基叔丁基醚。将反应混合液在40℃条件下搅拌17小时后停止反应,向反应体系中加入水淬灭,随后以二氯甲烷萃取(15ml*3),合并有机相,饱和氯化钠洗、无水硫酸钠干燥,过滤后真空浓缩得粗产品。所得粗产品通过柱层析法进行纯化分离,得到黄色产物3j,分离产率为70%mp:250-255℃.1h nmr(600mhz,dmso-d6)δ11.24(s,1h),7.74(d,j=8.4hz,2h),7.37(d,j=7.8hz,3h),7.26(d,j=7.2hz,1h),7.22(t,j=7.8hz,1h),7.16(d,j=8.4hz,1h),7.03(t,j=7.2hz,1h),6.88(t,j=
7.8hz,1h),6.78(d,j=7.8hz,1h),3.55(d,j=16.2hz,1h),3.30(d,j=16.2hz,1h),2.37(s,3h)ppm;
13
c nmr(150mhz,dmso-d6)δ176.7,144.5,140.9,138.8,135.8,132.3,129.8(2c),128.0,127.5(2c),127.3,125.5,123.5,123.1,121.1,114.5,111.8,71.8,41.6,21.0ppm;hrms(esi):m/z[m+h]
+
calcd for c
22h18
cln2o3s
+
425.0727;found 425.0725。
[0061]
实施例12:
[0062]
向一只10毫升的反应管中依次加入底物1f(0.4mmol,97.6mg),2a(0.4mmol,118mg)、碳酸氢铵(1.2mmol,94.9mg)以及4毫升甲基叔丁基醚。将反应混合液在40℃条件下搅拌17小时后停止反应,向反应体系中加入水淬灭,随后以二氯甲烷萃取(15ml*3),合并有机相,饱和氯化钠洗、无水硫酸钠干燥,过滤后真空浓缩得粗产品。所得粗产品通过柱层析法进行纯化分离,得到白色产物3k,分离产率为90%mp:269-273℃.1h nmr(400mhz,dmso-d6)δ10.91(s,1h),7.56(d,j=8.0hz,2h),7.44(d,j=8.0hz,1h),7.37(d,j=8.0hz,1h),7.31-7.25(m,4h),7.06(t,j=7.6hz,1h),6.91(d,j=8.0hz,1h),6.57(s,1h),3.51(d,j=16.0hz,1h),3.30(d,j=16.4hz,1h),2.37(s,3h)ppm;
13
c nmr(100mhz,dmso-d6)δ176.6,145.0,141.5,141.0,136.3,132.9,132.0,130.2(2c),128.6,127.8,127.5(2c),126.0,125.9,123.7,114.0,112.9,112.5,71.3,41.7,21.6ppm;hrms(esi):m/z[m+h]
+
calcd for c
22h18
brn2o3s
+
469.0222;found 469.0196。
[0063]
实施例13:
[0064]
向一只10毫升的反应管中依次加入底物1a(0.4mmol,66.8mg),2h(0.4mmol,148.4mg)、碳酸氢铵(1.2mmol,94.9mg)以及4毫升甲基叔丁基醚。将反应混合液在40℃条件下搅拌17小时后停止反应,向反应体系中加入水淬灭,随后以二氯甲烷萃取(15ml*3),合并有机相,饱和氯化钠洗、无水硫酸钠干燥,过滤后真空浓缩得粗产品。所得粗产品通过柱层析法进行纯化分离,得到白色产物3l,分离产率为73%mp:89-93℃.1h nmr(600mhz,cdcl3)δ7.76(d,j=8.4hz,2h),7.72(s,1h),7.44(s,1h),7.28-7.27(m,1h),7.23(d,j=8.4hz,2h),7.13-7.12(m,1h),7.01(d,j=7.8hz,1h),6.93-6.90(m,2h),6.87(d,j=8.4hz,1h),3.65(d,j=16.2hz,1h),3.15(d,j=15.6hz,1h),2.39(s,3h)ppm;
13
c nmr(150mhz,cdcl3)δ176.8,144.5,143.0,139.4,136.0,130.4,130.0,129.7(2c),128.0(2c),126.3,126.2,125.9,123.2,123.0,121.7,115.7,110.6,72.1,41.7,21.6ppm;hrms(esi):m/z[m+h]
+
calcd for c
22h18
brn2o3s
+
469.0222;found 469.0108。
[0065]
实施例14:
[0066]
向一只10毫升的反应管中依次加入底物1a(0.4mmol,66.8mg),2i(0.4mmol,125mg)、碳酸氢铵(1.2mmol,94.9mg)以及4毫升甲基叔丁基醚。将反应混合液在40℃条件下搅拌17小时后停止反应,向反应体系中加入水淬灭,随后以二氯甲烷萃取(15ml*3),合并有机相,饱和氯化钠洗、无水硫酸钠干燥,过滤后真空浓缩得粗产品。所得粗产品通过柱层析法进行纯化分离,得到白色产物3m,分离产率为92%mp:195-198℃.1h nmr(400mhz,dmso-d6)δ10.77(s,1h),7.67(d,j=8.0hz,2h),7.33(d,j=8.4hz,2h),7.28(t,j=7.6hz,1h),7.19-7.16(m,2h),7.05(d,j=9.2hz,1h),6.94(d,j=8.0hz,1h),6.85-6.77(m,2h),3.53(d,j=15.2hz,1h),3.24(d,j=16.4hz,1h),2.37(s,3h)ppm;
13
c nmr(100mhz,dmso-d6)δ176.8,144.9,141.5,138.0,136.3,130.6,130.1(2c),127.9(2c),123.1,122.5,114.8,114.5,113.6,113.3,113.0,112.9,110.8,41.8,25.6,21.5ppm;hrms(esi):m/z[m+h]
+
calcd for c
22h18
fn2o3s
+
409.1022;found 409.1010。
[0067]
实施例15:
[0068]
向一只10毫升的反应管中依次加入底物1g(0.4mmol,72.4mg),2a(0.4mmol,118mg)、碳酸氢铵(1.2mmol,94.9mg)以及4毫升甲基叔丁基醚。将反应混合液在40℃条件下搅拌17小时后停止反应,向反应体系中加入水淬灭,随后以二氯甲烷萃取(15ml*3),合并有机相,饱和氯化钠洗、无水硫酸钠干燥,过滤后真空浓缩得粗产品。所得粗产品通过柱层析法进行纯化分离,得到白色产物3n,分离产率为82%mp:282-284℃.1h nmr(400mhz,dmso-d6)δ10.64(s,1h),7.55(d,j=8.0hz,2h),7.34-7.25(m,5h),7.07-7.02(m,2h),6.83(d,j=8.0hz,1h),6.34(s,1h),3.51(d,j=16.4hz,1h),3.20(d,j=18.8hz,1h),2.36(s,3h),2.01(s,3h)ppm;
13
c nmr(150mhz,cdcl3)δ177.5,143.9,141.8,137.1,136.6,132.5,130.4,130.1,129.3(2c),128.1,127.9(2c),127.3,125.2,123.7,123.0,112.6,110.3,71.6,42.2,21.5,20.8ppm;hrms(esi):m/z[m+h]
+
calcd for c
23h21
n2o3s
+
405.1273;found 405.1261。
[0069]
实施例16:化合物的抗肿瘤活性试验(选择3a评价其对线粒体的损伤作用(附图3))
[0070]
比色测量:为了测试3a的细胞毒性,我们选择了实验室常用的比色测量工具cck-8。我们发现,当3a的给药浓度在10至50μm之间时,化合物没显示出细胞毒活性。由于普遍认为细胞毒测试反映的是细胞的活性而不是线粒体的行为,因此该测试该方法不能够准确地阐明药物对细胞单个线粒体的调控作用。
[0071]
线粒体成像:为了更准确地反映3a对线粒体的损害,我们应用了超分辨显微成像(sim),用于在活细胞中的单个线粒体水平上观察药物对线粒体的作用。sim基于已知的空间结构模式光来激发条纹位置和方向可以多次改变的样品,并记录每个位置的发射荧光信号,从而提供高达100nm的超高分辨率。因此,该工具可以帮助我们准确、定量地研究3a在活细胞系统中的行为。接下来,我们在hela细胞中加入10μm浓度的3a,然后在sim下观察。我们使用商业线粒体探针(mito-tracker green,mtg)在标记以化合物3a处理后的hela细胞中的线粒体。与在0小时捕获的sim图像相比,我们观察到在3a处理12小时和24小时后,线粒体形态已从纤维状变为圆形,表明线粒体被破坏。为了评估线粒体形态,如先前报道的那样引入了长宽比(l/w)。该系统提出了四个标准来测量线粒体的形态,即圆形或近圆形(1.0≤l/w《1.5)、中间(1.5≤l/w《2.0)、管状(2.0≤l/w《5.0)和hyperfusion(l/w≥5.0)。然后我们量化了hela细胞中单个线粒体的分布,发现线粒体形态的分布随着用药时间而改变,表明3a在10μm的浓度下可破坏线粒体形态的分布并诱导线粒体自噬途径,最终促进细胞凋亡。最后,我们通过增加3a的浓度来检查cck-8的检测阈值,发现当3a的浓度增加到150μm时才能观察到对细胞的细胞毒活性,这表明sim在探索药物对亚细胞行为的影响方面更为灵敏。
[0072]
实施例17:急性髓性白血病细胞系hl60活性实验
[0073]
hl-60细胞接种于96孔细胞板中,按照104/ml的浓度铺板,在37度5%co2培养箱培养过夜。随后加入小分子化合物,作用48h。随即加入10ul mtt溶液,4小时后吸走上清,加入dmso进行溶解。溶解后用酶标仪进行吸光度od560nm检测。
[0074]
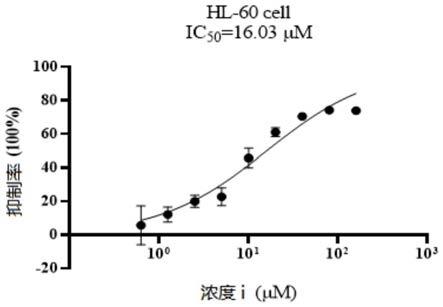
在对急性髓性白血病细胞系hl60抗增殖活性测试中,3j和3i显示出较好的抗增殖活性,在25μm时抑制率》50%。通过mtt测量,3g和3f的ic
50
分别为24.16μm和16.03μm,表明这
些化合物具有潜在的抗肿瘤活性,可进一步开发为抗肿瘤药物。
[0075]
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何不经过创造性劳动想到的变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应该以权利要求书所限定的保护范围为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1