高活性NK细胞的处理方法与流程
高活性nk细胞的处理方法
技术领域
1.本发明涉及具有高细胞毒性活性的细胞的冷冻保存方法。
背景技术:
2.nk细胞在肿瘤细胞和病毒感染细胞的排斥中是重要的。2017年8月嵌合抗原受体(car)t细胞疗法在美国得到承认,其以儿童和青壮年的复发
·
难治性b细胞性急性淋巴细胞白血病(b-all)为适应症,近年来,car-nk替代car-t的临床应用不断扩大(非专利文献1)。
3.在欲向患者施用细胞时,首先研究应用从患者自身采集的细胞,以便不引起排斥反应。但是,根据患者的状态,有时难以采集治疗所需量的细胞。此外,可在体外活化、增殖的程度有个体差异,存在增殖活化困难的情况。而且,由于细胞的活化
·
增殖需要一定时期,存在不能立即开始治疗的问题。在这方面,如果可以预先活化细胞、以供施用且保存,则是期望的。
4.作为保存细胞的方法,已知在短时间保存的情形中不进行冷冻以悬浮状态保存的方法(例如,专利文献1),此外,已知在长时间保存的情形中进行冷冻的保存方法(例如,专利文献2)。作为进一步将细胞冷冻、得到在融解后也维持高生存率的细胞,研究了应用含有钠盐、钾盐、糖、防冻剂、以及碳酸氢盐和/或碳酸盐的用于冷冻的溶液(专利文献3)。
5.现有技术文献
6.专利文献
7.专利文献1:特开2006-230396号公报
8.专利文献2:特开2002-233356号公报
9.专利文献3:wo2011/021618
10.非专利文献
11.非专利文献1:liu e,et al.n engl j med.2020;382:545-53
12.发明概述
13.发明要解决的课题
14.但是,对于应用以往的如二甲亚砜的保护剂的冷冻方法,可以保存t细胞系和原代nk细胞,但对细胞毒性活性高的nk细胞是不足的,通过冷冻融解操作,其活性和生存率显著降低。这不能用程序冷冻、细胞密度调节、葡聚糖、白蛋白、或羧化聚-l-赖氨酸等的添加等解决。然后以一定量的细胞死亡为前提进行用于施用的细胞的包装时,融解后需要用于再活化培养的步骤,得到的细胞需要进一步洗涤。因此存在下列现状,冷冻的、储存的高活性nk细胞只能在符合处理临床用细胞的细胞培养加工设备(cpc)的基准的设备中利用。
15.本发明的课题是提供可适用于高活性nk细胞的维持高生存率和高活性的冷冻保存、融解方法。
16.用于解决课题的手段
17.本发明提供以下各项。
18.[1]细胞的处理方法,其包括以下步骤:
[0019]
(1)将体外活化的细胞在用于细胞培养的培养基中回收;
[0020]
(2)将回收的细胞在用于冷冻保存的液体中悬浮;
[0021]
(3)将悬浮的细胞冷冻。
[0022]
[2][1]中记载的方法,其中,步骤(1)包括通过添加了选自由胆汁酸和苯基丁酸组成的组中的任一种的培养基的处理。
[0023]
[3][1]或[2]中记载的方法,其进一步包括以下步骤:
[0024]
(4)将冷冻保存的细胞融解、在融解溶剂i中悬浮。
[0025]
[4][1]~[3]的任一项中记载的方法,其中,融解溶剂i是包含以下的水溶液:
[0026]
·
氯化钠9.00~108mm、
[0027]
·
葡萄糖酸钠2.30~27.7mm,
[0028]
·
醋酸钠2.70~32.5mm,
[0029]
·
氯化钾0.496~5.96mm,和
[0030]
·
氯化镁0.148~1.78mm。
[0031]
[5][1]~[4]的任一项中记载的方法,其中,融解溶剂i满足以下至少一项:
[0032]
·
不含0.423mm以上的浓度的钙离子,
[0033]
·
不含5.55mm以上的浓度的葡萄糖,和
[0034]
·
不含27.7mm以上的浓度的乳酸盐。
[0035]
[6]用于悬浮高活性nk细胞的液体,其包含以下:
[0036]
·
氯化钠9.00~108mm,
[0037]
·
葡萄糖酸钠2.30~27.7mm,
[0038]
·
醋酸钠2.70~32.5mm,
[0039]
·
氯化钾0.496~5.96mm,和
[0040]
·
氯化镁0.148~1.78mm。
[0041]
[7][6]中记载的液体,其用于悬浮用于冷冻保存的液体中悬浮冷冻的高活性nk细胞。
[0042]
[8]药物组合物,其包含高活性nk细胞、用于冷冻保存的液体、和[6]中记载的液体。
[0043]
[9]包含细胞的药物组合物的制备方法,其包括以下步骤:
[0044]
(1)将体外活化的细胞在用于细胞培养的培养基中回收;
[0045]
(2)将回收的细胞在用于冷冻保存的液体中悬浮;
[0046]
(3)将悬浮的细胞冷冻。
[0047]
[10][9]中记载的制备方法,其中,步骤(1)包括通过添加了选自由胆汁酸和苯基丁酸组成的组中的任一种的培养基的处理。
[0048]
附图简述
[0049]
[图1-1]mito-ferrogreen反应后的各种细胞的流式细胞仪分析结果。高活性nk细胞的铁含量多,怀疑可能引起ferroptosis诱导。
[0050]
[图1-2]高活性nk细胞的冷冻融解时的光学显微镜照片。mp:甲基强的松龙、dex:地塞米松。确认高活性nk细胞的冷冻融解下活力显著降低。
[0051]
[图1-3]高活性nk细胞的融解时的活力。融解时用plasma-lyte a稀释时活力改善。但是,在向kbm501培养基添加葡萄糖酸的情形中,未见到改善。lacto=乳酸林格(lactoringer)
[0052]
[图1-4]图1-3的延续
[0053]
[图2]高活性nk细胞的融解时的活力。融解时用plasma-lyte a稀释时活力改善,但用包含40%血清(人ab型血清)的plasma-lyte a稀释时活力变差。
[0054]
[图3]高活性nk细胞的规定时间静置后的活细胞数和活力(右)与细胞毒性活性(左)。plasma=plasma-lyte a
[0055]
[图4]高活性nk细胞的冷冻预处理的影响。通过冷冻前用添加4-pba的kbm501处理,融解时的活力改善。
[0056]
[图5]2小时预处理后,冷冻、融解的高活性nk细胞的回收率。通过冷冻前用添加4-pba或tudca的kbm501培养基处理,融解时的活力改善。
[0057]
[图6-1]2小时预处理后,冷冻、融解的高活性nk细胞的细胞毒性活性。在悬浮融解后的细胞的液体为plasma-lyte a的情形中,1小时和3小时的两个时点见到tudca浓度依赖性的细胞毒性活性的改善。
[0058]
[图6-2]图6-1的延续
[0059]
[图7-1]2小时预处理后,冷冻、融解的高活性nk细胞的细胞毒性活性。将预处理时的tudca的浓度范围扩大而进行。靶标是k562细胞,在e:t=2∶1、2小时的条件进行。nk细胞的细胞数基于冷冻前计数算出。各图均为:1.融解后即刻、2.plasma-lyte a 1小时、3.plasma-lyte a3小时、4.plasma-lyte a 1小时+kbm5012小时。
[0060]
[图7-2]应用融解后的高活性nk细胞的实体瘤模型中的评价(3d杀伤试验)的结果。
[0061]
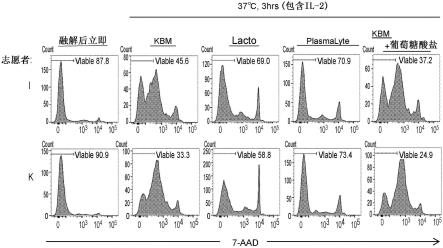
[图8-1]7-add染色后的细胞的流式细胞仪分析。融解后,用规定的溶剂稀释10倍,在室温温育2小时(右)、或在37℃温育3小时(左)。
[0062]
[图8-2]7-add染色后的细胞的流式细胞仪分析。回收时用pbs洗涤(左)、或用kbm501培养基洗涤(右),融解后,用规定的溶剂稀释10倍,在37℃温育3小时。
[0063]
[图8-3]7-add染色后的细胞的流式细胞仪分析。融解后,用各种溶剂稀释10倍,在37℃温育3小时。
[0064]
[图8-4]7-add染色后的细胞的流式细胞仪分析。回收时用pbs洗涤(左)、或用kbm501培养基洗涤(右),融解后,用规定的溶剂稀释10倍,在37℃温育3小时。
[0065]
[图8-5]7-add染色后的细胞的流式细胞仪分析。回收时用pbs洗涤(左)、或用kbm501培养基洗涤(右),融解后,用规定的溶剂稀释10倍,在37℃温育3小时。
[0066]
[图9-1]将洗涤
·
冷冻
·
融解后的高活性nk细胞以施用方式在室温静置0~4小时时的活力推移(a)、细胞毒性活性(b):靶标=k562,e∶t=1:2~4∶1,2小时、细胞毒性活性(c):靶标=k562,e:t=1:1,2~8小时。
[0067]
[图9-2]图9-1的延续
[0068]
[图9-3]洗涤
·
冷冻
·
融解后的高活性nk细胞的细胞毒性活性。以施用方式在室温静置各个时间。靶标=k562、e:t=1∶1、2小时
[0069]
[图10]活力推移。将kbm501培养基或pbs洗涤
·
冷冻后的高活性nk细胞在室温融
解,不进行稀释操作,在室温静置各个时间,其后用kbm501培养基或plasma-lyte a稀释10倍,通过7-aad进行染色,用flowjo软件分析(左)。将kbm501培养基或pbs洗涤
·
冷冻后的高活性nk细胞在37℃融解后,不进行稀释操作,在室温静置各个时间,其后用kbm501培养基或plasma-lyte a稀释10倍,通过7-aad进行染色,用flowjo软件分析(右)。
[0070]
[图11]活力推移。将kbm501培养基或pbs洗涤
·
冷冻后的高活性nk细胞在37℃融解,用kbm501培养基或plasma-lyte a稀释10倍后,在室温静置0~6小时,其后通过7-aad进行染色,用flowjo软件分析。
[0071]
[图12-1]活力推移。用灭菌蒸馏水梯度稀释的plasma-lyte a的稀释、和在37℃静置造成的影响。将各处理后的细胞通过7-aad进行染色,用flowjo软件分析(以下的图中相同)。
[0072]
[图12-2]图12-1的延续
[0073]
[图12-3]活力推移。用生理盐水梯度稀释的plasma-lyte a的稀释、和室温或在37℃静置造成的影响。
[0074]
[图12-4]图12-3的延续
[0075]
[图12-5]活力推移。用生理盐水梯度稀释的plasma-lyte a、或生理盐水的稀释、和室温或在37℃静置造成的影响。
[0076]
[图12-6]图12-5的延续
[0077]
[图12-7]活力推移。用各溶剂稀释、和在室温静置造成的影响。
[0078]
[图12-8]活力推移。用各溶剂稀释、和在37℃静置造成的影响。
[0079]
[图12-9]活力推移。在回收时用pbs洗涤的情形中,用各溶剂稀释、和在室温静置造成的影响。
[0080]
[图12-10]活力推移。在回收时用pbs洗涤的情形中,用各溶剂稀释、和在37℃静置造成的影响。
[0081]
用于实施发明的方式
[0082]
有关本发明,除了特别记载的情形,mm以与mmol/l相同的意义应用。数值范围用x~y表示时,该范围包含两端的值x和y。
[0083]
本发明涉及具有高细胞毒性活性的细胞的冷冻保存方法。
[0084]
[可适用的细胞]
[0085]
本发明可适用于各种细胞。本发明可优选适用的细胞之一是通过在体外应用某些细胞因子经历活化操作的细胞,这样的细胞包含细胞毒性活性高的nk细胞(高活性nk细胞)等。活化操作通常取决于应用包含白细胞介素(il)-2的培养基温育细胞。
[0086]
通常,nk细胞是不表达t细胞受体(tcr)、作为t细胞普遍的标记物的cd3、和作为膜免疫球蛋白的b细胞受体的大型颗粒性淋巴细胞,通常对于人cd16阳性并且cd56阳性。本领域技术人员基于细胞表面标记物的表达模式等可以容易地判断是否为nk细胞。nk细胞具有细胞毒性活性,该细胞毒性活性的有无和程度可以用公知各种方法测定。nk细胞可包含外周血nk细胞、脐带血nk细胞、原代nk细胞、培养nk细胞、高活性nk细胞。
[0087]
(原料)
[0088]
本发明可以优选适用的高活性nk细胞等的原料可以是外周血、脐带血、骨髓和/或淋巴结、通过单采术法采集的血液(单采术血液)。此外,原料也可以从选自下列的至少1种
细胞配制:源自选自胚胎干细胞、成体干细胞和人工多能性干(ips)细胞的任一种的干细胞的造血干细胞、源自脐带血的造血干细胞、源自外周血的造血干细胞、源自骨髓血的造血干细胞、脐带血单核细胞、外周血单核细胞。存在原料的供体是接受通过高活性nk细胞等的免疫治疗的患者自身、该患者的近亲、或与患者没有血缘关系的健康者的情形。供体可以是多个。
[0089]
(培养基)
[0090]
为了培养高活性nk细胞等而应用的培养基包括kbm501培养基(kojin bio株式会社。包含1,750jru/ml的il-2)、cosmedium 008(cosmo bio,包含1,750jru/ml的il-2)、fkcm101(fukoku,不含il-2或包含175iu/ml的il-2)、cellgro scgm培养基(celgenix、岩井化学药品株式会社)、x-vivo15培养基(lonza、takara bio株式会社)、gibco(注册商标)cts(注册商标)aim v(注册商标)medium(thermofisher scientific,用于增殖
·
操作t细胞和树突细胞的组成已知的无血清培养基)、cts optmizer t cell expansion basal medium(thermofisher scientific,用于人t淋巴细胞的成长和增殖)、imdm、mem、dmem、rpmi-1640等,但不限于这些。优选实例是kbm501培养基、fkcm101或cosmedium 008。另外,有关本发明,关于细胞提及培养(进行培养)时,除了特别记载的情形,指为了选自细胞的生存维持、细胞的扩增、和细胞的活化的任一种目的,将细胞在培养基或以其为标准的液体中维持规定时间。在特定温度进行处理规定时间的情形中,有时称为温育(进行温育)。
[0091]
存在在培养基中以可以实现本发明目的的浓度添加il-2的情形。存在il-2的浓度是2500iu/ml~2813iu/ml的情形。il-2优选具有人的氨基酸序列,在安全上,优选用重组dna技术生产。存在il-2的浓度用国内标准单位(jru)和国际单位(iu)表示的情形。由于1iu是约0.622jru,现有培养基的1750jru/ml相当于约2813iu/ml。
[0092]
存在与上述il-2同时或代替il-2,以可以实现本发明目的的浓度添加选自il-12、il-15、和il-18的任一种的情形(非专利文献2:leong jw et al.biol blood marrow transplant 20(2014)463-473)。存在各自的浓度无论其它细胞因子的有无和浓度为1pg/ml~1μg/ml的情形。il-2优选具有人的氨基酸序列,在安全上,优选用重组dna技术生产。
[0093]
存在培养基中添加被测者的自身血清、可得自biowhittaker公司等的人ab型血清、和可得自日本红十字会的献血人血清白蛋白的情形。自身血清和人ab型血清优选以1至10%的浓度添加,献血人血清白蛋白优选以1至10%的浓度添加。与血清同时或代替血清,可以添加人血小板裂解物(human platelet lysate:hpl)。hpl被市售,ultragrotm系列(aventacell biomedical公司)等被售卖。在应用hpl的情形中,可以在培养基中进一步添加肝素钠。
[0094]
以不损害nk细胞的培养效果为条件,存在培养基中包含适当的蛋白、细胞因子、抗体、化合物等成分的情形。存在细胞因子除上述il-2、il-12、il-15、和il-18之外也为il-3、il-7、il-21、干细胞因子(scf)和/或fms样酪氨酸激酶3配体(flt3l)的情形。它们的任一种都优选具有人的氨基酸序列,在安全上,优选用重组dna技术生产。
[0095]
培养基优选无血清培养基。无血清培养基优选包含血清白蛋白、转铁蛋白和胰岛素。用于培养淋巴细胞的无血清培养基被开发、市售,可以在本发明中应用它们。无血清培养基的优选实例之一是,向基础培养基添加作为支持人t细胞的增殖的组分而市售的cts immune cell sr(thermofisher scientific)。
017-501(每1x107个细胞2.5μl)),在4℃温育15分钟后,加入分离缓冲液(例如,包含0.5%人ab型血清(在56℃灭活处理30分钟)、2mm edta的pbs),充分悬浮,离心。除去上清,以成为ld柱(例如,miltenyi biotec,130-042-901)每1柱直至最大1x108个细胞的细胞数的方式悬浮于0.5ml的分离缓冲液。预先添加分离缓冲液2ml之后,向ld柱添加细胞悬浮液,回收来自ld柱的溶出液。进一步向ld柱添加分离缓冲液1ml,回收溶出液。进行回收的液体的离心分离,除去上清后,以在使用外周血的情形成为5x105个细胞/ml、使用冷冻单采术血液的情形成为1x106个细胞/ml的方式在适当的培养基(例如,包含5%人ab型血清(在56℃灭活处理30分钟)或者5%ultragro(aventacell、hpcplcrl10)中添加2u/ml肝素钠的任一种的kbm501培养基)中悬浮细胞,进行适当培养基交换,同时培养至第14天为止。
[0117]
[3]的高活性nk细胞的具体的制备方法可以参考本说明书的实施例的项目。
[0118]
[4]得到[1]~[3]的细胞时,通过与il-2同时或代替il-2,以可以实现本发明目的的浓度添加选自il-12、il-15、和il-18的任一种并培养而得到的细胞。这样的细胞的具体的制备方法可以参考上述非专利文献2。
[0119]
另外,以下,以应用高活性nk细胞的情形为例说明本发明,但本领域技术人员依据该说明也可以理解本发明应用通过在体外应用某些细胞因子经历活化操作的其它细胞的情形。
[0120]
(细胞毒性活性)
[0121]
有关本发明,关于高活性nk细胞等,提及活性或细胞毒性活性时,除了特别记载的情形,指代对象细胞(效应细胞、e)对靶标细胞(t)的溶解能力。细胞毒性活性可以由通过效应细胞导致死亡的靶标细胞的百分率(%)表示,根据下式求得。
[0122]
(与效应细胞共培养的情形的细胞死亡-自然细胞死亡(阴性对照))/(最大细胞死亡(阳性对照)-自然细胞死亡(阴性对照))
×
100
[0123]
细胞毒性活性测定时,通常,相应于效应细胞的细胞毒性活性的程度等,效应细胞与靶标细胞的混合比(e∶t)、效应细胞与靶标细胞的共培养时间可以相应于应用的细胞的种类和活性的强度设为适当。将nk细胞作为效应细胞时,存在靶标细胞是k562细胞、急性骨髓性白血病细胞、慢性骨髓性白血病细胞的情形,但不限于这些。效应细胞和靶标细胞、活细胞和死细胞可以通过用放射性物质、荧光染料等标记的抗体等试剂区分或定量。对于以nk细胞作为效应细胞时的细胞毒性活性,例如,以k562细胞为靶标细胞,e∶t=1∶0.05~10、优选1∶0.1~5,可以在温育小时为0.5~18小时、优选1~12小时的条件测定。
[0124]
有关本发明,提及nk细胞等的活性高时,除了特别记载的情形,指代以靶标细胞为k562细胞,在e∶t=2∶1混合1~3小时、更特定2小时、共培养情形中的细胞毒性活性是50%以上。活性优选60%以上,更优选70%以上。
[0125]
[回收]
[0126]
在本发明中,在后述的冷冻步骤之前,从培养系统回收应冷冻的高活性nk细胞等。回收可以通过离心分离而分离培养基和细胞进行。按需要,也可以向培养系统加入适当的浓度的edta,从培养容器表面剥离粘附的细胞。此外,也可以用适当的溶液洗涤施加培养基后的培养容器表面,得到残留的细胞。按需要用适当的溶液洗涤得到的细胞,在适当的溶液中悬浮。
[0127]
在回收步骤中,为了细胞的剥离和洗涤,可以应用培养基、等渗液、缓冲液等溶液。
作为可使用的培养基的实例,列举kbm501培养基、cosmedium 008、fkcm101、cellgro scgm培养基、x-vivo15培养基、gibco(注册商标)cts(注册商标)aim v(注册商标)medium、cts optmizer t cell expansion basal medium、imdm、mem、dmem、rpmi-1640。等渗液指具有与体液(血浆)的浸透压(285
±
5mosm/l)大致相等的浸透压的液体,有关本发明,指浸透压是285
±
13mosm/l的液体。例如,plasma-lyte a的浸透压是294mosm/l,pbs(-)的浸透压是280
±
4mosm/l(冰点下降法)。作为可使用的等渗液的实例,列举plasma-lyte a(baxter)、生理盐水、林格氏液(乳酸林格氏液、醋酸林格氏液、碳酸氢盐林格氏液等)、5%葡萄糖水溶液。作为可使用的缓冲液的实例,列举磷酸缓冲生理盐水(phosphate-buffered saline:pbs)、tris盐酸缓冲液、tris醋酸缓冲液、hepes缓冲液。
[0128]
回收步骤中应用的溶液的优选实例之一是培养基,更优选用于人淋巴细胞培养的培养基。用于人淋巴细胞培养的培养基也可以包含人血清白蛋白、人转铁蛋白、重组型人胰岛素、和重组型人il-2。这样的培养基的优选实例是kbm501培养基、fkcm101或cosmedium 008。kbm501培养基包含人血清白蛋白、人转铁蛋白、重组型人胰岛素、重组型人il-2,不包含它们以外的蛋白。此外,kbm501培养基包含抗生素(卡那霉素)、nahco3、l-谷氨酰胺、ph调节剂。
[0129]
在回收步骤中,应用pbs(-)时,存在融解时的细胞的生存率降低、优选没有的情形。pbs(-)典型地包含氯化钠136.9mm、氯化钾2.68mm、磷酸氢二钠8.1mm、磷酸氢钾1.47mm。
[0130]
[预处理]
[0131]
在本发明中,在后述冷冻步骤之前,也可以预处理应冷冻的高活性nk细胞等。预处理是将回收的细胞悬浮于包含添加剂的溶液。预处理包括用包含添加剂的溶液回收。
[0132]
作为预处理中应用的添加剂,可以应用选自由胆汁酸和苯基丁酸组成的组的任一种。胆汁酸的实例是牛磺熊脱氧胆酸(tudca)、熊脱氧胆酸(udca)、鹅脱氧胆酸、胆酸、猪脱氧胆酸、脱氧胆酸、7-氧代石胆酸、石胆酸、碘脱氧胆酸、碘胆酸、牛磺鹅脱氧胆酸、牛磺脱氧胆酸、甘氨熊脱氧胆酸、牛磺胆酸、甘氨胆酸或其类似物、衍生物。苯基丁酸的实例是4-苯基丁酸(4-pba)、甘油基(三-4-pba)、苯乙酸、2-poaa-ome、2-poaa-no2、2-noaa或药学上容许的盐、类似物、衍生物或前药。预处理中应用的添加剂的特别优选的实例是选自tudca和4-pba的任一种。
[0133]
在应用胆汁酸作为用于预处理的添加剂的情形中,浓度可设为适当,但优选100~5000μm,更优选200~2500μm,进一步优选400~1000μm。这样的范围在应用tudca的情形中特别适合。在应用苯基丁酸作为用于预处理的添加剂的情形中,浓度可设为适当,但优选1~1000μm,更优选5~500μm,进一步优选10~100μm。这样的范围在应用4-pba的情形中特别适合。
[0134]
用于预处理的添加剂的其它实例是二甲亚砜(dmso)。浓度可设为适当,但优选0.5~15%,更优选1~12.5%,进一步优选2~10%。
[0135]
用于预处理的溶液与回收之时应用的溶液同样,可为培养基、等渗液、缓冲液等溶液。预处理中应用的溶液的优选实例之一是培养基,更优选用于人淋巴细胞培养的培养基,进一步优选kbm501培养基、fkcm101或cosmedium 008。预处理中应用的培养基此外可以包含人血清白蛋白、人转铁蛋白、重组型人胰岛素、和重组型人il-2,也可以包含抗生素(卡那霉素)、nahco3、l-谷氨酰胺、ph调节剂。
[0136]
用于预处理的时间没有特别限定。为了预处理,悬浮细胞后,可以将悬浮液静置数分钟~数小时、例如5分钟~4小时、更优选30分钟~3小时。静置可以在环境温度(例如1~30℃、典型地15~25℃)进行,也可以在co2培养箱中(例如36~42℃、典型地37℃)进行。
[0137]
预处理之时的细胞密度可以设为适当,但设为适于细胞的维持的细胞密度即可。具体地,是1x105~1x107个细胞/ml,优选2x105~5x106个细胞/ml,更优选5x105~2x106个细胞/ml。
[0138]
在特别优选的方式中,预处理是在将tudca以400~1000μm、或将4-pba以10~100μm添加的kbm501培养基、fkcm101或cosmedium008中,以细胞密度为5x105~2x106个细胞/ml的方式悬浮。此时,在37℃、5%co2下温育30分钟~3小时即可。
[0139]
本发明中预处理不必需,但通过将高活性nk细胞等在冷冻前用添加4-pba或tudca的kbm501培养基预处理,与未进行预处理的情形比较,融解细胞时的生存率(也可称为回收率)可改善。
[0140]
[冷冻]
[0141]
在本发明中,回收的、优选预处理的细胞通过通常的顺序冷冻。具体地,按需要确认细胞数和生存率,离心分离除去上清后,以成为适当的细胞密度的方式在冷冻保存液中悬浮细胞。将细胞悬浮液在用于冷冻保存的容器中分配后,用-80℃的低温冷冻箱冷冻、保存。按需要用液氮罐冷冻保存。
[0142]
可在本发明中应用的冷冻保存液可含有钠盐、钾盐、糖类、碳酸氢盐、碳酸盐、和防冻剂。
[0143]
可使用的钠盐只要在溶剂中溶解时生成钠离子则没有特别限定,可为含氧酸盐、卤化物、氧化物、氢氧化物、无机盐或有机酸盐等。钠盐可以组合1种或多种。在本发明中,作为1种优选使用氯化钠,作为多种优选使用氯化钠和柠檬酸钠。钠盐含量没有特别限定,作为冷冻保存液中包含的总钠离子的终浓度,优选0.01~5000mm,更优选0.1~1000mm,进一步优选1~300mm。
[0144]
可使用的钾盐只要在溶剂中溶解时生成钾离子则没有特别限定,可为含氧酸盐、卤化物、氧化物、氢氧化物、无机盐或有机酸盐等。钾盐可以组合1种或多种。在本发明中,优选使用氯化钾。钾盐含量没有特别限定,作为冷冻保存液中包含的总钾离子的终浓度,优选0.01~5000mm,更优选0.1~1000mm,进一步优选1~100mm。
[0145]
可使用的碳酸氢盐只要在溶剂中溶解时生成碳酸氢离子则没有特别限定,可以应用与各种阳离子的盐。例如,列举碳酸氢铵、碳酸氢钾、碳酸氢钙、碳酸氢钠、碳酸氢镁等。可使用的碳酸盐只要在溶剂中溶解时生成碳酸离子则没有特别限定,可以应用与各种阳离子的盐。例如,列举碳酸铵、碳酸钾、碳酸钙、碳酸钠、碳酸钡、碳酸镁等。这些碳酸氢盐和/或碳酸盐可以组合1种或多种。在本发明中,优选使用碳酸氢钠。碳酸氢盐和/或碳酸盐的含量没有特别限定,作为冷冻保存液中包含的碳酸氢离子和碳酸离子的总计的终浓度,优选0.01~1000mm,更优选0.1~500mm,进一步优选1~100mm。
[0146]
冷冻保存液中的钠离子和钾离子的浓度比(钠离子/钾离子)优选1/1000~1000/1,更优选1/100~100/1,进一步优选1/10~100/1,进一步优选1/1~100/1,进一步优选10/1~50/1。
[0147]
可使用的糖类是单糖、寡糖或糖醇,例如,作为单糖列举葡萄糖、半乳糖、果糖、甘
露糖、木糖、阿拉伯糖,作为寡糖列举海藻糖、蔗糖、麦芽糖、乳糖、纤维二糖,作为糖醇列举木糖醇、山梨糖醇等。这些糖类可以组合1种或多种,本发明中优选选自葡萄糖、半乳糖、果糖、甘露糖、木糖和阿拉伯糖的至少1种糖类,更优选葡萄糖。糖类的含量是冷冻保存液中优选0.01~100g/l,更优选0.1~100g/l,进一步优选0.25~50g/l。
[0148]
作为可使用的防冻剂的实例,列举二甲亚砜(dmso)、羟乙基淀粉(hes)、乙二醇、甘油等。防冻剂可以组合1种或多种。在本发明中,优选使用选自dmso和羟乙基淀粉的任一种。在作为防冻剂联用dmso和羟乙基淀粉的情形中,优选总含量包含在前述范围内,并且各自的浓度是,dmso浓度优选0.01~50%、更优选1~30%、进一步优选2~15%,羟乙基淀粉浓度优选0.01~50%、更优选1~30%、进一步优选2~15%。
[0149]
在本发明的优选方式中,除了上述的本发明的细胞的冷冻保存方法中使用的溶液的必需成分,还可以进一步含有选自蛋白、镁盐和钙盐的成分。可使用的蛋白具体地列举血清白蛋白、血清球蛋白等。此外,作为血清白蛋白,列举人血清白蛋白、或牛血清白蛋白。在本发明中,优选人血清白蛋白。蛋白的含量在冷冻保存液中优选0.01~50%、更优选1~30%、进一步优选2~15%。可使用的镁盐只要在溶剂中溶解时生成镁离子则没有特别限定,可以应用含氧酸盐、卤化物、氧化物、氢氧化物、无机盐或有机酸盐等。镁盐可以组合1种或多种。在本发明中,优选使用氯化镁。镁盐含量没有特别限定,作为冷冻保存液中包含的总镁离子的终浓度,优选0,01~10mm,更优选0.1~5mm。可使用的钙盐只要在溶剂中溶解时生成钙离子则没有特别限定,可以应用含氧酸盐、卤化物、氧化物、氢氧化物、无机盐或有机酸盐等。钙盐可以组合1种或多种。在本发明中,优选使用氯化钙。钙盐含量没有特别限定,作为冷冻保存液中包含的总钙离子的终浓度,优选0.01~10mm,更优选0.1~5mm。此外,冷冻保存液中除上述的成分以外还可进一步含有对细胞没有损害性的物质,例如,维生素类、氨基酸类等。此外,从发挥ph调节和缓冲作用的观点看来,冷冻保存液除上述的成分以外还可含有磷酸离子。
[0150]
期望冷冻保存液的浸透压是冷冻时对细胞不产生损伤的范围,从冷冻时提高成分对细胞的浸透性和抑制冰晶形成的观点看来,可以是例如500~8000mosm/l,1000~7500mosm/l,也可以是1500~7000mosm/l,也可以是1800~5000mosm/l。期望冷冻保存液的ph是对细胞不产生损伤的范围,例如,3.0~10.0,更优选4.5~9.0。
[0151]
在本发明中,可以应用市售的用于冷冻保存的液体。作为可使用的制品的实例,可以列举用于细胞
·
组织的冷冻保存液cellbanker系列(stem-cellbanker(注册商标)),更特别地是stem-cellbanker(zenoaq、cb045)。
[0152]
冷冻之时的细胞优选处于对数增殖期。
[0153]
冷冻之时的细胞密度可以设为适当,具体地,是1x106~2x108个细胞/ml、优选2x106~1x108个细胞/ml,更优选1x107~5x107个细胞/ml。在优选的方式之一中,细胞在5ml容量的容器中以4x107个细胞/ml保存。高活性nk细胞的冷冻运输时可以高密度冷冻使制品更紧凑,有助于降低输送成本。
[0154]
[融解]
[0155]
在本发明中,冷冻保存的细胞可以通过各种顺序融解。例如,可以将放入细胞的用于冷冻保存的容器在37℃的温浴等中按需要边振动边迅速融解。或者,从冷库取出后可以不主动加温,在室温放置而自然融解。融解后的细胞与适当的融解时溶剂i混和。按需要,可
以进行离心分离除去上清,悬浮于适量的融解时溶剂ii,进行培养和活化处理。
[0156]
(融解时溶剂i)
[0157]
在本发明中,将融解在用于冷冻保存的液体中悬浮冷冻的细胞、与用于冷冻保存的液体共同在稀释时应用的溶液称为融解时溶剂i。对于根据本发明回收、按需要进行预处理的冷冻保存的细胞,可应用各种溶剂作为融解时溶剂i。
[0158]
在优选的方式之一中,融解时溶剂i可含有钠盐、钾盐、葡萄糖酸盐、和醋酸盐。进一步,也可含有镁盐。
[0159]
融解时溶剂i中可使用的钠盐可为含氧酸盐、卤化物、氧化物、氢氧化物、无机盐或有机酸盐等。钠盐可以组合1种或多种。融解时溶剂i优选包含选自氯化钠、葡萄糖酸钠、和醋酸钠的任一种,更优选包含氯化钠、葡萄糖酸钠、和醋酸钠。融解时溶剂i的钠盐的含量作为总钠离子的终浓度优选14.0~200mm,更优选28.0~182mm,进一步优选70.0~168mm。或者,优选作为氯化钠包含9.00~108mm,作为葡萄糖酸钠包含2.30~27.7mm,作为醋酸钠包含2.70~32.5mm。
[0160]
融解时溶剂i中可使用的钾盐可为含氧酸盐、卤化物、氧化物、氢氧化物、无机盐或有机酸盐等。钾盐可以组合1种或多种。融解时溶剂i优选包含选自氯化钾、葡萄糖酸钾、和醋酸钾的任一种,更优选包含氯化钾。融解时溶剂i的钾盐的含量作为总钾离子的终浓度优选0.50~8.0mm,更优选1.0~7.0mm,进一步优选2.5~6.0mm。或者,优选作为氯化钾包含0.496~5.96mm。
[0161]
融解时溶剂i中可使用的葡萄糖酸盐只要在溶剂中溶解时生成葡萄糖酸离子则没有特别限定,可以应用与各种阳离子的盐。例如,列举葡萄糖酸钠、葡萄糖酸钾等。融解时溶剂i优选包含葡萄糖酸钠。融解时溶剂i的葡萄糖酸盐的含量作为总葡萄糖酸离子的终浓度优选2.3~32.3mm,更优选4.6~29.9mm,进一步优选12.5~27.7mm。
[0162]
融解时溶剂i中可使用的醋酸盐只要在溶剂中溶解时生成醋酸离子则没有特别限定,可以应用与各种阳离子的盐。例如,列举醋酸钠、醋酸钾等。融解时溶剂i优选包含醋酸钠。融解时溶剂i的醋酸盐的含量作为总醋酸离子的终浓度优选2.7~37.8mm,更优选5.4~35.1mm,进一步优选13.5~32.5mm。
[0163]
作为这样的融解时溶剂i,可以应用市售的等渗液。作为可使用的制品的实例,可以列举plasma-lyte a、和将其用水稀释的液体。具体地,是包括以下的液体。
[0164]
·
氯化钠9.00~108mm
[0165]
·
葡萄糖酸钠2.30~27.7mm
[0166]
·
醋酸钠2.70~32.5mm
[0167]
·
氯化钾0.496~5.96mm
[0168]
·
氯化镁0.148~1.78mm
[0169]
在另一优选方式中,融解时溶剂i可含有仅钠盐。这样的融解时溶剂i中可使用的钠盐可为含氧酸盐、卤化物、氧化物、氢氧化物、无机盐或有机酸盐等。钠盐可以组合1种或多种。融解时溶剂i优选仅含有氯化钠。融解时溶剂i的钠盐的含量作为总钠离子的终浓度优选15.4~216mm,更优选30.8~200mm,进一步优选70.0~185mm。
[0170]
作为这样的融解时溶剂i,可以应用生理盐水或将其用水稀释的液体。
[0171]
与用于冷冻保存的液体共同在融解时溶剂i中悬浮的细胞可以用于原样施用。从
用于施用的观点看来,优选将用于冷冻保存的液体和融解时溶剂i混合后的混合液成为等渗(具有与体液大致相等的浸透压,具体地285
±
13mosm/l)。由于用于冷冻保存的液体在优选方式中为高渗液(例如,1500~7000mosm/l),融解时溶剂i可以是浸透压低的液体。本领域技术人员可以考虑用于冷冻保存的液体通过融解时溶剂i的稀释倍率,适当决定融解时溶剂i的成分浓度。
[0172]
此外,由于此处稀释倍率高的(例如15倍以上)情形可以说用于冷冻保存的液体的组成对混合液的浸透压的影响少,作为融解时溶剂i,优选应用等渗的液体。从这样的观点看来,融解时溶剂i具体地是包含以下的液体。
[0173]
·
氯化钠85.5~94.5mm
[0174]
·
葡萄糖酸钠21.8~24.2mm
[0175]
·
醋酸钠25.6~28.5mm
[0176]
·
氯化钾4.71~5.21mm
[0177]
·
氯化镁1.40~1.55mm
[0178]
或者,融解时溶剂i具体地是包含以下的液体。
[0179]
·
氯化钠146.3~161.7mm
[0180]
无论任一组成,融解时溶剂i优选不含0.423mm以上的浓度的钙离子。此外,无论任一组成,融解时溶剂i优选不含5.55mm以上的浓度的葡萄糖。进一步,无论任一组成,融解时溶剂i优选不含27.7mm以上的浓度的乳酸盐。这是由于存在融解的细胞的生存率或细胞毒性活性降低的情形。从这样的意义,存在rpmi培养基、hanks’balanced salt solution(hbss)(+)、和乳酸林格氏液不适于作为融解时溶剂i应用的情形。
[0181]
无论任一组成,融解时溶剂i优选不含40%以上的浓度的血清,更优选完全不含血清。这是由于包含血清时存在细胞的生存率降低的情形。
[0182]
在融解时溶剂i中悬浮时的细胞密度可以设为适当,可以设为适于细胞的维持的细胞密度,或设为适于施用的细胞密度。具体地,是1x105~1x107个细胞/ml,优选2x105~5x106个细胞/ml,更优选5x105~2x106个细胞/ml。
[0183]
细胞可以在融解时溶剂i中维持比较长的时间。在融解时溶剂i中悬浮细胞后,可以将悬浮液静置数分钟~数小时、例如5分钟~6小时、更优选30分钟~4小时。静置可以在环境温度(例如1~30℃、典型地15~25℃)进行,也可以在co2培养箱中(例如36~42℃、典型地37℃)进行。
[0184]
(融解时溶剂ii)
[0185]
在本发明中,应用融解时溶剂i将冷冻的细胞融解后,可以进一步应用融解时溶剂ii,培养或活化细胞。在本发明中,将为了回收、培养或活化等、用于将在融解时溶剂i中悬浮的细胞再次悬浮而应用的溶液称为融解时溶剂ii。相应于目的,可以应用各种溶剂作为融解时溶剂ii。
[0186]
[对药物组合物的利用]
[0187]
本发明提供药物组合物,其包含用适当的方法回收、按需要预处理、冷冻保存的高活性nk细胞等。
[0188]
根据本发明提供的药物组合物可以在对高活性nk细胞等具有敏感性的各种疾病的治疗和/或预防中应用。这样的疾病的实例是癌症或感染病,具体地,包括皮肤癌、口腔
癌、胆囊癌、胆管癌、肺癌、肝癌、胃癌、大肠癌、胰腺癌、肾癌、卵巢癌、膀胱癌、前列腺癌、神经母细胞瘤、白血病、和病毒、细菌等引起的感染病,但不限于这些。另外,本发明人应用用本技术的方法冷冻
·
融解的细胞,确认对不治疗则30天内死亡的大肠癌模型动物的效果。
[0189]
通过本发明的药物组合物的细胞疗法存在单独、或者与手术疗法、化学疗法、放射疗法、抗体药物等组合实施的情形。
[0190]
根据本发明提供的药物组合物的一个方式的特征在下文显示。
[0191]
(剂型)
[0192]
注射剂(细胞悬浮液)
[0193]
(成分
·
含量)
[0194]
构成细胞:高活性nk细胞等
[0195]
含量:6
×
106个~4.8
×
109个细胞/60kg
[0196]
(副成分)
[0197]
复合电解质液10~45%
[0198]
氯化钠液10~45%
[0199]
20~30%人血清白蛋白液5~30%
[0200]
二甲亚砜2~15%
[0201]
其它
[0202]
或者,
[0203]
作为药物添加剂的可容许的冷冻保存液100%
[0204]
(配制方法)
[0205]
用37℃的恒温水槽等融解,至冷冻的组合物完全融解为止。融解后迅速地无菌悬浮于可容许作为单独准备的药物添加剂的等渗液。
[0206]
(融解后的稳定性)
[0207]
融解后的有效期在室温保存时是6小时,优选4小时。
实施例
[0208]
[参考例和实施例中共通的方法]
[0209]
a)高活性nk细胞的培养方法
[0210]
原料1:利用外周血的情形
[0211]
从健康人志愿者采集外周血,应用ficoll(ge healthcare、17144002)通过密度梯度离心分离外周血单核细胞(pbmcs:peripheral blood mononuclear cells)。
[0212]
原料2:冷冻单采术血液的情形
[0213]
融解冷冻单采术血液(hemacare,pb001clp),使用lovo cell processing system(fresenius kabi)进行洗涤和浓缩,得到pbmcs。
[0214]
向得到的pbmcs添加
·
悬浮cd3珠
※1、cd34珠
※2(使用冷冻单采术血液的情形),4℃温育15分钟后,加入分离缓冲液
※3充分悬浮,进行300x g、10分钟离心分离。除去上清,以成为ld柱(miltenyi biotec,130-042-901)每1柱直至最大1x108个细胞的细胞数的方式,悬浮于0.5ml的分离缓冲液。预先添加2ml分离缓冲液之后,向ld柱添加细胞悬浮液,回收来自ld柱的溶出液。进一步,向ld柱添加1ml分离缓冲液,回收溶出液。其后,用1ml分离缓冲液洗
涤柱,计数回收的液体中的细胞数,算出总细胞数。进行500x g、5分钟离心分离,除去上清后,以使用原料1:外周血的情形成为5x105个细胞/ml、使用原料2:冷冻单采术血液的情形成为1x106个细胞/ml的方式悬浮于kbm501培养基
※4。培养使用6孔板(thermofisher scientific,140675)、t-75烧瓶(thermofisher scientific,156499)或粘附培养用袋(nipro),用co2培养箱进行(37℃,5%co2)。以培养第9天的最终液体量成为在6孔板的情形中每1孔6ml、在t-75烧瓶的情形中每1烧瓶50ml、在袋的情形中每1袋500ml的方式添加kbm501培养基,温育至第14天为止。
[0215]
以下,将通过从pbmcs经历该培养步骤得到的细胞称为“高活化nk细胞样cd3阴性细胞(highly activated nk cell-like cd3-negative cells)”或简单地“高活性nk细胞”。
[0216]
※
1:clinimacs cd3,miltenyi biotec,130-017-601(每1x107个细胞5μl)
[0217]
※
2:clinimacs cd34,miltenyi biotec,130-017-501(每1x107个细胞2.5μl)
[0218]
※
3:包含0.5%人ab型血清(cosmo bio,12181301,在56℃灭活处理30分钟)、2mm edta(thermofisher scientific,15575-020)的pbs(nacalai tesque、14249-24)
[0219]
※
4:包含5%人ab型血清(cosmo bio,12181301,在56℃灭活处理30分钟)或者5%ultragro(aventacell、hpcplcrl10)中添加2u/ml肝素钠(nipro)的任一种的kbm501(kojin bio,16025015)
[0220]
b)高活性nk细胞的回收方法
[0221]
回收方法1:以往的方法
[0222]
培养第14天回收培养液,进一步向培养容器加入1mm edta剥离粘附的细胞,用pbs(nacalai tesque、14249-24)洗涤回收剥离细胞后的培养容器。离心全部的细胞回收液后,用pbs洗涤、重悬浮。
[0223]
回收方法2:本技术的方法
[0224]
培养第14天回收培养液,进一步向培养容器加入1mm edta剥离粘附的细胞,用kbm501培养基洗涤回收剥离细胞后的培养容器。离心全部的细胞回收液后,用kbm501培养基洗涤、重悬浮。
[0225]
c)通过7-aad的染色方法
[0226]
将1x105个细胞/孔的各条件下融解的高活性nk细胞用96孔板(iwaki,4870-800sp)离心分离,除去上清后,添加用pbs稀释的7-氨基放线菌素d(7-aad)溶液(beckman coulter,a07704),悬浮,在室温(指15~25℃。以下的实验中相同)温育20分钟。将染色后的细胞用流式细胞仪(bd lsr fortessa、bd biosciences公司)进行测定。
[0227]
[参考例]
[0228]
将用高活性nk细胞的培养方法、回收方法1中记载的顺序得到的高活性nk细胞、pbmc、k562(人慢性骨髓性白血病细胞株)、thp-1(人急性单核细胞白血病细胞株)与mito-ferrogreen(同仁化学研究所、m489)反应,应用流式细胞仪(bd lsr fortessa、bd biosciences公司)进行测定。
[0229]
如图1-1所示,高活性nk细胞的铁含量多。根据形态学观察结果和至死的时间,假设冷冻融解下高活性nk细胞的活力显著降低的是ferroptosis(氧化应激)、凋亡、自噬、坏死和necroptosis 5种形式。对于各自形式的抑制剂在下文显示。
[0230]
[表1]
[0231][0232]
计数用高活性nk细胞的培养方法、回收方法1中记载的顺序得到的高活性nk细胞的活细胞数,用1ml的stem-cellbanker(zenoaq、cb045)悬浮1x107个细胞,在-80℃冷冻。将冷冻48小时以上的nk细胞在37℃、用水浴融解之后,用下文记载的溶剂稀释10倍,在各温度和时间静置后,用光学显微镜观察、拍照。
[0233]
《1》在kbm501培养基中稀释、在37℃3小时
[0234]
《2》在含有z-vad的kbm501培养基中稀释、在37℃3小时
[0235]
《3》在含有甲基强的松龙的kbm501培养基中稀释、在37℃3小时
[0236]
《4》在含有地塞米松的kbm501培养基中稀释、在37℃3小时
[0237]
《5》在kbm501培养基中稀释、在4℃3小时
[0238]
《6》在含有甲基强的松龙的kbm501培养基中稀释、在4℃静置3小时后、在37℃3小时
[0239]
《7》在含有地塞米松的kbm501培养基中稀释、在4℃静置3小时后、在37℃3小时
[0240]
结果示于图1-2。确认高活性nk细胞在冷冻融解下活力显著降低。此外,这通过冷冻融解后添加甲基强的松龙、地塞米松、或z-vad也没有改善。
[0241]
关于用高活性nk细胞的培养方法、回收方法1中记载的顺序得到的高活性nk细胞,回收后如表述的方法进行冷冻融解。
[0242]
冷冻融解的条件及其结果总结在下述的表中。对于实验的条件,在用pbs洗涤后冷冻的情形中,对所有活力改善方法不应答。认为对于通常已知的细胞保护方法难以得到目的效果。
[0243]
[表2-1]
[0244][0245]
[表2-2]
[0246][0247]
[表2-3]
[0248][0249]
[实施例1]
[0250]
(1-1)计数从2名健康人志愿者分别用高活性nk细胞的培养方法、回收方法1中记载的顺序得到的高活性nk细胞的活细胞数,分别将1x107个细胞、8x106个细胞悬浮于1ml的stem-cellbanker(zenoaq、cb045),在-80℃冷冻。将冷冻48小时以上的nk细胞用37℃水浴融解之后,融解后即刻将1x105个细胞在96孔板(iwaki)中分配。此外,用kbm501培养基、包含3500单位/ml il-2(celeuk(注册商标)注射用40,武田药品工业)、139.9mm麦芽糖的乳酸
林格(扶桑药品工业)、包含3500单位/ml il-2的plasma-lyte a(baxter)、包含5.02mg/ml葡萄糖酸钠(nacalai、16720-22)的kbm501培养基以稀释10倍的方式分别悬浮,在37℃、5%co2下温育3小时。融解后即刻的细胞在分配后迅速离心分离,其它4组在温育3小时后离心分离,用通过7-aad的染色方法中记载的方法进行测定,用flowjo软件(flowjo,llc)分析,算出活细胞率。
[0251]
(1-2)此外,关于5x106个细胞的从1名健康人志愿者、用高活性nk细胞的培养方法、回收方法1中记载的顺序得到的高活性nk细胞,同样地进行冷冻、融解,同样地进行处理、测定,用flowjo软件分析,算出活细胞率。
[0252]
结果示于图1-3、1-4。冷冻的高活性nk细胞在融解时用plasma-lyte a稀释时活力改善。融解时,通过kbm501培养基稀释,在添加葡萄糖酸(葡萄糖酸钠是plasma-lyte a中包含的成分之一)的情形也未见改善。
[0253]
[实施例2]
[0254]
计数用高活性nk细胞的培养方法、回收方法1中记载的顺序得到的高活性nk细胞的活细胞,将5x106个细胞、1x107个细胞用1ml的stem-cellbanker悬浮,在-80℃冷冻。将冷冻48小时以上的nk细胞用37℃、水浴融解之后,融解后即刻,将1x105个细胞在96孔板中分配。此外,用kbm501培养基、包含3500单位/ml il-2的乳酸林格、包含3500单位/ml的plasma-lyte a、包含40%血清(人ab型血清)的plasma-lyte a以稀释10倍的方式分别悬浮,在37℃、5%co2下温育3小时。融解后即刻的细胞在分配后迅速离心分离,其它4组在温育3小时后离心分离,用通过7-aad的染色方法中记载的方法进行测定,用flowjo软件分析,算出活细胞率。
[0255]
结果示于图2。冷冻的高活性nk细胞在融解时用plasma-lyte a稀释时活力改善,但用包含40%血清(人ab型血清)的plasma-lyte a稀释时活力恶化。
[0256]
[实施例3]
[0257]
计数用高活性nk细胞的培养方法、回收方法1中记载的顺序得到的高活性nk细胞的活细胞数,将1x107个细胞用1ml的stem-cellbanker悬浮,在-80℃冷冻。将冷冻48小时以上的nk细胞用37℃水浴融解之后,用包含3500单位/ml il-2(immunace、盐野义制药株式会社)的plasma-lyte a(溶剂(1))、或kbm501培养基(溶剂(2))稀释,算出每一下文记载的组的稀释后的活细胞数和活细胞率、细胞毒性活性率(%裂解)。
[0258]
《0》融解后即刻从stem-cellbanker分配
[0259]
《1》用溶剂(1)稀释10倍,在37℃静置1小时后,添加等量的kbm501培养基,在37℃温育3小时
[0260]
《2》用溶剂(1)稀释10倍,在37℃静置1小时后,添加等量的包含il-2的乳酸林格,在37℃温育3小时
[0261]
《3》用溶剂(1)稀释10倍,在37℃静置1小时后,添加等量的kbm501培养基,在37℃温育过夜
[0262]
《4》用溶剂(1)稀释10倍,在37℃静置1小时后,添加等量的包含il-2的乳酸林格,在37℃温育过夜
[0263]
《5》用溶剂(1)稀释10倍,在37℃静置3小时
[0264]
《6》用溶剂(2)稀释10倍,在37℃静置3小时
[0265]
《7》用溶剂(2)稀释10倍,在37℃静置过夜
[0266]
(细胞毒性活性率的算出)
[0267]
在细胞毒性活性的测定中,准备使nk细胞和k562细胞反应的组、作为阴性对照的仅k562细胞的组、作为阳性对照的将k562细胞用10%福尔马林固定的组。
[0268]
《nk细胞》
[0269]
温育各组记载的时间后,回收细胞,用10%fbs/rpmi1640配制为2x106个细胞/ml的浓度。
[0270]
《k562细胞》
[0271]
应用pkh26 red fluorescent cell linker kit(sigma,pkh26gl-1kt),染色将k562细胞(人慢性骨髓性白血病细胞株)用不含血清成分的rpmi1640培养基悬浮的k562细胞,最终用10%fbs/rpmi1640配制为2x106个细胞/ml。
[0272]
nk细胞和k562细胞以细胞比成为1∶1的方式添加于96孔板(iwaki,4870-800sp),混合,在37℃、5%co2下反应2小时。反应后,离心分离(500xg,5分钟),除去上清后,添加用pbs稀释的7-aad溶液,悬浮,在室温温育20分钟。应用流式细胞仪进行测定,用flowjo软件分析,算出细胞毒性活性率(%裂解)
※5。
[0273]
※
5:细胞毒性活性率=(skov3细胞死细胞率-阴性对照死细胞率)/(阳性对照死细胞率-阴性对照死细胞率)
×
100
[0274]
结果示于图3。冷冻
·
融解高活性nk细胞的活细胞数与活力相关。此外,活细胞数或活力与细胞毒性活性见到负相关的倾向。进一步,将冷冻
·
融解的细胞的处理液从plasma-lyte a替换为其它溶液时活力降低。
[0275]
[实施例4]
[0276]
计数用高活性nk细胞的培养方法、回收方法1中记载的顺序得到的高活性nk细胞的活细胞数,以成为1x106个细胞/ml的方式悬浮于下文列举的6种溶剂,接种在低吸附的6孔板(iwaki、4810-800sp)中,从而进行冷冻预处理。预处理的溶剂使用(1)包含10μm 4-苯基丁酸(4-pba、东京化成工业株式会社、p0643)的kbm501培养基、(2)包含100μm 4-苯基丁酸的kbm501培养基、(3)plasma-lyte a、(4)包含3000单位/ml il-2(immunace、盐野义制药株式会社)的plasma-lyte a、(5)包含10μm salubrinal(tocris、2347)的plasma-lyte a、(6)包含23mm葡萄糖酸钠的pbs,(1)、(2)组在37℃、5%co2下、(3)~(6)组在室温温育用各溶剂悬浮的细胞2小时。预处理后,基于处理时的细胞数,以成为1x107个细胞/ml的方式用stem-cellbanker悬浮,在-80℃冷冻保存。将冷冻48小时以上的完成预处理的nk细胞用37℃水浴融解,如下述稀释。融解后的稀释、温育全部用低吸附的6孔板进行。
[0277]
《预处理(1)含有10μm 4-苯基丁酸的kbm501培养基》
[0278]
在包含1000单位/ml il-2的plasma-lyte a或包含1000单位/ml il-2和100μm 4-pbs的plasma-lyte a中分别稀释11倍,在室温温育1小时后,在kbm501培养基中稀释5倍。
[0279]
《预处理(2)包含100μm 4-苯基丁酸的kbm501培养基》
[0280]
在plasma-lyte a中稀释11倍,在室温温育1小时后,在rpmi培养基
*6
或包含2400单位/ml il-2的rpmi培养基中分别稀释5倍。
[0281]
※
6:添加10%fbs(sigma、172012-500ml、在56℃灭活处理30分钟)的rpmi培养基(nacalai tesque、30264-56)
[0282]
《预处理(3)plasma-lyte a》
[0283]
在包含1000单位/ml il-2的plasma-lyte a或包含1000单位/ml il-2和100μm 4-pba的plasma-lyte a中分别稀释11倍,在室温温育1小时后,在kbm501培养基中稀释5倍。
[0284]
《预处理(4)包含3000单位/ml il-2的plasma-lyte a》
[0285]
在plasma-lyte a中稀释11倍,在室温或者37℃、5%co2下温育1小时后,分别在rpmi培养基、包含2400单位/ml il-2的rpmi培养基中稀释5倍。
[0286]
《预处理(5)包含10μm salubrinal的plasma-lyte a》
[0287]
在包含1000单位/ml il-2的plasma-lyte a、包含1000单位/ml il-2和100μm 4-pba的plasma-lyte a中分别稀释11倍,在室温温育1小时后,在kbm501培养基中稀释5倍。
[0288]
《预处理(6)包含23mm葡萄糖酸的pbs》
[0289]
在plasma-lyte a中稀释11倍,在室温或者37℃、5%co2下温育1小时后,分别在rpmi培养基、包含2400单位/ml il-2的rpmi培养基中稀释5倍。
[0290]
将培养基中稀释的各组的细胞在37℃、5%co2下温育过夜后,计数活细胞数。实验条件在下文总结。
[0291]
[表3]
[0292][0293]
结果示于图4。高活性nk细胞在冷冻前用添加4-pba的kbm501处理时,融解时的活力改善。
[0294]
[实施例5]
[0295]
计数用高活性nk细胞的培养方法、回收方法1和回收方法2中记载的顺序得到的高活性nk细胞的活细胞数,以成为1x106个细胞/ml的方式悬浮于各种溶剂,在低吸附的6孔板中接种,从而进行冷冻预处理。用pbs悬浮用回收方法1得到的nk细胞,在室温温育1小时。对于用回收方法2得到的nk细胞,将用(1)kbm501培养基、(2)包含30μm 4-苯基丁酸的kbm501培养基、(3)包含30μm牛磺熊脱氧胆酸二水合物(tudca、东京化成工业株式会社、t1567)的kbm501培养基、(4)包含30μm 4-苯基丁酸和30μm tudca的kbm501培养基悬浮的细胞在37℃、5%co2下温育2小时。预处理后,基于处理时的细胞数,以成为1x107个细胞/ml的方式,用stem-cellbanker悬浮,在-80℃冷冻保存。将冷冻48小时以上的完成预处理的高活性nk细胞用37℃水浴融解,各组分别在plasma-lyte a中稀释11倍,在室温温育1小时。1小时后,轻轻悬浮计数活细胞数。进一步,在kbm501培养基中稀释5倍在37℃、5%co2下温育2小时后,计数活细胞数,计算为相对于冷冻时的细胞数的回收率。
[0296]
结果示于下表和图5。通过冷冻前用添加4-pba或tudca的kbm501培养基预处理高活性nk细胞,融解时的回收率改善。
[0297]
[表4]
[0298][0299]
[实施例6]
[0300]
计数用高活性nk细胞的培养方法、回收方法2中记载的顺序得到的高活性nk细胞
的活细胞数,以成为1x106个细胞/ml的方式,用仅kbm501培养基、或包含tudca(10μm,30μm,90μm,270μm,810μm)的kbm501培养基悬浮,在低吸附的6孔板中接种,在37℃、5%co2下温育2小时进行冷冻预处理。预处理后,基于处理时的细胞数,以成为1x107个细胞/ml的方式,用stem-cellbanker悬浮,在-80℃冷冻保存。将冷冻48小时以上的完成预处理的nk细胞用37℃水浴融解,各组分别加入10倍量plasma-lyte a,在室温温育至3小时。1小时后和3小时后,轻轻悬浮计数活细胞数。此外,1小时后用kbm501培养基稀释5倍,在37℃、5%co2下温育2小时后,计数活细胞数。根据融解后各时点的活细胞数计算为相对于冷冻时的细胞数的回收率。此外,进行各时间点的高活性nk细胞的细胞毒性活性的测定。
[0301]
(细胞毒性活性率的算出)
[0302]
在细胞毒性活性的测定中,准备使nk细胞与k562细胞反应的组、作为阴性对照的仅k562细胞的组、作为阳性对照的将k562细胞用10%福尔马林固定的组。
[0303]
《nk细胞》
[0304]
基于冷冻时的活细胞数,分配所需量的用记载的方法融解、稀释的细胞后,用10%fbs/rpmi1640配制为2x106个细胞/ml的浓度。
[0305]
《k562细胞》
[0306]
将k562细胞用无血清rpmi1640培养基悬浮,应用pkh26 red fluorescent cell linker kit染色之后,用10%fbs/rpmi1640配制为2x106个细胞/ml。
[0307]
nk细胞和k562细胞以成为细胞比2∶1的方式添加于96孔板(iwaki,4870-800sp),混合,在37℃、5%co2下反应2小时。反应后,离心分离(500x g,5分钟),除去上清,添加用pbs稀释的7-aad溶液,悬浮,在室温温育20分钟。应用流式细胞仪进行测定,用flowjo软件分析,算出细胞毒性活性率(%裂解)。
[0308]
预处理条件、和融解条件得到的回收率示于下表。通过用以各种浓度添加tudca的kbm501培养基预处理高活性nk细胞,融解后的回收率改善。
[0309]
[表5]
[0310][0311]
细胞毒性活性的测定结果示于图6-1、6-2。见到预处理中tudca浓度依赖性细胞毒性活性改善。
[0312]
[实施例7]
[0313]
计数用高活性nk细胞的培养方法、回收方法2中记载的顺序得到的高活性nk细胞
的活细胞数,以成为1x106个细胞/ml的方式用仅kbm501培养基、包含266μm,810μm,2400μm tudca的kbm501培养基、包含2.4%dmso(nacalai tesque、13445-74)的kbm501培养基悬浮,在低吸附的6孔板中接种,在37℃、5%co2下温育2小时,进行冷冻预处理。预处理后,基于处理时的细胞数,以成为1x107个细胞/ml的方式用stem-cellbanker悬浮,在-80℃冷冻保存。将冷冻48小时以上的完成预处理的nk细胞用37℃水浴融解,各组分别在plasma-lyte a或包含3000单位/ml il-2的plasma-lyte a中稀释11倍,在室温温育至3小时。1小时后和3小时后,轻轻悬浮计数活细胞数。此外,1小时后用kbm501培养基稀释5倍,在37℃、5%co2下温育2小时后,计数活细胞数。根据融解后各时点的活细胞数算出相对于冷冻时的细胞数的回收率。
[0314]
此外,在融解、稀释的各时间点,用实施例6中记载的方法进行高活性nk细胞对k562细胞的细胞毒性活性的测定。
[0315]
进一步,关于融解后第1小时和第3小时的高活性nk细胞,进行实体瘤模型中的评价(3d杀伤试验)。详细地,基于冷冻时的细胞数,以成为1x106个细胞/ml的方式用kbm501培养基配制高活性nk细胞。对在384孔板中预先接种的1个skov3球加入50μl配制的nk细胞,在37℃、5%co2下反应4天时期。其后,用accutase剥离回收细胞,在24孔板中用rpmi培养基扩增培养。将在37℃、5%co2下扩增培养的17天后的细胞用4%pfa固定,用dapi染色,使用荧光显微镜(bz-9000、keyence)、bz-ii观察应用程序进行未接受通过nk的损害的skov3的面积定量。
[0316]
《skov3球体》
[0317]
用10%fbs/rpmi1640以成为3x104个细胞/ml的方式配制skov3细胞(人卵巢癌细胞株),96孔板的每1孔接种3x103/100μl。在37℃、5%co2下培养3天制备球体。
[0318]
预处理条件、和融解条件得到的回收率示于下表。通过用以各种浓度添加tudca的kbm501培养基预处理高活性nk细胞,融解后的回收率改善。
[0319]
[表6]
[0320][0321]
此外,细胞毒性活性的测定结果示于图7-1,用实体瘤模型的评价(3d杀伤试验)的结果示于图7-2。图7-1中不添加nk细胞的skov3球体表述为nega。
[0322]
扩大tudca的浓度范围、追加在实体瘤模型中的评价时,冷冻前添加的tudca优选以2,400μm和267μm之间的浓度应用,特别是以800μm应用时回收率高,并且对实体瘤模型的损害活性高。
[0323]
[实施例8]
[0324]
(8-1)计数用高活性nk细胞的培养方法、回收方法2中记载的顺序得到的高活性nk细胞的活细胞数,以成为1x107个细胞/ml的方式悬浮于stem-cellbanker,在-80℃冷冻保存。将冷冻48小时以上的高活性nk细胞用37℃水浴融解,在(1)plasma-lyte a、(2)包含1.48mm mgcl2·
6h2o(nacalai tesque、20909-55)的pbs(-)、(3)pbs(-)、(4)kbm501培养基、(5)包含62.2mg/l cacl2·
2h2o(nacalai tesque、08895-15)的plasma-lyte a、(6)包含0.1%葡萄糖(50%葡萄糖、terumo)的plasma-lyte a、(7)葡萄糖、(8)不含血清成分的rpmi培养基(nacalai tesque、09892-15)、(9)包含葡萄糖的rpmi培养基(nacalai tesque、30264-85)中稀释10倍,(1)~(4)在室温温育2小时、(1)和(5)~(9)在37℃温育3小时。其后,用通过7-aad的染色方法中记载的方法进行测定,用flowjo软件分析。
[0325]
(8-2)计数用高活性nk细胞的培养方法、回收方法1或回收方法2中记载的顺序得到的高活性nk细胞的活细胞数,以成为1x107个细胞/ml的方式悬浮于stem-cellbanker,在-80℃冷冻保存。将冷冻48小时以上的各自的高活性nk细胞用37℃水浴融解,在(1)plasma-lyte a、(2)包含1.48mm mgcl2(nacalai tesque、95812-85)的pbs(-)、(3)pbs(-)、(4)kbm501培养基、(5)乳酸林格、(6)hbss(+)(nacalai tesque、09735-75)中稀释10倍,在37℃温育3小时。其后,用通过7-aad的染色方法中记载的方法进行测定,用flowjo软件分析。
[0326]
(8-3)与(8-1)同样,但是作为稀释融解后的细胞的溶剂,应用(1)pbs、(2)plasma-lyte a、(3)包含27.7meq/l乳酸(nacalai tesque、20006-62)的plasma-lyte a、(4)包含48.84mg/l mgso4·
7h2o(nacalai tesque、21002-85)的plasma-lyte a、(5)乳酸林格、(6)veen f(扶桑药品工业)、(7)solita-t1(ay pharma)、(8)solita-t3(ay pharma)、(9)5%葡萄糖注射液(terumo)、(10)rpmi培养基,在37℃温育3小时。另外,有关(3),乳酸配合乳酸林格氏液的乳酸浓度添加,用石蕊试纸确认中性。有关(4),mgso4配合hbss的mgso4浓度添加。其后,用通过7-aad的染色方法中记载的方法进行测定,用flowjo软件分析。
[0327]
(8-4)与(8-2)同样,但是作为稀释融解后的细胞的溶剂,应用(1)pbs、(2)plasma-lyte a、(3)生理盐水(大冢制药)、(4)bicanate(大冢制药)、(5)solacet-f(terumo)处理。其后,用通过7-aad的染色方法中记载的方法进行测定,用flowjo软件分析。
[0328]
(8-5)计数用高活性nk细胞的培养方法、回收方法1和回收方法2中记载的顺序得到的高活性nk细胞的活细胞数,以成为1x107个细胞/ml的方式悬浮于stem-cellbanker,在-80℃冷冻保存。将冷冻48小时以上的高活性nk细胞用37℃水浴融解。完全溶解后即刻,用(1)plasma-lyte a、(2)生理盐水、(3)rpmi1640培养基、(4)乳酸林格、(5)用plasma-lyte a配制的0.423mm cacl2、(6)1.36mm cacl2稀释10倍,分别在37℃静置3小时。另外,(5)的cacl2配合rpmil640培养基、(6)的cacl2配合乳酸林格氏液添加。其后,用通过7-aad的染色方法中记载的方法进行测定,用flowjo软件分析。
[0329]
(结果)用flowjo软件分析结果示于图8-1~8-5。通过以冷冻前的溶剂为培养基、融解后使用plasma-lyte a,可以改善活力。融解、稀释后可以在室温维持(8-1)。
[0330]
[实施例9]
[0331]
(9-1)计数用高活性nk细胞的培养方法、回收方法2中记载的顺序得到的高活性nk细胞的活细胞数,以成为4x107个细胞/ml的方式悬浮于stem-cellbanker,在-80℃冷冻保
存。将冷冻48小时以上的高活性nk细胞用37℃水浴融解,在包含3000单位/ml il-2的plasma-lyte a中稀释10倍,在室温静置至6小时。在融解2小时后、5小时后、6小时后的时点,关于细胞毒性活性分别进行分析。对于细胞毒性活性,用实施例9-1(b)中记载的方法将nk细胞和k562细胞以成为细胞比1:1的方式在96孔板(iwaki,4870-800sp)中添加、混合之后,在37℃、5%co2下反应2小时。
[0332]
计数用高活性nk细胞的培养方法、回收方法2中记载的顺序得到的高活性nk细胞的活细胞数,以成为4x107个细胞/ml的方式悬浮于stem-cellbanker,在-80℃冷冻保存。将冷冻48小时以上的高活性nk细胞用37℃水浴融解,在包含3000单位/ml il-2的plasma-lyte a中稀释10倍,在室温静置至4小时。在融解后即刻、1小时后、2小时后、3小时后、4小时后的时点,关于活力的推移、细胞毒性活性(2小时反应固定、或e∶t=1∶1固定)分别进行分析。
[0333]
a)活力推移
[0334]
在各时点充分混和融解细胞,分配1x105个细胞,用通过7-aad的染色方法中记载的方法进行测定,用flowjo软件分析。
[0335]
b)细胞毒性活性(1)
[0336]
在细胞毒性活性的测定中,准备使nk细胞和k562细胞反应的组、作为阴性对照的仅k562细胞的组、作为阳性对照将k562细胞用10%福尔马林固定的组。
[0337]
《nk细胞》
[0338]
基于冷冻时的活细胞数分配所需量的nk细胞后,用10%fbs/rpmi1640配制为1x106个细胞/ml的浓度。
[0339]
《k562细胞》
[0340]
将k562细胞用无血清rpmi1640培养基悬浮,应用pkh26 red fluorescent cell linker kit染色之后,用10%fbs/rpmi1640配制为2x106个细胞/ml。
[0341]
nk细胞和k562细胞以细胞比成为1∶2、1∶1、2∶1、4∶1的方式在96孔板(iwaki,4870-800sp)中添加、混合,在37℃、5%co2下反应2小时。反应结束后,用通过7-aad的染色方法中记载的方法进行测定,用flowjo软件分析,算出细胞毒性活性率(%裂解)。
[0342]
c)细胞毒性活性(2)
[0343]
用上述b).细胞毒性活性(1)中记载的方法配制nk细胞和k562细胞,将nk细胞和k562细胞以细胞比成为1∶1的方式在96孔板(iwaki,4870-800sp)中添加、混合之后,在37℃、5%co2下反应2小时、4小时、6小时、8小时。反应结束后,用通过7-aad的染色方法中记载的方法进行测定,用flowjo软件分析,算出细胞毒性活性率(%裂解)。
[0344]
(9-2)与(9-1)同样,但是融解、稀释后静置至6小时,在2小时后、5小时后、6小时后的时点,用上述b)中记载的方法测定细胞毒性活性。详细地,将nk细胞和k562细胞以细胞比成为1∶1的方式在96孔板(iwaki,4870-800sp)中添加、混合之后,在37℃、5%co2下反应2小时。反应结束后,用通过7-aad的染色方法中记载的方法进行测定,用flowjo软件分析,算出细胞毒性活性率(%裂解)。
[0345]
结果示于图9-1、9-2、9-3。如果用适当的方法对高活性nk细胞进行预处理、冷冻、融解、稀释,即使以施用形式在室温静置,活力和活性也可以维持4小时。进一步,确认活性可以维持至6小时。例如,已知car-t细胞制剂kymriah以施用形式(融解后)仅能够维持其活
lyte a用由超纯蒸馏水(invitrogen、10977-015)稀释的80%,50%,10%plasma-lyte a稀释10倍,分别在室温和37℃静置至3小时。在稀释后即刻、1小时、2小时、3小时的时点分配1x105个细胞,用通过7-aad的染色方法中记载的方法进行测定,用flowjo软件分析。
[0356]
(12-2)与(12-1)同样处理、分析细胞。但是,替代超纯蒸馏水(invitrogen、10977-015),用由生理盐水稀释plasma-lyte a的80%,50%,10%plasma-lyte a稀释10倍,分别在室温和37℃静置至3小时。
[0357]
(12-3)与(12-1)同样处理、分析细胞。但是,替代超纯蒸馏水(invitrogen、10977-015),用由生理盐水稀释plasma-lyte a的那种、或生理盐水稀释10倍,分别在室温和37℃静置至3小时。
[0358]
(12-4)与(12-1)同样处理、分析细胞。但是,细胞完全溶解后即刻,用plasma-lyte a、生理盐水、以超纯蒸馏水配制的230mm nacl2、150mm kcl、100mm mgcl2、11%海藻糖、10%蔗糖、5%蔗糖、以plasma-lyte a配制的10%、20%ultragro稀释10倍,分别在室温静置至3小时。
[0359]
(12-5)与(12-4)同样处理、分析细胞。但是,用各自的溶液稀释细胞10倍,分别在37℃静置至3小时。
[0360]
(12-6)计数用高活性nk细胞的培养方法、回收方法1中记载的顺序得到的高活性nk细胞的活细胞数,以成为1x107个细胞/ml的方式悬浮于stem-cellbanker,在-80℃冷冻保存。将冷冻48小时以上的高活性nk细胞用37℃水浴融解。完全溶解后即刻,用plasma-lyte a、生理盐水、以超纯蒸馏水配制的230mm nacl2、150mm kcl、100mm mgcl2、100mm cacl2、11%海藻糖、10%蔗糖、5%蔗糖、以plasma-lyte a配制的10%、20%ultragro、10%、20%、30%、40%ab血清(cellect、2938249)稀释10倍,分别在室温静置至3小时。在稀释后即刻、1小时、2小时、3小时的时点,分配1x105个细胞,用通过7-aad的染色方法中记载的方法进行测定,用flowjo软件分析。
[0361]
(12-7)与(12-6)同样处理、分析细胞。但是,用各自的溶液稀释细胞10倍,分别在37℃静置至3小时。
[0362]
(结果)用flowjo软件分析结果示于图12-1~12-10。
[0363]
在12-1~3的条件,融解时应用的plasma-lyte a的成分可以稀释至其1/10,其稀释中应用的液体可以是生理盐水也可以是蒸馏水。即,知晓融解时应用的液体可以是低渗液或生理盐水。
[0364]
在12-4和5的条件,回收时用kbm501培养基洗涤时,不论融解时应用的液体是低渗或高渗,只要是nacl溶液则可以维持活力。此外,即使应用单糖类或多糖类的等渗液,如果是室温、或者如果是短时期,也可以维持活力。另一方面,在100mm mgcl2活力差。
[0365]
在12-6和7的条件,知晓在回收时用pbs洗涤的情形难以维持活力。
[0366]
[融解时的溶液的组成一览(单位是mm)][表7]
[0367][0368]
[实施例1~12总结]
[0369]
以上内容总结于一览表。另外,下表中,有关时间,除了记载为“小时”的情形,单位
是分钟。此外,有关温度,“r.t.”表示室温,其以外的情形是37℃。有关活力,a表示70%以上,b表示50%以上不足70%,c表示不足50%,-表示不评价。有关活性,a表示70%以上,b表示50%以上不足70%,c表示不足50%,-表示不评价。如果评价是a或b,则说明实现了目的。
[0370]
[表8-1]
[0371][0372]
[表8-2]
[0373][0374]
[表8-3]
[0375][0376]
[表8-4]
[0377][0378]
[表8-5]
[0379][0380]
[表8-6]
[0381]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1