膜联蛋白A1N-末端肽的制剂和方法与流程
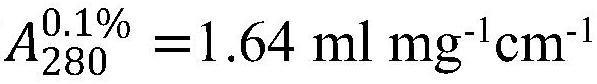
本发明涉及包含膜联蛋白a1(anxa1)n-末端-肽的药物制剂,所述药物制剂具有改善的溶解度和/或稳定性,并且包括液体制剂、由其衍生的冷冻-干燥制剂以及重构制剂或溶液。液体制剂的ph>6或2<ph<3,并且包含治疗有效量的膜联蛋白a1(anxa1)n-末端-肽和选自水(例如超纯水)和基本上非离子或低离子的和/或基本上等张的溶液的溶剂,任选地包含等张调节剂,例如碳水化合物和/或糖醇。所公开的制剂可特别有效地用于治疗缺血性和炎性疾病。
背景技术:
1、膜联蛋白超家族由13种具有显著生物学上和结构上的同源性的钙磷脂结合蛋白组成。膜联蛋白在结构上分为高度保守的核心结构域和可变的n-末端结构域。膜联蛋白a1(anxa1,37kda–seq id no:1)是一种抑制血源性多形核白细胞(pmn)向周围组织外渗的抗炎蛋白。所述蛋白与n-甲酰肽受体(fpr)2或fpr-l1受体结合,并由此启动一系列信号传导事件。在炎性刺激后,血源性多形核白细胞(pmn)迁移到周围组织中。pmn的迁移或外渗受介体如粘附分子、细胞因子和蛋白酶的调节,这些介体控制促炎和抗炎过程。pmn的破坏性潜力很高,并且可能会损害自我。因此,控制pmn外渗和炎性应答很重要。
2、对于作为抗炎剂的治疗目的,完整的膜联蛋白a1蛋白相对于其功能片段或修饰形式具有许多缺点。所述蛋白的大尺寸使其更难通过可用于较小多肽的技术进行递送(例如经皮或经粘膜)。对于用于治疗眼部炎症,预期较小的分子能够更好地穿透角膜上皮。此外,对蛋白水解降解的敏感性是对于所有肽药物来说特别关注的问题,尤其是大的肽,并且尤其是在考虑(许多患者优选的)口服递送的情况下。
3、一些在多肽n-末端侧缺乏重要区域的膜联蛋白a1衍生物已被证明在一些炎性和介体释放测定中缺乏显著活性,而全长的n-末端n-乙酰基膜联蛋白a1在多种系统下都被认为具有生物活性。许多主要衍生自膜联蛋白a1蛋白的独特n-末端部分的肽都已被证明具有抗炎特性。研究最广泛的膜联蛋白a1肽之一是肽ac2-26,它模拟54个氨基酸的n-末端区域的第2到第26个氨基酸。与ac 1-188片段(和天然蛋白)一样,它具有n-末端乙酰化以增加其稳定性,并可能增加其半衰期。已经表明,膜联蛋白a1及其n-末端肽(ac2-26)通过fpr2/脂氧素a4(fpr2/alx)受体而发挥其大部分抗炎作用。在体内,已表明ac2-26肽在心肌缺血再灌注(i/r)、肠系膜i/r、糖原腹膜炎和il1气囊模型中发挥抗炎作用,据报道可显著减少嗜中性粒细胞向损伤/炎性部位的募集。
4、ac2-26肽的较短版本,如肽ac2-12和ac2-6,也已显示在急性炎性模型中发挥一定程度的抗炎作用。已经公开了具有抗炎作用的较长多肽,例如对应于氨基酸残基2-48、2-50和11-48的多肽,包括蛋白酶抗性v24l变体(wo 2012/174397)。
5、肽治疗剂具有自我结合的潜力,从而导致聚集和/或原纤维化。为了制备稳定的肽制剂,应当保持天然肽构象。稳定的制剂和长期稳定性对于开发保留生物利用度的有效治疗组合物很重要,并且可以用于将肽暴露于机械应力的递送装置(例如连续输注系统)中。
6、肽在水性溶液中的溶解度在很大程度上取决于许多因素,包括缓冲系统、张力提供者以及肽的浓度和形式(例如盐和其他修饰)的选择。
7、鉴于膜联蛋白a1(anxa1)n-末端-肽的治疗潜力,需要开发可以通过多种施用途径进行施用的安全、有效和稳定的制剂。
技术实现思路
1、膜联蛋白a1(anxa1)n-末端-肽,例如膜联蛋白a1 2-48 v24l(sed id no:8)在本文中显示出差的溶解度,在约7.3的中性ph的盐水中具有非常高的原纤维化(fibrillation)倾向,从而不适合进行药物施用。为了克服溶解度和稳定性问题,本发明人开发了膜联蛋白a1 n-末端-肽的稳定溶液,其降低了形成原纤维和颗粒的倾向,并在可选的冷冻-干燥过程中保存肽以使其在相同的储存过程中稳定。
2、本公开涉及以下发现:膜联蛋白a1 n-末端-肽显示出明显的ph依赖性原纤维化特征,在ph 6以下完全不溶于任何测试的溶剂(盐水、超纯水和基本上非离子和等张的溶液)。因此,保持ph高于6或低于3,例如高于6.5或低于2.5;并且在一些实施方案中,保持基本上非离子或低离子强度(例如1μm至50mm)的溶液,例如通过避免盐(包括盐水)的存在;和任选地保持基本上等张的溶液;可显著且出乎意料地增加了所述膜联蛋白a1 n-末端-肽的溶解度和稳定性。
3、本文公开的具有改善的溶解度和/或稳定性的药物制剂包含治疗有效量的膜联蛋白a1 n-末端-肽和溶剂,所述溶剂选自水(例如超纯水)和基本上非离子或低离子和/或基本上等张的溶液,所述溶液任选地包含等张调节剂,例如碳水化合物和/或糖醇,其中所述制剂保持ph>6或2<ph<3。
4、所述药物制剂特别适用于治疗缺血性和炎性病况。
5、本公开的一个方面是提供ph>6或2<ph<3的液体药物制剂,所述制剂包含:
6、a.治疗有效量的膜联蛋白a1(anxa1)n-末端-肽,其选自amvseflkq awfieneeqeyvqtvksskg gpgsavspyp tfnpssdvaa lhka(anxa1 2-54,seq id no:3),及其片段,及其变体,及其片段的变体;和
7、b.溶剂,其选自:
8、i.水,例如超纯水,和
9、ii.基本上非离子或低离子和/或基本上等张的溶液,任选地包含等张调节剂,例如碳水化合物和/或糖醇。
10、在一个实施方案中,所述膜联蛋白a1 n-末端-肽选自以下:
11、amvseflkqawfieneeqeyvqtvksskggpgsavspyptfnpssd vaa(sed id no:4,膜联蛋白a1 2-50),
12、amvseflkqawfieneeqeyvqtvksskggpgsavspyptfnpssd v(sed id no:5,膜联蛋白a1 2-48),和
13、amvseflkqawfieneeqeyvqtvksskggpgsavspyptfnpss(sed id no:6,膜联蛋白a12-46),
14、以及seq id no:4-6中任一个的变体,包括具有v24l取代和c-末端酰胺化的变体。
15、本公开的另一个方面提供了通过冻干本文公开的液体药物制剂获得的冻干药物制剂。还公开了所述冻干药物制剂的重构溶液(reconstituted solution)。还公开了如本文所公开的液体药物制剂和所述冻干药物制剂的重构溶液用作药物,例如用于治疗缺血性病况和/或炎性病况。
技术特征:
1.液体药物制剂,所述制剂ph>6.0或2<ph<3,所述制剂包含:
2.根据权利要求1所述的液体药物制剂,其中ph≥7.4,或2<ph<2.6。
3.根据前述权利要求中任一项所述的液体药物制剂,其中ph≥7.4,例如ph≥7.5,例如ph≥7.6,例如ph≥7.7,例如ph≥7.8,例如ph≥7.9,例如ph≥8.0。
4.根据前述权利要求中任一项所述的液体药物制剂,其中ph≥8,或2<ph<2.6。
5.根据前述权利要求中任一项所述的液体药物制剂,其中ph为8至8.5。
6.根据前述权利要求中任一项所述的液体药物制剂,其中ph≥8.3。
7.根据前述权利要求中任一项所述的液体药物制剂,所述制剂基本上不包含原纤维和/或基本上不包含≥1μm,例如≥10μm,例如≥100μm的蛋白性颗粒。
8.根据前述权利要求中任一项所述的液体药物制剂,与ph为3<ph<6,例如3<ph<6.5,例如3<ph<7,例如3<ph<7.4的液体药物制剂相比,和/或与盐水液体药物制剂相比,和/或与具有>50mm的离子强度的溶液相比,和/或与不含等张调节剂的溶液相比,所述制剂:
9.根据前述权利要求中任一项所述的液体药物制剂,其中所述膜联蛋白a1 n-末端-肽具有至少0.1mg/ml,例如至少0.5mg/ml,例如至少1.0mg/ml,例如至少1.5mg/ml,例如至少2.0mg/ml,例如至少2.5mg/ml,例如至少3.0mg/ml,例如至少3.5mg/ml,例如至少4.0mg/ml,例如至少5.5mg/ml,例如至少5.0mg/ml,例如至少7.5mg/ml,例如至少10.0mg/ml的水性溶解度。
10.根据前述权利要求中任一项所述的液体药物制剂,其中所述膜联蛋白a1 n-末端-肽具有至少0.8mg/ml,例如至少1mg/ml,例如至少1.6mg/ml,例如至少2mg/ml,例如至少2.5mg/ml,例如至少3mg/ml,例如至少3.3mg/ml,例如至少3.5mg/ml的水性溶解度。
11.根据前述权利要求中任一项所述的液体药物制剂,所述制剂具有浓度为0.1至10mg/ml,例如0.1至0.5mg/ml,例如0.5至1mg/ml,例如1至2mg/ml,例如2至3mg/ml,例如3至4mg/ml,例如4至5mg/ml,例如5至6mg/ml,例如6至7mg/ml,例如7至8mg/ml,例如8至9mg/ml,例如9至10mg/ml的所述膜联蛋白a1 n-末端-肽。
12.根据前述权利要求中任一项所述的液体药物制剂,所述制剂具有浓度为至少0.8mg/ml,例如至少1mg/ml,例如至少1.6mg/ml,例如至少2mg/ml,例如至少2.5mg/ml,例如至少3mg/ml,例如至少3.3mg/ml,例如至少3.5mg/ml的所述膜联蛋白a1 n-末端-肽。
13.根据前述权利要求中任一项所述的液体药物制剂,其中ph>6并且所述膜联蛋白a1n-末端-肽具有至少0.8mg/ml,例如至少1mg/ml,例如至少1.6mg/ml,例如至少2mg/ml,例如至少2.5mg/ml,例如至少3mg/ml,例如至少3.3mg/ml,例如至少3.5mg/ml的水性溶解度;和/或所述制剂具有浓度为至少0.8mg/ml,例如至少1mg/ml,例如至少1.6mg/ml,例如至少2mg/ml,例如至少2.5mg/ml,例如至少3mg/ml,例如至少3.3mg/ml,例如至少3.5mg/ml的所述膜联蛋白a1 n-末端-肽。
14.根据前述权利要求中任一项所述的液体药物制剂,其中所述溶液具有1μm至50mm的离子强度。
15.根据前述权利要求中任一项所述的液体药物制剂,其中所述溶液具有100%(等张)+/-20%的张力,例如80%至120%,例如80-85%,例如85-90%,例如90-95%,例如95-100%,例如100-105%,例如105-110%,例如110-115%的张力,例如115-120%的张力。
16.根据前述权利要求中任一项所述的液体药物制剂,其中
17.根据前述权利要求中任一项所述的液体药物制剂,其中
18.根据前述权利要求中任一项所述的液体药物制剂,其中
19.根据前述权利要求中任一项所述的液体药物制剂,其中
20.根据前述权利要求中任一项所述的液体药物制剂,其中
21.根据前述权利要求中任一项所述的液体药物制剂,其中
22.根据前述权利要求中任一项所述的液体药物制剂,其中ph≥7.4,例如ph≥8.0,例如ph≥8.3,并且所述膜联蛋白a1 n-末端-肽的水性溶解度为至少4.0mg/ml,例如至少4.5mg/ml,例如至少5.0mg/ml,例如至少6.0mg/ml,例如至少7.0mg/ml,例如至少8.0mg/ml,例如至少9.0mg/ml,例如至少10.0mg/ml,例如至少15.0mg/ml;和/或所述制剂具有浓度为至少4.0mg/ml,例如至少4.5mg/ml,例如至少5.0mg/ml,例如至少6.0mg/ml,例如至少7.0mg/ml,例如至少8.0mg/ml,例如至少9.0mg/ml,例如至少10.0mg/ml,例如至少15.0mg/ml的所述膜联蛋白a1 n-末端-肽。
23.根据前述权利要求中任一项所述的液体药物制剂,其中所述溶剂包含一种或多种等张调节剂,例如碳水化合物和/或糖醇。
24.根据前述权利要求中任一项所述的液体药物制剂,其中所述等张调节剂选自戊糖单糖、己糖单糖、二糖和三糖。
25.根据前述权利要求中任一项所述的液体药物制剂,其中所述等张调节剂选自蔗糖、海藻糖、甘露糖、核糖、麦芽糖、葡萄糖、乳糖、半乳糖、阿拉伯糖、甘露糖醇、山梨糖醇、肌醇、甘油、木糖醇、丙二醇、聚乙二醇(peg)和聚丙二醇/乙二醇共聚物。
26.根据前述权利要求中任一项所述的液体药物制剂,其中所述溶液包含蔗糖和/或甘露醇。
27.根据前述权利要求中任一项所述的液体药物制剂,其中所述溶液包含蔗糖。
28.根据前述权利要求中任一项所述的液体药物制剂,其中所述溶液包含约4%(w/v)的甘露醇和/或约1%的蔗糖,例如包含3至5%(w/v)的甘露醇和/或0.5至2%(w/v)的蔗糖,例如包含0至8%(w/v)的甘露醇和/或0至5%(w/v)的蔗糖。
29.根据前述权利要求中任一项所述的液体药物制剂,其中
30.根据前述权利要求中任一项所述的液体药物制剂,其中
31.根据前述权利要求中任一项所述的液体药物制剂,其中
32.根据前述权利要求中任一项所述的液体药物制剂,其中
33.根据前述权利要求中任一项所述的液体药物制剂,其中
34.根据前述权利要求中任一项所述的液体药物制剂,其中
35.根据前述权利要求中任一项所述的液体药物制剂,进一步包含一种或多种缓冲剂。
36.根据前述权利要求中任一项所述的液体药物制剂,进一步包含一种或多种选自以下的缓冲剂:乙酸盐缓冲剂,tris,含胺缓冲剂,基于氨基酸的缓冲剂如赖氨酸、羟基-赖氨酸、组氨酸和甘氨酰-甘氨酸,非磷酸盐缓冲剂,碳酸氢盐缓冲剂,聚山梨酯-80(例如tween80),hepes和硼酸盐。
37.根据前述权利要求中任一项所述的液体药物制剂,进一步包含甘氨酰-甘氨酸和/或tween20。
38.根据前述权利要求中任一项所述的液体药物制剂,进一步包含甘氨酰-甘氨酸和tween20,例如包含1至20mm甘氨酰-甘氨酸和0.001至0.1%tween20,例如包含10mm甘氨酰-甘氨酸和0.01%tween20。
39.根据前述权利要求中任一项所述的液体药物制剂,包含约4%的甘露醇、约1%的蔗糖、约10mm的甘氨酰甘氨酸、约0.01%的聚山梨酯80,且ph为约8.3。
40.根据前述权利要求中任一项所述的液体药物制剂,进一步包含组氨酸。
41.根据前述权利要求中任一项所述的液体药物制剂,进一步包含1-100mm的组氨酸。
42.根据前述权利要求中任一项所述的液体药物制剂,其中seq id no:4-9中任一个的所述变体包含1至6个单独的氨基酸取代,例如1个氨基酸取代,例如2个氨基酸取代,例如3个氨基酸取代,例如4个氨基酸取代,例如5个氨基酸取代,例如6个单独的氨基酸取代。
43.根据前述权利要求中任一项所述的液体药物制剂,其中所述膜联蛋白a1 n-末端-肽是amvseflkqawfieneeqeyvqtlksskggpgsavspyptfnpssdv-nh2(sed id no:8,膜联蛋白a1 2-48v24l),或其包含1至6个单独的氨基酸取代的变体,例如包含1个氨基酸取代,例如2个氨基酸取代,例如3个氨基酸取代,例如4个氨基酸取代,例如5个氨基酸取代,例如6个单独的氨基酸取代。
44.根据前述权利要求中任一项所述的液体药物制剂,其中seq id no:4-9中任一个的所述变体包含3个单独的氨基酸取代。
45.根据前述权利要求中任一项所述的液体药物制剂,其中seq id no:4-9中任一个的所述变体包含2个单独的氨基酸取代。
46.根据前述权利要求中任一项所述的液体药物制剂,其中seq id no:4-9中任一个的所述变体包含1个氨基酸取代。
47.根据前述权利要求中任一项所述的液体药物制剂,其中所述膜联蛋白a1 n-末端-肽是c-末端酰胺化的。
48.根据前述权利要求中任一项所述的液体药物制剂,其中所述膜联蛋白a1 n-末端-肽是amvseflkqawfieneeqeyvqtlksskggpgsavspyptfnpssdv-nh2(sed id no:8,膜联蛋白a1 2-48v24l),任选是c-末端酰胺化的。
49.一种制备前述权利要求中任一项所述的液体药物制剂的方法,包括以下步骤:
50.一种制备冻干药物制剂的方法,所述方法包括以下步骤:
51.通过权利要求50所述的方法获得的冻干药物制剂。
52.一种制备包含膜联蛋白a1 n-末端-肽的重构溶液的方法,所述方法包括
53.通过权利要求52所述的方法获得的重构溶液。
54.前述权利要求中任一项所述的液体药物制剂或冻干药物制剂或重构溶液,其用作药物。
55.前述权利要求中任一项所述的液体药物制剂或冻干药物制剂或重构溶液,其用于治疗缺血性病况和/或炎性病况。
技术总结
本发明涉及包含治疗有效量的膜联蛋白A1(AnxA1)N‑末端‑肽的药物制剂,其具有改善的溶解度和/或稳定性,同时对包括FPR1、FPR2和FPR3.5在内的一种或多种甲酰基肽受体保持激动活性。
技术研发人员:J·T·布克林斯基,P·S·图隆,M·H·闫森
受保护的技术使用者:雷索特制药股份有限公司
技术研发日:
技术公布日:2024/1/13
- 还没有人留言评论。精彩留言会获得点赞!