一种产细菌漆酶的基因工程菌及其构建方法与应用
1.本发明涉及基因工程技术领域,尤其涉及一种产细菌漆酶的基因工程菌及其构建方法与在染料脱色中的应用。
背景技术:
2.漆酶(laccase,ec 1.10.3.2)是一大类含铜的氧化酶,可以催化多种酚类物质和非酚类化合物的氧化,同时可以将氧分子还原为水。漆酶广泛分布在自然界中,在细菌、真菌、古菌和动植物中均存在,其作用底物广泛,催化效率高,在生物制药、造纸纸浆漂白、食品品质改善、纺织染料处理、生物传感器研发等方面具有极其重要的潜在开发价值,近年来成为了酶工程和环境修复工程等领域的研究热点。
3.目前纺织印染行业中大量使用人工合成的活性染料对纺织品如棉、麻等织物进行染色,但是当前的染色工艺会产生大量污水,其中含有较多的活性染料和大量氯离子等,增大了污水处理的难度。随着我国经济不断发展,印染纺织品的需求不断增大,随之而来的污水直接排放或者不完全处理则会对生态环境造成极大的破坏。对这些印染废水的传统处理方案如物理吸附或化学处理等方法在成本较高,能耗较大,并且容易产生各种副产物造成二次污染。近期研究发现,运用漆酶对活性染料进行脱色可以弥补上述传统处理方法的不足。
4.当前研究较多的漆酶主要来自于真菌如侧耳属、灵芝属和鬼伞属等,然而真菌漆酶在碱性条件和高浓度氯离子环境下活性下降迅速,影响了其在纺织废水脱色中的应用。近期研究发现,细菌来源漆酶在碱性条件下具有较好的催化活性,并能够耐受一定浓度的氯离子,适用于纺织废水的脱色处理。然而,目前被系统研究的细菌漆酶数量并不多,基本都停留在实验室水平,还没有在纺织废水脱色中的细菌漆酶的大规模应用报道。同时,已报道的细菌漆酶的异源表达中较多需要添加价格昂贵的异丙基-β-d-硫代半乳糖苷(iptg)进行诱导表达,这在一定程度上提高了细菌漆酶的生产成本,需要进一步研究与开发细菌漆酶的低成本生产工艺。
技术实现要素:
5.本发明所要解决的技术问题在于提供一种产细菌漆酶的基因工程菌及其构建方法与在靛蓝类和偶氮类染料脱色处理的过程中的应用。
6.本发明采用以下技术方案解决上述技术问题:
7.一种产细菌漆酶的基因工程菌,所述基因工程菌包括如seq id no.2所示的核苷酸序列。
8.作为本发明的优选方式之一,还包括如seq id no.3所示的核苷酸序列。
9.一种产细菌漆酶的基因工程菌的构建方法,包括如下步骤:
10.(1)细菌漆酶基因密码子的优化
11.选择基因序列如seq id no.1所示的海单胞菌来源的细菌漆酶基因进行密码子优
化,以得到适合在大肠杆菌中高效表达的基因序列;
12.(2)全基因合成
13.将密码子优化后的细菌漆酶序列命名为lac1并进行全基因合成,基因序列如seq id no.2所示;同时,将光诱导基因序列命名为light并进行全基因合成,基因序列如seq id no.3所示;
14.(3)工程菌的获得
15.①
以密码子优化后的细菌漆酶基因lac1序列为模板,以引物lac1-f和引物lac1-r进行pcr扩增;以光诱导基因序列light为模板,以引物light-f和引物light-r进行pcr扩增;同时,以表达载体pet22b基因序列为模板,以引物22b-f和引物22b-r进行pcr扩增;其中,所述lac1-f和引物lac1-r的核苷酸序列如seq id no.4、5所示,light-f和引物light-r的核苷酸序列如seq id no.6、7所示,22b-f和引物22b-r的核苷酸序列如seq id no.8、9所示;
16.②
将上述各pcr扩增产物进行琼脂糖凝胶电泳,并将回收获得的序列进行重组连接,获得光诱导表达载体pet22b-light-lac1;将该光诱导表达载体经过热激转化法转化入bl21(de3)菌株,并涂布于含氨苄青霉素的lb培养基平板;挑取不同的重组转化子单克隆进行pcr鉴定,鉴定为阳性的菌株即为目标所需的产细菌漆酶的基因工程菌bl21(de3)-pet22b-light-lac1。
17.作为本发明的优选方式之一,所述步骤(1)中,采用在线密码子优化软件不改变蛋白编码序列,将原始的漆酶基因三联体密码子改为大肠杆菌密码子偏爱的碱基。
18.作为本发明的优选方式之一,所述步骤(3)中,将光诱导表达载体经过热激转化法转化入bl21(de3)菌株,并涂布于含终浓度100μg/ml氨苄青霉素的lb培养基平板。
19.作为本发明的优选方式之一,所述步骤(3)中,在获得目标所需的产细菌漆酶的基因工程菌后,将其扩大培养,并取菌液保存于15~25%的甘油管中,放置于-80℃温度环境下保菌。
20.一种采用上述构建方法得到的产细菌漆酶的基因工程菌在染料脱色中的应用:利用所述产细菌漆酶的基因工程菌所产生的细菌漆酶作为催化剂对靛蓝类染料和偶氮类染料进行脱色。
21.作为本发明的优选方式之一,利用所述基因工程菌获得细菌漆酶的方法为:
22.(1)基因工程菌的光照诱导表达
23.将目标菌株接种于含100μg/ml氨苄青霉素的液体lb培养基中,在20~37℃,100~200rpm条件下避光培养至od
600
值达到0.4~0.6时,进行3000~9000lx强度的白光照射,并降温至14~18℃进行诱导表达;16~24h后,结束发酵并收集发酵液;
24.(2)漆酶lac1的纯化
25.将步骤(1)中收集的发酵液在4℃、4000rpm下离心20min,收集沉淀中的菌体并弃去上清;以ph 7.5的50mm na2hpo
4-kh2po4缓冲液重悬清洗沉淀2次后,再以适量缓冲液重悬细胞并利用超声破碎的方法对菌体进行破壁,将破碎液在4℃、12000rpm下离心40min,弃去沉淀收集上清液获得lac1粗酶液;用2ml柱体积的镍离子亲和层析柱纯化细菌漆酶lac1,获得漆酶lac1纯酶液。其中,蛋白纯化的具体步骤如下:
26.①
将lac1粗酶液加入镍离子亲和层析柱;
27.②
待lac1粗酶液流过后,加入10ml wash buffer将杂蛋白清洗下来;
28.③
加入6ml elute buffer冲洗并收集目标蛋白lac1;
29.④
将收集获得的6ml的lac1溶液置于透析袋中,将透析袋至于1l体积的dialysis buffer中,在4℃环境透析4次,获得漆酶lac1纯酶液。
30.作为本发明的优选方式之一,wash buffer的配方为:20mm tris-hcl,500mm nacl,50mm imidazole,ph 8.0;elute buffer的配方为:20mm tris-hcl,500mm nacl,500mm imidazole,ph 8.0;dialysis buffer的配方为:50mm na2hpo
4-kh2po4,ph 7.5。
31.作为本发明的优选方式之一,利用所述漆酶lac1纯酶液在靛蓝类染料和偶氮类染料脱色处理的过程中作为催化剂使用。
32.作为本发明的优选方式之一,所述靛蓝类染料包括靛蓝胭脂红,偶氮类染料包括刚果红;对靛蓝胭脂红的脱色参数为:50mm na2hpo
4-kh2po4缓冲液,100μm cuso4,ph 7.5,温度50℃,体系酶量为10u/l,体系染料量为100μm,反应时间60min;对刚果红的脱色参数为:50mm na2hpo
4-kh2po4缓冲液,100μm cuso4,ph 8.0,温度50℃,体系酶量为10u/l,体系染料量为100μm,反应时间24h。本发明细菌漆酶lac1可在无介体的存在下直接催化染料脱色,且对靛蓝胭脂红脱色率达到99.7%,对刚果红脱色率为99.5%。
33.本发明相比现有技术的优点在于:
34.本发明将海单胞菌来源的细菌漆酶基因进行密码子优化后进行了全基因合成,同时将光照诱导相关基因中相关序列进行了全基因合成,将基因序列与pet22b质粒连接,并转化e.coli bl21(de3)菌株,通过培养及诱导条件的优化,制得可以高效表达具有优良酶学特性的细菌漆酶蛋白lac1的工程菌株;本发明构建的产细菌漆酶的基因工程菌能够在光照诱导条件下高效表达lac1蛋白,且实现了其对靛蓝类染料和偶氮类染料的脱色,具有重要的工业应用价值。
附图说明
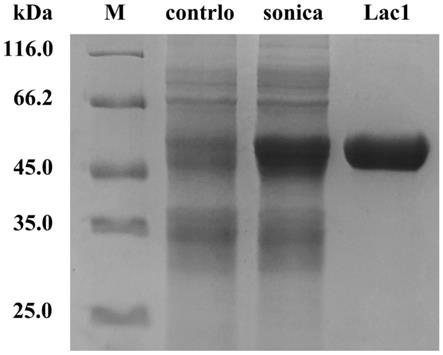
35.图1是实施例3中细菌漆酶lac1纯化后sds-page电泳检测结果图(图中,m为标准蛋白分子量marker,control为不含细菌漆酶基因的大肠杆菌全蛋白,sonica为含有细菌漆酶基因的大肠杆菌超声破碎后的全蛋白,lac1为纯化后细菌漆酶lac1纯蛋白条带);
36.图2是实施例5中细菌漆酶lac1脱色靛蓝胭脂红染料时的脱色率随时间变化情况;
37.图3是实施例5中细菌漆酶lac1脱色刚果红染料时的脱色率随时间变化情况。
具体实施方式
38.下面对本发明的实施例作详细说明,本实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实施例。
39.实施例1
40.实施例用以说明本发明各溶液及培养基的配制:
41.1、溶液的配制
42.50mm na2hpo
4-kh2po4缓冲液:称取7.098g na2hpo4溶解于纯水中并定容至1l,称取6.805g k h2po4溶解于超纯水中并定容至1l,取适当体积混合获得相应ph值的缓冲液。
43.10mm cuso4母液:称取2.497g cuso4·
5h2o溶于纯水中并定容至1l。
44.10mm丁香醛连氮母液:称取0.0144g丁香醛连氮粉末溶于二甲基亚砜中并定容至4ml。
45.wash buffer:20mm tris-hcl,500mm nacl,50mm imidazole,ph 8.0。
46.elute buffer:20mm tris-hcl,500mm nacl,500mm imidazole,ph 8.0。
47.dialysis buffer:50mm na2hpo
4-kh2po4,ph 7.5。
48.10mm靛蓝胭脂红染料母液:称取4.66g靛蓝胭脂红染料溶于纯水中,定容至1l。
49.10mm刚果红染料母液:称取6.97g刚果红染料溶于纯水中并定容至1l。
50.2、培养基的配制
51.lb培养基:取5.0g酵母提取物,10.0g胰蛋白胨,10.0g氯化钠,溶解于ddh2o中并定容至1000ml,121℃高压灭菌20min,使用前添加氨苄青霉素至终浓度(如需制作平板需在灭菌前加入1.5%琼脂粉)。
52.实施例2
53.本实施例用以说明产细菌漆酶lac1的基因工程菌的构建方法,包括如下步骤:
54.(1)细菌漆酶基因密码子的优化
55.由于大肠杆菌宿主对基因的表达有一定的密码子偏好性,故将海单胞菌来源的细菌漆酶基因(序列如seq id no.1所示)进行密码子优化,优化为适合大肠杆菌表达系统的表达的基因序列。采用在线密码子优化软件不改变蛋白编码序列,将原始的细菌漆酶基因三联体密码子改为大肠杆菌密码子偏爱的碱基。
56.(2)全基因合成
57.将密码子优化后的细菌漆酶序列命名为lac1并进行全基因合成(序列如seq id no.2所示)。基因合成交由上海生物工程有限公司完成(连接在puc18上,基因上下游分别插入noti和ecori酶切位点,转化入dh5a菌株)。同时,将光诱导基因序列命名为light并进行全基因合成(序列如seq id no.3所示);
58.(3)工程菌的获得
59.①
以密码子优化后的细菌漆酶基因lac1序列为模板,以引物lac1-f和引物lac1-r进行pcr扩增;以光诱导基因序列light为模板,以引物light-f和引物light-r进行pcr扩增;同时,以表达载体pet22b基因序列为模板,以引物22b-f和引物22b-r进行pcr扩增。其中,lac1-f和引物lac1-r的核苷酸序列如seq id no.4、5所示,light-f和引物light-r的核苷酸序列如seq id no.6、7所示,22b-f和引物22b-r的核苷酸序列如seq id no.8、9所示。
60.使用primestar gxl premix扩增试剂盒进行pcr扩增,且pcr反应体系50μl(引物各1μl,模板1μl,premix 25μl,灭菌水22μl),反应条件为98℃预变性2min,随后进行31个循环(98℃15s,55℃15s,72℃1min 30s),循环结束后在72℃延伸10min,最后4℃保温。
61.②
对pcr产物进行核酸电泳检测,并采用axyprep dna凝胶回收试剂盒将lac1、light和pet22b载体片段进行回收。
62.③
使用2
×
genrec重组试剂盒将回收获得的序列进行重组连接,连接体系20μl(2
×
genrec assembly master mix 10μl,lac1、light和pet22b载体片段各2μl,灭菌水4μl),冰上充分混匀各组分,放入50℃水浴锅反应60min,获得光诱导表达载体pet22b-light-lac1。
63.④
将该光诱导表达载体经过热激转化法转化入bl21(de3)菌株,并涂布于含100μg/ml浓度的氨苄青霉素的lb培养基平板,37℃培养;挑取不同的重组转化子单克隆进行pcr鉴定(引物使用lac1-f和lac1-r),鉴定为阳性的菌株即为目标所需的产细菌漆酶的基因工程菌bl21(de3)-pet22b-light-lac1,将其扩大培养,取菌液保存于15~25%的甘油管中,优选为20%,放置于-80℃温度环境下保菌。
64.实施例3
65.本实施例用以说明利用产细菌漆酶lac1的基因工程菌生产细菌漆酶lac1的具体方法:
66.(1)基因工程菌的光照诱导表达
67.甘油管中保存的目标菌株接种于含有100ml液体lb培养基(含终浓度为100μg/ml的氨苄青霉素)的500ml三角摇瓶中,接种量为1ml,在37℃,100~200rpm条件下避光培养至od
600
值达到0.4~0.6之间时,进行3000-9000lx强度的白光照射,并降温至16℃进行诱导表达;24h后结束发酵并收集发酵液。
68.(2)漆酶lac1的纯化
69.将步骤(1)中收集的发酵液在4℃、4000rpm下离心20min,收集沉淀中的菌体并弃去上清;以ph 7.5的50mm na2hpo
4-kh2po4缓冲液重悬清洗沉淀2次后,再以适量缓冲液重悬细胞并利用超声破碎的方法对菌体进行破壁,将破碎液在4℃、12000rpm下离心40min,弃去沉淀收集上清液获得lac1粗酶液;用2ml柱体积的镍离子亲和层析柱(内装ni-nta 6ff琼脂糖纯化树脂)纯化细菌漆酶lac1,获得漆酶lac1纯酶液。其中,蛋白纯化的具体步骤如下:
70.①
将lac1粗酶液加入镍离子亲和层析柱;
71.②
待lac1粗酶液流过后,加入10ml wash buffer将杂蛋白清洗下来;
72.③
加入6ml elute buffer冲洗并收集目标蛋白lac1;
73.④
将收集获得的6ml的lac1溶液置于10kda孔径透析袋中,将透析袋至于1l体积的dialysis buffer中,在4℃环境透析4次,获得漆酶lac1纯酶液。
74.以15%的sds-聚丙烯酰胺凝胶(sds-page)检测获得的漆酶lac1纯酶液的蛋白纯度,同时将本实施例步骤(2)中含有细菌漆酶lac1基因并进行光照诱导表达之后的工程菌细胞超声破碎液与不含细菌漆酶基因lac1的大肠杆菌破碎液进行对比,结果如图1所示。
75.由图1可知,纯化后的细菌漆酶lac1纯度较高,且分子量大小约为48kda。
76.实施例4
77.本实施例用以说明细菌漆酶lac1酶活的测定。
78.本实验细菌漆酶lac1酶活测定采用比色法。1ml反应液包括:20μl适当稀释的酶液、10μl 10mm cuso4母液、10μl 10mm丁香醛连氮母液、960μl 50mm ph 7.5na2hpo
4-kh2po4缓冲液,50℃反应5min,立即放入冰水冷却30s,在od
525
测定吸光值。
79.丁香醛连氮的摩尔消光系数ε
525
=65000mol-1
·
cm-1
,一个酶活力单位u定义为在50℃条件下催化1μmol/min的底物转化所需的酶量。
80.经测,本发明获得的细菌漆酶lac1的酶活高达367u/l。
81.实施例5
82.本实施例用以说明细菌漆酶lac1在靛蓝类染料靛蓝胭脂红和偶氮类染料刚果红脱色处理的过程中作为催化剂使用的效果。
83.1、配置靛蓝胭脂红的脱色反应体系10ml:10μm靛蓝胭脂红母液100μl、10mm cuso4母液100μl、细菌漆酶lac1酶活至10u/l、ph7.5 50mm na2hpo
4-kh2po4缓冲液定容至10ml。将反应体系置于50℃水浴锅反应1h,从0min开始每隔10min检测od吸光值变化,并计算脱色率。
84.2、配置刚果红的脱色反应体系10ml:10μm刚果红母液100μl、10mm cuso4母液100μl、细菌漆酶lac1酶活至10u/l、ph8.0 50mm na2hpo
4-kh2po4缓冲液定容至10ml。将反应体系置于50℃水浴锅反应24h,从0h开始每隔4h检测od吸光值变化,并计算脱色率。
85.脱色率计算公式如下:
86.脱色率=(a
0-a1)/a0×
100%;
87.式中,a0为反应前体系初始吸光值,a1为反应开始后的不同时间点取样检测的反应体系体系吸光值。
88.最终,细菌漆酶lac1脱色靛蓝胭脂红染料时的脱色率随时间变化情况如图2所示,细菌漆酶lac1脱色刚果红染料时的脱色率随时间变化情况如图3所示。
89.由图2、图3可知,本发明细菌漆酶lac1可在无介体的存在下直接催化染料脱色,对靛蓝胭脂红的脱色率在1h达到99.7%,对刚果红脱色率在24h达到99.5%,据此,本发明产细菌漆酶的基因工程菌及其生产的细菌漆酶具有非常好的工业化应用前景。
90.以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1