鸭α干扰素及其突变体、制备方法和应用
鸭
α
干扰素及其突变体、制备方法和应用
1.本技术是以下案件的分案申请,原申请申请日:2019年6月13日,原申请申请号:201910510526.7,原申请发明名称:鸭α干扰素及其突变体、制备方法和应用。
技术领域
2.本发明涉及一种鸭α干扰素突变体,还涉及一种利用家蚕杆状病毒表达系统制备所述鸭α干扰素突变体的方法;本发明还涉及所述鸭α干扰素突变体在制备预防或治疗鸭病毒性疾病的药物或试剂中的应用,属于鸭α干扰素突变体的制备及应用领域。
背景技术:
3.干扰素是一种具有广谱抗病毒、抗寄生于细胞内细菌、抗肿瘤、调节免疫功能等广泛生物活性的细胞因子。ifn蛋白家族根据其编码基因的序列、染色体定位和受体特异性分为ⅰ型、ⅱ型和ⅲ型干扰素。ⅰ型干扰素包括ifn-α、ifn-β、ifn-ω、ifn-δ、ifn-ε、ifn-ζ、ifn-τ等,哺乳动物中主要是ifn-α和ifn-β。ⅰ型干扰素具有较强的抗病毒活性,主要通过干扰病毒的复制抑制其增殖,还具有抗肿瘤和免疫调节的功能。ⅱ型干扰素只有ifn-γ一个成员,又称为免疫干扰素,主要作用是激活巨噬细胞杀灭微生物。ⅲ型干扰素是新发现的细胞因子,包括λ1(il-29)、λ2(il-28a)和λ3(il-28b)。ⅲ型干扰素与ⅰ型干扰素关系密切,但有特殊的生理学功能,如刺激主要组织相容性复合体(major histocompatibility complex,mhc)分子的活化和表达,调节先天免疫和获得性免疫等。由于干扰素具有广谱抗病毒、抗肿瘤的活性以及强大的免疫调节作用,现已成为病毒学、细胞学、分子生物学、临床医学、免疫学、肿瘤学等相关领域的研究热点之一。
4.干扰素首先在禽类中发现,但与人及其他哺乳动物相比,鸭干扰素分子水平的研究起步较晚,与鸡相比,鸭干扰素方面的研究也相对较少。近年来,家禽病毒感染引起的流感、新城疫、传染性支气管炎、传染性喉气管炎、传染性法氏囊病、鸭瘟、鸭肝炎和马立克等传染性疾病愈演愈烈,每年都会给养禽业带来巨大的经济损失,严重制约了养禽业的健康发展,而如何有效的预防和治疗家禽的病毒性传染病一直是禽病防治和治疗研究中的重点。
5.鸭的α干扰素基因最早是由德国研究人员schultz等于1995年利用已报道的chifn-α基因作为探针经过克隆筛选得到。国内研究人员夏春2000年报道了北京鸭的α干扰素基因,其他研究人员后续报道了番鸭、绍兴鸭、麻鸭等各品种鸭的α干扰素基因,此外研究人员相继报道了重组鸭α干扰素对各种病毒的抵抗作用,schultz等证实了重组干扰素有抵抗水泡型口炎病毒、a型流感病毒、鸭肝炎病毒和新城疫病毒的作用;周雪等2007年采用带有鸭α干扰素基因的质粒注射樱桃谷鸭后表现出一定的抗鸭瘟强毒感染的能力;pei gao等2018年用重组鸭α干扰素治疗2日龄鸭来研究其对高致病性禽流感病毒h5n1的抵抗作用,结果显示与病毒对照组相比试验组的鸭死亡率从60%下降到10%,说明重组鸭α干扰素对2日龄鸭感染禽流感病毒h5n1具有抵抗作用。陈斌从四川麻鸭中克隆ifn-α基因,原核表达后检测其抗vsv活性为150u/ml,比活力为440u/mg,高佩在原核表达系统上分别表达rduifn-α、
rduifn-γ及rduifnα-duifnγ,抗vsv活性分别为2.1
×
105u/mg、3.6
×
104u/mg、1.6
×
107u/mg。由于原核表达系统不能对表达的重组蛋白进行复杂的翻译后加工修饰,所表达的鸭α干扰素效价偏低,所以本方法采用家蚕杆状病毒表达系统在家蚕虫(蛹)体内对鸭α干扰素进行表达,以获得大量优质廉价的重组鸭α干扰素蛋白。
技术实现要素:
6.本发明所要解决的第一个技术问题是提供一种鸭α干扰素及鸭α干扰素突变体,所述鸭α干扰素突变体具有高抗病毒活性;
7.本发明所要解决的第二个技术问题是提供一种利用家蚕杆状病毒表达系统制备所述鸭α干扰素或鸭α干扰素突变体的方法;
8.本发明所要解决的第三个技术问题是提供所述鸭α干扰素或鸭α干扰素突变体在制备预防或治疗鸭病毒性疾病的药物或试剂中的用途。
9.为解决上述技术问题,本发明所采取的技术方案是:
10.本发明首先公开了一种鸭α干扰素,其氨基酸序列为seq id no.1所示,其编码基因的多核苷酸序列为(a)或(b)或(c)所示:
11.(a)seq id no.2所示的多核苷酸序列;或
12.(b)与seq id no.2的互补序列在严谨杂交条件能够进行杂交的多核苷酸序列,该多核苷酸编码的蛋白仍具有干扰素的功能或活性;或
13.(c)与seq id no.2的多核苷酸序列至少有80%以上同源性的多核苷酸序列,且该多核苷酸编码的蛋白仍具有干扰素的功能或活性;优选的,与seq id no.2的多核苷酸序列至少有85%以上同源性的多核苷酸序列,且该多核苷酸编码的蛋白仍具有干扰素的功能或活性;更优选的,与seq id no.2的多核苷酸序列至少有90%以上同源性的多核苷酸序列,且该多核苷酸编码的蛋白仍具有干扰素的功能或活性。
14.根据家蚕密码子偏好性对鸭α干扰素基因序列进行密码子优化,对影响基因转录效率、翻译效率和蛋白折叠的gc含量、cpg二核苷酸含量、密码子偏好性、mrna的二级结构、mrna自由能稳定性、rna不稳定性基序、重复序列等多种相关参数进行优化设计,有利于提高所优化基因在家蚕中的转录效率与翻译效率,并保持最终翻译成的蛋白序列不变;为了提高在家蚕杆状病毒真核表达体系中的翻译起始效率,在基因前面加了kozak序列gccaac。此外,还去除了基因序列内部的bamhi、ecori、smai等限制性酶切位点,在基因上游加上了bamhi,在基因下游加上了ecori限制性酶切位点;得到新的鸭α干扰素优化序列duifn-α-o,其氨基酸序列为seq id no.3所示,优化后的基因核苷酸序列为seq id no.4所示。
15.本发明进一步公开了一种鸭α干扰素突变体,是将氨基酸序列为seq id no.3所示的鸭α干扰素突变体进行p2a、l19t、p25l、r35p、d38n、n51d、h64n、l73i、q80r、d95k、h108d、q117r、h123y、r127q、l136s、r142c、i148t、l159f、d170e或r182c任何一种氨基酸单位点突变获得的突变体;优选为,将氨基酸序列为seq id no.3所示的鸭α干扰素突变体进行p25l、n51d、q80r、h108d、l136s和d170e任何一种氨基酸单位点突变获得的突变体。其中,将氨基酸序列为seq id no.3所示的鸭α干扰素突变体进行n51d氨基酸单位点突变获得的突变体的氨基酸序列为seq id no.5所示,其编码基因的核苷酸序列为seq id no.6所示。
16.其中,本发明所述氨基酸单位点突变p2a,表示将氨基酸序列为seq id no.3所示
id no.3所示,优化后的基因核苷酸序列为seq id no.4所示。抗病毒活性结果显示,在家蚕幼虫体内表达的duifn-α效价为1.14
×
106u/ml。
23.本发明以duifn-α的优化基因序列为模板设计多对引物,利用融合pcr法进行氨基酸单位点突变、氨基酸双位点突变、氨基酸多位点突变,获得了多个鸭α干扰素突变体。其中,在duifn-α-o的基础上,分别进行p25l、n51d、q80r、h108d、l136s和d170e这6个位点单位点突变后,表达的鸭α干扰素效价高于duifn-α-o表达测得的效价,抗病毒效价达到7.80
×
104u/ml~3.16
×
106u/ml;而其余位点突变后效价不变甚至降低,说明这6个位点的突变是有效突变,可以达到提高抗病毒活性的目的。其中,进行n51d单位点突变获得的duifn-α-o-n51d突变体具有最强抗病毒作用。
24.本发明进一步将抗病毒活性提高的单突变位点p25l、n51d、q80r、h108d、l136s和d170e两两组合,将duifn-α-o进行双位点突变。抗病毒活性的检测结果表明,p25l-q80r、n51d-h108d、n51d-d170e三组双突变后,表达的鸭α干扰素效价高于保守序列、单突变序列表达测得的效价,抗病毒效价达到8.01
×
104u/ml~4.50
×
106u/ml,而其余几组位点突变后效价不变甚至降低,说明这3个组合位点的突变是有效突变,可以达到提高抗病毒活性的目的。其中,进行n51d-h108d双位点突变获得的duifn-α-o-n51d-h108d突变体具有最强抗病毒作用。
25.本发明进一步将获得的具有高效价的双突变位点组合,将duifn-α-o突变体进行氨基酸多位点突变。突变体抗病毒活性的检测结果表明,p25l-n51d-q80r-h108d-d170e多位点突变后,表达的鸭α干扰素效价远高于保守序列、单突变序列、双突变序列表达测得的效价,为5.78
×
106u/ml;而其余几组位点突变后效价不变甚至降低。说明此组合位点的突变是有效突变,可以达到提高抗病毒活性的目的。
26.本发明还公开了含有所述鸭α干扰素或者鸭α干扰素突变体的编码基因的重组载体或重组宿主细胞。其中,所述重组载体为重组表达载体或重组克隆载体。
27.本发明所构建的转移载体包括:
28.(1)含有duifn-α-o进行氨基酸单位点突变后的突变体(duifn-α-o-m1突变体)基因序列的载体pvl-duifn-α-o-m1;
29.(2)含有duifn-α-o进行氨基酸双位点突变后的突变体(duifn-α-o-m1-m2突变体)基因序列的载体pvl-duifn-α-o-m1-m2;
30.(3)含有duifn-α-o进行氨基酸多位点突变后的突变体(duifn-α-o-m1-m2-m3、duifn-α-o-m1-m2-m3-m4、duifn-α-o-m1-m2-m3-m4-m5突变体)基因序列的载体pvl-duifn-α-o-m1-m2-m3、pvl-duifn-α-o-m1-m2-m3-m4、pvl-duifn-α-o-m1-m2-m3-m4-m5。
31.本发明所获得的重组杆状病毒包括:重组家蚕核型多角体病毒rbmbacmid(duifn-α)、rbmbacmid(duifn-α-o、duifn-α-o-m1、duifn-α-o-m1-m2、duifn-α-o-m1-m2-m3、duifn-α-o-m1-m2-m3-m4、duifn-α-o-m1-m2-m3-m4-m5)。
32.本发明还公开了所述的鸭α干扰素或者鸭α干扰素突变体在制备预防或治疗鸭病毒性疾病的药物或试剂中的用途。
33.其中,所述鸭病毒性疾病包括:雏鸭病毒性肝炎、鸭瘟(鸭病毒性肠炎)、小鹅瘟、番鸭细小病毒病、雏番鸭小鹅瘟、鸭流行性出血症(黑羽病)、鸭花肝病、鸭病毒性脑炎、鸭呼肠孤病毒感染、鸭腺病毒感染、鸭的传染性囊病、鸭副黏病毒病(鸭新城疫)、鸭冠状病毒感染、
鸭流感中的至少一种。
34.本发明还公开了一种制备所述鸭α干扰素或者鸭α干扰素突变体的方法,包括以下步骤:(1)分别将所述鸭α干扰素或者所述鸭α干扰素突变体的编码基因克隆到杆状病毒转移载体中,构建得到重组转移载体;(2)将重组转移载体与杆状病毒dna共转染昆虫细胞,获得重组杆状病毒;(3)将重组杆状病毒感染昆虫细胞或昆虫宿主,培养被感染的昆虫细胞或昆虫宿主表达相应的蛋白,纯化,即得。
35.其中,所述杆状病毒转移载体选自acrp23-lacz、acrp6-sc、acuwl-lacz、bacpak6、bac to pac、bacmid、blucbacii(petl)、p2bac、p2blue、p89b310、pac360、pac373、pacab3、pacab 4、pacas3、pacc129、pacc4、dzi、pacgp67、paciel、pacjpl、pacmlf2、pacmlf7、pacmlf 8、pacmpl、pacmp2、pacrp23、pacrp 25、pacrw4、pacsmag、pacuwl、pacuw21、pacuw2a、pacuw2b、pacuw3、pacuw31、pacuw41、pacuw42、pacuw43、pacuw51、pacvc2、pacvc 3、pacyml、pacjcc5、pbacl、pbac2、pbluebaciii、pbluebaswis、pev55、mxiv、pieineo、pjvetl、pjvnhel、pjvp10、pjvrsmag、pmbac、pp10、ppakl、ppbac、pshonex 1.1、psyn xiv vi+、psynvi+wp、psynxiv vi-、pvl1391、pvl 1392、pvl 1393、pvl941、pvl 945、pvl 985、pvtbac、pbm030或puac-5;
36.所述杆状病毒选自家蚕杆状病毒亲本株bmbacmid、bmnpv、acmnpv、apnpv、hanpv、hznpv、ldmnpv、mbmnpv、opmnpv、slmnpv、semnpv或spltnpv;
37.所述昆虫宿主选自家蚕(bombyx mori)、野蚕(bombyx mandarina)、蓖麻蚕(philosamia cynthia ricim)、樟蚕(dictyoploca japanica)、樗蚕(philosamia cynthia pryeri)、柞蚕(antheraea pernyi)、日本柞蚕(antheraea yamamai)、野天蚕(antheraea polyphymus)、苜蓿尺蠖(atographa califorica)、茶尺蠖(ectropis obliqua)、甘兰夜蛾(mamestra brassicae)、斜纹夜蛾(spodoptera littoralis)、秋粘虫(spodoptera frugiperda)、粉纹夜蛾(triswoplusia ni)、行军虫(thaumetopoea wilkinsoni)、棉铃虫(heliothis armigera)、美国棉铃虫(heliothis zea)、烟青虫(heliothis assulta)、烟草夜蛾(heliothis virescens)、东方粘虫(pseudaletia separata)或舞毒蛾(lymantria dispar);
38.优选的,所述杆状病毒转移载体为pvl1393;所述杆状病毒为家蚕杆状病毒亲本株bmbacmid;所述昆虫宿主为家蚕(bombyx mori)。
39.所述感染是指重组杆状病毒通过吞食或透过表皮来感染1-5龄的昆虫幼虫或蛹体;优选为,将重组家蚕杆状病毒感染家蚕细胞或穿刺接种1-5龄的家蚕幼虫或蛹,在感染3-6天后收集含各种鸭α干扰素基因的家蚕幼虫或蛹的体液或组织匀浆;其中,所述的蛹最优为1-2天的早期嫩蛹。
40.其中,seq id no.1:鸭α干扰素原始氨基酸序列;
41.mpgpsappppaiysalallllltppanafscsplrlhdsafawdslqllrnmapsptqpcpqqhapcsfpdtlldtndtqqaahtalhllqhlfdtlsspstpahwlhtarhdllnqlqhhihhlercfpadaarlhrrgprnlhlsinkyfgciqhflqnhtyspcawdhvrleahacfqrihrltrtmr*
42.seq id no.2:鸭α干扰素原始核苷酸序列;
43.atgcctgggccatcagccccaccaccaccagccatctacagcgccctggccctcctgctcctcctcacgcctcccgccaacgccttctcctgcagccccctgcgcctccacgacagcgccttcgcctgggacagcctccagctcct
ccgcaacatggctcccagccccacacagccctgcccgcagcaacacgcgccttgctccttcccggacaccctcctggacaccaacgacacgcagcaagccgcacacaccgccctccacctcctccaacacctcttcgacaccctcagcagccccagcacccccgcgcactggctccacaccgcacgccacgacctcctcaaccagcttcagcaccacatccaccacctcgagcgctgcttcccagccgacgccgcgcgcctccacaggcgagggccccgcaaccttcacctcagcatcaacaagtacttcggctgcatccaacacttcctccagaaccacacctacagcccctgcgcatgggaccacgtccgcctcgaggctcacgcctgcttccagcgcatccaccgcctcacccgcaccatgcgctaa
44.seq id no.3:duifn-α-o氨基酸序列;
45.mpgpsappppaiysalallllltppanafscsplrlhdsafawdslqllrnmapsptqpcpqqhapcsfpdtlldtndtqqaahtalhllqhlfdtlsspstpahwlhtarhdllnqlqhhihhlercfpadaarlhrrgprnlhlsinkyfgciqhflqnhtyspcawdhvrleahacfqrihrltrtmr*
46.seq id no.4:duifn-α-o核苷酸序列;
47.atgcctggaccatcagctcctccaccgcccgccatctactctgctttggccctgttgctcctgttgacccctccagctaacgccttcagctgctccccgttgagactccacgactcggctttcgcctgggatagtctgcaactcctgagaaatatggctcctagcccaactcaaccttgcccacaacagcatgctccgtgttccttccccgacacattgctcgacaccaacgatacacaacaggctgcccacactgctctccacctgttgcaacacctcttcgacactctgtcatctccttcaaccccagctcactggctgcacactgccagacacgatctcctgaatcaattgcagcaccacatacaccacctcgaaagatgcttccctgctgacgctgccagattgcacagaagaggtccaagaaacctgcacttgtcaatcaacaaatacttcggatgtattcaacacttcctccagaaccacacctactctccatgcgcctgggatcacgtgagactggaagctcacgcctgtttccagagaatccacagattgacaagaactatgagataa
48.seq id no.5:duifn-α-o-n51d突变体氨基酸序列;
49.mpgpsappppaiysalallllltppanafscsplrlhdsafawdslqllrdmapsptqpcpqqhapcsfpdtlldtndtqqaahtalhllqhlfdtlsspstpahwlhtarhdllnqlqhhihhlercfpadaarlhrrgprnlhlsinkyfgciqhflqnhtyspcawdhvrleahacfqrihrltrtmr*
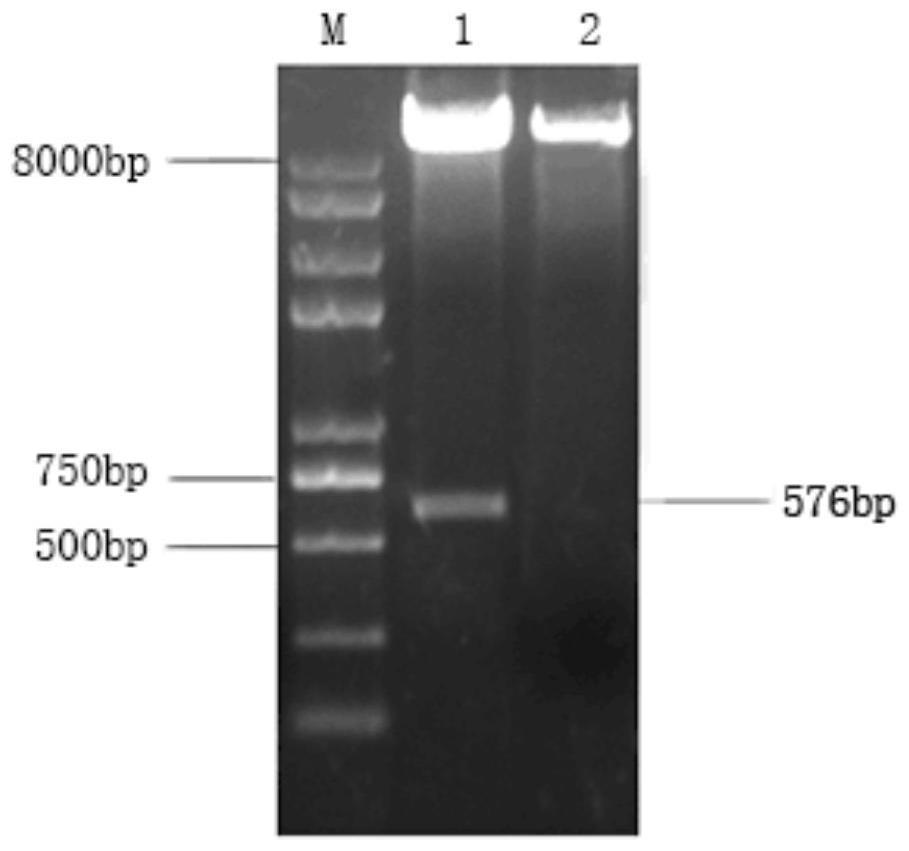
50.seq id no.6:duifn-α-o-n51d突变体核苷酸序列;
51.atgcctggaccatcagctcctccaccgcccgccatctactctgctttggccctgttgctcctgttgacccctccagctaacgccttcagctgctccccgttgagactccacgactcggctttcgcctgggatagtctgcaactcctgagagatatggctcctagcccaactcaaccttgcccacaacagcatgctccgtgttccttccccgacacattgctcgacaccaacgatacacaacaggctgcccacactgctctccacctgttgcaacacctcttcgacactctgtcatctccttcaaccccagctcactggctgcacactgccagacacgatctcctgaatcaattgcagcaccacatacaccacctcgaaagatgcttccctgctgacgctgccagattgcacagaagaggtccaagaaacctgcacttgtcaatcaacaaatacttcggatgtattcaacacttcctccagaaccacacctactctccatgcgcctgggatcacgtgagactggaagctcacgcctgtttccagagaatccacagattgacaagaactatgagataa
52.seq id no.7:duifn-α-o-n51d-h108d突变体氨基酸序列;
53.mpgpsappppaiysalallllltppanafscsplrlhdsafawdslqllrdmapsptqpcpqqhapcsfpdtlldtndtqqaahtalhllqhlfdtlsspstpahwldtarhdllnqlqhhihhlercfpadaarlhrrgprnlhlsinkyfgciqhflqnhtyspcawdhvrleahacfqrihrltrtmr*
54.seq id no.8:duifn-α-o-n51d-h108d突变体核苷酸序列;
55.atgcctggaccatcagctcctccaccgcccgccatctactctgctttggccctgttgctcctgttgacccctccagctaacgccttcagctgctccccgttgagactccacgactcggctttcgcctgggatagtctgcaactcct
gagagatatggctcctagcccaactcaaccttgcccacaacagcatgctccgtgttccttccccgacacattgctcgacaccaacgatacacaacaggctgcccacactgctctccacctgttgcaacacctcttcgacactctgtcatctccttcaaccccagctcactggctggacactgccagacacgatctcctgaatcaattgcagcaccacatacaccacctcgaaagatgcttccctgctgacgctgccagattgcacagaagaggtccaagaaacctgcacttgtcaatcaacaaatacttcggatgtattcaacacttcctccagaaccacacctactctccatgcgcctgggatcacgtgagactggaagctcacgcctgtttccagagaatccacagattgacaagaactatgagataa
56.seq id no.9:duifn-α-o-p25l-n51d-q80r-h108d-d170e突变体氨基酸序列;
57.mpgpsappppaiysalallllltplanafscsplrlhdsafawdslqllrdmapsptqpcpqqhapcsfpdtlldtndtrqaahtalhllqhlfdtlsspstpahwldtarhdllnqlqhhihhlercfpadaarlhrrgprnlhlsinkyfgciqhflqnhtyspcawehvrleahacfqrihrltrtmr*
58.seq id no.10:duifn-α-o-p25l-n51d-q80r-h108d-d170e突变体核苷酸序列:
59.atgcctggaccatcagctcctccaccgcccgccatctactctgctttggccctgttgctcctgttgacccctctagctaacgccttcagctgctccccgttgagactccacgactcggctttcgcctgggatagtctgcaactcctgagagatatggctcctagcccaactcaaccttgcccacaacagcatgctccgtgttccttccccgacacattgctcgacaccaacgatacacgacaggctgcccacactgctctccacctgttgcaacacctcttcgacactctgtcatctccttcaaccccagctcactggctggacactgccagacacgatctcctgaatcaattgcagcaccacatacaccacctcgaaagatgcttccctgctgacgctgccagattgcacagaagaggtccaagaaacctgcacttgtcaatcaacaaatacttcggatgtattcaacacttcctccagaaccacacctactctccatgcgcctgggaacacgtgagactggaagctcacgcctgtttccagagaatccacagattgacaagaactatgagataa
60.本发明技术方案与现有技术相比,具有以下有益效果:
61.本发明通过分析ncbi上所有鸭α干扰素氨基酸序列,进行序列比对及信号肽分析,生成共有序列作为原始序列,并对原始序列进行密码子优化,以密码子优化后的序列为模板设计多对引物用融合pcr法进行氨基酸单位点突变、氨基酸双位点突变、氨基酸多位点突变,获得了多个鸭α干扰素突变体。本发明利用家蚕杆状病毒表达系统在家蚕生物反应器中表达所述鸭α干扰素突变体,所表达的鸭α干扰素突变体的抗病毒活性大幅度提高,具有较为明显的抗病毒活性。本发明方法工艺简单,可快速获得大量安全可靠的鸭α干扰素。本发明所述的鸭α干扰素突变体能够用于制备预防或治疗鸭病毒性疾病的药物或试剂,对鸭养殖业的发展具有重大意义。
62.本发明所涉及到的术语定义:
63.除非另外定义,否则本文所用的所有技术及科学术语都具有与本发明所属领域的普通技术人员通常所了解相同的含义。
64.术语“多核苷酸”或“核苷酸”意指单股或双股形式的脱氧核糖核苷酸、脱氧核糖核苷、核糖核苷或核糖核苷酸及其聚合物。除非特定限制,否则所述术语涵盖含有天然核苷酸的已知类似物的核酸,所述类似物具有类似于参考核酸的结合特性并以类似于天然产生的核苷酸的方式进行代谢。除非另外特定限制,否则所述术语也意指寡核苷酸类似物,其包括pna(肽核酸)、在反义技术中所用的dna类似物(硫代磷酸酯、磷酰胺酸酯等等)。除非另外指定,否则特定核酸序列也隐含地涵盖其保守修饰的变异体(包括(但不限于)简并密码子取代)和互补序列以及明确指定的序列。特定而言,可通过产生其中一个或一个以上所选(或所有)密码子的第3位经混合碱基和/或脱氧肌苷残基取代的序列来实现简并密码子取代
(batzer等人,nucleic acid res.19:5081(1991);ohtsuka等人,j.biol.chem.260:2605-2608(1985);和cassol等人,(1992);rossolini等人,molcell.probes8:91-98(1994))。
65.术语“同源性”,指与天然核酸序列的序列相似性。“同源性”包括与本发明的调控片段的核苷酸序列具有优选地85%或更高,更优选地90%或更高,以及最优选地95%或更高同一性的核苷酸序列。同源性可以用肉眼或计算机软件进行评价。使用计算机软件,两个或多个序列之间的同源性可以用百分比(%)表示,其可以用来评价相关序列之间的同源性。
66.术语“互补的”在此指的是两种包括反向平行核苷酸序列的核苷酸序列,反向平行核苷酸序列能在反向平行核苷酸序列的互补碱基残基之间形成氢键后彼此相互配对。本领域已知的是,当都从5’到3’的方向看序列时,两种互补链的核苷酸序列是彼此反向互补的。本领域也已知的是,两种在给定的条件组下能彼此杂交的序列不必必须是100%完全互补的。
67.术语“严谨杂交条件”意指在所属领域中已知的低离子强度和高温的条件。通常,在严谨条件下,探针与其靶序列杂交的可检测程度比与其它序列杂交的可检测程度更高(例如超过本底至少2倍)。严谨杂交条件是序列依赖性的,在不同的环境条件下将会不同,较长的序列在较高温度下特异性杂交。通过控制杂交的严谨性或洗涤条件可鉴定与探针100%互补的靶序列。对于核酸杂交的详尽指导可参考有关文献(tijssen,techniques in biochemistry and molecular biology-hybridization with nucleic probes,"overview of principles of hybridization and the strategy of nucleic acid assays.1993)。更具体的,所述严谨条件通常被选择为低于特异序列在规定离子强度ph下的热熔点(tm)约5-10℃。tm为在平衡状态下50%与目标互补的探针杂交到目标序列时所处的温度(在指定离子强度、ph和核酸浓度下)(因为目标序列过量存在,所以在tm下在平衡状态下50%的探针被占据)。严谨条件可为以下条件:其中在ph 7.0到8.3下盐浓度低于约1.0m钠离子浓度,通常为约0.01到1.0m钠离子浓度(或其它盐),并且温度对于短探针(包括(但不限于)10到50个核苷酸)而言为至少约30℃,而对于长探针(包括(但不限于)大于50个核苷酸)而言为至少约60℃。严谨条件也可通过加入诸如甲酰胺的去稳定剂来实现。对于选择性或特异性杂交而言,正信号可为至少两倍的背景杂交,视情况为10倍背景杂交。例示性严谨杂交条件可如下:50%甲酰胺,5
×
ssc和1%sds,在42℃下培养;或5
×
ssc,1%sds,在65℃下培养,在0.2
×
ssc中洗涤和在65℃下于0.1%sds中洗涤。所述洗涤可进行5、15、30、60、120分钟或更长时间。
68.术语“突变”和“突变体”在此具有它们的常用含义,指的是在核酸或多肽序列中的遗传的、天然存在的或引入的变化,它们的意义与本领域人员通常所知的意义相同。
69.术语“宿主细胞”或“重组宿主细胞”意指包含本发明多核苷酸的细胞,而不管使用何种方法进行插入以产生重组宿主细胞,例如直接摄取、转导、f配对或所属领域中已知的其它方法。外源性多核苷酸可保持为例如质粒的非整合载体或者可整合入宿主基因组中。
70.术语“转染”指真核细胞由于外源dna掺入而获得新的遗传标志的过程。
附图说明
71.图1为细胞病变比例对应的荧光图;其中,a,
“‑”
:无细胞病变;b,
“±”
:几个细胞病
变;c,“+”:20%~30%细胞病变;d,“++”:50%~60%细胞病变;
72.图2为重组质粒pvl-duifn-α的双酶切鉴定;其中,m:dna分子质量标准;1:重组质粒pvl-duifn-α双酶切产物;2:阴性对照;
73.图3为细胞出现荧光的各种比例的情况;其中,a:高浓度干扰素完全抑制vsv病毒后细胞不显示荧光;b:细胞对照组中大量细胞在vsv病毒感染时显示荧光;c:低浓度浓度干扰素不能完全抑制vsv病毒时部分细胞感染vsv病毒所显示的荧光。
具体实施方式
74.下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但是应理解所述实施例仅是范例性的,不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改或替换均落入本发明的保护范围。
75.1、试验材料与试剂
76.转移载体pvl1393,e.coli菌株top10,bmn细胞,vsv-gfp病毒,均由中国农业科学院生物技术研究所保存和提供;试验家蚕品种秋丰
×
白玉为江苏科技大学蚕业研究所提供,亲本病毒bmbacmid dna按照文献(专利号:zl 201110142492.4,授权日期:2013.01.23)中所公开的方法构建。spf鸭胚购自北京梅里亚维通实验动物技术有限公司,限制性内切酶、t
4 dna连接酶购自promega公司,pcr反应所用的la taq dna聚合酶及其它相关试剂均购自takara公司,脂质体购自invitrogen公司,dmem细胞培养基、胎牛血清为gibco公司产品。有关溶液和培养基的配置方法参照相关工具书(joseph et al.,分子克隆实验指南第三版,2002;奥斯伯,等人,精编分子生物学指南,1998;david l.spector,细胞实验指南,2001);除非另外说明,否则百分比和份数按重量计算。
77.2、实验方法
78.实验方法中鸭外周血单核细胞的pha诱导,参照黄爱龙等人(鸭子α—干扰素基因表达及多样性分析[j].中国免疫学杂志,2000,16(12):644-647)所描述的方法进行。
[0079]
实验方法中用于定点突变的融合pcr方法,参照邝翡婷等人(一种载体构建的新方法:重组融合pcr法,基因组学与应用生物学,2012年,第31卷,第6期,第634-639页)所描述的方法进行。
[0080]
实验方法中计算干扰素的效价,利用def/vsv*gfp系统,使用reed-muench方法,具体操作参照刘兴健,等(猫ω-like干扰素在家蚕中的表达和生物活性检测,生物技术进展,2015,5(6):441-445)以及summers md等(a manual of methods for baculovirus vectors and insect cell culture procedures[r].texas agricultural experiment station,1987)所描述的方法进行,其中判断细胞病变的标准参照图1。
[0081]
每一个实施案例中的最佳改良方案均作为下一实施案例改良方案的比较标准。
[0082]
实施例1duifn-α原始序列在家蚕生物反应器中的表达与检测
[0083]
1、实验方法
[0084]
1.1鸭α干扰素原始序列的获得
[0085]
1.1.1鸭外周血单核细胞(pbmc)的体外刺激
[0086]
无菌采鸭外周抗凝血,采用淋巴细胞分离液分离外周血单核细胞和红细胞。利用
fbs。27℃恒温培养4~5天,至细胞脱落浮起,收集细胞培养液,获得含有目的基因的重组病毒rbmbacmid(duifn-α)。
[0101]
重组家蚕杆状病毒的纯化和扩增方法如下:接种适量细胞(约70~80%)于35mm小平皿中,细胞贴壁后,吸去培养基,将收集的细胞培养液进行不同浓度稀释,取1ml加到贴壁细胞中,分布均匀。27℃感染1h后,吸去感染液,将2%低融点琼脂糖凝胶于60℃水浴中融化,冷至40℃与40℃预热的2
×
tc-100培养基(含20%fbs)混合均匀,每个平皿加4ml胶,待凝固后用parafilm封口,27℃倒置培养3~5d,显微镜观察。把不含有多角体的空斑挑选出来,重复以上步骤,经过2~3轮的纯化获得纯的重组家蚕杆状病毒rbmbacmid(duifn-α)。
[0102]
将重组家蚕杆状病毒rbmbacmid(duifn-α)感染正常生长的bmn细胞,培养3天后收集上清液,上清中即含有大量的重组病毒rbmbacmid(duifn-α)。
[0103]
1.4鸭α干扰素在家蚕体内表达
[0104]
将重组病毒培养液按105pfu/头的剂量注射5龄起蚕,在27℃、70%~80%湿度的条件下培养,家蚕幼虫生长晚期,duifn-α在多角体基因启动子的作用下得到高效表达。接种感染3.5d~4d左右,可以观察到家蚕幼虫体节肿胀、行为异常、食欲下降等症状,当观察到幼虫体积明显缩小,停止进食时,收集血淋巴,-20℃保存备用。
[0105]
1.5鸭胚成纤维细胞(def)的制备及鸭α干扰素抗病毒活性检测
[0106]
取10~12日龄鸭胚,超净台中消毒蛋壳以后,从气室敲碎蛋壳,取出胚体,剪去头和四肢,hbss冲洗3次,将胚体放入灭菌三角瓶中并剪成的小块儿,再用hbss冲洗3次,加胰酶在37℃消化40min,弃去胰酶并用hbss冲洗3次,以除去残留胰酶,加入30ml完全培养基,吹打并晃动三角瓶使细胞分散,用8层灭菌纱布过滤,得到细胞悬液,进行细胞计数并将细胞稀释至106个/ml。
[0107]
采用微量细胞病变抑制法在def/vsv*gfp系统上检测蚕血淋巴中表达的鸭α干扰素的抗病毒活性。将制备好的def细胞以3.0
×
105个/ml的密度接种于96孔培养板中。将已超声破碎并过滤除菌的蚕血淋巴用含50ml/l胎牛血清的m199培养液配制成不同稀释度的溶液,将稀释好的样品按100μl/孔接种于已经铺满def细胞的培养孔内,每个稀释度和对照蚕血至少设12个复孔,同时设不加蚕血淋巴及vsv*gfp的细胞对照组和添加vsv*gfp的病毒对照组,于37℃、5%co2条件下培养18~24h。将稀释至100tcid
50
的vsv*gfp病毒,按100μl/孔加入已经吸弃上清液的培养孔内,置于37℃、5%co2条件下培养。在倒置荧光显微镜下观察,当病毒对照组各孔中大量细胞出现荧光,而细胞对照组中的细胞仍完全生长良好,无荧光出现时,则表明对照系统完全合格,即可作全面观察。
[0108]
2、实验结果
[0109]
2.1重组转移载体的鉴定
[0110]
重组转移载体pvl-duifn-α经bamhi和ecori双酶切,在1%琼脂糖凝胶电泳分离出2个片段,小片段位于500-750bp之间,与目的基因片段576bp大小相符,大片段位于8000bp上方,与pvl1393片段9607bp大小相符。将酶切鉴定正确的质粒送北京擎科新业生物技术有限公司进行核苷酸测序,用megaalign比对结果表明序列与原先设计的序列一致,表明鸭α干扰素基因已成功插入到pvl1393转移载体中bamhi和ecori之间。
[0111]
2.2鸭α干扰素重组病毒的获得及重组产物的检测
[0112]
应用微量细胞病变抑制法在def/vsv*gfp系统上检测家蚕幼虫表达的鸭α干扰素
抗病毒活性。在倒置荧光显微镜下观察到,细胞对照组中的细胞生长状态良好,无荧光出现;感染病毒对照组中的细胞发生病变,大多数细胞出现荧光,添加重组鸭α干扰素蛋白的细胞具有抵抗病毒感染的能力。根据鸭α干扰素对def细胞的保护作用,观察细胞的病变程度,待有绿色荧光细胞出现,这一孔细胞就记为“+”,按照reed-muench方法计算干扰素的效价。检测结果显示其效价达8.70
×
105u/ml。
[0113]
实施例2 duifn-α进行优化后的序列在家蚕生物反应器中的表达与检测
[0114]
1.1鸭α干扰素密码子优化突变体基因的构建
[0115]
通过对ncbi上所有的鸭α干扰素氨基酸序列进行分析,得到其共有序列,经过与实施例1中克隆得到的鸭α干扰素原始氨基酸序列对比,共有序列氨基酸序列与原始氨基酸序列一致,其氨基酸序列为seq id no.1所示,其编码基因的核苷酸序列为seq id no.2所示。
[0116]
本发明利用optimumgene
tm
技术对上述鸭α干扰素共有序列基因进行优化,根据生物反应器家蚕的密码子偏好性对基因序列进行改造,对影响基因转录效率、翻译效率和蛋白折叠的gc含量、cpg二核苷酸含量、密码子偏好性、mrna的二级结构、mrna自由能稳定性、rna不稳定性基序、重复序列等多种相关参数进行优化设计,有利于提高所优化基因在家蚕中的转录效率与翻译效率,并保持最终翻译成的蛋白序列不变。
[0117]
为了提高在家蚕杆状病毒真核表达体系中的翻译起始效率,在基因atg前面加了kozak序列gccaac。此外,还去除了基因序列内部的bamhi、ecori、smai等限制性酶切位点,在基因上游加上了bamhi,在基因下游加上了ecori限制性酶切位点,以便后续克隆到真核转移载体pvl1393中。
[0118]
所设计的鸭α干扰素基因进行优化后的序列由生物科技公司人工合成,命名为duifn-α-o,其核苷酸序列如seq id no.4所示,合成的基因片段插入puc57载体,形成质粒puc57-duifn,命名为puc57-duifn-α-o。
[0119]
1.2构建重组杆状病毒转移载体
[0120]
具体操作参照实施例1,将测序正确的质粒命名为pvl-duifn-α-o。
[0121]
1.3重组家蚕杆状病毒的获得、纯化与扩增
[0122]
bmn细胞的复苏、传代参照实施例1,通过共转染获得含有目的基因的重组病毒rbmbacmid(duifn-α-o)。
[0123]
重组家蚕杆状病毒的纯化和扩增方法参照实施例1,通过纯化获得纯的重组家蚕杆状病毒rbmbacmid(duifn-α-o)。
[0124]
将重组家蚕杆状病毒rbmbacmid(duifn-α-o)感染正常生长的bmn细胞,培养3天后收集上清液,上清中即含有大量的重组病毒rbmbacmid(duifn-α-o)。
[0125]
1.4鸭α干扰素突变体在家蚕体内表达
[0126]
同实施例1。
[0127]
1.5鸭胚成纤维细胞(def)的制备及鸭α干扰素抗病毒活性检测
[0128]
同实施例1。
[0129]
2、实验结果
[0130]
2.1重组转移载体的鉴定
[0131]
重组转移载体pvl-duifn-α-o经bamhi和ecori双酶切,在1%琼脂糖凝胶电泳分离出2个片段,小片段位于500-750bp之间,与目的基因片段576bp大小相符,大片段位于
8000bp上方,与pvl1393片段9607bp大小相符。将酶切鉴定正确的质粒送北京擎科新业生物技术有限公司进行核苷酸测序,用megaalign比对结果表明序列与原先设计的序列一致,表明鸭α干扰素突变体基因已成功插入到pvl1393转移载体中bamhi和ecori之间。
[0132]
2.2鸭α干扰素重组病毒的获得及重组产物的检测
[0133]
应用微量细胞病变抑制法在def/vsv*gfp系统上检测家蚕幼虫表达的鸭α干扰素抗病毒活性。在倒置荧光显微镜下观察到,细胞对照组中的细胞生长状态良好,无荧光出现;感染病毒对照组中的细胞发生病变,大多数细胞出现荧光,添加重组鸭α干扰素蛋白的细胞具有抵抗病毒感染的能力。根据鸭α干扰素对def细胞的保护作用,观察细胞的病变程度,待有绿色荧光细胞出现,这一孔细胞就记为“+”,按照reed-muench方法计算干扰素的效价。检测结果列于表1,抗病毒活性测定结果表明在蚕幼虫体内表达的duifn-α-o有较为显著的抗病毒活性,效价达1.14
×
106u/ml,达到了预期的效果,说明在鸭α干扰素基因上优化的方法来提高duifn-α抗病毒活性是可行和有效的。
[0134]
表1鸭α干扰素突变体优化后抗病毒活性的检测结果
[0135][0136]
实施例3 duifn-α-o进行氨基酸单位点突变后在家蚕生物反应器中的表达与检测
[0137]
1、实验方法
[0138]
1.1鸭α干扰素突变体基因的构建
[0139]
本发明以duifn-α-o的基因序列为模板,设计多对引物对序列进行定点突变,定点突变是利用融合pcr的方法进行,融合pcr的方法见前述“2、实验方法”。
[0140]
突变位点分别为p2a、l19t、p25l、r35p、d38n、n51d、h64n、l73i、q80r、d95k、h108d、q117r、h123y、r127q、l136s、r142c、i148t、l159f、d170e或r182c;所得的鸭α干扰素突变体命名为duifn-α-o-m1(p2a、l19t、p25l、r35p、d38n、n51d、h64n、l73i、q80r、d95k、h108d、q117r、h123y、r127q、l136s、r142c、i148t、l159f、d170e或r182c)突变体。
[0141]
duifn-α-o核苷酸序列进行氨基酸单位点、双位点及多位点突变所需引物:
[0142]
(1)两侧上下游引物:
[0143]
f:tcataccgtcccaccatcgggcgcggatccgccaacatgcctggaccatcag(seq id no.14)
[0144]
r:gatctgcagcggccgctccggaattcttatctcatagttcttgtcaatc(seq id no.15)
[0145]
(2)中间上下游引物
[0146]
1.p2a其引物为整条链的两端引物
[0147]
f1:tcataccgtcccaccatcgggcgcggatccgccaacatggctggaccatcag(seq id no.16)
[0148]
r1:gatctgcagcggccgctccggaattcttatctcatagttcttgtcaatc(seq id no.17)
[0149]
2.
[0150]
f2:gctttggccctgacgctcctgttgac(seq id no.18)
[0151]
r2:gtcaacaggagcgtcagggccaaagc(seq id no.19)
[0152]
3.
[0153]
f3:gttgacccctctagctaacgccttcagc(seq id no.20)
[0154]
r3:gctgaaggcgttagctagaggggtcaac(seq id no.21)
[0155]
4.
[0156]
f4:gctgctccccgttgccactccacgactc(seq id no.22)
[0157]
r4:gagtcgtggagtggcaacggggagcagc(seq id no.23)
[0158]
5.
[0159]
f5:gagactccacaactcggctttcgcctgg(seq id no.24)
[0160]
r5:caggcgaaagccgagttgtggagtctcaacg(seq id no.25)
[0161]
6.
[0162]
f6:gcaactcctgagagatatggctcctagc(seq id no.26)
[0163]
r6:gctaggagccatatctctcaggagttgc(seq id no.27)
[0164]
7.
[0165]
f7:cacaacagaatgctccgtgttccttccccgac(seq id no.28)
[0166]
r7:gaacacggagcattctgttgtgggcaaggttg(seq id no.29)
[0167]
8.
[0168]
f8:cgacacaatactcgacaccaacgatacacaac(seq id no.30)
[0169]
r8:cgttggtgtcgagtattgtgtcggggaaggaac(seq id no.31)
[0170]
9.
[0171]
f9:caacgatacacgacaggctgcccacactgc(seq id no.32)
[0172]
r9:gtgggcagcctgtcgtgtatcgttggtgtcg(seq id no.33)
[0173]
10.
[0174]
f10:gcaacacctcttcaagactctgtcatctc(seq id no.34)
[0175]
r10:gagatgacagagtcttgaagaggtgttgc(seq id no.35)
[0176]
11.
[0177]
f11:gctcactggctggacactgccagacacg(seq id no.36)
[0178]
r11:cgtgtctggcagtgtccagccagtgagc(seq id no.37)
[0179]
12.
[0180]
f12:cgatctcctgaatcgattgcagcaccaca(seq id no.38)
[0181]
r12:gctgcaatcgattcaggagatcgtgtctg(seq id no.39)
[0182]
13.
[0183]
f13:gcagcaccacatataccacctcgaaagatgc(seq id no.40)
[0184]
r13:gcatctttcgaggtggtatatgtggtgctgc(seq id no.41)
[0185]
14.
[0186]
f14:catacaccacctcgaacaatgcttccctgc(seq id no.42)
[0187]
r14:gcgtcagcagggaagcattgttcgaggtgg(seq id no.43)
[0188]
15.
[0189]
f15:cgctgccagatcgcacagaagaggtccaag(seq id no.44)
[0190]
r15:ctcttctgtgcgatctggcagcgtcagcag(seq id no.45)
[0191]
16.
[0192]
f16:gaggtccatgcaacctgcacttgtcaatc(seq id no.46)
[0193]
r16:gtgcaggttgcatggacctcttctgtgc(seq id no.47)
[0194]
17.
[0195]
f17:gcacttgtcaaccaacaaatacttcggatg(seq id no.48)
[0196]
r17:cgaagtatttgttggttgacaagtgcagg(seq id no.49)
[0197]
18.
[0198]
f18:gtattcaacacttcttccagaaccacac(seq id no.50)
[0199]
r18:gtggttctggaagaagtgttgaatacatc(seq id no.51)
[0200]
19.
[0201]
f19:catgcgcctgggaacacgtgagactggaag(seq id no.52)
[0202]
r19:ctcacgtgttcccaggcgcatggagagtag(seq id no.53)
[0203]
20.
[0204]
f20:gctcacgcctgtttccagtgcatccacag(seq id no.54)
[0205]
r20:ctgtggatgcactggaaacaggcgtgagc(seq id no.55)
[0206]
1.2构建重组杆状病毒转移载体
[0207]
具体操作同实施例1。测序正确的质粒命名为pvl-duifn-α-o-m1(p2a、l19t、p25l、r35p、d38n、n51d、h64n、l73i、q80r、d95k、h108d、q117r、h123y、r127q、l136s、r142c、i148t、l159f、d170e或r182c)。
[0208]
1.3重组家蚕杆状病毒的获得、纯化与扩增
[0209]
同实施例1。
[0210]
通过共转染获得含有目的基因的重组病毒rbmbacmid(duifn-α-o-m1)。
[0211]
通过纯化获得纯的重组家蚕杆状病毒rbmbacmid(duifn-α-o-m1)。
[0212]
将重组家蚕杆状病毒rbmbacmid(duifn-α-o-m1)感染正常生长的bmn细胞,培养3天后收集上清液,上清中即含有大量的重组病毒rbmbacmid(duifn-α-o-m1)。
[0213]
1.4鸭α干扰素突变体在家蚕体内表达
[0214]
同实施例1。
[0215]
1.5鸭胚成纤维细胞(def)的制备及鸭α干扰素抗病毒活性检测
[0216]
同实施例1。
[0217]
2、实验结果
[0218]
2.1重组转移载体的鉴定
[0219]
重组转移载体pvl-duifn-α-o-m1经bamhi和ecori双酶切,在1%琼脂糖凝胶电泳分离出2个片段,小片段位于500-750bp之间,与目的基因片段576bp大小相符,大片段位于8000bp上方,与pvl1393片段9607bp大小相符。将酶切鉴定正确的质粒送北京擎科新业生物技术有限公司进行核苷酸测序,用megaalign比对结果表明序列与原先设计的序列一致,表明鸭α干扰素突变体基因已成功插入到pvl1393转移载体中bamhi和ecori之间。
[0220]
2.2鸭α干扰素重组病毒的获得及重组产物的检测
[0221]
应用微量细胞病变抑制法在def/vsv*gfp系统上检测家蚕幼虫表达的鸭α干扰素抗病毒活性。在倒置荧光显微镜下观察到,细胞对照组中的细胞生长状态良好,无荧光出现;感染病毒对照组中的细胞发生病变,大多数细胞出现荧光,添加重组鸭α干扰素蛋白的
细胞具有抵抗病毒感染的能力。根据鸭α干扰素对def细胞的保护作用,观察细胞的病变程度,待有绿色荧光细胞出现,这一孔细胞就记为“+”,按照reed-muench方法计算干扰素效价,检测结果列于表2,所有鸭α干扰素突变体测得效价在7.80
×
104u/ml~3.16
×
106u/ml,其中p25l、n51d、q80r、h108d、l136s和d170e这6个位点突变后,表达的鸭α干扰素效价略高于保守序列表达测得的效价,而其余位点突变后效价不变甚至降低,说明这6个位点的突变是有效突变,可以达到提高duifn-α抗病毒活性的目的。其中,duifn-α-o-n51d突变体具有最强抗病毒作用,其氨基酸序列为seq id no.5所示,编码基因的核苷酸序列为seq id no.6所示。
[0222]
表2重组鸭α干扰素单位点突变抗病毒活性的检测结果
[0223][0224][0225]
实施例4 duifn-α-o-m1突变体进行氨基酸双位点突变后在家蚕生物反应器中的表达与检测
[0226]
1、实验方法
[0227]
1.1鸭α干扰素突变体基因的构建
[0228]
鉴于实施例3的结果,确定部分位点的突变是有效突变,可以达到提高duifn-α-o突变体的抗病毒活性目的。考虑到氨基酸的排列顺序是蛋白质的一级结构,并决定着蛋白
质的高级结构,且实施例3中进行的氨基酸单位点突变有部分突变位点的位置可能是相互关联的,故尝试进行氨基酸双位点突变。本发明将抗病毒活性提高的单突变位点p25l、n51d、q80r、h108d、l136s和d170e两两组合,进行双位点突变,双位点突变是在实施例3获得的单位点突变序列的基础之上,以其(duifn-α-o-m1)作为模板,利用相应的引物(详见实施例3),通过融合pcr的方法进行第二位的定点突变,从而获得双位点突变的目的片段,融合pcr的方法见前述“2、实验方法”。
[0229]
双突变位点为p25l-n51d、p25l-q80r、p25l-h108d、p25l-l136s、p25l-d170e、n51d-q80r、n51d-h108d、n51d-l136s、n51d-d170e、q80r-h108d、q80r-l136s、q80r-d170e、h108d-l136s、h108d-d170e或l136s-d170e共15种组合,所获得的鸭α干扰素突变体命名为duifn-α-o-m1-m2(p25l-n51d、p25l-q80r、p25l-h108d、p25l-l136s、p25l-d170e、n51d-q80r、n51d-h108d、n51d-l136s、n51d-d170e、q80r-h108d、q80r-l136s、q80r-d170e、h108d-l136s、h108d-d170e或l136s-d170e)突变体。
[0230]
1.2构建重组杆状病毒转移载体
[0231]
方法同实施例1。测序正确的质粒命名为pvl-duifn-α-o-m1-m2(p25l-n51d、p25l-q80r、p25l-h108d、p25l-l136s、p25l-d170e、n51d-q80r、n51d-h108d、n51d-l136s、n51d-d170e、q80r-h108d、q80r-l136s、q80r-d170e、h108d-l136s、h108d-d170e或l136s-d170e)。
[0232]
1.3重组家蚕杆状病毒的获得、纯化与扩增
[0233]
同实施例1。
[0234]
通过共转染获得含有目的基因的重组病毒rbmbacmid(duifn-α-o-m1-m2)。
[0235]
通过纯化获得纯的重组家蚕杆状病毒rbmbacmid(duifn-α-o-m1-m2)。
[0236]
将重组家蚕杆状病毒rbmbacmid(duifn-α-o-m1-m2)感染正常生长的bmn细胞,培养3天后收集上清液,上清中即含有大量的重组病毒rbmbacmid(duifn-α-o-m1-m2)。
[0237]
1.4鸭α干扰素突变体在家蚕体内表达
[0238]
同实施例1。
[0239]
1.5鸭胚成纤维细胞(def)的制备及鸭α干扰素抗病毒活性检测
[0240]
同实施例1。
[0241]
2、实验结果
[0242]
2.1重组转移载体的鉴定
[0243]
重组转移载体pvl-duifn-α-o-m1-m2经bamhi和ecori双酶切,在1%琼脂糖凝胶电泳分离出2个片段,小片段位于500-750bp之间,与目的基因片段576bp大小相符,大片段位于8000bp上方,与pvl1393片段9607bp大小相符。将酶切鉴定正确的质粒送北京擎科新业生物技术有限公司进行核苷酸测序,用megaalign比对结果表明序列与原先设计的序列一致,表明鸭α干扰素突变体基因已成功插入到pvl1393转移载体中bamhi和ecori之间。
[0244]
2.2鸭α干扰素重组病毒的获得及重组产物的检测
[0245]
应用微量细胞病变抑制法在def/vsv*gfp系统上检测家蚕幼虫表达的鸭α干扰素抗病毒活性。在倒置荧光显微镜下观察到,细胞对照组中的细胞生长状态良好,无荧光出现;感染病毒对照组中的细胞发生病变,大多数细胞出现荧光,添加重组鸭α干扰素蛋白的细胞具有抵抗病毒感染的能力。根据鸭α干扰素对def细胞的保护作用,观察细胞的病变程度,待有绿色荧光细胞出现,这一孔细胞就记为“+”,按照reed-muench方法计算干扰素效
n51d-q80r-h108d-d170e。所获得的鸭α干扰素突变体命名为duifn-α-o-m1-m2-m3(p25l-n51d-q80r、p25l-q80r-h108d、p25l-q80r-d170e、p25l-n51d-h108d、n51d-q80r-h108d、n51d-h108d-d170e、p25l-n51d-d170e、n51d-q80r-d170e)或duifn-α-o-m1-m2-m3-m4(p25l-n51d-q80r-h108d、n51d-q80r-h108d-d170e、p25l-n51d-h108d-d170e)或duifn-α-o-m1-m2-m3-m4-m5(p25l-n51d-q80r-h108d-d170e)突变体。
[0253]
1.2构建重组杆状病毒转移载体
[0254]
同实施例1。
[0255]
测序正确的质粒命名为pvl-duifn-α-o-m1-m2-m3(p25l-n51d-q80r、p25l-q80r-h108d、p25l-q80r-d170e、p25l-n51d-h108d、n51d-q80r-h108d、n51d-h108d-d170e、p25l-n51d-d170e、n51d-q80r-d170e)或pvl-duifn-α-o-m1-m2-m3-m4(p25l-n51d-q80r-h108d、n51d-q80r-h108d-d170e、p25l-n51d-h108d-d170e)或pvl-duifn-α-o-m1-m2-m3-m4-m5(p25l-n51d-q80r-h108d-d170e)。
[0256]
1.3重组家蚕杆状病毒的获得、纯化与扩增
[0257]
具体操作见实施例1。
[0258]
通过共转染获得含有目的基因的重组病毒rbm-bacmid(duifn-α-o-m1-m2-m3或duifn-α-o-m1-m2-m3-m4或duifn-α-o-m1-m2-m3-m4-m5)。
[0259]
通过纯化获得纯的重组家蚕杆状病毒rbm-bacmid(duifn-α-o-m1-m2-m3或duifn-α-o-m1-m2-m3-m4或duifn-α-o-m1-m2-m3-m4-m5)。
[0260]
将重组家蚕杆状病毒rbm-bacmid(duifn-α-o-m1-m2-m3或duifn-α-o-m1-m2-m3-m4或duifn-α-o-m1-m2-m3-m4-m5)感染正常生长的bmn细胞,培养3天后收集上清液,上清中即含有大量的重组病毒rbm-bacmid(duifn-α-o-m1-m2-m3或duifn-α-o-m1-m2-m3-m4或duifn-α-o-m1-m2-m3-m4-m5)。
[0261]
1.4鸭α干扰素突变体在家蚕体内表达
[0262]
同实施例1。
[0263]
1.5鸭胚成纤维细胞(def)的制备及鸭α干扰素抗病毒活性检测
[0264]
同实施例1。
[0265]
2、实验结果
[0266]
2.1重组转移载体的鉴定
[0267]
重组转移载体pvl-duifn-α-o-m1-m2-m3或pvl-duifn-α-o-m1-m2-m3-m4或pvl-duifn-α-o-m1-m2-m3-m4-m5经bamhi和ecori双酶切,在1%琼脂糖凝胶电泳分离出2个片段,小片段位于500-750bp之间,与目的基因片段576bp大小相符,大片段位于8000bp上方,与pvl1393片段9607bp大小相符。将酶切鉴定正确的质粒送北京擎科新业生物技术有限公司进行核苷酸测序,用megaalign比对结果表明序列与原先设计的序列一致,表明鸭α干扰素突变体基因已成功插入到pvl1393转移载体中bamhi和ecori之间。
[0268]
2.2鸭α干扰素重组病毒的获得及重组产物的检测
[0269]
应用微量细胞病变抑制法在def/vsv*gfp系统上检测家蚕幼虫表达的鸭α干扰素抗病毒活性。在倒置荧光显微镜下观察到,细胞对照组中的细胞生长状态良好,无荧光出现;感染病毒对照组中的细胞发生病变,大多数细胞出现荧光,添加重组鸭α干扰素蛋白的细胞具有抵抗病毒感染的能力。根据鸭α干扰素对def细胞的保护作用,观察细胞的病变程
度,待有绿色荧光细胞出现,这一孔细胞就记为“+”,按照reed-muench方法计算干扰素效价,检测结果列于表4,所有鸭α干扰素突变体测得效价在2.51
×
105u/ml~5.78
×
106u/ml,其中五位点p25l-n51d-q80r-h108d-d170e突变后,表达的鸭α干扰素效价远高于保守序列、单突变序列、双突变序列表达测得的效价,为5.78
×
106u/ml。而其余几组位点突变后效价不变甚至降低,说明此组合位点的突变是有效突变,可以达到提高duifn-α-o-m1-m2突变体抗病毒活性的目的。duifn-α-o-p25l-n51d-q80r-h108d-d170e突变体的氨基酸序列为seq id no.9所示,其编码基因的核苷酸序列为seq id no.10所示。
[0270]
表4重组鸭α干扰素多位点突变抗病毒活性的检测结果
[0271][0272]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1