一种波生坦的制备方法
1.本发明属于医药技术领域,具体涉及一种波生坦的制备方法。
背景技术:
2.波生坦(bosentan)由瑞士actelion公司研究开发,2001年被fda批准在美国上市,用于治疗ⅲ期和iv期原发性pah患者,或者治疗硬皮病引起的肺高压,其合成路线有三条:
3.合成路线一:
[0004][0005]
该合成路线以2-氰基嘧啶为原料先与乙醇钠在0-5℃低温反应6h,再与氯化铵在25-30℃条件下反应4h得到2-嘧啶甲脒盐酸盐;所得物与2-(2-甲氧基-苯氧基)丙二酸二甲酯在35-40℃条件下反应5h,再与三氯氧磷在100℃条件下反应4h,后处理用甲苯萃取。该合成路线具有原料易得,价格优廉,反应条件温和且操作简单等优点。缺点是乙二醇钠由金属钠和乙二醇反应所得,反应选择性较低,易发生副反应,得到不期望的二聚体;反应条件温和,反应速度慢,并且反应时间较短,导致反应不完全,产率较低,参见
[1]
。
[0006]
合成路线二:
[0007][0008]
该合成路线以丙二酸二乙酯为原料,在nbs作用回流反应8h,所得物与邻甲氧基苯酚在80℃条件下反应4h,再与2-嘧啶甲脒盐酸盐在50℃条件下反应11h,所得物与三氯氧磷回流反应3h,总收率为37.29%。该合成路线具有原料易得、反应条件温和、操作简单等优点。缺点是反应步骤较长,导致合成关键中间体的收率不高,总合成路线收率降低:购买2-嘧啶甲脒盐酸盐参与反应,价格较高,成本升高,经济效应降低,不利于工业化生产,参见
[2]
。
[0009]
合成路线三:
[0010][0011]
该合成路线以4,6-二氯-5-(2-甲氧基-苯氧基)-2,2'-联嘧啶为原料,在碳酸钾的作用下与4-叔丁基苯磺酰胺发生单氯置换反应,再与2-叔丁氧基乙醇发生第二个氯置换反应,然后经过与甲酸酯化、氢氧化钠碱水解,除去叔丁基,最终得到波生坦,该方法优点在于通过使用单边保护的乙二醇,提高了反应的选择性,能够制备高纯度波生坦,解决了二聚体形成的问题。反应中叔丁基将乙二醇的一个羟基的氢修饰为叔丁基,然后通过甲酸脱叔丁基保护,然后用碱水解酯键,从而产生含有游离羟基的乙二醇磺酰胺衍生物,即波生坦。此方法缺点是:由于2-叔丁氧基乙醇比乙二醇价格高,并且脱保护导致步骤增多,故而收率降低,成本升高。
技术实现要素:
[0012]
本发明为了解决上述技术问题提供一种波生坦的制备方法,将波生坦的总合成收率从6%左右提高到10%,反应条件温和,副产物较少,纯度好,大部分收率高于80%,后处理简单,易于大规模工业化生产等特点。
[0013]
本发明解决上述技术问题的技术方案如下:本波生坦的制备方法包括:包括
[0014]
s1,2-嘧啶甲脒盐酸盐的制备:
[0015]
分别称取2-基嘧啶和碱性催化剂,按照摩尔比为1:(0.25-0.75)进行过夜反应,得到中间体;
[0016]
将中间体和铵盐按照摩尔比为(0.25-0.75):(1-2)溶解在溶剂a中,发生pinner反应,得到2-嘧啶甲脒盐酸盐;
[0017]
s2:将步骤s1得到的2-嘧啶甲脒盐酸盐与2-(2-甲氧基苯氧基)丙二酸二甲酯、碱性催化剂按照摩尔比为1:1-1.5:2.5-4溶解在无水醇溶剂中,得到5-(2-甲氧基-苯氧基)-1h-[2,2']联嘧啶-4,6-二酮,然后在70-90℃发生氯代反应得到4,6-二氯-5-(2-甲氧基苯氧基)-2,2'-联嘧啶基;
[0018]
s3:将步骤s3得到的4,6-二氯-5-(2-甲氧基苯氧基)-2,2'-联嘧啶基与4-叔丁基苯磺酰胺、缚酸剂、相转移催化剂按照摩尔比为1:1.1-1.5:1.1-1.5:0.05-0.1溶解在溶剂a中,得到n-[6-氯-5(2-甲氧基苯氧基)[2,2'-二嘧啶]-4-基]-4-叔丁基-苯磺酰胺;
[0019]
s4:将步骤s3中的n-[6-氯-5(2-甲氧基苯氧基)[2,2'-二嘧啶]-4-基]-4-叔丁基-苯磺酰胺、乙二醇、碱性催化剂按照摩尔比为1:5-10:1-4溶解在溶剂b中,进行取代反应得到波生坦。
[0020]
在上述技术方案的基础上,本发明还可以做如下改进。
[0021]
进一步,步骤s1中,所述碱性催化剂为甲醇钠、乙醇钠、氢氧化钠、氢化钠、叔丁醇钾或二异丙基氨基锂的一种;更优选为甲醇钠;所述无水醇溶剂为无水甲醇、无水乙醇、无水四氢呋喃、甲苯或乙腈的任意一种;更优选为无水甲醇。
[0022]
采用上述进一步的有益效果是:甲醇钠的催化效果好,成本低;无水甲醇作为样品的溶解剂,适用范围很广。
[0023]
进一步,步骤s1中,所述2-氰基嘧啶与所述碱性催化剂的反应温度为5-25℃,反应时间为16-24h;然后2-氰基嘧啶与所述碱性催化剂反应后与所述铵盐的反应温度为55-75℃,反应时间为3-7h。
[0024]
采用上述进一步的有益效果是:均是在本方法中最佳的反应温度和时间,产品总收率高。
[0025]
进一步,步骤s1中,所述铵盐为氯化铵,硫酸铵、醋酸铵或苯磺酸铵的任意一种;更优选为氯化铵。
[0026]
采用上述进一步的有益效果是:能快速反应得到2-嘧啶甲脒盐酸盐。
[0027]
进一步,步骤s2中,所述无水醇溶剂为无水甲醇、无水乙醇、无水四氢呋喃、甲苯或乙腈的任意一种,更优选为无水甲醇;所述2-嘧啶甲脒盐酸盐与2-(2-甲氧基苯氧基)丙二酸二甲酯、碱性催化剂的反应温度为45-75℃,反应时间为5-7h;所述氯代反应的反应温度为70-90℃,反应时间为5-7h。
[0028]
采用上述进一步的有益效果是:无水甲醇不改变溶剂的使用,减少杂质的引入;反应温度为70-90℃,减少副产物产生的同时加快反应进程。
[0029]
进一步,步骤s2中,所述碱性催化剂选自甲醇钠、氢氧化钠、有机胺、氢氧化钠或叔丁醇钾的任意一种,更优选碱性催化剂为氢氧化钠。
[0030]
采用上述进一步的有益效果是:能有效提高反应速度。
[0031]
进一步,步骤s2中,氯代反应是按照5-(2-甲氧基-苯氧基)-1h-[2,2']联嘧啶-4,6-二酮、三氯氧磷、碱性催化剂的摩尔比为1:5-20:1.5-5在溶剂c中进行反应,反应时间为5-7h。
[0032]
采用上述进一步的有益效果是:均是在本方法中最佳的反应温度和时间,产品总收率高。
[0033]
进一步,步骤s2中,所述溶剂c为甲苯、二甲苯、二氯甲烷、二甲基亚砜、甲醇、四氢呋喃、丙酮或乙腈中的任意一种,更优选为乙腈;所述氯代反应中的碱性催化剂为三乙胺、n,n-二甲基苯胺、吡啶或甲醇钠中的任意一种,更优选为三乙胺。
[0034]
采用上述进一步的有益效果是:乙腈可以在80℃回流,并且利于后处理;三乙胺提高反应速度。
[0035]
进一步,步骤s3中,所述溶剂a为甲苯、二甲苯、二氯甲烷、二甲基亚砜、甲醇、四氢呋喃、丙酮或乙腈的任意一种,更优选为甲苯;所述缚酸剂为氢氧化钾、氢氧化钠、碳酸钾、碳酸钠、三乙胺、甲醇钠、吡啶和四丁基溴化铵中的任意一种,更优选为无水碳酸钾;所述相转移催化剂选自聚醚、环状冠醚类、季铵盐、叔胺或季膦盐中的任意一种,更优选为四丁基溴化铵;反应温度为100-110℃,反应时间为16-24h。
[0036]
采用上述进一步的有益效果是:甲苯,较高的沸点使得反应体系温度可以升高,加快反应进程;无水碳酸钾廉价易得,方便使用;四丁基溴化铵成本低,操作方便。
[0037]
进一步,步骤s4中,溶剂b为甲苯、二甲苯、二氯甲烷、二甲基亚砜、甲醇、四氢呋喃、丙酮或乙腈的任意一种,更优选为甲苯;所述碱性催化剂为金属钠、叔丁醇钾、氢化钠或甲醇钠中的任意一种,更优选为叔丁醇钾;反应温度为100-110℃,反应时间为4-6h。
[0038]
采用上述进一步的有益效果是:甲苯能减少溶剂的变化,降低杂质引入;叔丁醇钾的催化效果较好,使用安全
[0039]
有益效果:
[0040]
本制备路线具有原料合理,反应条件温和,处理简单,收率较高,绿色环保,总收率高达10%,且每一步反应中间体不用经过精制,可以直接用于下一步反应,不会对下一步反应的收率产生影响,符合工业化生产的需求。
附图说明
[0041]
图1为本发明提供的波生坦的制备工艺路线图;
[0042]
图2本发明制备得到的波生坦的核磁共振氢谱;
[0043]
图3本发明制备得到的波生坦的质子定位图;
具体实施方式
[0044]
以下结合附图对本发明的原理和特征进行描述,所举实例只用于解释本发明,并非用于限定本发明的范围。
[0045]
实施例一
[0046]
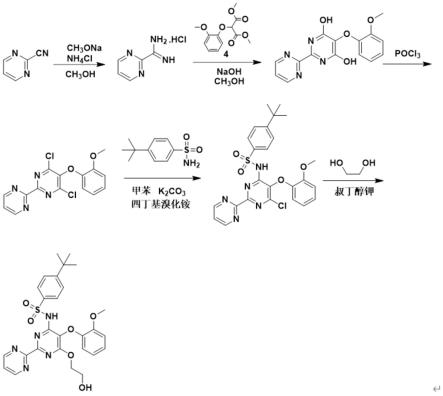
如图1所示,本实施例提供一种波生坦的制备方法,包括:
[0047]
(1)2-嘧啶甲脒盐酸盐的制备
[0048]
在室温下,向圆底烧瓶中依次加入无水甲醇(4ml)、2-氰基嘧啶(0.30g,2.85mmol)
和甲醇钠(38.50mg,0.71mmol),室温反应16h后加入氯化铵(0.23g,4.30mmol),回流反应3h,tlc跟踪反应,反应结束后冷却反应液至室温,过滤,滤液减压蒸馏去除有机溶剂,剩余物干燥即得0.54g,根据紫外分析仪测定吸光度,测定其纯度为62.28%,收率为74.12%。
[0049]
(2)5-(2-甲氧基-苯氧基)-1h-[2,2']联嘧啶-4,6-二酮的制备
[0050]
在室温下,向圆底烧瓶中依次加入2-嘧啶甲脒盐酸盐(192.8mg,1.22mmol)和无水甲醇(3ml),分批加入氢氧化钠(188.8mg,4.75mmol),室温条件下搅拌30min,在冰浴条件下滴加2-(2-甲氧基苯氧基)丙二酯二甲酯(0.51g,2.0mmol)的无水甲醇溶液(10ml),1h内滴完,回流反应5h,tlc跟踪反应,反应结束后冷却反应液至室温,过滤,滤液解压蒸馏去除有机溶剂,加蒸馏水,调ph至1.5,在室温条件下搅拌30min,再在0-5℃条件下搅拌30min,析晶过滤,烘干即得产物0.0528g,收率14%。
[0051]
(3)4,6-二氯-5-(2-甲氧基苯氧基)-2,2'-联嘧啶基的制备
[0052]
在室温下,向圆底烧瓶中依次加入5-(2-甲氧基-苯氧基)-1h-[2,2']联嘧啶-4,6-二酮(43.4mg,0.206mmol)和乙腈(3ml),慢慢滴加三乙胺(0.25ml,1.8mmol)和三氯氧磷(1ml,0.011mol),滴加完毕后,在80℃条件下反应6h,tlc跟踪反应,反应结束后冷却反应液至室温,加10倍体积的碎冰淬灭反应,用乙酸乙酯进行萃取,有机层依次用蒸馏水、饱和碳酸氢钠溶液、饱和食盐水洗涤,无水硫酸钠干燥,减压蒸馏去除有机溶剂,剩余物干燥即得0.0366g,收率75.42%。
[0053]
(4)n-[6-氯-5(2-甲氧基苯氧基)[2,2'-二嘧啶]-4-基]-4-叔丁基-苯磺酰胺的制备
[0054]
在50℃下,向圆底烧瓶中依次加入4,6-二氯-5-(2-甲氧基苯氧基)-2,2'-联嘧啶基(0.15g,0.43mmol)和甲苯(4ml),依次加入4-叔丁基苯磺酰胺(98.4mg,0.46mmol)、无水碳酸钾(86.9mg,0.63mmol)和四丁基溴化铵(6.8mg,0.021mmol),加料完毕,回流反应16h,tlc跟踪反应,反应结束后冷却反应液至室温,减压蒸馏去除有机溶剂,加蒸馏水调ph至3;用二氯甲烷萃取,有机层依次用2n盐酸,蒸馏水,饱和食盐水洗涤,其中2n盐酸可以去除有机层中没有反应完的4-叔丁基苯磺酰胺,无水硫酸钠干燥后过滤,减压蒸馏去除有机溶剂,剩余物干燥即得产物0.2160g,收率97.94%。
[0055]
(5)波生坦的制备
[0056]
在室温下,向圆底烧瓶中依次加入叔丁醇钾(0.096g,0.86mmol)、甲苯(4ml)和乙二醇(0.5ml),回流反应1h,直至白色固体溶解,结束反应后冷却至室温,加入n-[6-氯-5(2-甲氧基苯氧基)[2,2'-二嘧啶]-4-基]-4-叔丁基-苯磺酰胺(0.15g,0.29mmol),再回流反应5h,tlc跟踪反应,反应结束后冷却反应液至室温,减压蒸馏去除有机溶剂,加蒸馏水调ph至3,在室温条件下搅拌30min,过滤,滤饼干燥,即得无定形化合物0.1538g,收率97.51%。
[0057]
如图2、3所示,配合下表1
[0058]
位置化学位移质子数偶合常数j(hz)2.49.082(d)4.837.651(t)5.01311.351(s)/166.671(d)7.8186.791(t)7.7
17,197.10-6.982(m)/233.783(s)/25,297.532(d)8.326,288.22(d)8.231,32,331.249(s)/374.312(t)5.4383.452(s)/394.681(s)/
[0059]
(1)1h nmr谱中,共有十三组质子峰,其积分比(从低到高场)为9:2:3:2:1:1:1:2:2:1:2:2:1。共计二十九个氢原子,这与化合物1氢原子个数相符合。按质子化学位移规律判断δh12.04(1h,s)对应着磺酰胺胺基上的氢质子;δh4.68(1h,s)对应着羟基上的氢质子。
[0060]
(2)根据质子数量,判断δh3.78(3h,s)为c-23甲基的氢原子;δh1.24(9h,s)为c-31、c-32、c-33叔丁基的氢质子。
[0061]
(3)结合质子峰的裂分情况和偶合常数,判断δh6.67(dd,j=7.8hz,1h),根据其偶合常数7.8hz,确定该质子受到邻位偶合,裂分为d峰,区别于结构中c-2和c-4与n原子相连h质子会向地场移动,故此判断该质子应了c-16上的氢质子;δh7.10-6.98(2h,m)可能为c-17h和c-19形成的重叠峰;δh6.79(1h,t)对应了c-18上的氢质子。
[0062]
(4)根据质子裂分情况、偶合常数和质子数量,判断了δh9.08(d,j=4.8hz,2h),根据其偶合常数4.8hz,确定该质子受到邻位偶合,裂分为d峰,区别于结构中c-16,故此判断该质子对应了c-2和c-4;δh7.65(1h,t)对应了c-3上的氢质子。
[0063]
实施例二:
[0064]
(1)2-嘧啶甲脒盐酸盐的制备
[0065]
在室温下,向圆底烧瓶中依次加入无水甲醇(4ml)、2-氰基嘧啶(0.30g,2.85mmol)和甲醇钠(38.50mg,0.71mmol),室温反应16h后加入氯化铵(0.15g,2.85mmol),室温反应3h,tlc跟踪反应,反应结束后,过滤,滤液减压蒸馏去除有机溶剂,剩余物干燥即得0.41g,根据紫外分析仪测定吸光度,测定其纯度为66.38%,收率为61.16%。
[0066]
(2)5-(2-甲氧基-苯氧基)-1h-[2,2']联嘧啶-4,6-二酮的制备
[0067]
在室温下,向圆底烧瓶中依次加入2-嘧啶甲脒盐酸盐(213.8mg,1.35mmol)和无水甲醇(3ml),分批加入氢氧化钠(135.2mg,3.38mmol),室温条件下搅拌30min,在冰浴条件下滴加2-(2-甲氧基苯氧基)丙二酯二甲酯(0.34g,1.34mmol)的无水甲醇溶液(10ml),1h内滴完,45℃条件下反应5h,tlc跟踪反应,反应结束后冷却反应液至室温,过滤,滤液解压蒸馏去除有机溶剂,加蒸馏水,调ph至1.5,在室温条件下搅拌30min,再在0-5℃条件下搅拌30min,析晶过滤,烘干即得产物0.023g,收率5.46%。
[0068]
(3)4,6-二氯-5-(2-甲氧基苯氧基)-2,2'-联嘧啶基的制备
[0069]
在室温下,向圆底烧瓶中依次加入5-(2-甲氧基-苯氧基)-1h-[2,2']联嘧啶-4,6-二酮(61.8mg,0.20mmol)和乙腈(3ml),慢慢滴加三乙胺(0.25ml,1.8mmol)和三氯氧磷(1ml,0.011mol),滴加完毕后,在70℃条件下反应6h,tlc跟踪反应,反应结束后冷却反应液至室温,加10倍体积的碎冰淬灭反应,用乙酸乙酯进行萃取,有机层依次用蒸馏水、饱和碳酸氢钠溶液、饱和食盐水洗涤,无水硫酸钠干燥,减压蒸馏去除有机溶剂,剩余物干燥即得
0.0325g,收率47.03%。
[0070]
(4)n-[6-氯-5(2-甲氧基苯氧基)[2,2'-二嘧啶]-4-基]-4-叔丁基-苯磺酰胺的制备
[0071]
在50℃下,向圆底烧瓶中依次加入4,6-二氯-5-(2-甲氧基苯氧基)-2,2'-联嘧啶基(0.14g,0.41mmol)和甲苯(4ml),依次加入4-叔丁基苯磺酰胺(96mg,0.45mmol)、无水碳酸钾(84.8mg,0.61mmol)和四丁基溴化铵(6.6mg,0.02mmol),加料完毕,回流反应16h,tlc跟踪反应,反应结束后冷却反应液至室温,减压蒸馏去除有机溶剂,加蒸馏水调ph至3;用二氯甲烷萃取,有机层依次用2n盐酸,蒸馏水,饱和食盐水洗涤,其中2n盐酸可以去除有机层中没有反应完的4-叔丁基苯磺酰胺,无水硫酸钠干燥后过滤,减压蒸馏去除有机溶剂,剩余物干燥即得产物0.2029g,收率94.25%。
[0072]
(5)波生坦的制备
[0073]
在室温下,向圆底烧瓶中依次加入叔丁醇钾(0.096g,0.86mmol)、甲苯(4ml)和乙二醇(0.5ml),回流反应1h,直至白色固体溶解,结束反应后冷却至室温,加入n-[6-氯-5(2-甲氧基苯氧基)[2,2'-二嘧啶]-4-基]-4-叔丁基-苯磺酰胺(0.15g,0.29mmol),再回流反应4h,tlc跟踪反应,反应结束后冷却反应液至室温,减压蒸馏去除有机溶剂,加蒸馏水调ph至3,在室温条件下搅拌30min,过滤,滤饼干燥,即得无定形化合物0.1531g,收率97.14%。
[0074]
实施例三:
[0075]
(1)2-嘧啶甲脒盐酸盐的制备
[0076]
在室温下,向圆底烧瓶中依次加入无水甲醇(4ml)、2-氰基嘧啶(0.30g,2.85mmol)和甲醇钠(38.50mg,0.71mmol),室温反应16h后加入氯化铵(0.31g,5.80mmol),回流反应5h,tlc跟踪反应,反应结束后冷却反应液至室温,过滤,滤液减压蒸馏去除有机溶剂,剩余物干燥即得0.64g,根据紫外分析仪测定吸光度,测定其纯度为46.35%,收率为65.77%。
[0077]
(2)5-(2-甲氧基-苯氧基)-1h-[2,2']联嘧啶-4,6-二酮的制备
[0078]
在室温下,向圆底烧瓶中依次加入2-嘧啶甲脒盐酸盐(0.33g,2.08mmol)和无水甲醇(3ml),分批加入氢氧化钠(0.25g,6.25mmol),室温条件下搅拌30min,在室温条件下滴加2-(2-甲氧基苯氧基)丙二酯二甲酯(0.53g,2.08mmol)的无水甲醇溶液(10ml),1h内滴完,回流反应8h,tlc跟踪反应,反应结束后冷却反应液至室温,过滤,滤液解压蒸馏去除有机溶剂,加蒸馏水,调ph至1.5,在室温条件下搅拌30min,再在0-5℃条件下搅拌30min,析晶过滤,烘干即得产物0.0232g,收率3.54%。
[0079]
(3)4,6-二氯-5-(2-甲氧基苯氧基)-2,2'-联嘧啶基的制备
[0080]
在室温下,向圆底烧瓶中依次加入5-(2-甲氧基-苯氧基)-1h-[2,2']联嘧啶-4,6-二酮(98.6mg,0.316mmol),慢慢滴加n,n-二甲基苯胺(0.25ml,1.97mmol)和三氯氧磷(1ml,0.011mol),滴加完毕后,在80℃条件下反应6h,tlc跟踪反应,反应结束后冷却反应液至室温,加10倍体积的碎冰淬灭反应,用乙酸乙酯进行萃取,有机层依次用蒸馏水、饱和碳酸氢钠溶液、饱和食盐水洗涤,无水硫酸钠干燥,减压蒸馏去除有机溶剂,剩余物干燥即得0.0487g,收率44.17%。
[0081]
(4)n-[6-氯-5(2-甲氧基苯氧基)[2,2'-二嘧啶]-4-基]-4-叔丁基-苯磺酰胺的制备
[0082]
在50℃下,向圆底烧瓶中依次加入4,6-二氯-5-(2-甲氧基苯氧基)-2,2'-联嘧啶
基(0.15g,0.41mmol)和甲苯(4ml),依次加入4-叔丁基苯磺酰胺(96mg,0.45mmol)、无水碳酸钾(62.5mg,0.45mmol)和四丁基溴化铵(8.5mg,0.026mmol),加料完毕,回流反应16h,tlc跟踪反应,反应结束后冷却反应液至室温,减压蒸馏去除有机溶剂,加蒸馏水调ph至3;用二氯甲烷萃取,有机层依次用2n盐酸,蒸馏水,饱和食盐水洗涤,其中2n盐酸可以去除有机层中没有反应完的4-叔丁基苯磺酰胺,无水硫酸钠干燥后过滤,减压蒸馏去除有机溶剂,剩余物干燥即得产物0.1195g,收率55.90%。
[0083]
(5)波生坦的制备
[0084]
在室温下,向圆底烧瓶中依次加入叔丁醇钾(0.096g,0.86mmol)、甲苯(4ml)和乙二醇(0.5ml),回流反应1h,直至白色固体溶解,结束反应后冷却至室温,加入n-[6-氯-5(2-甲氧基苯氧基)[2,2'-二嘧啶]-4-基]-4-叔丁基-苯磺酰胺(0.15g,0.29mmol),在100℃条件下反应5h,tlc跟踪反应,反应结束后冷却反应液至室温,减压蒸馏去除有机溶剂,加蒸馏水调ph至3,在室温条件下搅拌30min,过滤,滤饼干燥,即得无定形化合物0.1239g,收率78.56%。
[0085]
实施例四:
[0086]
(1)2-嘧啶甲脒盐酸盐的制备
[0087]
在室温下,向圆底烧瓶中依次加入无水甲醇(4ml)、2-氰基嘧啶(0.30g,2.85mmol)和甲醇钠(115.8mg,2.14mmol),室温反应16h后加入氯化铵(0.31g,5.80mmol),室温反应4h,tlc跟踪反应,反应结束后,过滤,滤液减压蒸馏去除有机溶剂,剩余物干燥即得0.56g,根据紫外分析仪测定吸光度,测定其纯度为43.64%,收率为54.68%。
[0088]
(2)5-(2-甲氧基-苯氧基)-1h-[2,2']联嘧啶-4,6-二酮的制备
[0089]
在室温下,向圆底烧瓶中依次加入2-嘧啶甲脒盐酸盐(213.8mg,1.35mmol)和无水甲醇(3ml),分批加入氢氧化钠(0.16g,4.05mmol),室温条件下搅拌30min,在冰浴条件下滴加2-(2-甲氧基苯氧基)丙二酯二甲酯(0.51g,2.00mmol)的无水甲醇溶液(10ml),1h内滴完,回流反应5h,tlc跟踪反应,反应结束后冷却反应液至室温,过滤,滤液解压蒸馏去除有机溶剂,加蒸馏水,调ph至1.5,在室温条件下搅拌30min,再在0-5℃条件下搅拌30min,析晶过滤,烘干即得产物0.0413g,收率9.81%。
[0090]
(3)4,6-二氯-5-(2-甲氧基苯氧基)-2,2'-联嘧啶基的制备
[0091]
在室温下,向圆底烧瓶中依次加入5-(2-甲氧基-苯氧基)-1h-[2,2']联嘧啶-4,6-二酮(51.5mg,0.165mmol)和甲苯(3ml),慢慢滴加n,n-二甲基苯胺(0.25ml,1.97mmol)和三氯氧磷(1ml,0.011mol),滴加完毕后,在70℃条件下反应6h,tlc跟踪反应,反应结束后冷却反应液至室温,加10倍体积的碎冰淬灭反应,用乙酸乙酯进行萃取,有机层依次用蒸馏水、饱和碳酸氢钠溶液、饱和食盐水洗涤,无水硫酸钠干燥,减压蒸馏去除有机溶剂,剩余物干燥即得0.0069g,收率11.98%。
[0092]
(4)n-[6-氯-5(2-甲氧基苯氧基)[2,2'-二嘧啶]-4-基]-4-叔丁基-苯磺酰胺的制备
[0093]
在50℃下,向圆底烧瓶中依次加入4,6-二氯-5-(2-甲氧基苯氧基)-2,2'-联嘧啶基(0.1465g,0.42mmol)和甲苯(4ml),依次加入4-叔丁基苯磺酰胺(116.2mg,0.54mmol)、无水碳酸钾(86.9mg,0.63mmol)和四丁基溴化铵(8.8mg,0.027mmol),加料完毕,回流反应16h,tlc跟踪反应,反应结束后冷却反应液至室温,减压蒸馏去除有机溶剂,加蒸馏水调ph
至3;用二氯甲烷萃取,有机层依次用2n盐酸,蒸馏水,饱和食盐水洗涤,其中2n盐酸可以去除有机层中没有反应完的4-叔丁基苯磺酰胺,无水硫酸钠干燥后过滤,减压蒸馏去除有机溶剂,剩余物干燥即得产物0.2177g,收率98.64%。
[0094]
(5)波生坦的制备
[0095]
在室温下,向圆底烧瓶中依次加入叔丁醇钾(0.064g,0.57mmol)、甲苯(4ml)和乙二醇(0.5ml),回流反应1h,直至白色固体溶解,结束反应后冷却至室温,加入n-[6-氯-5(2-甲氧基苯氧基)[2,2'-二嘧啶]-4-基]-4-叔丁基-苯磺酰胺(0.15g,0.29mmol),再回流反应5h,tlc跟踪反应,反应结束后冷却反应液至室温,减压蒸馏去除有机溶剂,加蒸馏水调ph至3,在室温条件下搅拌30min,过滤,滤饼干燥,即得无定形化合物0.1425g,收率90.41%。
[0096]
实施例五:
[0097]
(1)2-嘧啶甲脒盐酸盐的制备
[0098]
在室温下,向圆底烧瓶中依次加入无水甲醇(40ml)、2-氰基嘧啶(3.0g,28.5mmol)和甲醇钠(386.8mg,7.2mmol),室温反应16h后加入氯化铵(2.3g,43.0mmol),回流反应3h,tlc跟踪反应,反应结束后冷却反应液至室温,过滤,滤液减压蒸馏去除有机溶剂,剩余物干燥即得5.0214g,根据紫外分析仪测定吸光度,测定其纯度为46.96%,收率为52.09%。
[0099]
(2)5-(2-甲氧基-苯氧基)-1h-[2,2']联嘧啶-4,6-二酮的制备
[0100]
在室温下,向圆底烧瓶中依次加入2-嘧啶甲脒盐酸盐(1.77g,11.16mmol)和无水甲醇(30ml),分批加入氢氧化钠(1.73g,43.25mmol),室温条件下搅拌30min,在冰浴条件下滴加2-(2-甲氧基苯氧基)丙二酯二甲酯(4.72g,18.57mmol)的无水甲醇溶液(50ml),1h内滴完,回流反应5h,tlc跟踪反应,反应结束后冷却反应液至室温,过滤,滤液解压蒸馏去除有机溶剂,加蒸馏水,调ph至1.5,在室温条件下搅拌30min,再在0-5℃条件下搅拌30min,析晶过滤,烘干即得产物0.7938g,收率22.8%。
[0101]
(3)4,6-二氯-5-(2-甲氧基苯氧基)-2,2'-联嘧啶基的制备
[0102]
在室温下,向圆底烧瓶中依次加入5-(2-甲氧基-苯氧基)-1h-[2,2']联嘧啶-4,6-二酮(1.12g,3.59mmol)和乙腈(10ml),慢慢滴加三乙胺(2ml,14.39mmol)和三氯氧磷(10ml,0.11mol),滴加完毕后,在80℃条件下反应24h,tlc跟踪反应,反应结束后冷却反应液至室温,加10倍体积的碎冰淬灭反应,用乙酸乙酯进行萃取,有机层依次用蒸馏水、饱和碳酸氢钠溶液、饱和食盐水洗涤,无水硫酸钠干燥,减压蒸馏去除有机溶剂,剩余物干燥即得1.03g,收率82.15%。
[0103]
(4)n-[6-氯-5(2-甲氧基苯氧基)[2,2'-二嘧啶]-4-基]-4-叔丁基-苯磺酰胺的制备
[0104]
在50℃下,向圆底烧瓶中依次加入4,6-二氯-5-(2-甲氧基苯氧基)-2,2'-联嘧啶基(0.14g,0.41mmol)和甲苯(4ml),依次加入4-叔丁基苯磺酰胺(96mg,0.45mmol)、无水碳酸钾(84.8mg,0.61mmol)和四丁基溴化铵(6.6mg,0.02mmol),加料完毕,回流反应16h,tlc跟踪反应,反应结束后冷却反应液至室温,减压蒸馏去除有机溶剂,加蒸馏水调ph至3;用二氯甲烷萃取,有机层依次用2n盐酸,蒸馏水,饱和食盐水洗涤,其中2n盐酸可以去除有机层中没有反应完的4-叔丁基苯磺酰胺,无水硫酸钠干燥后过滤,减压蒸馏去除有机溶剂,剩余物干燥即得产物0.2029g,收率94.25%。
[0105]
(5)波生坦的制备
scale synthesis of bosentan monohy-drate[j].organic preparations and procedures international,2016,48(6):481-491
[0122]
[2]黄娇娇,张珩,杨艺虹,等.4,6-二氯-5-(2-甲氧基苯氧基)-2,2'-联嘧啶的合成[j].合成化学,2011,19(6):809-811
[0123]
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
[0124]
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1