一种提高CRM197蛋白产量的发酵培养方法与流程
一种提高crm197蛋白产量的发酵培养方法
技术领域
1.本技术涉及微生物培养技术领域,具体涉及一种提高crm197蛋白产量的发酵培养方法。
背景技术:
2.白喉毒素(dt)是由白喉杆菌(corynebacterium diphtheriae)的产毒菌株合成和分泌的蛋白质性毒素。crm197蛋白为白喉毒素的无毒形式,但其在免疫上与白喉毒素没有区别,由不产毒噬菌体β197tox感染的白喉棒杆菌(文中简称为crm197菌)产生。由于没有毒性的crm197蛋白仍然可与敏感细胞的受体结合,即crm197蛋白在丧失酶活性及毒性的同时仍保留白喉毒素的免疫原性,是一种理想的多糖结合疫苗载体蛋白。
3.现有制备crm197蛋白的方法,主要通过发酵培养crm197菌,从crm197菌的培养物纯化而得。因此,crm197菌无论是天然菌种还是重组构建的工程菌种,培养方式是制约crm197蛋白量产的重要一环。为了提高crm197蛋白的产量,申请人对发酵使用的培养基做了优化,具体参见申请号为201910651534.3的中国发明专利。
4.但是按上述的培养方法对菌种进行发酵,crm197蛋白的产量仍处于较低的水平,因此急需研发一种更为优异的发酵培养方法,使crm197菌得以大规模扩增而获得高表达量的发酵菌液。
技术实现要素:
5.本技术提供一种提高crm197蛋白产量的发酵培养方法,具体通过控制发酵过程中的温度和溶氧量,实现增加crm197蛋白产量的目的。
6.本技术采用如下的技术方案:一种提高crm197蛋白产量的发酵培养方法,包括以下步骤:种子罐培养:将crm197菌种液和液体培养基投入种子罐中混合为菌种培养液,在36.5
±
0.5℃的温度下培养至od
600
值>10.0收获种子罐菌液;所述菌种培养液在培养时,控制溶氧>40%;生产罐培养:将所述种子罐菌液和液体培养基投入生产罐中混合为菌种发酵液,培养至od
600
值>40.0收获生产罐菌液;当od
600
值<15.0时,控制培养温度为27.0-37.5℃,所述菌种发酵液的溶氧>40%;当od
600
值≥15.0时,控制培养温度为27.0-34.5℃,所述菌种发酵液的溶氧为10-40%。
7.不同的菌种在培养时溶氧和温度都会存在较大的差异,本技术试验的crm197菌是好养菌,需要在适宜温度、有氧环境下培养。为此,本技术在发酵培养时,将种子罐的培养温
度控制在36.5℃、溶氧控制在>40%,这是基于种子罐培养无需考虑crm197菌是否表达分泌蛋白,其一定温度和氧容量范围内,温度和溶氧越高,菌种发酵效率越快,进而使菌种量能快速扩增。
8.本技术在生产罐培养时,生产罐在前期将培养温度控制在27.0-37.5℃、溶氧控制在>40%,在后期将培养温度控制在27.0-34.5℃、溶氧控制在10-40%。这是前期需要将菌种量扩增到一定数量,后期再控制菌种大量表达分泌crm197蛋白。发明人经过研究实验发现,在控制菌种表达分泌蛋白时,溶氧不是越高越好,也不是越低越好,需要在不同生长阶段空置在不同的范围中才能较高地表达crm197蛋白。溶氧过低,会影响crm197菌种的生长繁殖速率;溶氧过高,crm197菌种大量繁殖产生crm197蛋白的同时,还会产生降解crm197蛋白的物质,进而使crm197蛋白的收获量降低。此外,降低培养温度、在不同生长阶段控制不同的溶氧能适当减缓菌种的繁殖而有促使菌种先生长表达分泌蛋白,从而达到较高产率的目的。由此,按照本技术的温度和溶氧控制方法,能够有效促使crm197菌有效繁殖并表达分泌crm197蛋白,提高crm197蛋白的产量,能够较好地应用于crm197蛋白的生产工艺中。
9.优选的,包括以下步骤:种子罐培养:将crm197菌种液和液体培养基投入种子罐中混合为菌种培养液,在36.5
±
0.5℃的温度下培养至od
600
值>10.0收获种子罐菌液;当od
600
值<2.0时,控制所述菌种培养液的溶氧为45-50%;当od
600
值为2.0-10.0时,控制所述菌种培养液的溶氧为55-60%;生产罐培养:将所述种子罐菌液和液体培养基投入生产罐中混合为菌种发酵液,培养至od
600
值>40.0收获生产罐菌液;当od
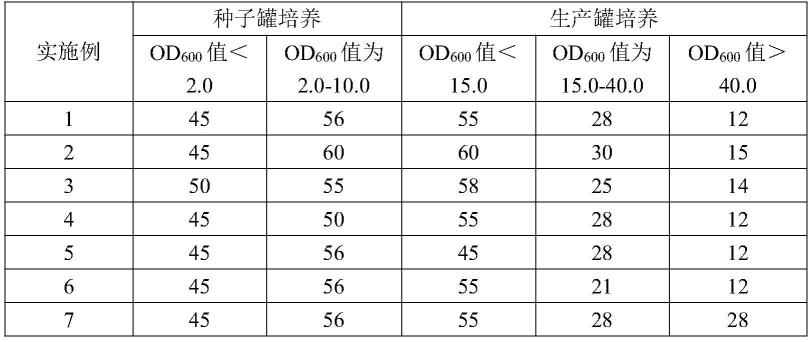
600
值<15.0时,控制培养温度为27.0-37.5℃,所述菌种发酵液的溶氧为55-60%;当od
600
值为15.0-40.0时,控制培养温度为27.0-34.5℃,所述菌种发酵液的溶氧为25-30%;当od
600
值>40.0时,控制培养温度为27.0-33.0℃,所述菌种发酵液的溶氧为12-15%。
10.本技术在种子罐培养时,od
600
值<2.0时的菌种量相对较少,溶氧维持在45-50%即可满足菌种的繁殖所需,待od
600
值到达2.0-10.0时,菌种量开始逐渐增加,此时将溶氧适当提升到55-60%,由此不但能让菌种快速扩增到设定量,还能减少氧气供应所造成的能源浪费。
11.本技术在生产罐培养时,od
600
值<15.0时主要是为了菌种扩增,待od
600
值维持在15.0-40.0时主要是为了促进菌种表达分泌crm197蛋白,此时培养温度和溶氧量不宜过低或过高,控制在27.0-34.5℃的温度、25-30%的溶氧下能使菌种在保证稳定生长的同时大量分泌的crm197蛋白;od
600
值>40.0时,菌种发酵效率放缓,产蛋白能力下降,本技术将温度和溶氧进一步降低有效减缓菌种的代谢速率,进而减少菌种发酵液中的代谢产物量,使crm197蛋白稳定存在于发酵菌液中,由此能收获高产量的crm197蛋白。
12.优选的,在所述种子罐培养中,所述菌种培养液的溶氧采用如下步骤进行控制:
当od
600
值<2.0时,保持通气量为0.1-0.3vvm,控制搅拌转速为200-500rpm;当od
600
值为2.0-10.0时,保持通气量为0.1-0.3vvm,控制搅拌转速为200-500rpm,待搅拌转速达到500rpm,控制通气量为0.2-2vvm。
13.优选的,在所述种子罐培养中,所述菌种培养液的溶氧采用如下步骤进行控制:当od
600
值<2.0时,保持通气量为0.2vvm,控制搅拌转速为200-500rpm;当od
600
值为2.0-10.0时,保持通气量为0.2vvm,加速搅拌转速至500rpm,控制通气量为0.5-1.0vvm。
14.优选的,在所述生产罐培养中,所述菌种发酵液的溶氧采用如下步骤进行控制:当od
600
值≤40.0时,保持通气量为0.05-0.2vvm,控制搅拌转速为50-300rpm,待搅拌速度达到300rpm,控制通气量为0.2-2.0vvm;当od
600
值>40.0时,保持转速为300rpm,控制通气量为0.2-2.0vvm。
15.优选的,在所述生产罐培养中,所述菌种发酵液的溶氧采用如下步骤进行控制:当od
600
值≤40.0时,保持通气量为0.1vvm,控制搅拌转速为50-300rpm,待搅拌速度达到300rpm,控制通气量为0.5-1.0vvm;当od
600
值>40.0时,保持转速为300rpm,控制通气量为0.5-1.0vvm。
16.在实际发酵培养过程中,通气量和搅拌速度会直接影响菌种与氧气的接触效果,而且不同菌种的通气量和搅拌速度的需求存在差异;为此,本技术经过大量研究及试验,发现本技术中若采用通气量过多、搅拌速度慢的方式,容易出现不同区域菌种的发酵效率存在较大偏差;若采用通气量少、搅拌速度快的方式,容易出现菌种与氧气接触时间不够而影响其生长和/繁殖。而采用上述通气量和搅拌速度来控制不同发酵程度(od
600
值)时的溶氧,能够促使菌种高密度表达crm197蛋白,因此本技术将其作为进一步的优选。
17.菌种在种子罐培养时,0.1-0.3vvm的通气量具体可以为0.1vvm、0.15vvm、0.2vvm、0.25vvm、3.0vvm等,进一步优选0.2vvm的通气量,搅拌速度允许在200-500rpm之间调整;当搅拌速度达到500rpm时,本技术将通气量调整为0.2-2vvm,具体可以为0.5vvm、0.6vvm、0.7vvm、0.8vvm、0.9vvm、1.0vvm等,进一步优选0.5-1.0vvm的通气量,由此方便种子罐内的通气量的快速调整。
18.同理,菌种在生产罐培养时,0.05-0.2vvm的通气量具体可以为0.05vvm、0.1vvm、0.15vvm、0.2vvm等,进一步优选0.1vvm的通气量,搅拌速度允许在50-300rpm之间调整;当搅拌速度达到300rpm时,本技术将通气量调整为0.2-2vvm,具体可以为0.5vvm、0.6vvm、0.7vvm、0.8vvm、0.9vvm、1.0vvm等,进一步优选0.5-1.0vvm的通气量,由此方便生产罐内的通气量的快速调整。
19.优选的,所述种子罐培养过程中,所述菌种液与液体培养基的体积比为1:(10-15);所述生产罐培养过程中,所述种子罐菌液与液体培养基的体积比为1:(5-10)。
20.本技术的菌种在种子罐培养时,菌种大量繁殖消耗大量的营养物质,因此液体培养基的添加量需要适当过量,以保证菌种健壮生长并进行繁殖,待菌种转移到生产罐后液体培养液的添加量有所减少,一方面是由于种子罐中有多余的营养物质能继续参与发酵,另一方面是生产罐中的菌种量扩增完成后保持在稳定范围内,此时的营养物质难以维持菌种的繁殖所需,进而促使菌种开始大量表达分泌crm197蛋白;其中,本技术按照上述体积比培养的发酵菌液具有高含量的crm197蛋白,因此将其作为进一步优选。
21.优选的,所述生产罐培养过程中,当od
600
值>40.0时,培养时30min内od
600
值增长≤2.0时停止培养。
22.优选的,所述生产罐培养过程中,当od
600
值>40.0时,培养时30min内od
600
值增长0.5-1.0时停止培养。
23.发明人经研究发现,crm197菌种在收获阶段,因各种代谢产物浓度较高,因此相差半个小时进行收获,亦将会有很大的产率差异。本技术的菌种当od
600
值>40.0后,crm197蛋白的生产速率放缓,其中培养时30min内od
600
值增长≤2.0时crm197蛋白产量的增加趋于较低水平,当od
600
值增长≤1.0时crm197蛋白的产量几乎没有增加,当od
600
值增长≤0.5时crm197蛋白的产量不增反降。基于此,本技术以od
600
值的增长值为参照依据,对菌种停止培养的节点进行及时把控,由此收获更高含量的crm197蛋白。
24.由此,按照本技术的发酵收获控制方法,选择适宜的收获终点,将在产率曲线顶点捕获目标crm197蛋白,在控制代谢副反应物质的前提下,最大限度地提高crm197蛋白的产量,并通过扩大规模验证,可以重复实现并应用于crm197蛋白的生产工艺中。
25.综上所述,本技术具有以下有益效果:1、本技术通过将种子罐维持高溶氧量和适宜温度,保持菌种一定的生长扩增水平,再将生产罐维持适度溶氧量和交底温度,将菌种的生长速率控制在可高效表达分泌crm197蛋白的适宜范围内,从而实现crm197蛋白高产量的目的,能够较好地应用于crm197蛋白的生产工艺中;2、本技术优选采用转速和通气量来控制溶氧,从而实现高密度表达crm197蛋白;3、本技术优选采用od
600
值的增长值为参照依据对菌种停止培养的节点进行及时把控,有助于收获更高含量的crm197蛋白。
具体实施方式
26.原料准备1、crm197菌种本技术中crm197菌种来自美国典型培养物保藏中心(atcc),菌株编号为atcc39255。除此之外,本技术的crm197菌种还可以选用菌株编号为atcc39526、atcc11049、atcc51926、atcc51280等其他菌种。在使用上述菌种之前,先将其使用液体培养基1ml进行复苏活化。
27.2、液体培养基每升由以下配方的组分配置而成:250ml基础营养液、7.2ml乙酸、30g一水麦芽糖、2ml乳酸钠、0.5g酪氨酸、1.96g磷酸二氢钾、5.1g磷酸氢二钾、6.13ml生长因子a、8ml生长因子b、8ml生长因子c和1.3g氯化钙,余量为水。
28.其中,每升基础营养液由以下配方的组分组成:2g精氨酸、2g天冬酰胺、0.5g门冬氨酸、0.5g谷氨酸、2gl-谷氨酰胺、0.5g甘氨酸、1.5g组氨酸、2gl-异亮氨酸、2g亮氨酸、2g赖氨酸盐酸盐、0.6g甲硫氨酸、1g苯丙氨酸、2g脯氨酸、2g丝氨酸、1g苏氨酸、0.6g色氨酸、1.5g缬氨酸和0.5gβ-丙氨酸,余量为水;每升生长因子a由以下配方的组分组成:2g l-胱氨酸和2ml盐酸,余量为水;每升生长因子b由以下配方的组分组成:6.5g烟酸、0.5g无水硫酸铜、0.15g庚二
酸、30ml盐酸、200g七水硫酸镁、0.8g七水硫酸锌和0.393g四水氯化锰,余量为水;每升生长因子c由以下配方的组分组成:0.1g维生素b1、0.75g维生素b5和0.075g维生素b6,余量为水。
29.上述液体培养基的制备方法,包括以下步骤:
①
、将0.5g酪氨酸用浓度为20wt%的氢氧化钠溶解,比例为10%(w/v),得到酪氨酸溶液;
②
、在容器中加入适量55℃(允许在50℃-60℃之间波动)的注射用水,依次准确称取或量取7.2ml乙酸、30g一水麦芽糖、2ml乳酸钠、步骤
①
制得的全部酪氨酸溶液、1.96g磷酸二氢钾和5.1g磷酸氢二钾加入该注射用水中混匀,得到初混液;
③
、待初混液降至室温,依次准备量取25l基础营养液、6.13ml生长因子a、8ml生长因子b和8ml生长因子c加入其中,充分混匀后用注射用水定容,用浓度为20wt%的氢氧化钠调节ph至7.4,混合均匀,得到待分层液;
④
、往待分层液中加入1.3g氯化钙,充分溶解后静置30min至分层,用硅胶管虹吸上清液,经除菌过滤后即得液体培养基。
30.以下结合实施例和对比例对本技术作进一步详细说明。
31.实施例1一种提高crm197蛋白产量的发酵培养方法,包括以下步骤:(一)、摇瓶培养1、一代液体摇瓶:开启一支crm197菌种,接种入50ml液体培养基中,加入2.5ml酵母提取物(10g/l,购自oxiod),在36.5
±
0.5℃、200rpm(允许在100-300rpm之间波动)的条件下摇瓶培养,直至od
600
在1.0以上,收获一代液体摇瓶菌液。
32.2、二代液体摇瓶:接种一代液体摇瓶菌液1.5ml入500ml液体培养基中,加入25ml酵母提取物(10g/l,购自oxiod),此为二代液体摇瓶菌液,在36.5
±
0.5℃、200rpm(允许在100-300rpm之间波动)的条件下摇瓶培养,直至od
600
在2.0以上,收获二代液体摇瓶菌液。
33.(二)、生物反应器培养3、种子罐培养:接种全部二代液体摇瓶菌液入7000ml液体培养基中混合为菌种培养液,在36.5℃(允许在
±
0.5℃内波动)的温度下培养至od
600
值>10.0收获种子罐菌液;当od
600
值<2.0时,保持通气量为0.2vvm,在200-500rpm的范围内调整搅拌转速,以控制菌种培养液的溶氧为50%;当od
600
值为2.0-10.0时,保持通气量为0.2vvm,加速搅拌转速至500rpm后保持该转速,在0.5-1.0vvm范围内调整通气量,以控制菌种培养液的溶氧为56%。
34.4、生产罐培养:接种全部种子罐菌液入60000ml液体培养基中混合为菌种发酵液,培养至od
600
值>40.0且培养时30min内od
600
值增长为1.0时停止培养,收获生产罐菌液,即完成crm197菌种的发酵培养;当od
600
值<15.0时,控制培养温度为36.5℃,保持通气量为0.1vvm,在50-300rpm
的范围内调整搅拌转速,以控制菌种发酵液的溶氧为55%;当od
600
值为15.0-40.0时,控制培养温度为34.5℃,保持通气量为0.1vvm,在50-300rpm的范围内调整搅拌转速,待搅拌转速达到300rpm后保持该转速,在0.5-1.0vvm范围内调整通气量,以控制菌种发酵液的溶氧为28%;当od
600
值>40.0时,控制培养温度为33.0℃,保持搅拌速度为300rpm,控制通气量为0.5-1.0vvm,以控制菌种发酵液的溶氧为12%。
35.实施例2实施例2-5在实施例1的方法基础上,对溶氧量进行调整,调整情况参见下表一。表一 实施例1-5的溶氧量的调整参数表(单位:%)
36.对比例1本对比例在实施例1的方法基础上,将种子罐培养的溶氧量进行调整,具体为:od
600
值≤10.0时控制溶氧为25%。
37.对比例2本对比例在实施例1的方法基础上,将生产罐培养的溶氧量进行调整,具体为:od
600
值≤40.0时控制溶氧均为25%。
38.性能检测试验按实施例1-7以及对比例1-2的方法对应发酵9个批次的crm197菌种,其批号对应记为a202204001-a202204007以及d202204001-d202204002,其收获的生产罐菌液按2015版《中国药典》中记载的絮状单位(lf)测定法对crm197蛋白产量加以测定。
39.其中,絮状单位是评价蛋白表达水平的直接指标,表示发酵培养液中所含特定蛋白的浓度水平,且絮状蛋白水平越高,蛋白的表达量也越高。测定结果参见下表二。表二 实施例1-7的生产罐菌液中crm197蛋白产量的检测结果
40.结合表二的检测结果可得,本技术将种子罐培养的溶氧控制在>40%,将生产罐培养的溶氧在od
600
值<15.0时控制在>40%、在od
600
值≥15.0时控制在10-40%时,其收获的生产罐菌液(a202204001-a202204007)的絮状单位(lf)明显高于对比例收获的生产罐菌液(d202204001-d202204002)的絮状单位(lf),可见本技术的溶氧控制能有效提高crm197蛋白产量。
41.而且,从发酵批次a202204001-a202204007的检测结果来看,若种子罐培养的溶氧在od
600
值<2.0时控制在45-50%,在od
600
值为2.0-10.0时控制在55-60%,与此同时,生产罐的溶氧在od
600
值<15.0时控制在55-60%,在od
600
值为15.0-40.0时控制在25-30%,再od
600
值>40.0时控制在12-15%,其收获的生产罐菌液(a202204001-a202204003)的絮状单位(lf)相对更高,即crm197蛋白产量更高,进一步优选a202204001的生产罐菌液。
42.实施例8-10实施例8-10以实施例1作为优选实施例,在实施例1的方法基础上,对生产罐内的培养温度进行调整,调整情况参见下表三。表三 实施例1以及实施例8-10的培养温度的调整参数表(单位:℃)
43.对比例3本对比例在实施例1的方法基础上,将生产罐内的培养温度保持在36.5℃(允许在
±
0.5℃内波动)。
44.性能检测试验按实施例8-10以及对比例3的方法对应发酵4个批次的crm197菌种,其批号对应记为a202204008-a2022040010以及d202204003,其收获的生产罐菌液按2015版《中国药典》中记载的絮状单位(lf)测定法对crm197蛋白产量加以测定,检测结果参见下表四。表四 实施例1、8-10以及对比例3的crm197蛋白产量的检测结果发酵批次最终od
600
絮状单位lf/ml
a20220400141.5195a20220400842.2187a20220400941.3184a202204001042.0190d20220400341.8155
45.结合表四的检测结果可得,本技术的菌种培养时,生产罐的培养温度对crm197蛋白产量有着一定的影响。按照本技术“在od
600
值<15.0时控制在27.0-37.5℃,在od
600
值为15.0-40.0时控制在27.0-34.5℃,再od
600
值>40.0时控制在27.0-33.0”进行设置时,其收获的crm197蛋白产量更高,可作为进一步的优选。
46.将表二和表四的检测结果来看,可见本技术通过将种子罐维持高溶氧量和适宜温度,保持菌种一定的生长扩增水平,再将生产罐维持适度溶氧量和交底温度,将菌种的生长速率控制在可高效表达分泌crm197蛋白的适宜范围内,从而实现crm197蛋白高产量的目的。
47.实施例11-16实施例11-16在实施例1的方法基础上,对通气量做出相应调整,具体调整情况参见下表五。表五 实施例11-16的通气量的调整参数表(单位:vvm)
48.性能检测试验按实施例11-16的方法对应发酵6个批次的crm197菌种,其批号对应记为a2022040011-a2022040016,其收获的生产罐菌液按2015版《中国药典》中记载的絮状单位(lf)测定法对crm197蛋白产量加以测定,检测结果参见下表六。表六 实施例1以及实施例11-16的crm197蛋白产量的检测结果
49.结合表六的检测结果可得,本技术的菌种在发酵培养过程中,通气量和搅拌速度会直接影响菌种与氧气的接触效果,若采用通气量过多、搅拌速度慢的方式,容易出现不同区域菌种的发酵效率存在较大偏差;若采用通气量少、搅拌速度快的方式,容易出现菌种与氧气接触时间不够而影响其生长和繁殖。
50.为此,本技术进一步优选种子罐培养时用0.2vvm的变速通气量(搅拌速度允许在200-500rpm之间调整时的通气量)以及0.5-1.0vvm的匀速通气量(搅拌速度达到500rpm时的通气量),生产罐培养时选用0.1vvm的变速通气量(搅拌速度允许在50-300rpm之间调整时的通气量)以及0.5-1.0vvm的匀速通气量(搅拌速度达到300rpm时的通气量)。
51.实施例17-20实施例17-20在实施例1的方法基础上,对二代液体摇瓶菌液与液体培养基的体积比以及种子罐菌液与液体培养基的体积比进行调整,具体调整情况参见下表七。表七 实施例1以及实施例17-20的菌种液与液体培养基的体积比
52.性能检测试验按实施例17-20的方法对应发酵4个批次的crm197菌种,其批号对应记为a2022040017-a2022040020,其收获的生产罐菌液按2015版《中国药典》中记载的絮状单位(lf)测定法对crm197蛋白产量加以测定,检测结果参见下表八。表八 实施例1以及实施例17-20的crm197蛋白产量的检测结果发酵批次最终od
600
絮状单位lf/mla20220400141.5195a202204001741.2186a202204001842.0190a202204001941.8180a202204002042.5182
53.结合表八的检测结果可得,本技术在种子罐培养过程中,将二代液体摇瓶菌液与液体培养基的体积比限定在1:(10-15),生产罐培养过程中,将种子罐菌液与液体培养基的体积比限定在1:(5-10),其能收获crm197蛋白含量更高的发酵菌液,因此将其作为进一步的优选。
54.收获终点性能检测试验
按实施例1的方法发酵crm197菌种,在生产罐培养的发酵过程中每隔30min对其收获的生产罐菌液按2015版《中国药典》中记载的絮状单位(lf)测定法对crm197蛋白产量加以测定,检测结果参见下表九。表九 实施例1的菌种在不同培养时间的crm197蛋白产量的检测结果培养时间/min306090120150180210240270od
600
值增长量18.012.06.04.02.01.00.70.50.1絮状单位lf/ml3176121162188195196190181
55.由表九可见,crm197菌种在收获阶段,因各种代谢产物浓度较高,因此相差半个小时进行收获,亦将会有很大的产率差异。本技术的菌种当od
600
值>40.0(培养150min)后,crm197蛋白的生产速率放缓,其中培养时30min内od
600
值增长≤2.0时crm197蛋白产量的增加趋于较低水平,当od
600
值增长≤1.0时crm197蛋白的产量几乎没有增加,当od
600
值增长≤0.5时crm197蛋白的产量不增反降。
56.基于此,本技术以od
600
值的增长值为参照依据,对菌种停止培养的节点进行及时把控,由此收获更高含量的crm197蛋白。其中优选30min内od
600
值增长≤2.0时(培养150min)停止培养,进一步优选30min内od
600
值增长0.5-1.0时(培养180-240min)停止培养,其获得crm197蛋白的含量相对较高。
57.综上,本技术在设定培养温度下,通过转速和通气量来控制溶氧以实现高密度表达crm197蛋白,最后采用od
600
值的增长值为参照依据对菌种停止培养的节点进行及时把控,将菌种的生长速率控制在可高效表达分泌crm197蛋白的适宜范围内,从而实现crm197蛋白高产量的目的,能够较好地应用于crm197蛋白的生产工艺中。
58.本具体实施例仅仅是对本技术的解释,其并不是对本技术的限制,本领域技术人员在阅读完本说明书后可以根据需要对本实施例做出没有创造性贡献的修改,但只要在本技术的权利要求范围内都受到专利法的保护。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1