抗VZV病毒抗体、其药物组合物及用途
本发明属于生物医药领域,涉及一种抗vzv病毒抗体、其药物组合物及用途。具体地,本发明涉及一种具有vzv病毒中和活性的单克隆抗体。
背景技术:
1、水痘-带状疱疹病毒(varicella-zoster virus,简称为vzv,也称为人类疱疹病毒3)是一种嗜神经人类疱疹病毒,是一种普遍存在的甲疱疹病毒,具有双链dna基因组,可引起水痘和带状疱疹两种不同的疾病。原发感染引起水痘,其特征是全身瘙痒性皮疹,从斑点迅速发展为丘疹、水疱性病变,然后结痂。病灶呈个别散在,反映病毒已扩散至皮肤。而后vzv潜伏于脑神经节、背根神经节、肠和自主神经节(1)。
2、病毒的重新激活导致病毒复制,从而导致受相关神经元支配的组织出现带状疱疹(带状疱疹)、炎症和细胞死亡——这一过程可导致持续的根性疼痛(带状疱疹后神经痛)。疱疹后神经痛的发病机制尚不清楚,治疗困难。此外,还可能出现其他带状疱疹并发症,包括脊髓炎、脑神经麻痹、脑膜炎、中风(血管病变)、视网膜炎和胃肠炎感染,如溃疡、胰腺炎和肝炎。带状疱疹的全球发病率范围为3-5/1000人年,≥50岁人群的发病率范围为5.23-10.9/1000人年(2)。
3、超过90%的成年人体内潜伏感染vzv,约1/3的人会有带状疱疹的发作。在中国每年约有150万人发病。由于老年人数量不断增加、免疫系统受到抑制的器官移植受者、因癌症或自身免疫性疾病接受化疗的患者、艾滋病毒感染者和慢性病患者,越来越多人口表现出对vzv的免疫力受损,并发展为带状疱疹(3)。疱疹后神经痛疼痛剧烈可持续数年甚至更久,甚至会导致自杀,极大的影响患者生活质量。
4、目前针对带状疱疹没有特效药,主要应用药物为抗病毒药物,如阿昔洛韦、伐昔洛韦等。虽然抗病毒治疗能减轻带状疱疹相关的急性疼痛,但尚未证实能可靠地降低带状疱疹后遗神经痛(postherpetic neuralgia,简称为phn)的风险,也不推荐用于治疗已确诊的phn(4)。另外,虽然针对带状疱疹的疫苗已上市,但对于已经发病患者无效。因此寻找快速有效的治疗手段非常迫切。
5、水痘-带状疱疹病毒(vzv)糖蛋白e(ge)是vzv感染所必需的。ge在甲疱疹病毒中很保守,是病毒复制的关键糖蛋白。ge与胰岛素降解酶(ide)相互作用,促进vzv感染和病毒的细胞间传播(5)。目前上市的带状疱疹疫苗也都是以ge蛋白为靶点。
6、几十年来,使用杂交瘤技术分离小鼠单克隆抗体。然而,这些抗体的治疗应用受到抗小鼠抗体的诱导和自身反应性的限制。通过噬菌体展示文库分离单克隆抗体这项技术已经产生了许多有用的抗体,但其适用性受到在细菌细胞和真核细胞中表达的抗体之间结合特性的差异的限制。
技术实现思路
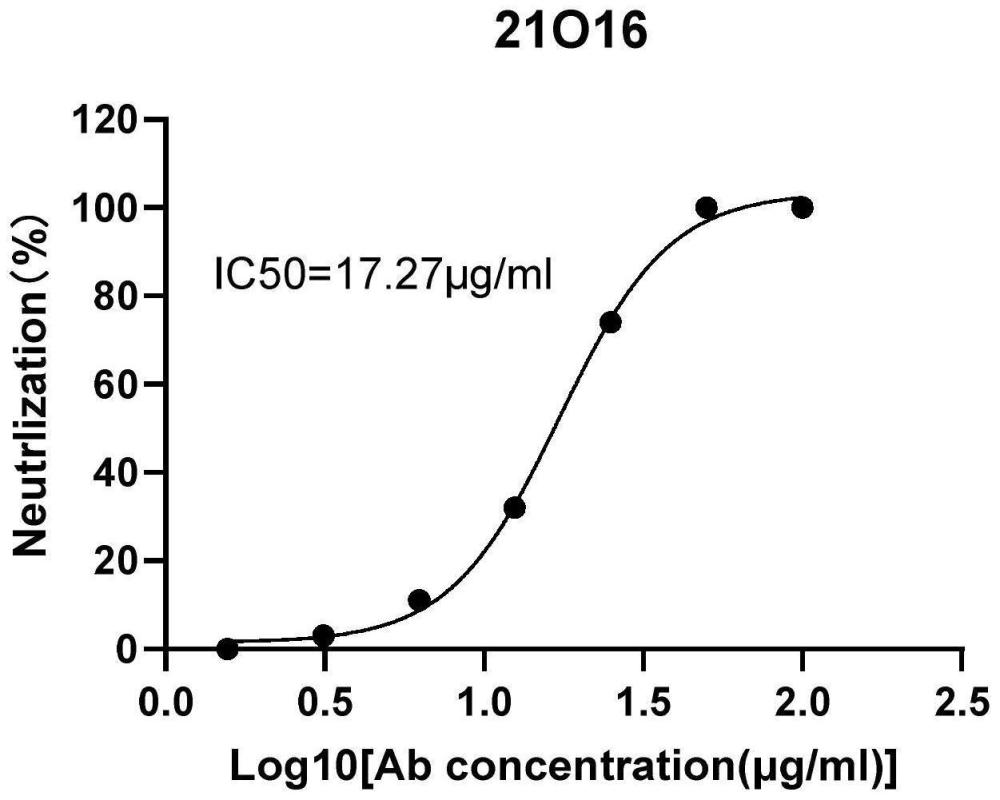
1、本发明人经过深入的研究和创造性的劳动,从患者外周血中分离记忆b细胞、培养b细胞、收集上清液以ge蛋白作为靶点进行筛选以及b细胞裂解进行免疫球蛋白重链和轻链扩增和克隆,得到了一株抗vzv病毒抗体。本发明人惊奇地发现,该抗体能够有效地中和vzv病毒,是一株具有vzv病毒中和活性的全人源单抗,命名为21o16。由此提供了下述发明:
2、本发明的一个方面涉及一种抗vzv病毒抗体或其抗原结合片段,所述抗体包含重链可变区和轻链可变区,所述重链可变区包含hcdr1至hcdr3,所述轻链可变区包含lcdr1至lcdr3,其中:
3、hcdr1的氨基酸序列如seq id no:5所示、hcdr2的氨基酸序列如seq id no:6所示和hcdr3的氨基酸序列如seq id no:7所示,并且
4、lcdr1的氨基酸序列如seq id no:8所示、lcdr1的氨基酸序列如seq id no:9所示和lcdr1的氨基酸序列如seq id no:10所示。
5、在本发明的一些实施方案中,所述的抗vzv病毒抗体或其抗原结合片段,其中,所述抗体的重链可变区的氨基酸序列如seq id no:2所示,并且轻链可变区的氨基酸序列如seq id no:4所示。
6、在本发明的一些实施方案中,所述的抗vzv病毒抗体或其抗原结合片段,其中,所述抗体的重链恒定区为ig gamma-1chain c region(例如ncbi accession:p01857)或iggamma-4chain c region(例如ncbi accession:p01861.1);轻链恒定区为ig kappa chainc region(例如ncbi accession:p01834)。
7、在本发明的一些实施方案中,所述的抗vzv病毒抗体或其抗原结合片段,其中,所述抗vzv病毒抗体或其抗原结合片段选自fab、fab'、f(ab')2、fd、fv、dab、互补决定区片段、单链抗体、人源化抗体、嵌合抗体或双抗体。
8、在本发明的一些实施方案中,所述的抗vzv病毒抗体或其抗原结合片段,其中,所述抗vzv病毒抗体与vzv病毒ge蛋白的结合的ec50为小于或等于10μg/ml、小于或等于5μg/ml、或者小于或等于3μg/ml。
9、在本发明的一些实施方案中,所述的抗vzv病毒抗体为单克隆抗体,优选为人源化的单克隆抗体。
10、在本发明的一些实施方案中,所述的抗vzv病毒抗体或其抗原结合片段,其中,所述抗vzv病毒抗体为全人源抗体,例如为人源单克隆抗体。
11、在本发明的一些实施方案中,所述的抗vzv病毒抗体或其抗原结合片段,其中,所述抗vzv病毒抗体的重链的氨基酸序列如seq id no:40所示,并且所述抗vzv病毒抗体的轻链的氨基酸序列如seqid no:42所示。
12、本发明的另一方面涉及一种分离的核酸分子,其编码本发明中任一项所述的抗vzv病毒抗体或其抗原结合片段。优选地,所述分离的核酸分子的序列如seq id no:41和seq id no:43所示。
13、本发明的再一方面涉及一种重组载体,其包含本发明的分离的核酸分子。
14、本发明的再一方面涉及一种宿主细胞,其包含本发明的分离的核酸分子,或者本发明的重组载体。
15、本发明的再一方面涉及偶联物,其包括抗体以及偶联部分,其中,所述抗体为本发明中任一项所述的抗vzv病毒抗体或其抗原结合片段,所述偶联部分为可检测的标记;优选地,所述偶联部分为放射性同位素、荧光物质、有色物质或酶。
16、本发明的再一方面涉及一种药物组合物,其包含本发明中任一项所述的抗vzv病毒抗体或其抗原结合片段或者本发明的偶联物;可选地,所述药物组合物还包括一种或多种药学上可接受的辅料。
17、本发明的再一方面涉及本发明中任一项所述的抗vzv病毒抗体或其抗原结合片段或者本发明的偶联物在制备治疗或预防水痘或带状疱疹的药物中的用途。
18、根据本发明中任一项所述的抗vzv病毒抗体或其抗原结合片段或者本发明的偶联物,其用于治疗或预防水痘或带状疱疹。
19、本发明的再一方面涉及一种治疗或预防水痘或带状疱疹的方法,包括给予有需求的受试者以有效量的本发明中任一项所述的抗vzv病毒抗体或其抗原结合片段或者本发明的偶联物的步骤。
20、在本发明的一些实施方式中,所述的治疗或预防水痘或带状疱疹的方法,其中,
21、所述抗vzv病毒抗体或其抗原结合片段的单次给药剂量为每千克体重0.1-100mg,优选每千克体重5-50mg或5-15mg;
22、优选地,每3天、每4天、每5天、每6天、每10天、每1周、每2周或每3周给药一次;
23、优选地,给药方式为静脉滴注或静脉注射。
24、在本发明中,除非另有说明,否则本文中使用的科学和技术名词具有本领域技术人员所通常理解的含义。并且,本文中所用的细胞培养、分子遗传学、核酸化学、免疫学实验室操作步骤均为相应领域内广泛使用的常规步骤。同时,为了更好地理解本发明,下面提供相关术语的定义和解释。
25、如本文中所使用的,术语ec50是指半最大效应浓度(concentration for 50%ofmaximal effect),是指能引起50%最大效应的浓度。
26、如本文中所使用的,术语“抗体”是指通常由两对多肽链(每对具有一条“轻”(l)链和一条“重”(h)链)组成的免疫球蛋白分子。抗体轻链可分类为κ和λ轻链。重链可分类为μ、δ、γ、α或ε,并且分别将抗体的同种型定义为igm、igd、igg、iga和ige。在轻链和重链内,可变区和恒定区通过大约12或更多个氨基酸的“j”区连接,重链还包含大约3个或更多个氨基酸的“d”区。各重链由重链可变区(vh)和重链恒定区(ch)组成。重链恒定区由3个结构域(ch1、ch2和ch3)组成。各轻链由轻链可变区(vl)和轻链恒定区(cl)组成。轻链恒定区由一个结构域cl组成。抗体的恒定区可介导免疫球蛋白与宿主组织或因子,包括免疫系统的各种细胞(例如,效应细胞)和经典补体系统的第一组分(c1q)的结合。vh和vl区还可被细分为具有高变性的区域(称为互补决定区(cdr)),其间散布有较保守的称为构架区(fr)的区域。各vh和vl由按下列顺序:fr1、cdr1、fr2、cdr2、fr3、cdr3和fr4从氨基末端至羧基末端排列的3个cdr和4个fr组成。各重链/轻链对的可变区(vh和vl)分别形成抗体结合部位。氨基酸至各区域或结构域的分配遵循bethesda m.d.,kabat sequences of proteins ofimmunological interest(national institutes of health,(1987and 1991)),或chothia&lesk j.mol.biol.1987;196:901-917;chothia等人nature 1989;342:878-883,或者imgt编号系统定义,见ehrenmann f,kaas q,lefranc m p.imgt/3dstructure-db andimgt/domaingapalign:a database and a tool for immunoglobulins or antibodies,tcell receptors,mhc,igsf and mhcsf[j].nucleic acids research,2009;38(suppl_1):d301-d307的定义。
27、术语“抗体”不受任何特定的产生抗体的方法限制。例如,其包括,重组抗体、单克隆抗体和多克隆抗体。抗体可以是不同种型的抗体,例如,igg(例如,igg1,igg2,igg3或igg4亚型),iga1,iga2,igd,ige或igm抗体。
28、如本文中所使用的,术语“单抗”和“单克隆抗体”是指,来自一群高度同源的抗体分子中的一个抗体或抗体的一个片段,也即除可能自发出现的自然突变外,一群完全相同的抗体分子。单抗对抗原上的单一表位具有高特异性。多克隆抗体是相对于单克隆抗体而言的,其通常包含至少2种或更多种的不同抗体,这些不同的抗体通常识别抗原上的不同表位。单克隆抗体通常可采用kohler等首次报道的杂交瘤技术获得(g,milsteinc.continuous cultures of fused cells secreting antibody of predefinedspecificity[j].nature,1975;256(5517):495),但也可采用重组dna技术获得(如参见u.s.patent 4,816,567)。
29、如本文中所使用的,术语“人源化抗体”是指,人源免疫球蛋白(受体抗体)的全部或部分cdr区被一非人源抗体(供体抗体)的cdr区替换后得到的抗体或抗体片段,其中的供体抗体可以是具有预期特异性、亲和性或反应性的非人源(例如,小鼠、大鼠或兔)抗体。此外,受体抗体的构架区(fr)的一些氨基酸残基也可被相应的非人源抗体的氨基酸残基替换,或被其他抗体的氨基酸残基替换,以进一步完善或优化抗体的性能。关于人源化抗体的更多详细内容,可参见例如,jones et al.,nature 1986;321:522 525;reichmann etal.,nature,1988;332:323 329;presta,curr.op.struct.biol.1992;2:593-596;和clark,immunol.today 2000;21:397 402。在一些情况下,抗体的抗原结合片段是双抗体(diabodies),其中vh和vl结构域在单个多肽链上表达,但使用太短的连接体以致不允许在相同链的两个结构域之间配对,从而迫使结构域与另一条链的互补结构域配对并且产生两个抗原结合部位(参见,例如,holliger p.et al.,proc.natl.acad.sci.usa 1993;90:6444-6448和poljak r.j.et al.,structure 1994;2:1121-1123)。
30、如本文中所使用的,术语“单链抗体(single chain fragment variable,scfv)”是指,包含通过连接体连接的抗体重链可变区(vh)和抗体轻链可变区(vl)的分子。其中vl和vh结构域通过使其能够产生为单个多肽链的连接体配对形成单价分子(参见,例如,birdet al,science 1988;242:423-426和huston et al,proc.natl.acad.sci.usa 1988;85:5879-5883)。此类scfv分子可具有一般结构:nh2-vl-连接片段-vh-cooh或nh2-vh-连接片段-vl-cooh。合适的现有技术接头由重复的ggggs氨基酸序列或其变体组成。例如,可使用具有氨基酸序列(ggggs)4的接头,但也可使用其变体(holliger et al,proc.natl.acad.sci.usa 1993;90:6444-6448)。可用于本发明的其他接头由alfthan etal,protein eng.1995;8:725-731,choi et al,eur.j.immunol.2001;31:94-106,hu etal,cancer res.1996;56:3055-3061,kipriyanov et al,j.mol.biol.1999;293:41-56和roovers et al,cancer immunology,immunotherapy,2001,50(1):51-59.描述。
31、如本文中所使用的,术语“分离的”或“被分离的”指的是,从天然状态下经人工手段获得的。如果自然界中出现某一种“分离”的物质或成分,那么可能是其所处的天然环境发生了改变,或从天然环境下分离出该物质,或二者情况均有发生。例如,某一活体动物体内天然存在某种未被分离的多聚核苷酸或多肽,而从这种天然状态下分离出来的高纯度的相同的多聚核苷酸或多肽即称之为分离的。术语“分离的”或“被分离的”不排除混有人工或合成的物质,也不排除存在不影响物质活性的其它不纯物质。
32、如本文中所使用的,术语“载体(vector)”是指,可将多聚核苷酸插入其中的一种核酸运载工具。当载体能使插入的多核苷酸编码的蛋白获得表达时,载体称为表达载体。载体可以通过转化,转导或者转染导入宿主细胞,使其携带的遗传物质元件在宿主细胞中获得表达。载体是本领域技术人员公知的,包括但不限于:质粒;噬菌粒;柯斯质粒;人工染色体,例如酵母人工染色体(yac)、细菌人工染色体(bac)或p1来源的人工染色体(pac);噬菌体如λ噬菌体或m13噬菌体及动物病毒等。可用作载体的动物病毒包括但不限于,逆转录酶病毒(包括慢病毒)、腺病毒、腺相关病毒、疱疹病毒(如单纯疱疹病毒)、痘病毒、杆状病毒、乳头瘤病毒、乳头多瘤空泡病毒(如sv40)。一种载体可以含有多种控制表达的元件,包括但不限于,启动子序列、转录起始序列、增强子序列、选择元件及报告基因。另外,载体还可含有复制起始位点。
33、如本文中所使用的,术语“宿主细胞”是指,可用于导入载体的细胞,其包括但不限于,如大肠杆菌或枯草杆菌等的原核细胞,如酵母细胞或曲霉菌等的真菌细胞,如s2果蝇细胞或sf9等的昆虫细胞,或者如纤维原细胞,cho细胞,gs细胞,cos细胞,nso细胞,hela细胞,bhk细胞,hek 293细胞或人细胞等的动物细胞。
34、如本文中使用的,术语“特异性结合”是指,两分子间的非随机的结合反应,如抗体和其所针对的抗原之间的反应。在某些实施方式中,特异性结合某抗原的抗体(或对某抗原具有特异性的抗体)是指,抗体以小于大约10-5m,例如小于大约10-6m、10-7m、10-8m、10-9m或10-10m或更小的亲和力(kd)结合该抗原。
35、如本文中所使用的,术语“kd”是指特定抗体-抗原相互作用的解离平衡常数,其用于描述抗体与抗原之间的结合亲和力。平衡解离常数越小,抗体-抗原结合越紧密,抗体与抗原之间的亲和力越高。通常,抗体以小于大约10-5m,例如小于大约10-6m、10-7m、10-8m、10-9m或10-10m或更小的解离平衡常数(kd)结合抗原(例如,水痘-带状疱疹病毒的ge蛋白)。可以使用本领域技术人员知悉的方法测定kd,例如使用fortebio分子相互作用仪测定。
36、如本文中所使用的,术语“单克隆抗体”和“单抗”具有相同的含义且可互换使用;术语“多克隆抗体”和“多抗”具有相同的含义且可互换使用。并且在本发明中,氨基酸通常用本领域公知的单字母和三字母缩写来表示。例如,丙氨酸可用a或ala表示。
37、如本文中所使用的,术语“药学上可接受的载体和/或赋形剂”是指在药理学和/或生理学上与受试者和活性成分相容的载体和/或赋形剂,其是本领域公知的(参见例如remington's pharmaceutical sciences.edited by gennaro ar,19thed.pennsylvania:mack publishing company,1995),并且包括但不限于:ph调节剂,表面活性剂,佐剂,离子强度增强剂。例如,ph调节剂包括但不限于磷酸盐缓冲液;表面活性剂包括但不限于阳离子,阴离子或者非离子型表面活性剂,例如tween-80;离子强度增强剂包括但不限于氯化钠。
38、如本文中所使用的,术语“有效量”是指足以获得或至少部分获得期望的效果的量。例如,预防疾病(例如水痘或带状疱疹)有效量是指,足以预防,阻止,或延迟疾病(例如水痘或带状疱疹)的发生的量;治疗疾病有效量是指,足以治愈或至少部分阻止已患有疾病的患者的疾病和其并发症的量。测定这样的有效量完全在本领域技术人员的能力范围之内。例如,对于治疗用途有效的量将取决于待治疗的疾病的严重度、患者自己的免疫系统的总体状态、患者的一般情况例如年龄,体重和性别,药物的施用方式,以及同时施用的其他治疗等等。
39、发明的有益效果
40、本发明的抗vzv病毒抗体能够有效地结合vzv病毒ge蛋白,具有良好的vzv病毒中和活性。
- 还没有人留言评论。精彩留言会获得点赞!