一种检测AAV抗体滴度的方法与流程
本发明属于生物医学,尤其涉及一种检测aav抗体滴度的方法。
背景技术:
1、aav是广泛应用的基因治疗载体,目前未发现aav病毒引起的相关疾病,因此具有安全性、同时具有不同组织靶向性和高效转导效率,成为目前应用最广泛的基因治疗载体。在很大程度上由于病毒载体技术的发展,对基因治疗领域的兴趣和投资重新兴起,最终在2017年美国食品和药物管理局批准了第一个针对单一突变疾病的基因治疗产品。在2000年代,源自非病原性和非包膜复制缺陷型细小病毒的腺相关病毒(aav)载体已成为一种安全有效的基因递送工具,引发了第二波临床浪潮。在多种疾病的基因疗法中,如眼、神经、心脏、肝、肺、肌肉、血液等,aav载体是最优选的基因治疗载体。
2、aav载体基因治疗临床应用面临的困境之一:体内预先存在的aav抗体会降低甚至抵消aav载体的治疗效果,大大限制了aav基因治疗的应用。研究显示,在出生后2年,部分人就产生了针对aav病毒衣壳的抗体;在健康人群中,有60%的受试者出现了针对aav2病毒的抗体。50%~90%的人群暴露于aav感染,其中约50%的病例导致针对aav衣壳的中和抗体(nabs)的发生。
3、aav载体基因治疗临床应用面临的困境之二:aav血清型中存在高度的衣壳氨基酸序列同源性。nabs对各种aav血清型的交叉反应性是aav载体应用的另一局限。据报道,血液中低至1:5的nab滴度可以完全阻止体内aav转导。因此,针对特定aav血清型的nabs存在进行预筛选是动物实验和临床试验中的关键程序。
4、目前aav抗体筛查的主要方法如下:
5、1:elisa为基础的总抗体检测法(total anti-capsid antibody,tab):方法简单易行,可以相对灵敏的检测与aav结合的抗体含量,但是不能反应抗体的中和活性,而且检测方法本身耗时且成本高,检测结果也是半定量的方式。
6、2:细胞介导的体外转导抑制实验(transduction inhibition,ti assay):用于筛查和检测中和性aav抗体含量。这种方法最常用的报告系统是荧光素酶系统:待测样本进行梯度稀释,与aav病毒孵育,孵育完成后,感染不同的细胞系,检测荧光素酶发光值rul,推算aav抗体滴度。这种方法的主要局限是:虽然相对容易设置,但大多数aav血清型在体外转导细胞方面效率非常低下,因此在测定中使用高多重感染(mois),导致抗体检测的灵敏度较低。此外,与细胞培养条件相关的几个参数可能有助于测定的可变性,例如使用的细胞系,细胞密度和报告载体制备;荧光酶发光信号的检测是一种半定量的方式,无法精确检测aav抗体量。抗体滴度展示方式缺乏可解释性,难以交流,不容易理解,无法确定抗体究竟能中和多少aav载体。另外,荧光酶系统需要加入反应底物,产生荧光进行监测,最佳监测窗口只有几分钟,因此在实际操作过程中,难以把握,导致误差很大。荧光酶系统需要荧光检测仪进行监测,仪器检测费用高且普通实验室不具备,实施性差。
技术实现思路
1、有鉴于此,本发明的目的在于提供一种检测aav抗体滴度的方法,该方法能够精确检测aav抗体滴度。
2、为了实现上述发明目的,本发明提供了以下技术方案:
3、本发明提供了一种检测aav抗体滴度的方法,包括如下步骤:
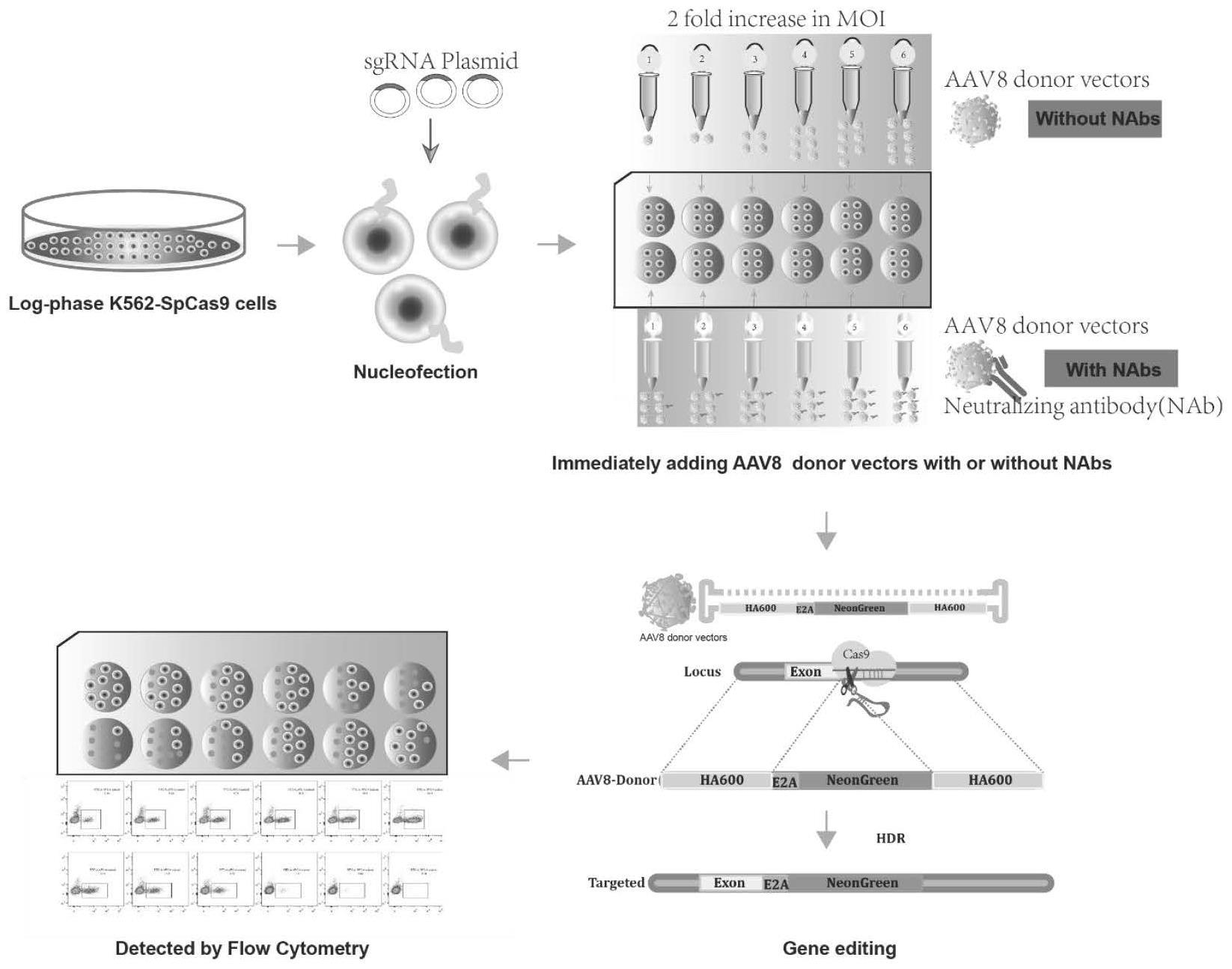
4、s1:制备不同moi值的无血清孵育的aav载体;制备含不同体积的待测血清样本与已知moi值aav载体共孵育的混合液;
5、s2:将含有crispr-cas9基因编辑系统的质粒加入电转液中,进行已知数量细胞的电转过程,分别加入步骤s1中的无血清孵育的aav载体和混合液至电转后的细胞中,所述crispr-cas9基因编辑系统包括sp/sacas9-sgrna,所述aav载体包括报告基因;
6、s3:根据检测结果计算待测血清样本中aav抗体滴度。
7、优选的,所述不同moi值包括0.25×105、0.5×105、1.0×105、2.0×105、4.0×105和8×105;所述已知moi值为0.25×105、0.5×105、1.0×105、2.0×105、4.0×105、8×105中的任意一种。
8、优选的,所述不同体积包括0.5、1、1.5、2、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8μl中的多种。
9、优选的,所述aav载体的切割位点包括eef1a1位点、eef2位点、cd326a或aavs1。
10、优选的,所述aav载体包含切割位点两侧同源臂序列。
11、优选的,所述报告基因包括绿色荧光表达蛋白gfp、mnenogreen、crimson、tdtomato或luciferase。
12、优选的,所述sgrna的核苷酸序列如seq id no.1或seq id no.2所示。
13、优选的,所述细胞包括k562、hela、293t、ht1080或ipsc。
14、优选的,所述两侧同源臂序列的长度包括50、100、150、300、600、1000、1500或2000bp。
15、所述计算待测血清样本中aav抗体滴度步骤如下:
16、s3-1、根据无血清孵育的aav载体不同moi值和已知数量细胞计算aav病毒粒子数,aav病毒粒子数=moi×细胞数;
17、s3-2、根据无血清孵育的aav载体检测到的报告基因的表达效率,制作多项式曲线,其中以aav病毒粒子数为横坐标,报告基因的表达效率为纵坐标,得到曲线公式;
18、s3-3、根据混合液检测报告基因的表达效率,利用s3-2得到的曲线公式,计算所需aav病毒粒子数;
19、s3-4、被抗体中和的aav粒子数=孵育前所加aav病毒粒子数-s3-3得出的所需aav病毒粒子数;
20、s3-5、以被抗体中和的aav粒子数为纵坐标,以加入待测血清样本的体积为横坐标,制作多项式曲线公式;
21、s3-6、根据中和50%aav载体所需样本体积数作为aav抗体滴度,aav抗体滴度vg/ml=中和50%aav载体数vg/样本体积数ml。
22、相对于现有技术,本发明具有如下有益效果:
23、本发明提供了一种检测aav抗体滴度的方法,利用crispr-cas9-aav基因编辑体系为体外aav抗体筛查提供了一种颠覆性的技术革新,其基于未被aav抗体抑制的aav载体作为供体插入到电转后细胞的敲入(ki)效率,并且aav抗体滴度与靶细胞中插入的aav基因组效率呈负相关。本发明颠覆传统的基于细胞的体外转导抑制测定法,其主要优势是可以将aav抗体滴度以数字化、定量的方式展示,便于理解与交流,并且使用不同细胞系、不同aav转导剂量都得到稳定可靠的结果。这种方法易于标准化和验证,比传统的方法省时、省力、节约检测费用,且直接反应抗体中和活性。
技术特征:
1.一种检测aav抗体滴度的方法,其特征在于,包括如下步骤:
2.根据权利要求1所述的方法,其特征在于,所述不同moi值包括0.25×105、0.5×105、1.0×105、2.0×105、4.0×105和8×105;所述已知moi值为0.25×105、0.5×105、1.0×105、2.0×105、4.0×105、8×105中的任意一种。
3.根据权利要求1所述的方法,其特征在于,所述不同体积包括0.5、1、1.5、2、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8μl中的多种。
4.根据权利要求1所述的方法,其特征在于,所述aav载体的切割位点包括eef1a1位点、eef2位点、cd326a或aavs1。
5.根据权利要求1所述的方法,其特征在于,所述aav载体包含切割位点两侧同源臂序列。
6.根据权利要求1所述的方法,其特征在于,所述报告基因包括绿色荧光表达蛋白gfp、mnenogreen、crimson、tdtomato或luciferase。
7.根据权利要求1所述的方法,其特征在于,所述sgrna的核苷酸序列如seq id no.1或seq id no.2所示。
8.根据权利要求1所述的方法,其特征在于,所述细胞包括k562、hela、293t、ht1080或ipsc。
9.根据权利要求5所述的方法,其特征在于,所述两侧同源臂序列的长度包括50、100、150、300、600、1000、1500或2000bp。
10.根据权利要求1~9任意一项所述的方法,其特征在于,所述计算待测血清样本中aav抗体滴度步骤如下:
技术总结
本发明提供了一种检测AAV抗体滴度的方法,属于生物医学技术领域,包括:S1制备不同MOI值的无血清孵育的AAV载体;制备含不同体积的待测血清样本与已知MOI值AAV载体共孵育的混合液;S2:将含有CRISPR‑Cas9基因编辑系统的质粒加入电转液中,进行已知数量细胞的电转过程,分别加入步骤S1中的无血清孵育的AAV载体和混合液至电转后的细胞中,分别检测电转后报告基因的表达效率;S3:根据检测结果计算待测血清样本中AAV抗体滴度。本发明主要优势是可以将AAV抗体滴度以数字化、定量的方式展示,便于理解与交流,并且使用不同细胞系、不同AAV转导剂量都得到稳定可靠的结果。这种方法易于标准化和验证,比传统的方法省时、省力、节约检测费用,且直接反应抗体中和活性。
技术研发人员:张孝兵,李国华,赵梅,张健萍,程涛,张凤
受保护的技术使用者:苏州吉纳星辰生物技术有限公司
技术研发日:
技术公布日:2024/1/13
- 还没有人留言评论。精彩留言会获得点赞!